国家标准硫酸亚铁铵的标定
几种常用标准溶液配制与标定

溴酸钾标准溶液的配制与标定配制:c(1/6KBrO3)=0.1mol/l称取3g溴酸钾,溶于1000ml水中,摇匀标定方法及计算同溴标准溶液的标定及计算碘标准溶液的配制与标定配制:c(1/2b)=0.1mol/l称取13g碘及25g碘化钾,溶于100ml水中,稀释至1000ml,摇匀,保存于棕色具塞瓶中。
称取0.15g预先在硫酸干燥器中干燥至恒重的基准三氧化二砷,称准至0.0001g。
置于碘量瓶中,加4ml氢氧化钠溶液[C(NaOH)=1.0mol/l]溶解,加50ml水,加2 滴酚酞指示剂,用硫酸溶液[C(1/2H2SO4)=1.0mol/l]中和,加3g碳酸氢钠及3ml5g/l 淀粉指示剂,用配好的碘溶液c(1/212)=0.1mol/l滴定至溶液呈浅蓝色。
同时作空白试验。
计算:C(1/2I2)=硫酸标准溶液配制与标定配制:量取规定体积的硫酸,缓缓注入1000mL水中,冷却,摇匀称取上述规定定量的于270-300 C灼烧至恒重的基准无水碳酸钠,称准至0.0001g。
溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2mi n,冷却后继续滴定至溶液再呈暗红色。
同样做空白试验,计算:C(1/2H2SO4)=m/[(V1-V2 ) *0.05299)]V1 ------- 硫酸之用量,mlV2 ------- 空白试验硫酸之用量,ml0.05299——于1.0000ml硫酸标准溶液相当的以克表示的无水碳酸钠的质量比较方法:量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。
计算:C(1/2H2SO4)=V1*C1/VV1 ------- 氢氧化钠标准溶液之用量,mlV --------- 硫酸之用量,mlC1 --------- 氢氧化钠标准溶液之物质的量浓度,mol/l氢氧化钠标准溶液的配制与标定配制:称取100g氢氧化钠,溶于100ml水中,摇匀,注入聚乙烯容器,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000ml无二氧化碳的水称取上述规定的量于105-110C烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g。
硫酸亚铁铵标准溶液标定中浓H2SO4用量探讨

目前在安钢焦化污水分析中,化学需氧量的测定主要采用 CODCr法,其中硫酸亚铁铵作为还原性试剂,在酸性介质中极易被空气氧化而不稳定,一般放置超过24h,硫酸亚铁铵由澄清变为浑浊,出现黄色沉淀,因此每次使用时必须重新标定。
常用重铬酸钾标准溶液进行标定,用浓 H2SO4调整溶液酸度,标定过程每次需加入30ml浓 H2SO4,造成浓 H2SO4大量消耗。
为降低试验成本,通过下列试验来探讨减少浓 H2SO4用量的可行性。
一、试验方案和内容1.试验方案用 K2Cr2O7标准溶液对[Fe(NH4)2(SO4)2]溶液标定时分别加入 30 ml、20 ml、10 ml、5 ml、4 ml、3 ml 浓 H2SO4,进行比对试验,观察试验现象。
2.试验试剂及配制方法(1) c(1/6K2Cr2O7)=0.1mol/L准确称量 4.9035 g 干燥好的 K2Cr2O7,溶于水,转入 1 L 容量瓶中,加水稀释至刻度。
(2) c[Fe(NH4)2(SO4)2]=0.1 mol/L准确称量 39.2 g Fe(NH4)2(SO4)2.6H2O溶于适量水,缓慢加入20ml浓H2SO4,再用水释至1L。
(3)试亚铁灵指示剂称取1.485g邻非啰啉、0.695 g硫酸亚铁,溶于水,稀释至100ml,贮存于棕色瓶中。
3.试验方法自滴定管加入 20 ml c(1/6K2Cr2O7)=0.1 mol/L标准溶液,放入500m l锥形瓶中,加水稀释至110m l左右,缓慢加入浓H2S O4,冷却后,加入3滴试亚铁灵指示剂,用c[(NH4)2Fe(SO4)2]=0.1 mol/L 滴定,溶液颜色由黄色经蓝绿色至红褐色即为终点。
反应方程式如下:Cr2O2-+6Fe2++14H+=2Cr3++6Fe3++7HO二、试验结果按照试验方案,在用 K2Cr2O7标准溶液对[Fe(NH4)2(SO4)2]溶液标定时分别加入 30 ml、20 ml、10 ml、5 ml、4 ml、3 ml 浓 H2SO4,试验结果见表 1。
硫酸亚铁铵的标定

硫酸亚铁铵的标定
重铬酸钾标准溶液:称取1.9615g 重铬酸钾(预先在150 摄氏度干燥2 小时并在干燥器中冷却至室温),置于250ml 烧杯中,加适量水溶解,移人1000mL 容量瓶,用水稀释至刻度,混匀。
硫酸亚铁铵标准滴定溶液:称取15.68g 硫酸亚铁铵溶于1000ml 硫酸(5 95)溶液中,混匀。
标定:移取25.00ml 重铬酸钾标准溶液置于250ml 锥形瓶中,加人10ml 硫酸(1 4),5ml 磷酸,用硫酸亚铁铵标准滴定溶液滴定至橙黄色消失,滴加2 滴N-苯代邻氨基苯甲酸指示剂溶液(N-苯代邻氨基苯甲酸指示剂溶液(0.2g/L):称取0.2gN-苯代邻氨基苯甲酸溶于少量水中,加0.2g 碳酸钠,低温加热溶解后,加水至体积为100ml,混匀。
),继续小心滴至溶液刚呈绿色即为终点。
按下式计算硫酸亚铁铵标准滴定溶液相当于锰的质量浓度p.单位为克每毫升p=c*25.00*54.94*10^-3/(V1 V2) c:重铬酸钾标准溶液的浓度(mol/L)25.00:移取的重铬酸钾标准溶液体积(ml) 54.94:锰的摩尔质量(g/mol) V1:滴定时消耗硫酸亚铁铵标准滴定溶液的体积(ml) V2:滴定空白时消耗硫酸亚铁铵标准滴定溶液的体积(ml) 空白值的侧定:移取10.00ml 重铬酸钾标准溶液于250ml 锥形瓶中,加人40ml 硫酸(1 4),5ml磷酸,用硫酸亚铁铵标准滴定溶液滴定至橙黄色消失,滴加 2 滴N-苯代邻氨基苯甲酸指示剂溶液,继续小心滴至溶液刚呈绿色即为终点。
滴至终点后,再移取10.00ml 重铬酸钾标准溶液于上述锥形瓶中,继续用硫酸亚铁铵标准滴定溶液滴定至终点其两次滴定体积之差即为空白值。
标准溶液的配制和标定方法

标准溶液的配制和标定方法Prepared on 24 November 2020标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/)C(NaOH)= 1mol/LC(NaOH)= LC(NaOH)= LC(NaOH)= L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 5628(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 808080802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/)C(HCl)= 1mol/LC(HCl)= LC(HCl)= L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL190450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
C灼烧至质量恒定的基准无水碳酸钠,称准至0.0001 g。
溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的盐酸溶液滴定至溶液由绿色变为紫红色,再煮沸2min,冷却后,继续滴定至溶液再呈暗紫色。
硫酸亚铁铵的制备和质量鉴定

50 mL 蒸发皿
加入所需 (NH4)2SO4
水浴蒸发 出现晶膜
滤纸 晾干后称量 计算产率
硫酸亚铁铵的制备和质量鉴定
9
3. KMnO4溶液标定
准确称取 Na2C2O4 1.6~2.0g
H2O 100mL
定容250mL 容量瓶
250mL
25.00mL Na2C2O4 溶液 加热 75 - 85℃ 加H2O 30mL KMnO4溶液滴定 3 mol·L-1 H2SO4 10mL
4
合成原理
1. Fe + H2SO4 = FeSO4 + H2↑ 2. FeSO4 + (NH4)2SO4+6H2O = (NH4)2SO4 · FeSO4 · 6H2O
硫酸亚铁铵的制备和质量鉴定
5
检测原理
标定的基本原理
5C2O42- + 2MnO4- + 8H+ = 10CO2 + 2Mn2+ + 4H2O
硫酸亚铁铵 的制备与质量鉴定
制作者
李秀玲
硫酸亚铁铵的制备和质量鉴定 Nhomakorabea1
一、 实验目的
1.
了解复盐的一般特性和制备方法 掌握减压过滤、蒸发结晶等基本操作过 程
2.
3.
掌握KMnO4滴定法测定铁的方法和原理
硫酸亚铁铵的制备和质量鉴定
2
二、实验原理
本实验为小的综合实验,自己合成的产品自己进行品 质检测。 硫酸亚铁铵为浅蓝色单斜晶体。它在空气中比一般亚 铁盐稳定,不易被氧化,溶于水不溶于乙醇,是常用 的化学试剂之一。 与其他复盐相似, (NH4)2SO4 FeSO4 6(H2O)溶解度最小。 可据此进行分离。
标准溶液的配制和标定方法

标准溶液的配制和标定方法标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 560.5 280.313 17.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 6.0 800.5 3.0 800.313 1.878 800.1 0.6 802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×0.2042式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
2020版《中国药典》硫酸亚铁铵滴定液配制与标定操作规程
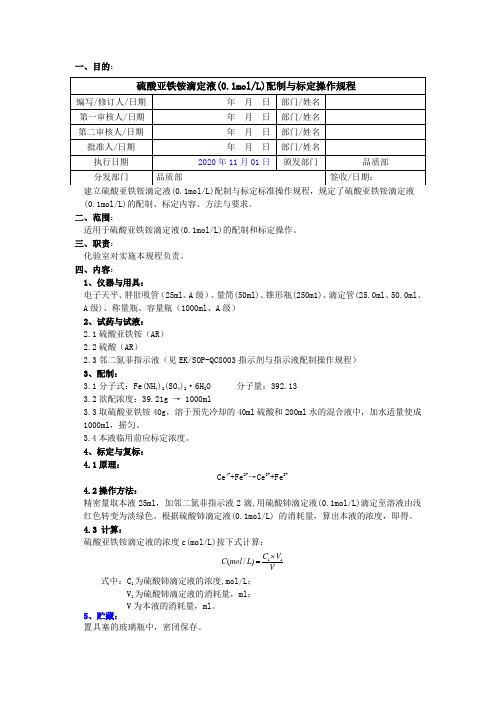
一、目的:(0.1mol/L)的配制、标定内容、方法与要求。
二、范围:适用于硫酸亚铁铵滴定液(0.1mol/L)的配制和标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平、胖肚吸管(25ml 、A 级)、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、称量瓶、容量瓶(1000ml 、A 级)2、试药与试液:2.1硫酸亚铁铵(AR )2.2硫酸(AR )2.3邻二氮菲指示液(见EK/SOP-QC8003指示剂与指示液配制操作规程)3、配制:3.1分子式:Fe(NH 4)2(SO 4)2·6H 2O 分子量:392.133.2欲配浓度:39.21g → 1000ml3.3取硫酸亚铁铵40g ,溶于预先冷却的40ml 硫酸和200ml 水的混合液中,加水适量使成1000ml ,摇匀。
3.4本液临用前应标定浓度。
4、标定与复标:4.1原理:Ce 4++Fe 2+→Ce 3++Fe 3+4.2操作方法:精密量取本液25ml ,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。
根据硫酸铈滴定液(0.1mol/L) 的消耗量,算出本液的浓度,即得。
4.3 计算:硫酸亚铁铵滴定液的浓度c(mol/L)按下式计算:VV C L mol C 11)/(⨯=式中:C 1为硫酸铈滴定液的浓度,mol/L ;V 1为硫酸铈滴定液的消耗量,ml ;V 为本液的消耗量,ml 。
5、贮藏:置具塞的玻璃瓶中,密闭保存。
五、参考文献:《中国药典》2020年版四部通则8006 P431 六、相关文件:EK/SOP-QC8003指示剂与指示液配制操作规程七、相关记录:N/A八、变更记录及原因:。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/)C(NaOH)= 1mol/LC(NaOH)= LC(NaOH)= LC(NaOH)= L(一)氢氧化钠标准溶液的配制:的水中,摇匀,注入聚乙烯容器中,密闭放称取120gNaOH,溶于100mL无CO2置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO的水稀释至21000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 5628(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸的水中,加2滴酚酞指示液(10 氢钾,称准至0.0001 g,溶于下列规定体积的无CO2g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
水,mLC(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO21 808080802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------)×(V—V式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;V——消耗氢氧化钠的量,mL;——空白试验消耗氢氧化钠的量,mL;VM——邻苯二甲酸氢钾的质量,g;——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/)C(HCl)= 1mol/LC(HCl)= LC(HCl)= L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL190450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
C灼烧至质量恒定的基准无水碳酸钠,称准至0.0001 g。
溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的盐酸溶液滴定至溶液由绿色变为紫红色,再煮沸2min,冷却后,继续滴定至溶液再呈暗紫色。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
国家标准硫酸亚铁铵的标定

硫酸亚铁铵溶液的标定
重铬酸钾法测COD时必须要标定硫酸亚铁铵,只要做到随测随标,对测定结果影响不大,如果是提前几天配置的滴定试剂而滴定的时候不进行标定就会误差很大COD的计算公式:CODCr=(V0-V1)×C×8×1000/V
式中C——硫酸亚铁铵标准溶液的浓度,mol/L
V——水样体积,mL
V0——滴定空白时硫酸亚铁铵标准溶液的用量,mL
V1——滴定水样时硫酸亚铁铵标准溶液的用量,mL
8——氧(1/2)摩尔质量,g/mol
(C×8×1 000)/V相当于硫酸亚铁铵对O2的滴定度TO2/(NH4)2Fe(SO4)2,即T=C×8×1000/V
当V=20mL,C=0.1mol/L时,T=(0.1×8×1000)/20=40mg/mL;
当C=0.05mol/L时,T=(0.05×8×1000)/20=20mg/mL。
可见,当C减小时,T也减小
没有明确的要求:硫酸亚铁铵浓度为约等于0.1时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.15~0.40 硫酸亚铁铵浓度为约等于0.01时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.2~0.5。
硫酸亚铁铵的执行标准

硫酸亚铁铵的执行标准
硫酸亚铁铵是一种常用的化学品,其执行标准如下:
1. 外观:白色晶体或无色结晶体。
2. 主要化学指标:
(1)含量:≥99.0%;
(2)铁含量:≤0.002%;
(3)重金属(以Pb计)含量:≤0.001%;
(4)砷(As)含量:≤0.0005%。
3. 硫酸亚铁铵的包装:一般采用铝箔袋、纸板桶或塑料桶等密闭包装,净重每包一般为25公斤或50公斤。
4. 贮藏要求:在干燥、清洁、通风良好的地方储存,避免阳光直射及潮湿、受热、受压或混入有害物质。
注意:以上标准仅供参考,具体标准以所在地区或行业的标准为准。
在使用或储存硫酸亚铁铵时,需严格遵守安全操作规程,如有任何疑问或问题,应及时咨询相关专业人士。
对国标法(HJ828-2017)中硫酸亚铁铵溶液标定方法的改进

对国标法(HJ828-2017)中硫酸亚铁铵溶液标定方法的改进董星星
【期刊名称】《皮革制作与环保科技》
【年(卷),期】2022(3)10
【摘要】在国标(HJ828-2017)水质化学需氧量的测定方法中,标定硫酸亚铁铵标准溶液过程的步骤较多,耗时长,使用药品试剂多,增加了实验的成本。
以滴定完毕的空白样品为介质,加入重铬酸钾溶液,用硫酸亚铁铵标准溶液进行滴定。
通过实验证明这两种方法标定硫酸亚铁铵标准溶液的结果相差不大,且准确性满足实验要求,以滴定完毕的空白样品为介质标定硫酸盐铁铵标准溶液进行平行试验,结果显示其精密性较好。
采取空白样品为介质标定法既省略了标定步骤、节约了标定时间,又节约了样品试剂、节省了试验成本。
【总页数】3页(P180-182)
【作者】董星星
【作者单位】怀远县生态环境监测站
【正文语种】中文
【中图分类】TS5
【相关文献】
1.对国标法(HJ828-2017)测定高氯废水CODCr分析方法的改进
2.COD测定中对低浓度硫酸亚铁铵溶液标定的研究
3.国标法标定高锰酸钾标准溶液的实验条件改
进4.COD_(Cr)中硫酸亚铁铵标准溶液标定方法的改进5.硫酸亚铁铵标准溶液标定中浓H2SO4用量探讨
因版权原因,仅展示原文概要,查看原文内容请购买。
硫酸亚铁铵浓度标定计算公式

硫酸亚铁铵浓度标定计算公式哎呀,说起硫酸亚铁铵浓度标定计算公式,这可是化学里一个挺重要的知识点呢。
咱们先来说说这个公式到底是咋来的。
想象一下,你在实验室里,面前摆着一堆瓶瓶罐罐,各种化学试剂,然后你要通过一系列的操作来得出硫酸亚铁铵的准确浓度。
这就像一场解谜游戏,而这个计算公式就是解开谜题的关键钥匙。
标定硫酸亚铁铵浓度的时候,咱们通常会用到一种叫重铬酸钾的物质。
为啥用它呢?因为重铬酸钾性质稳定,就像一个靠谱的“基准”。
比如说有一次我在实验室里带着学生们做这个实验。
有个学生特别紧张,手都有点抖,结果不小心把试剂加过量了。
我就笑着跟他说:“别慌别慌,这只是一次小失误,咱们重新来。
”然后一步一步地带着他重新操作。
那这个计算公式具体是啥样呢?一般是这样的:$c[(NH_4)_2Fe(SO_4)_2] = \frac{6c_1V_1}{V_2}$ 。
这里面,$c_1$ 是重铬酸钾标准溶液的浓度,$V_1$ 是消耗的重铬酸钾标准溶液的体积,$V_2$ 是滴定时消耗硫酸亚铁铵溶液的体积。
在实际计算的时候,可不能马虎。
要仔细地读取数据,保证每一个数字都是准确的。
就像搭积木一样,一块出错,整个房子就歪了。
还记得有一回,一个学生计算的时候把小数点的位置点错了,结果得出一个特别离谱的浓度值。
我就指着他的计算过程,耐心地跟他说:“你看啊,这里小数点一错,后面可就全乱套啦。
”然后带着他重新梳理计算步骤。
总之,掌握硫酸亚铁铵浓度标定计算公式,需要咱们多动手做实验,多细心计算。
可别嫌麻烦,每一次准确的计算都是向化学世界更深处探索的一小步。
就像在化学的海洋里航行,这个公式就是我们的指南针,指引着我们找到正确的方向。
所以呀,同学们,加油吧!认真对待每一次实验,熟练运用这个公式,让我们在化学的奇妙世界里畅游无阻!。
硫酸亚铁铵含量测定

谢 谢!
微红色,从而指示滴定终点,不需另外再加其它指示剂 。
根据KMnO4标准溶液的浓度和滴定所消耗的体积,即可计算 出试样中亚铁的物质的量,进而计算出试样中硫酸亚铁铵的
百分含量 。
W=
5C(KMnO4)V(KMnO4) ×10-3×M m样
× 100%
M=392g/mol M-H2O=284g/mol
三、实验仪器与试剂
C(KMnO4)/mol/L V(KMnO4)/ml
硫酸亚铁铵的含量(%) 硫酸亚铁铵的平均含量(%)
绝对偏差di 绝对平均偏差d
六、注意事项
1、标定过程中三次体积的极差应不大于0.05ml。
2、测定硫酸亚铁铵时,应将锥形瓶编好号码,要溶 解一份滴一份,因为Fe 2+易被氧化。
七、问题讨论
1、KMnO4法测定亚铁的方法、原理是什么? 2、加入H3PO4的作用是什么?
硫酸亚铁铵含量测定
一、实验目的
掌握KMnO4法测定亚铁盐中铁含量的原理和方法 。
二、实验原理
•
KMnO4在酸性介质中可将Fe2+离子定量地氧化,其
本身被还原为Mn2+ ,反应式为:
5Fe2+ + MnO4- + 8H+ = Mn2+ + 5Fe3+ + 4H2O 滴定到化学计量点时,微过量的KMnO4即可使溶液呈现
仪器: 容量瓶(250 mL)、烧杯(l00 mL 250 mL)、移
液管(25 mL)、滴定管(50 mL)、 量筒(10 mL)、锥形瓶。
药品: 硫酸亚铁铵、H2SO4-H3PO4混酸、高锰酸钾
(0.025SO4·FeSO4·6H2O样品
Fe标准溶液的配置解析

标定方法如下:准确吸取25.0mL氯标准溶液于250mL锥形瓶中,加入5mL硝酸溶液和25.0mL硝酸银溶液,摇动至沉淀分层,加入5mL邻苯二甲酸二丁酯,摇动片刻。
加入水,使溶液总体积约为100mL,加入2mL硫酸铁铵指示液,用硫氰酸铵标准滴定溶液滴定剩余的硝酸银,至出现浅橙红色或浅砖红色为止。
同时进行空白试验。
硫酸亚铁铵标准滴定液 GB/T 601-2002---硫酸亚铁铵标准滴定液C[(NH4)2Fe2(SO4) 2]= 0.1 mol/L1.1配制:称取40克硫酸亚铁铵[(NH4)2F e2(SO4) 2·6H2O],溶于300毫升硫酸溶液(20%)中,加700毫升水,摇均。
1.2 标定:量取35.00毫升~40.00毫升配制好的硫酸亚铁铵溶液,加25毫升无氧的水,用高锰酸钾标准滴定液[C(1/5KMnO4)=0.1 mol/L]滴定至溶液呈粉红色,并保持30秒,临用前标定。
硫酸亚铁铵标准滴定液的浓度{C[(NH4)2Fe2(SO4) 2]},数值以摩尔每升(mol/L)表示,按式(16)计算:C[(NH4)2Fe2(SO4) 2]= V1 c1/V (16)式中: c1----高锰酸钾标准滴定液的浓度的准确数值,单位为摩尔每升(mol/L);V1---高锰酸钾标准滴定液的体积的数值,单位为毫升(ml);V---硫酸亚铁铵溶液的体积的准确数值,单位为毫升(ml);实验原理过量的铁溶于稀硫酸可得硫酸亚铁。
等物质的量的硫酸亚铁与硫酸铵作用,能生成溶解度较小的硫酸亚铁铵((NH4)2SO4·FeSO4·6H2O,浅绿色晶体),该晶体的商品名称为摩尔盐。
Fe(铁屑)+ H2SO4(稀)= FeSO4+ H2 ↑FeSO4 +(NH4)2SO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O硫酸亚铁铵是一种复盐,一般亚铁盐在空气中易被氧化,但形成复盐后就比较稳定,不易被氧化,因此在定量分析中常用来配制亚铁离子的标准溶液。
中华人民共和国国家标准 铬

中华人民共和国国家标准固体废物总铬的测定硫酸亚铁铵滴定法Solid waste一Determination of total chromium —Titrimetric methodGB/T 15555.8—19951 主题内容与适用范围1.1 本标准规定了测定固体废物浸出液中总铬的硫酸亚铁铵滴定法。
1.2 本标准方法适用于固体废物浸出液中总铬的测定,方法也可测定水和废水中的总铬。
1.2.1 方法的定量下限为1 mg/mL。
1.2.2 干扰钒对测定有干扰,除钒渣浸出液外一般浸出液中钒的含量不会影响测定。
三价铁干扰测定,当三价铁的浓度(m/L)为铬的l75倍时,可引入2.8%的相对误差。
2 原理在酸性溶液中,以银盐作催化剂,用过硫酸铵将三价铬氧化成六价铬。
加入少量氯化钠煮沸除去过量的过硫酸铵及反应中产生的氯气等氧化剂。
以苯基代邻氨基苯甲酸做指示剂,用硫酸亚铁铵溶液滴定六价铬,过量的硫酸亚铁铵与指示剂反应,溶液呈亮绿色作为终点。
根据硫酸亚铁铵标准溶液的用量计算出固体废物浸出液中的总铬含量。
反应方程式如下:3(NH4)2S2O8+Cr2(SO4)3+7H2O=3(NH4)2SO4+H2Cr2O7+6H2SO46Fe(NH4)2(SO4)2+H2Cr2O7+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+6(NH4)2SO4+7H2O 3 试剂除非另有说明,均使用符合国家标准或专业标准的试剂,去离子水或同等纯度的水。
3.1 氨水:(1+1)。
3.2 硫酸-磷酸混合溶液:将150mL浓硫酸缓慢加入到700 mL水中,冷却后加入150 mL 浓磷酸溶液,混匀。
3.3 硝酸银溶液5g/L:将硝酸银(AgNO3)0.5g溶于水中并稀释至100mL。
3.4 硫酸锰溶液10 g/L:将硫酸锰1g溶于水中并稀释至100 mL。
3.5 过硫酸铵溶液250g/L:将25 g过硫酸铵[(NH4)2S2O8]溶于100mL水中。
化验室常用药品的配制和标定方法

化验室常用药品的配制和标定方法一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 560.5 280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 6.0800.5 3.0800.1 0.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×0.2042式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L; V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL1900.5 450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
硫酸亚铁标准溶液标定

硫酸亚铁标准溶液标定
硫酸亚铁标准溶液是化学实验室中常用的一种溶液,用于分析化学中的滴定和定量分析。
标定硫酸亚铁标准溶液是为了确定其准确浓度的过程,确保实验结果的准确性。
本文将介绍硫酸亚铁标准溶液的标定方法及步骤。
首先,准备好所需试剂和设备,包括硫酸亚铁标准溶液、硫酸、硝基酚、硫酸铵、甲醛、酚酞指示剂、容量瓶、移液管、烧杯等。
其次,进行标定操作。
首先取一定量的硫酸亚铁标准溶液,用移液管转移到烧杯中。
然后加入适量的硫酸和硝基酚,加热至沸腾,使得硫酸亚铁完全氧化为三价铁离子。
接着加入硫酸铵和甲醛,使得三价铁离子还原为二价铁离子。
最后用酚酞指示剂进行滴定,直至出现颜色变化,记录所耗硫酸亚铁标准溶液的体积。
最后,计算硫酸亚铁标准溶液的浓度。
根据滴定时所耗标准溶液的体积和反应的化学方程式,可以计算出硫酸亚铁标准溶液的浓度。
在进行硫酸亚铁标准溶液的标定过程中,需要注意以下几点,首先,实验操作要准确无误,尽量避免误差的产生;其次,要严格按照标定方法和步骤进行操作,确保实验结果的可靠性;最后,对实验数据进行仔细的处理和计算,得出准确的硫酸亚铁标准溶液浓度。
总之,硫酸亚铁标准溶液的标定是化学实验中重要的一步,它直接关系到实验结果的准确性和可靠性。
只有通过严谨的实验操作和精确的计算,才能得到准确的硫酸亚铁标准溶液的浓度,从而保证实验结果的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸亚铁铵溶液的标定
重铬酸钾法测COD时必须要标定硫酸亚铁铵,只要做到随测随标,对测定结果影响不大,如果是提前几天配置的滴定试剂而滴定的时候不进行标定就会误差很大COD的计算公式:CODCr=(V0-V1)×C×8×1000/V
式中C——硫酸亚铁铵标准溶液的浓度,mol/L
V——水样体积,mL
V0——滴定空白时硫酸亚铁铵标准溶液的用量,mL
V1——滴定水样时硫酸亚铁铵标准溶液的用量,mL
8——氧(1/2)摩尔质量,g/mol
(C×8×1 000)/V相当于硫酸亚铁铵对O2的滴定度TO2/(NH4)2Fe(SO4)2,即T=C×8×1000/V
当V=20mL,C=0.1mol/L时,T=(0.1×8×1000)/20=40mg/mL;
当C=0.05mol/L时,T=(0.05×8×1000)/20=20mg/mL。
可见,当C减小时,T也减小
没有明确的要求:硫酸亚铁铵浓度为约等于0.1时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.15~0.40 硫酸亚铁铵浓度为约等于0.01时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.2~0.5。
