硫酸亚铁铵(0.1 ) 滴定液07.5.30
硫酸亚铁铵的标定

硫酸亚铁铵的标定硫酸亚铁铵(Ammonium ferrous sulfate),也称为褐矾,是一种常用的分析化学试剂,通常用于分析化学实验中的铁离子检测和标定。
标定硫酸亚铁铵的目的是确定其精确浓度,以便在实验中准确测量其他物质的含量。
下面是标定硫酸亚铁铵的一般步骤:实验所需材料和试剂:- 硫酸亚铁铵样品(待标定的)- 氯化银标准溶液(用于指示剂)- 铜硫酸标准溶液(用于还原硫酸亚铁铵)- 硫酸亚铁铵标准溶液(用于标定)- 蒸馏水- 玻璃烧杯、烧杯夹、滴定管等实验室用具标定步骤:1. 取一定量(通常称为样品体积)的硫酸亚铁铵样品,加入烧杯中。
2. 加入几滴氯化银标准溶液作为指示剂。
这将导致硫酸亚铁铵溶液变为白色乳状。
3. 通过滴定管,缓慢滴入铜硫酸标准溶液,同时不断搅拌。
铜硫酸会还原硫酸亚铁铵中的铁离子。
当硫酸亚铁铵完全被还原时,白色沉淀将完全消失。
4. 记录滴定液滴加的体积。
这是硫酸亚铁铵中铁离子的等当量体积。
5. 使用硫酸亚铁铵标准溶液的浓度和已知体积,计算出待标定硫酸亚铁铵的精确浓度。
通常使用滴定反应的方程式来进行计算。
注意事项:- 确保实验室操作安全,佩戴适当的个人防护装备,如实验室手套和护目镜。
- 涉及到有害物质的操作时,需在通风良好的实验室环境中进行。
- 标定硫酸亚铁铵需要高精度,确保仪器和试剂的准确性和精密度。
请注意,标定硫酸亚铁铵的实际步骤可能因具体实验和试剂的不同而有所变化,因此在进行标定之前,请查阅试剂瓶上的生产商提供的详细标定方法。
此外,确保在实验室中按照安全操作规程进行操作。
COD国标(1)

5.3 25mL或50mL酸式滴定管。
6 采样和样品
6.1 采样 水样要采集于玻璃瓶中,应尽快分析。如不能立即分析时,应加入硫酸(4.3)至pH<2,置4℃下保存。但保存时间不多于5天。采集水样的体积不得少于100mL。
2 定义
在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸钾盐相对应的氧的质量浓度。
3 原理
在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾有西欧爱好的硫酸亚铁铵的量换算成消耗氧的质量浓度。
4.6.3 硫酸亚铁铵标准滴定溶液浓度的计算: 10.00*0.250 2.50 C〔(NH4)2Fe(SO4)2·6H2O〕= V V 式中:V——滴定时消耗硫酸亚铁铵溶液的毫升数。
4.6.4 浓度为C〔(NH4)2Fe(SO4)2·6H2O〕≈0.010mol/L的硫酸亚铁铵标准滴定溶液:将4.6.1条的溶液稀释10倍,用重铬酸钾标准溶液(4.5.2)标定,其滴定步骤及浓度计算分别与4.6.2及4.6.3类同。 4.7 邻苯二甲酸氢钾标准溶液,C(KCr6H5O4)=2.0824m mol/L:称取105℃时干燥2h的邻苯二甲酸氢钾(HOOCC6H4COOK)0.4251g溶于水,并稀释至1000Ml,混匀。以重铬酸钾为氧化剂,将邻苯二甲酸氢钾完全氧化的COD值为1.176g氧/克(指1g邻苯二甲酸氢钾耗氧1.176g)故该标准溶液的理论COD值为500mg/L。 4.8 1,10-菲绕啉(1,10-phenathroline monohy drate)指示剂溶液:溶解0.7g七水合硫酸亚铁(FeSO4·7H2O)于50mL的水中,加入1.5g1,10-菲绕啉,搅动至溶解,加水稀释至100mL。
硫酸亚铁铵滴定液

本液临用前应标定浓度。
标
定
基准试剂名称:硫酸铈滴定液(0.1mol/L)
步骤:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.1mol/L)的消耗量,算出本液的浓度,即得。
要求:1.校正因子:0.95~1.05 2.精密度:相对平均偏差(D)≤0.1%
标
化
称量记录
溶液与浓度
起始
读数
终止
读数
实耗体积(ml)
计算
F值
D
结论
该滴定液浓度为
mol/L
复核Βιβλιοθήκη 标化员复核员复
标
该滴定液浓度为
mol/L
复
核
标化员
复核员
备注
滴定液配制及标化记录
编号:011
滴定液名称:硫酸亚铁铵配制数量:配制日期:年月日
基准试剂名称:硫酸铈滴定液(0.1mol/L)标化温度:标化日期:年月日
标化指示剂名称:邻二氮菲复标温度:复标日期:年月日
配
制
方法依据:《中国药典2005版》二部附录
步骤:取硫酸亚铁铵g,溶于预先冷却的ml硫酸和ml水的混合液中,加水适量使成
硫酸亚铁铵标准溶液的配制和标定

硫酸亚铁铵标准溶液的配制和标定
硫酸亚铁铵(Ammonium Ferrous Sulfate)是一种重要的化学试剂,常用于分析化学和质量控制等领域。
以下是关于硫酸亚铁铵标准溶液的配制和标定的详细内容:
配制标准溶液的步骤:
1.准备所需材料:硫酸亚铁铵固体、蒸馏水。
2.称取适量硫酸亚铁铵固体,放入干净的容器中。
3.加入适量蒸馏水,搅拌溶解,直至固体完全溶解。
4.将溶液转移到容量瓶中,并用蒸馏水稀释至刻度线标记。
5.用瓶塞封好容量瓶,轻轻摇匀。
6.标上浓度、配制日期和标识。
标定标准溶液的步骤:
1.取一定量硫酸亚铁铵标准溶液,转移至容量瓶中。
2.加入适量稀硫酸溶液(浓度较低),使反应发生,生成Fe3+。
3.用稀硫酸溶液滴定Fe3+,直到颜色由浅黄色变为浅红色。
4.记录滴定所需的稀硫酸溶液体积V1。
5.根据反应方程式计算Fe3+的摩尔浓度。
6.根据已知的硫酸亚铁铵标准溶液的摩尔浓度和稀硫酸溶液的体积,计算出
标准溶液的浓度。
通过以上步骤,我们可以得到硫酸亚铁铵标准溶液的准确浓度,并且可以根据需要进行调整。
配制和标定标准溶液的过程需要严格控制实验条件,使用精密仪器和优质试剂,确保结果的可靠性和准确性。
同时,在实验过程中要注意安全操作,避免直接接触硫酸亚铁铵和稀硫酸溶液,穿戴好实验服、手套和护目镜等防护装备。
希望以上内容对你了解硫酸亚铁铵标准溶液的配制和标定有所帮助!。
化学分析方法(容量法)

□□□□□□□□工程公司企业标准金属化学分析方法(容量法)□□□□□□□□工程公司标准化委员会发布Q/YS1.658—2006目次前言 (Ⅱ)1 范围 (1)2 引用文件 (1)3 术语和定义 (1)4 职责 (2)5 工作程序 (2)5.1 检测流程图 (2)5.2 接收《检验委托单》 (2)5.3 技术交底 (3)5.4 确认被检项目(部件) (3)5.5 检测准备 (3)5.6 管式炉内燃烧后气体容量法测定碳量 (5)5.7 管式炉内燃烧后碘酸钾滴定法测定硫量 (7)5.8 过硫酸铵氧化容量法测定铬量 (11)5.9 亚砷酸钠——亚硝酸钠滴定法测定锰量 (16)5.10 硫酸亚铁铵滴定法测定钒含量 (19)5.11 记录 (22)5.12 检验结果评判 (23)5.13 不合格品处理 (23)5.14 检验报告 (23)5.15 质量控制 (23)5.16 安全环境控制 (25)6 记录 (26)附录A (规范性附录)金属化学分析(容量法)流程图 (27)附录B (资料性附录)记录表样 (29)表B.金属026 化学分析(容量法)检验记录 (30)表B.金属027 化学分析(碳硫)检验记录 (31)Q/YS1.658—2006前言本标准中附录表A为规范性附录。
本标准中附录表B为资料性附录。
本标准由金属检测中心提出。
本标准批准人:本标准归口部门:本标准审核人:本标准会审人:本标准起草单位:本标准起草人:本标准校对人:本标准于××××年×月首次发布。
更改记录页说明:本表由文件持有人根据“文件更改审批通知单”及时填写。
Q/YS1.658—2006金属化学分析方法(容量法)1 范围本方法适用于金属材料中碳量的气体容量法,铬量的氧化容量法,硫、锰、钒量的滴定法测定。
2 引用标准下列标准中的条文通过本标准的引用而成为本标准的条文。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,凡是不注日期的引用文件,其最新版本适用于本标准。
重铬酸钾测COD__国标法测定COD的方法

重铬酸钾测COD__国标法测定COD的方法COD实验室检测标准方法1、主题内容与应用范围本标准规定了水中化学需氧量的测定方法。
本标准适用于各种类型的含COD值大于30mg,L的水样~对未经稀释的水样的测定上限为700mg,L。
本标准不适用于含氯化物浓度大于1000mg,L(稀释后)的含盐水。
2 、定义在一定条件下~经重铬酸钾氧化处理时~水样中的溶解性物质和悬浮物所消耗的重铬酸盐相对应的氧的质量浓度。
3 、原理在水样中加入已知量的重铬酸钾溶液~并在强酸介质下以银盐作催化剂~经沸腾回流后~以试亚铁灵为指示剂~用硫酸亚铁铵滴定水样中未被还原的重铬酸钾由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。
在酸性重铬酸钾条件下~芳烃及吡啶难以被氧化~其氧化率较低。
在硫酸银催化作用下~直链脂肪族化合物可有效地被氧化。
4、试剂除非另有说明~实验时所用试剂均为符合国家标准的分析纯试剂~试验用水均为蒸馏水或同等纯度的水。
4.1 硫酸银(Ag2SO4)~化学纯。
4.2 硫酸汞(HgS04)~化学纯。
4.3 硫酸(H2SO4)~p,1.84g,mL。
4.4 硫酸银,硫酸试剂:向1L硫酸(4.3)中加入10g硫酸银(4.1).放置1—2天使之溶解~并混匀~使用前小心摇动。
4.5 重铬酸钾标准溶液:4.5.1 浓度为C(1,6K2Cr2O7),0.250mol,L的重铬酸钾标准溶液:将12.258g在105?干燥2h后的重铬酸钾溶于水中~稀释至1000mL。
4.5.2 浓度为C(1/6K2Cr2O7),0.0250mo1,L的重铬酸钾标准溶液:将4.5.1条的溶液稀释10倍而成。
4.6硫酸亚铁铵标准滴定溶液4.6.1 浓度为C[(NH4)2Fe(SO4)2〃6H2O]?0.10mo1,L的硫酸亚铁铵标准滴定溶液,溶解39g硫酸亚铁铵[(NH4)2Fe(SO4)2〃6H2O]于水中~加入20mL硫酸(4.3)~待其溶液冷却后稀释至1000mL。
水和废水检测 化学需氧量的测定 重铬酸盐法 GB 11914

水和废水检测 化学需氧量的测定 重铬酸盐法 GB 11914-19891. 定义在一定条件下,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸盐相对应的氧的质量浓度。
2. 原理在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。
在酸性重铬酸钾条件下,芳烃及吡啶难以被氧化,其氧化率较低。
在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化。
3. 试剂3.1 硫酸银,化学纯。
3.2 硫酸汞,化学纯。
3.3 硫酸,ρ=1.84 g/ml,。
3.4 硫酸银-硫酸试剂:向1L 硫酸(3.3)中加入10硫酸银(3.1),放置1-2天,使之溶解,并混匀,使用前小心摇动。
3.5 重铬酸钾标准溶液: 3.5.1 浓度为C (61K 2Cr 2O 7)=0.250mol/L 的重铬酸钾标准溶液:将12.258g 在105℃干燥2h 后的重铬酸钾溶于水中,稀释至1000ml 。
3.5.2 浓度为C (61K 2Cr 2O 7)=0.250mol/L 的重铬酸钾标准溶液:将3.5.1条的溶液稀释10倍而成。
3.6 硫酸亚铁铵标准滴定溶液3.6.1 浓度为C ≈0.10mol/L 的硫酸亚铁铵标准滴定溶液:溶解29g 硫酸亚铁铵于水中,加入20ml ,硫酸(3.3),待其溶液冷却后稀释至1000ml 。
3.6.2 每日 ,必须用重铬酸钾标准溶液(3.5.1)准确标定此溶液(3.6.1)的浓度。
取10.00ml 重铬酸钾标准溶液(3.5.1)置于锥形瓶中,用水标定至约100ml ,加入30ml 硫酸(3.3),混匀,冷却后,加3滴(约0.15ml )试亚铁灵指示剂(3.7),用硫酸亚铁铵(3.6.1)滴定溶液的颜色由黄色经蓝绿色变为红褐色,即为终点。
记录下硫酸亚铁铵的消耗量(ml )。
硫酸亚铁铵滴定液标定记录单

名称
硫酸亚铁铵滴定液
配制浓度
0.1mol/L
标定温度
℃
标定浓度
mol/L
相对湿度
%
配制量
ml
配制日期
年月日标定人标定来自期年月日依据《中国药典》2010年版二部
标定:
精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。根据硫酸铈滴定液(0.01mol/L)的消耗量,算出本液的浓度。即得。
消耗硫酸铈滴定液(0.1mol/l)的毫升数:
⑴ml;⑵ml;⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。标定结果。
标定人:
2020版《中国药典》硫酸亚铁铵滴定液配制与标定操作规程
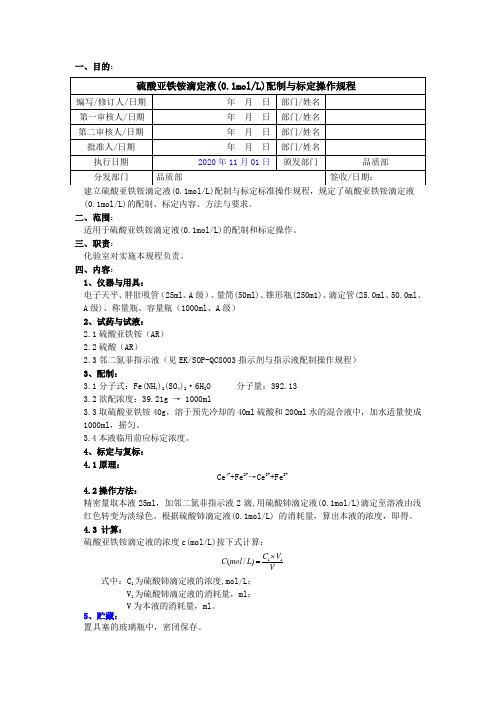
一、目的:(0.1mol/L)的配制、标定内容、方法与要求。
二、范围:适用于硫酸亚铁铵滴定液(0.1mol/L)的配制和标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平、胖肚吸管(25ml 、A 级)、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、称量瓶、容量瓶(1000ml 、A 级)2、试药与试液:2.1硫酸亚铁铵(AR )2.2硫酸(AR )2.3邻二氮菲指示液(见EK/SOP-QC8003指示剂与指示液配制操作规程)3、配制:3.1分子式:Fe(NH 4)2(SO 4)2·6H 2O 分子量:392.133.2欲配浓度:39.21g → 1000ml3.3取硫酸亚铁铵40g ,溶于预先冷却的40ml 硫酸和200ml 水的混合液中,加水适量使成1000ml ,摇匀。
3.4本液临用前应标定浓度。
4、标定与复标:4.1原理:Ce 4++Fe 2+→Ce 3++Fe 3+4.2操作方法:精密量取本液25ml ,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由浅红色转变为淡绿色。
根据硫酸铈滴定液(0.1mol/L) 的消耗量,算出本液的浓度,即得。
4.3 计算:硫酸亚铁铵滴定液的浓度c(mol/L)按下式计算:VV C L mol C 11)/(⨯=式中:C 1为硫酸铈滴定液的浓度,mol/L ;V 1为硫酸铈滴定液的消耗量,ml ;V 为本液的消耗量,ml 。
5、贮藏:置具塞的玻璃瓶中,密闭保存。
五、参考文献:《中国药典》2020年版四部通则8006 P431 六、相关文件:EK/SOP-QC8003指示剂与指示液配制操作规程七、相关记录:N/A八、变更记录及原因:。
硫酸亚铁铵标准溶液的配制

硫酸亚铁铵标准溶液的配制硫酸亚铁铵标准溶液是实验室常用的一种溶液,通常用于分析化学中的定量分析和质量分析。
它的配制需要严格按照一定的比例和步骤进行,以保证溶液的准确性和稳定性。
下面将介绍硫酸亚铁铵标准溶液的配制方法。
首先,准备所需的原料和仪器。
配制硫酸亚铁铵标准溶液所需的原料包括硫酸亚铁铵、二甲苯、甲醇等。
配制过程需要使用的仪器有天平、烧杯、容量瓶、移液管等。
在配制过程中,需要确保原料和仪器的干净和无污染,以免影响溶液的准确性。
其次,按照一定的比例将硫酸亚铁铵溶解于溶剂中。
在配制硫酸亚铁铵标准溶液时,需要根据所需浓度的不同来确定溶解比例。
一般来说,可以先将一定质量的硫酸亚铁铵称取到烧杯中,然后加入适量的溶剂进行溶解。
在溶解的过程中,需要充分搅拌以保证溶质充分溶解,从而得到均匀的溶液。
接着,将溶解好的溶液转移至容量瓶中,并用溶剂定容。
在将溶解好的溶液转移至容量瓶中时,需要借助移液管等工具,以避免溶液的挥发或溢出。
在转移过程中,需要注意容量瓶的刻度线,并在接近刻度线时,逐滴加入溶剂,直至液面达到刻度线。
然后轻轻摇匀容量瓶中的溶液,使其充分混合,最终得到所需浓度的硫酸亚铁铵标准溶液。
最后,进行溶液的调整和稳定。
配制好的硫酸亚铁铵标准溶液可能会因为各种因素而出现浓度偏差,因此需要进行适当的调整。
可以使用标准物质进行校准,以确保溶液的准确性。
另外,为了保证溶液的稳定性,可以在配制好的溶液中加入一定量的稳定剂,以延长其有效期限。
总之,硫酸亚铁铵标准溶液的配制需要严格按照一定的步骤和比例进行,以确保溶液的准确性和稳定性。
在配制过程中,需要注意原料和仪器的清洁,溶解比例的准确性,溶液的转移和稳定等关键步骤,从而得到符合要求的标准溶液。
希望以上内容能对您在实验室工作中的配制工作有所帮助。
国家标准硫酸亚铁铵的标定

硫酸亚铁铵溶液的标定
重铬酸钾法测COD时必须要标定硫酸亚铁铵,只要做到随测随标,对测定结果影响不大,如果是提前几天配置的滴定试剂而滴定的时候不进行标定就会误差很大COD的计算公式:CODCr=(V0-V1)×C×8×1000/V
式中C——硫酸亚铁铵标准溶液的浓度,mol/L
V——水样体积,mL
V0——滴定空白时硫酸亚铁铵标准溶液的用量,mL
V1——滴定水样时硫酸亚铁铵标准溶液的用量,mL
8——氧(1/2)摩尔质量,g/mol
(C×8×1 000)/V相当于硫酸亚铁铵对O2的滴定度TO2/(NH4)2Fe(SO4)2,即T=C×8×1000/V
当V=20mL,C=0.1mol/L时,T=(0.1×8×1000)/20=40mg/mL;
当C=0.05mol/L时,T=(0.05×8×1000)/20=20mg/mL。
可见,当C减小时,T也减小
没有明确的要求:硫酸亚铁铵浓度为约等于0.1时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.15~0.40 硫酸亚铁铵浓度为约等于0.01时,定时的用量与滴定空白样时硫酸亚铁铵的用量差0.2~0.5。
硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量

143管理及其他M anagement and other硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量陈 瑶,李 轩,伍 换,李孟宽(阳江海关综合技术服务中心,广东 阳江 529500)摘 要:为研究硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量,本文采用过氧化钠碱熔融法熔化高碳铬铁标样,置于660℃熔融9min,在硫磷酸介质条件下,用硫酸亚铁铵滴定法测定其铬的含量,结果与标准样品值相符。
方法操作流程简单,精密度和准确度均能够满足铬铁合金中铬含量的分析要求。
关键词:铬铁合金;硫酸亚铁铵;铬;滴定法中图分类号:X781.1 文献标识码:A 文章编号:11-5004(2021)07-0143-2 收稿日期:2021-04作者简介:陈瑶,女,生于1990年,汉族,广东人,本科,化学工程与工艺助理工程师,研究方向:化学检验。
铬铁合金按其含碳量可分为高碳铬铁、中碳铬铁、低碳铬铁、微碳铬铁和超微碳铬铁,而高碳铬铁是生产不锈钢的重要原料。
在炼钢工艺中,铬能改善钢的抗氧化性、耐蚀性,200系不锈钢含铬量约在16%,300系不锈钢含铬量约在25%,400系不锈钢含铬量约在14%[1]。
因此,铬含量是衡量不锈钢质量的一项重要指标,决定其实际用途。
本文采用过氧化钠碱熔融法分解高碳铬铁标样,用硫酸亚铁铵滴定法测定其铬的含量,也对影响铬铁合金中快速测定铬的各种因素进行了选择试验,该方法反应现象明显,操作条件易掌握。
1 实验部分1.1 仪器和试剂过氧化钠;磷酸;硫酸(1+1);高锰酸钾溶液(1g/L);氯化钠溶液(100g/L);N-苯基邻氨基苯甲酸指示剂(2g/L,溶于2g/L 无水碳酸钠溶液);硫酸亚铁铵标准滴定溶液(0.1000mol/L)。
上述溶液所用试剂均为分析纯,试验用水为超纯水。
普兰德 AS 级滴定管(50mL)。
硫酸亚铁铵标准滴定溶液(0.1000mol/L)按GB/T601-2016[2]方法标定。
(整理)常用滴定液配制与标定

常用滴定液配制与标定乙二胺四醋酸二钠滴定液(0.05mol/L) C10H14N2Na2O8·2H2O=372.24 18.61g→1000ml【配制】取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
【标定】取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液 (0.05mol/L) 相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
乙醇制氢氧化钾滴定液(0.5mol/L) KOH=56.11 28.06g→1000ml【配制】取氢氧化钾35g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
【标定】精密量取盐酸滴定液(0.5mol/L)25ml,加水50ml稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
【贮藏】置橡皮塞的棕色玻瓶中,密闭保存。
四苯硼钠滴定液(0.02mol/L) (C6H5)4BNa=342.22 6.845g→1000ml【配制】取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25ml水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000ml,摇匀。
【标定】精密量取本液10ml,加醋酸-醋酸钠缓冲液(pH3.7)10ml与溴酚蓝指示液0.5ml,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。
用重铬酸钾标定硫酸亚铁铵滴定液

y = 0.999 9 x + 4 E-06 R = 1用重铬酸钾标定硫酸亚铁铵滴定液张 涛!张 静!耿可聪(华北制药康欣有限公司,河北 石家庄 050015)[ 摘 要] 以重铬酸钾为基准物标定硫酸亚铁铵滴定液,将标定结果与法定标准(硫酸铈法)做对照,通过相关分析表明,两种方法完全一致。
该方法具有简便、快速、准确的特点。
[ 关键词] 重铬酸钾;硫酸亚铁铵滴定液;相关系数 [ 中图分类号] O 655.2[ 文献标识码] B[ 文章编号] 1003-5095(2008)08-0076-02中国药典 2005 年版规定硫酸亚铁铵滴定液的标定方法为硫酸铈法[1]。
该法为间接标定,硫酸铈滴定 液还需用基准物三氧化二砷(俗称砒霜)来标定。
药典 的方法不仅复杂、难操作,而且用到剧毒品,对人对环 境有较大危害。
本文用重铬酸钾标定硫酸亚铁铵滴定 液,并将滴定结果与硫酸铈法做了对照。
化二砷为基准物[1]。
2 结果与分析取硫酸亚铁铵滴定液高、中、低共 5 个浓度点,分别用重铬酸钾法和硫酸铈法标定(表 1)。
表 1 两种方法标定硫酸亚铁铵滴定液的浓度(单位:mol/L ) 浓度点1 2 3 4 5 0.104 7 0.104 7 0.104 6 0.103 8 0.103 7 0.103 6 0.102 1 0.102 0 0.102 2 0.100 2 0.100 1 0.100 3 0.0771 7 0.0771 50.0771 61 1. 1 实验原理重铬酸钾法 4 次平行 6 Fe(NH 4)2(SO 4)2+K 2Cr 2O 7+7 H 2SO 4=3 Fe 2(SO 4)3+Cr 2(SO 4)3+K 2SO 4+6 (NH 4)2SO 4+7 H 2O实验材料重铬酸钾:基准物质,天津市化学试剂研究所;硫0.104 70.103 6 0.102 1 0.100 2 0.0771 5 重铬酸钾 法平均值 0.104 7 0.103 7 0.102 1 0.100 2 0.0771 61. 2 硫酸铈法 平均值0.104 6 0.103 7 0.102 1 0.100 3 0.0771 42. 1 直观分析由表 1 可知,每个浓度点 4 次平行的相对偏差均不大于 0.1%,这符合中国药典对平行实验精密度的 要求。
标准溶液配制与标定

标准溶液配制与标定标准溶液配制与标定2007-09-20 17:46硫代硫酸钠标准溶液配制与标定硫代硫酸钠标准溶液配制与标定硫代硫酸钠滴定液(0.1mol/L)配制称取26g硫代硫酸钠(Na2S2O3·5H2O)(或无水硫代硫酸钠16g),溶于1000ml纯水中,缓缓煮沸10分钟,冷却,放置两周后滤过备用。
2.标定(1)标定方法称取在120℃干燥至恒重的基准重铬酸钾0.15g,称准至0.0001g,置于碘量瓶中,加水25ml使溶解,加碘化钾2.0g,轻轻振摇使溶解,加20%硫酸20ml,摇匀,密塞;在暗处放置10分钟后,加水150ml稀释,用配制好的硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液3ml(5g/L),继续滴定至蓝色消失而显亮绿色,同时作空白实验。
(2)计算:C=M/mvm————重铬酸钾g;c(Na2S2O3)——硫代硫酸钠标准溶液的量浓度,mol/L;V1————滴定时硫代硫酸钠标准溶液的用量ml;V2————空白滴定时硫代硫酸钠标准溶液的用量ml;0.04903——与1.00ml (0.1mol/L)硫代硫酸钠标准溶液相当的以克表示的重铬酸钾的质量。
称取13g结晶硫代硫酸钠(Na2S2O3·5H2O)或8g无水硫代硫酸钠,溶于500 mL 水中,缓缓煮沸10 min,冷却。
放置2周后过滤,待标定。
称取基准重铬酸钾0.15g(称准至0.0001g)于碘量瓶中,加25 mL水使其溶解。
加2g碘化钾及20 mL硫酸溶液,盖上瓶塞轻轻摇匀,以少量水封住瓶口,于暗处放置10 min。
取出,用洗瓶冲洗瓶塞及瓶内壁,加入150 mL水,用配制的Na2S2O3溶液滴定,接近终点时(溶液为浅黄绿色),加入3 mL淀粉指示液,继续滴定至溶液由蓝色变为亮绿色为终点。
平行标定三份。
同时做空白实验淀粉溶液;称取1g可溶性淀粉,用冷水调成悬浮浆,然后加入约80mL煮沸水中,边加边搅拌,稀释到100mL;煮沸几分钟后放置沉淀过夜,取上清液使用,如需较长时间保存可加入1.25g水杨酸或0.4g氯化锌氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
物质安全数据表(MSDS)-硫酸亚铁铵

身体防护:着工作服。
手 防 护:戴橡胶手套。
其他防护:及时换洗工作服。保持良好的卫生习惯。
第九部分:理化特性
外观与性状:浅蓝绿色结晶。
pH值:3~5(50g/L溶液,25oC)
熔点(oC):无
沸点(oC):无
相对密度(水=1):无
相对蒸气密度(空气=1):无
饱和蒸气压(kPa):无
废弃处置方法:处置前应参阅国家和地方有关法规。
废弃注意事项:无
第十四部分:运输信息
危险货物编号:无
UN编号:无
包装标志:无
包装类别:无
包装方法:无
运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。
第十五部分:法规信息
法规信息:下列法律法规和标准,对化学品的安全使用、储存、运输、装卸、分类和标志等方面均作了相应的规定:
第一部分:化学品及企业标识
化学品中文名:硫酸亚铁铵
化学品英文名:Ammonium iron sulfate
分子式或其简写:□混合物
有害物成分
浓度
CAS No.
硫酸亚铁铵
/
10045-89-3
第三部分:危险性概述
危险性类别:未列入危险品名录
侵入途径:食入、吸入、皮肤接触
食入:用水漱口,饮牛奶或蛋清。就医。
第五部分:消防措施
危险特性:不燃
有害燃烧产物:无
灭火方法及灭火剂:不燃,根据着火原因选择灭火剂
灭火注意事项:消防人员必须穿全身消防服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。
第六部分:泄漏应急处理
应急处理:隔离泄露污染区,限制出入,穿防酸碱防护服,冲洗废液放入废水处理系统。避免粉尘,用洁净的铲子收集于干燥洁净的容器中。
硫酸亚铁铵的标定

硫酸亚铁铵的标定
重铬酸钾标准溶液:称取1.9615g 重铬酸钾(预先在150 摄氏度干燥2 小时并在干燥器中冷却至室温),置于250ml 烧杯中,加适量水溶解,移人1000mL 容量瓶,用水稀释至刻度,混匀。
硫酸亚铁铵标准滴定溶液:称取15.68g 硫酸亚铁铵溶于1000ml 硫酸(5 95)溶液中,混匀。
标定:移取25.00ml 重铬酸钾标准溶液置于250ml 锥形瓶中,加人10ml 硫酸(1 4),5ml 磷酸,用硫酸亚铁铵标准滴定溶液滴定至橙黄色消失,滴加2 滴N-苯代邻氨基苯甲酸指示剂溶液(N-苯代邻氨基苯甲酸指示剂溶液(0.2g/L):称取0.2gN-苯代邻氨基苯甲酸溶于少量水中,加0.2g 碳酸钠,低温加热溶解后,加水至体积为100ml,混匀。
),继续小心滴至溶液刚呈绿色即为终点。
按下式计算硫酸亚铁铵标准滴定溶液相当于锰的质量浓度p.单位为克每毫升p=c*25.00*54.94*10^-3/(V1 V2) c:重铬酸钾标准溶液的浓度(mol/L)25.00:移取的重铬酸钾标准溶液体积(ml) 54.94:锰的摩尔质量(g/mol) V1:滴定时消耗硫酸亚铁铵标准滴定溶液的体积(ml) V2:滴定空白时消耗硫酸亚铁铵标准滴定溶液的体积(ml) 空白值的侧定:移取10.00ml 重铬酸钾标准溶液于250ml 锥形瓶中,加人40ml 硫酸(1 4),5ml磷酸,用硫酸亚铁铵标准滴定溶液滴定至橙黄色消失,滴加 2 滴N-苯代邻氨基苯甲酸指示剂溶液,继续小心滴至溶液刚呈绿色即为终点。
滴至终点后,再移取10.00ml 重铬酸钾标准溶液于上述锥形瓶中,继续用硫酸亚铁铵标准滴定溶液滴定至终点其两次滴定体积之差即为空白值。
013.烃铵盐滴定液(0.01molL)标配操作规程

1.主题内容与适用范围1.1本规程规定了烃铵盐滴定液(0.01mol/L)配制与标定的操作方法。
1.2本规程适用于烃铵盐滴定液(0.01mol/L)配制与标定的操作。
2.引用标准2.1《中国药典》2010年版二部附录2.2《中国药品检验标准操作规程》2010年版3.操作方法3.1仪器与用具恒温干燥臬,分析天平(感量0.1mg)、量瓶、移液管、干燥滤纸、锥形瓶、滴定管、试剂瓶。
3.2试纸与试液氯化二甲基苄基烃铵(AR)、氯化钾(基准试剂)、醋酸一醋酸钠缓冲液(PH3.7)、四苯硼钠滴定液(0.02mol/L)、溴酚蓝指示液。
3.3配制取氯化二甲基苄基烃铵3.8g,加水溶解后,加醋酸一醋酸钠缓冲液(PH3.7)10ml,再加水稀释成1000ml,摇匀。
3.4标定与复标3.4.1取在150℃干燥1小时的分析纯氯化钾纺0.18g,精密称定,置250ml量瓶中,加醋酸一醋酸钠缓冲液(PH3.7)使溶解并稀释至刻度,摇匀,精密量取20ml,置50ml量瓶中,精密加入四苯硼钠滴定液(0.02mol/L)25ml,用水稀释至刻度,摇匀,经干燥滤纸滤过,精密量取续滤液25ml,置150ml锥形瓶中,加溴酚蓝指示液0.5ml,用本液滴定至蓝色,并将滴定的结果用空白试验校正。
每1ml烃铵盐滴定液(0.01mol/L)相当于0.7455mg的氯化钾。
3.4.2本滴定液的浓度C(mol/L)按下式计算:m×20.00C(mol/L)=2(V1-V2)×74.55×250.0式中:m为基准氯化钾的称取量(mg);V1为空白试验中本滴定液的用量(ml)V2为本滴定液的消耗量(ml)74.55为与每1ml的烃铵盐滴定液(1.000mol/L)相当的以毫克表示的氯化钾的质量20.00和250.00分别为精密量取氯化钾溶液时所用移液管和量瓶的容量(ml)2为50ml量瓶与精密量取续滤液25的比值3.4.3标定中,3份平行试验结果的相对平均偏差不得大于0.2%。
硫酸亚铁铵滴定液的配制与标定

硫酸亚铁铵标准滴定液C[(N H4)2F e2(SO4) 2]= 0.1 mol/L
1.1配制:
称取40克硫酸亚铁铵[(NH4)2Fe2(SO4) 2·6H2O],溶于300毫升硫酸溶液(20%)中,加700毫升水,摇均。
1.2 标定:
量取35.00毫升~40.00毫升配制好的硫酸亚铁铵溶液,加25毫升无氧的水,用高锰酸钾标准滴定液 [C(1/5KMnO4)=0.1 mol/L]滴定至溶液呈粉红色,并保持30秒,临用前标定。
硫酸亚铁铵标准滴定液的浓度{C[(NH4)2Fe2(SO4) 2]},数值以摩尔每升(mol/L)表示,按式(16)计算:
C[(NH4)2Fe2(SO4) 2]= V1 c1/V (16)
式中:
c1----高锰酸钾标准滴定液的浓度的准确数值,单位为摩尔每升(mol/L);
V1---高锰酸钾标准滴定液的体积的数值,单位为毫升(ml);
V---硫酸亚铁铵溶液的体积的准确数值,单位为毫升(ml);
操作步骤:
2g样品200ml容量瓶250ml锥形瓶,加0.4mol/L的重铬酸钾50ml,加
15ml浓硫酸于沸水浴中加热氧化30min冷却,稀释至约100ml,加3滴邻菲罗林指示剂3滴滴定(由橙色经绿色变为砖红色为终点):同时做空白。
计算公式:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸亚铁铵滴定液(0.1mol/L)配制与标定标准操作程序
1.目的:建立硫酸亚铁铵滴定液(0.1mol/L)配制与标定的标准操作程序,保证正确操作。
2.适用范围:本标准规定了硫酸亚铁铵滴定液(0.1mol/L)配制与标定的方法和操作要求;适用于本公司质量控制室硫酸亚铁铵滴定液(0.1mol/L)的配制、标定与复标。
3.责任:配制、标化及复标检验员。
4.内容:
4.1 误差要求:
4.2试剂与试药:邻二氮菲指示剂硫酸亚铁铵硫酸
4.3试剂的配制:按《化学试剂配制标准操作程序》(SOP-H10-04)相关条款配制
4.4仪器与设备:三角瓶(250ml) 酸式滴定管(50ml)移液管(25ml)分析天平
4.5操作步骤:
4.5.1 Fe(NH)(SO4)2 . 6H2O=392.13 39.21→1000ml
4.5.2配制:取硫酸亚铁铵40g,溶于预先冷却的40ml硫酸和200ml水的混合液中,加水适量使成1000ml,摇匀。
(本液临用前标定浓度)
4.5.3标定:精密量取本液25ml,加邻二氮菲指示液2滴,用硫酸铈滴定液(0.1mol/l)滴定至溶
编号:SOP-H08-032-04 共 2 页第 2 页
液由浅红色转变为淡绿色,根据硫酸铈滴定液(0.1mol/l)的消耗量,算出本液的浓度。
即得。
4.5.4计算公式:
F= V 25.00× F
式中:F为硫酸铈滴定液(0.1mol/l)浓度
v 为滴定所消耗硫酸铈滴定液的体积(ml)
4.5.5反应原理:硫酸铈是一种氧化剂,它可与还原性物质定量反应,四价铈被还原为三价铈,用已知浓度的硫酸铈与被测还原性物质反应,根据到达终点所消耗的硫酸铈滴定液的浓度和毫升数,可计算出被测物质的含量。
半反应式: Ce4++e Ce3+
4.6注意事项:
4.6.1配制溶液时应注意严禁将水注入硫酸中,并应避免将瓶口对准自己或别人,以免硫酸飞溅
伤人。
4.7引用标准:《中华人民共和国药典》(2005年版二部附录)
《中国药品检验标准操作规范》(2005年版)。
