PCR实验常见失败原因、对策分析及体系优化
PCR常见问题、原因分析及其对策

镁离子浓度不当
总结词
镁离子是PCR反应的重要成分,对PCR的效率和产物质量有 重要影响。
详细描述
镁离子浓度过高可能导致非特异性扩增和产物稳定性下降; 镁离子浓度过低则可能影响DNA聚合酶的活性,导致PCR失 败或扩增效率低下。因此,需要根据实验条件和试剂盒推荐 ,选择合适的镁离子浓度。
03
pcr问题对策
详细描述
模板质量的好坏直接影响到pcr的扩增 效果,因此需要确保模板的纯度和浓 度,避免使用降解严重的模板,以提 高pcr的产量和特异性。
优化pcr循环参数
总结词
pcr循环参数的优化可以显著提高pcr的效率和特异性。
详细描述
通过调整变性、退火、延伸等温度和时间,可以优化pcr循环参数,提高pcr的效率和特异性。同时, 合理设置预变性时间和循环数,可以有效避免非特异性扩增和产物积累。
优化引物设计
总结词
引物设计是pcr反应的关键,优化引物设计可以显著提高pcr的特异性和效率。
详细描述
引物设计时需考虑特异性、长度、GC含量、引物二聚体和发夹结构等因素,通过合理设计引物,可以避免非特 异性扩增和引物二聚体形成,提高pcr的特异性。
提高模板质量
总结词
模板质量对pcr结果的影响不容忽视, 提高模板质量可以提高pcr的产量和特 异性。
模板质量差
总结词
模板质量的好坏直接影响到PCR的效率和产物质量。
详细描述
模板中可能含有抑制剂、DNA聚合酶抑制剂或DNA聚合酶竞争性抑制剂等物质, 这些物质会影响DNA聚合酶的活性,导致PCR失败或扩增效率低下。此外,模 板的浓度过低或过高也可能影响PCR结果。
pcr循环参数不当
总结词
PCR循环参数包括变性、退火、延伸等步骤,这些步骤 的温度和时间设置对PCR结果有重要影响。
PCR常见问题分析及对策

PCR反应常见问题汇总(转自tiangen)----PCR常见问题分析及对策1.PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
2.假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR 循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD 值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
PCR实验常见问题、原因分析及其解决方案

PCR实验常见问题、原因分析及其解决方案PCR产物的电泳检测时间,一般为48h以内,有些最好于当日进行检查,大于48h后带型不规则甚至消失。
但有时仍会与到这样那样的问题,影响检测结果的判断,具体归类为以下常见的4点,描述如下:问题一:无扩增产物现象:正对照有条带,而样品则无原因:1、模板:含有抑制物,含量低2、Buffer对样品不合适3、引物设计不当或者发生降解4、反应条件:退火温度太高,延伸时间太短对策:1、纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2、更换Buffer或调整浓度3、重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4、降低退火温度、延长延伸时间问题二:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1、引物特异性差2、模板或引物浓度过高3、酶量过多4、Mg2+浓度偏高5、退火温度偏低6、循环次数过多对策:1、重新设计引物或者使用巢式PCR2、适当降低模板或引物浓度3、适当减少酶量4、降低镁离子浓度5、适当提高退火温度或使用二阶段温度法6、减少循环次数问题三:拖尾现象:产物在凝胶上呈Smear状态原因:1、模板不纯2、Buffer不合适3、退火温度偏低4、酶量过多5、dNTP、Mg 2+浓度偏高6、循环次数过多对策:1、纯化模板2、更换Buffer3、适当提高退火温度4、适量用酶5、适当降低dNTP和镁离子的浓度6、减少循环次数问题四:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交叉污染对策:1、操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2、除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3、各种试剂最好先进行分装,然后低温贮存[ 来源]:实验室之家,以及相关网络知识、转载仅为分享知识,如有侵权请联系删除。
}热文推荐:1、化学分析方法确认和验证指南PDF版全文(新版2018年4月1日实施)2、最全微生物实验室规划设计方案3、谱知识总结篇4、移液器操作六部曲,这些细节很重要化学先生(号码:chemistrysir),化学检测工作者自己的公众号。
PCR实验常见失败原因、对策分析及体系优化

PCR实验常见失败原因、对策分析及体系优化PCR虽然为一个简单的实验,但在实际过程中可能会出现各种问题.产生问题的原因可能来源于以下几个方面:实验操作,试剂质量,PCR反应过程中各种试剂的含量,以及反应条件,温度设置等,本文对各个方面进行了讨论,大家遇到问题后可以对号入座的查一下.当然,具体问题的解决还依靠实验者就可能的原因逐项排除,并不断的摸索才能彻底解决.假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件.寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改.酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性.需注意的是有时忘加Taq酶或溴乙锭.引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带.反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
PCR检测常见问题与解决途径

PCR 检测常见问题与解决途径利用 PCR 方法检测转基因成分时,经常出现假阳性、假阴性、非特异性扩增和涂抹带。
尤其是假阳性和假阴性可使检测结果得出错误结论,有时可造成严重后果。
为了提高转基因检测的准确性和可靠性,PCR 检测应尽量减少假阳性、假阴性、非特异性扩增和涂抹带现象的发生。
一个好的PCR 方法不但要求特异性好、灵敏度高、还要求具有高的可重复性、重现性、鲁棒性,尽量减少假阳性、假阴性和非特异性扩增。
本文对 PCR 检测中出现的假阳性、假阴性、非特异性扩增和涂抹带的原因及其解决方法予以综述。
一、假阳性:(一)假阳性现象假阳性是指检测阴性材料得到阳性结果。
如果一次实验中的几个阴性对照中出现一个或几个阳性结果,提示本次实验中其它标本的检测结果可能有假阳性。
实验中设立的阴性对照可提示有无假阳性结果出现。
(二)造成假阳性的原因1.样品间交叉污染:样本污染主要有收集样本的容器被污染,或样本放置时,由于密封不严溢于容器外,或容器外粘有样本而造成相互间交叉污染;样本核酸模板在提取过程中,由于吸样枪污染导致标本间污染;2.PCR 试剂的污染:主要是由于在 PCR 试剂配制过程中,由于加样枪、容器、双蒸水及其它溶液被 PCR 核酸模板污染。
3. PCR 扩增产物污染:这是 PCR 贝量大 (一般为 1013 拷贝 /ml),远远高于物污染,就可形成假阳性。
反应中最主要最常见的污染问题。
因为PCRPCR 检测数个拷贝的极限,所以极微量的产物拷PCR 产4. 气溶胶污染:在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染。
据计算一个气溶胶颗粒可含 48000 拷贝,因而由其造成的污染是一个值得特别重视的问题。
5.实验室中克隆质粒的污染:由于克隆质粒在单位容积内含量相当高,另外在纯化过程中需用较多的用具及试剂,而且在活细胞内的质粒,由于活细胞的生长繁殖的简便性及具有很强的生命力,其污染可能性也很大。
pcr技术审核中存在的问题和解决措施方案

实验操作不规范
总结词
PCR实验的重复性和准确性很大程度上取决于实验人员的操 作技能和经验。不规范的操作可能导致实验失败或产生偏差 。
详细描述
实验操作不规范包括但不限于:操作步骤错误、仪器使用不 当、试剂配制错误、反应条件控制不严格等。这些问题可能 会引发实验失败,并影响后续的数据分析和实验结果。
引物设计不合理
详细描述
模板质量不稳定包括但不限于: DNA/RNA降解、浓度过低、含 有抑制剂等。这些问题会导致 PCR反应效率降低或失败,进而 影响实验结果。
反应条件不一致
总结词
反应条件不一致是PCR实验中常见的问题之一,可能影响实验的重复性和准确性 。
详细描述
反应条件不一致包括但不限于:反应体系不完整、反应温度不正确、循环次数不 当等。这些问题会导致PCR反应产物量不足或不均一,进而影响实验结果。
标准化操作规范应根据国家和行业标准制定 ,以确保实验结果的准确性和可靠性。
对标准化操作规范的执行情况进行 监督和检查,以确保实验操作的标 准化和规范化。
03
引物设计不合理解决措施
建立引物设计标准流程
确保引物设计的科学性和合理性,建立标准流程,包括引物设计的基本原则、软件选择、参数设置、 实验验证等环节,确保每个步骤都得到规范执行。
对模板进行预处理与纯化
去除杂质
通过离心、过滤等手段去除模板中的杂质, 如核酸酶、蛋白质等,以确保PCR反应的顺 利进行。
纯化模板
根据实验需求,采用合适的纯化方法对模板 进行纯化,如用硅胶膜、玻璃纤维或聚丙烯
酰胺凝胶电泳等方法去除其他杂质。
05
反应条件不一致解决措施
建立反应条件标准化流程
01
确保PCR反应体系的一致性
PCR常见问题及对策

PCR常见问题及对策(一)没有得到扩增产物(1)酶失活或在反应体系中未加入酶。
Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
(2)模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。
(3)变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
(4)反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5-10分钟。
(5)引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
(6)使用PCR试剂盒时还应注意:①是否严格按照说明书操作;②试剂使用前是否充分混匀;③试剂储存过久或不当而失效。
(二)扩增产物在凝胶中涂布或成片状(1)酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
(2)dNTP浓度过高。
减少dNTP的浓度。
(3)MgCl2浓度过高。
可适当降低其用量。
(4)循环次数过多;增加模板量减少循环次数,缩短退火时间及延伸时间,或改用二种温度的PCR循环。
(5)退火温度过低。
(6)电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。
(7)若为PCR试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
(8)降解的陈旧模板扩增也易产生涂布。
(三)溴酚蓝前有区带(很宽)(1)模板量太低。
增加模板DNA的用量。
(2)循环次数太多。
减少循环次数。
(3)复性度偏低。
提高复性温度。
(4)预变性后没有立刻上机循环。
(5)引物3'端是否互补;重新设计合成较长的引物。
(6)引物用量偏多。
降低引物的使用量。
(四)扩增产物出现多条带(1)引物用量偏大,引物的特异性不高。
应调换引物或降低引物的使用量。
(2)循环的次数过多。
适当增加模板的量,减少循环次数。
PCR常见问题、原因分析及其对策汇总

提高PCR反应特异性的策略
策略之二:递减PCR(TouchDown PCR)
递减PCR通过在PCR的前几个循环使用严谨的退火 条件提高特异性。循环设在比估算的Tm高大约5℃ 的退火温度下开始,然后每个循环降低1-2℃,直到 退火温度低于Tm 5℃。 特异性最高的目的模板会被优先扩增,这些产物在 随后的循环中继续扩增占据优势。 递减PCR对于那些不了解引物和目的模板同源性程 度的方法更为有用,如AFLP、DNA指纹分析。
PCR技术的简介
PCR技术的发展历史
1985 关于PCR 的文章首次由美国科学Kary Mullis等 人在 《Science》杂志上发表 1989 《Science》杂志报道了耐热性DNA多聚酶 Taq酶 (生活在温泉中的水生嗜热杆菌内提取到的一种耐 热的DNA聚合酶 )的发现,预示着分子时代的到 来。12月《Science》杂志将PCR和它所使用的聚 合酶命名为第一个“年度分子”。 1993 Kary Mullis 因PCR的发明获得诺贝尔化学奖。
1. 现象:空白对照出现目的扩增产物 原因:靶序列或扩增产物的交叉污染 对策: 操作时应小心轻柔,防止将靶序列吸入加样枪 内或溅出离心管外; 2. 除酶及不能耐高温的物质外,所有试剂或器材 均应高压消毒。所用离心管及加样枪头等均应 一次性使用。 3. 各种试剂最好先进行分装,然后低温贮存。
原 因
1.
2. 3. 4. 5. 6.
模板不纯 Buffer不合适 退火温度偏低 酶量过多 dNTP、Mg2+浓度偏高 循环次数过多
1.
2.
对 策
3. 4. 5.
6.
纯化模板 更换Buffer 适当提高退火温度 适量用酶 适当降低dNTP和镁离子的 浓度 减少循环次数
PCR常见问题分析及对策

PCR常见问题分析及对策PCR常见问题分析及对策(⽆扩增产物、⾮特异性扩增、拖尾、假阳性)问题1:⽆扩增产物现象:正对照有条带,⽽样品则⽆原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发⽣降解4.反应条件:退⽕温度太⾼,延伸时间太短对策:1.纯化模板或者使⽤试剂盒提取模板DNA或加⼤模板的⽤量2.更换Buffer或调整浓度3.重新设计引物(避免链间⼆聚体和链内⼆级结构)或者换⼀管新引物4.降低退⽕温度、延长延伸时间问题2:⾮特异性扩增现象:条带与预计的⼤⼩不⼀致或者⾮特异性扩增带原因:1.引物特异性差2.模板或引物浓度过⾼3.酶量过多4.Mg2+浓度偏⾼5.退⽕温度偏低6.循环次数过多对策:1.重新设计引物或者使⽤巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离⼦浓度5.适当提⾼退⽕温度或使⽤⼆阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退⽕温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏⾼6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提⾼退⽕温度4.适量⽤酶5.适当降低dNTP和镁离⼦的浓度6.减少循环次数问题4:假阳性现象:空⽩对照出现⽬的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应⼩⼼轻柔,防⽌将靶序列吸⼊加样枪内或溅出离⼼管外;2.除酶及不能耐⾼温的物质外,所有试剂或器材均应⾼压消毒。
所⽤离⼼管及加样枪头等均应⼀次性使⽤。
3.各种试剂最好先进⾏分装,然后低温贮存琼脂糖凝胶电泳回收PCR产物⼀.原理DNA⽚断的分离与回收是基因⼯程操作中的⼀项重要技术,例如可收集特定酶切⽚断⽤于克隆或制备探针,回收PCR产物⽤于再次鉴定等。
回收实验中两个最重要的技术指标是纯度和回收率:前者未达标时会严重影响以后的酶切、连接、标记等酶参与的反应;后者不理想时往往会⼤⼤增加前期的⼯作量。
PCR实验中常见问题解决方法

QuikStrip 已变干。
加入 40 μL 水,在装载前轻轻上下移液以混合均匀。
3.电泳凝胶上看不到条带、对照 DNA 和PCR 产物
凝胶未正确制备。
确保正确稀释电泳缓冲液。
融化琼脂糖时需要特别注意较高浓度 (>0.8%) 的凝胶。在倒入凝胶之前,确保溶液 没有“团块 ”和玻璃状颗粒,也可以直接使用配置好的预制胶。省时省力。
凝胶未正确染色。
染色时注意浓度,实在不行就重新染色。
电泳装置或电源出现故障。
请联系电泳仪或电泳设备供应商,帮忙排除故障
4.凝胶染色后,DNA 条带模糊。
凝胶没有染色足够长的时间。
严格按照染色流程说明进行实验操作。
5.染色后,条带可见,但不存在 PCR 产物。
PCR扩增不成功。
注意引物设计是否合理,DNA聚合酶的加入量是否适宜。
PCR实验中常见问题解决方法
PCR实验中常见问题及解决方案
PCR实验中常见问题汇总
问题,管中的液体较少。
样品挥发,损失
确保加热的盖子达到适当的温度。
吸取样本后,尽快盖上PCR 管的盖子。防止挥发。
移液不准确
确保吸取 20 µL 引物混合物和 5 µl Lambda DNA 模板到 PCR 管中。样本量少时需要采用高精度移液器。
确保PCR的正确操作,温度设计是否合理。
6.染色后,凝胶上可见条带和对照 PCR 产物,其中一部分样品不存在。
PCR 反应中添加了错误体积的 DNA 和引物。
熟练使用移液器进行精准移液定量,确保移液的准确度
PCR常见问题分析与对策

PCR常见问题分析与对策PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
或100ul,应用多大体积进行PCR扩增,是根据科研和临床检测不同目的而设定,在做小体积如20ul后,再做大体积时,一定要模索条件,否则容易失败。
PCR扩增失败的原因分析汇总.

PCR扩增失败的原因分析2010-12-13 16:48:31| 分类:默认分类|字号订阅PCR扩增失败原因分析,PCR产物电泳2010-05-15 16:07一模板质量问题:1)模板提取不完整,其中不含你的目的基因,或目的基因含量太低。
可以跑个电泳看看提取的DNA,PCR阳性样品与阴性样品是否有明显差别。
如果确定是这种问题,可以增加模板量试试,但不一定行得通。
2)模板里面残留某种试剂成份,可能抑制Taq聚合酶的活性,如果是这种情况,可以用试剂盒把模板再纯化一下,或将模板做个梯度稀释以确定最佳的模板量。
3)为什么跑电泳会出现拖带呢?1. 有可能的因为你的电压调的太高了。
电泳跟很多因素有关,其中就有一个是电压,在适当的电压范围内增加是可以加快迁移速率,但是要是超到一个临界值反而有害。
你可以适当的调低点看看。
2.有时候发现上样量太多的话会有拖带。
你看能否回收之后,按1:50 或1:100 等稀释后,再当成模板扩一次怎么样。
二引物问题1)样品自身的基因型差异导致扩增失败。
也就是说你的引物与某些基因型的样品结合的好,而和另一些基因型结合不好。
可以换一对更保守的引物试试。
祝顺利!2)普通PCR所用的一对引物中有一个引物加多了,为正常的三倍只要引物特异性比较好,那么不会产生大的影响。
如果恰巧是加多的这条引物不是很特异的话,也许会扩出来非特异带。
在制备单链探针时候就采取这样的不对称pcr,没关系的三 Taq酶处于失活状态。
因为活性降低了能出现二聚体。
tap酶种类高特异性Taq酶高度特异性地扩增所需的片段是PCR最基本的要求,影响PCR特异性的因素很多,包括模板、引物性质及质量、反应条件的控制等等,而高特异性Taq 酶的出现大大减少了摸条件这一繁琐的实验过程,也为PCR产物快速有效的纯化(PCR产物直接纯化)打下了基础。
这类酶最典型的代表是热启动Taq酶。
大家都知道,在PCR第一个循环变性之前,有一个升温的过程,引物和模板会有一些非特异性配对,如果这时Taq酶发挥活性,就很容易产生非特异性扩增,由于循环初期模板量非常少,产生的非特异性条带经过后面的指数扩增,就会严重干扰目的片段的扩增,甚至导致特异性条带不能扩出。
PCR常见问题、原因分析及其对策

化学修饰
•
•
Roche : FastStart Taq Abgene: Thermo-start® DNA Polymerase Stratagene: SureStart™ Taq
•大大提高PCR
反应的特异性
抗体抑制
Invitrogen: AccuPrimeTM Taq Platinum® Taq • TaKaRa: ExTaqTM HotStart Version
PCR试剂盒 复杂模板扩增、大规模基因检测
特异性
- 热启动 Taq酶
原 理
• 蜡封 • 抗体抑制 • 化学修饰
特 点
用 途
• 避免非特异性扩增 • 提高PCR反应的 特异性 • 基因组扩增
• RT-PCR
特异性
产 品 类 型
- 热启动 Taq酶
产品名称
• 天为时代: HotStart Taq
•
产品性能
策略之四
• 使用PCR增强剂
甲酰胺,DMSO,甘油,甜菜碱等都可充当PCR的增强剂。 其可能的机理是降低熔解温度,从而有助于引物退火并辅 助DNA聚合酶延伸通过二级结构区。
增强剂浓度要适当
北京天为时代科技有限公司
http//
免费咨询:800-810-2177
PCR常见问题之三
• 拖尾
现象:产物在凝胶上呈Smear状态。
M 1 2
PCR常见问题之三
• 拖尾
原 因
1.
2. 3. 4. 5. 6.
模板不纯 Buffer不合适 退火温度偏低 酶量过多 dNTP、Mg2+浓度偏高 循环次数过多
1.
2.
对 策
3. 4. 5.
PCR常见问题分析及对策

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
PCR常见问题及解决方案

PCR常见问题及解决方案问题可能原因解决方法无产物或产量低模板浓度偏低或偏高电泳检测模板浓度,调整模板用量模板降解重新制备;基因组DNA、cDNA应小量分装后低温保存模板中含有抑制反应的杂质纯化模板引物浓度不足调整引物浓度,特别是针对长片段PCR引物存在二级结构重新设计引物,避免二级结构;优化退火温度引物降解引物应高浓度小量分装,-20℃保存,避免反复冻融Mg2+浓度偏低适当提高Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP降解-20℃保存,小量分装,避免反复冻融酶纯度低,扩增效率差选用高质量DNA聚合酶酶量不足适当增加酶量用酶不当针对模板、目标片段的特选择适当的酶(详见PCR产品选择指南)缓冲液失效更换缓冲液或使用预混PCR反应体系模板变性不充分适当延长变性时间;对高GC或复杂结构模板,提高起始变性温度至98℃退火温度偏高降低退火温度,应比引物Tm低至少5℃ 延伸时间不足增加延伸时间,特别是针对长片段PCR 循环数目不够增加循环数PCR管污染质量可靠的PCR管通常不需灭菌,否则应先高温高压灭菌处理;用过的PCR管不可清洗后重复使用PCR仪故障检查程序和模块温度其他使用PCR增强剂非特异产物过多,引物二聚体拖尾严重体系污染设计对照实验寻找污染源,操作时应注意避免交叉污染引物浓度过高适当减少引物浓度引物序列特异性差重新设计引物Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP浓度过高降低dNTP浓度酶量过多减少酶量,以0.5 U间隔递减退火温度过低提高退火温度延伸时间过短增加延伸时间,以1 min间隔递增循环次数过多减少循环次数模板结构过于复杂或目标片段过长特选择适当的酶(详见PCR产品选择指南);使用PCR增强剂其他HotStart PCRTouchDown PCR巢式PCR引物3’末端存在互补序列重新设计引物引物浓度过高降低引物浓度模板浓度过低提高模板浓度退火温度不合适优化退火温度循环次数过多减少循环次数其他HotStart PCR引物浓度过高调整引物浓度引物序列特异性差或模板上存在同源序列重新设计引物模板降解重新制备模板模板浓度过高降低模板浓度dNTP浓度过高减少dNTP用量Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度酶量过多或质量差减少酶量,以0.5 U间隔递减;更换质量可靠的酶变性温度过低提高变性温度,以0.5℃递增退火温度过低提高退火温度延伸时间过长缩短延伸时间循环次数过多减少循环次数,以2个循环间隔递减体系污染设计对照实验,消除污染源其他HotStart PCR TouchDown PCR 巢式PCR假阳性目标片段与非特异扩增片段间存在同源性设计阴性对照,确认为引物问题后重新设计引物体系污染设计阴性对照判断是否有污染,去除污染源。
PCR常见问题分析及解决策略

Mg 2+浓度
•过低无扩增产物
•浓度适当
dNTPs
•避免反复冻融
•pH值适当 •避免污染
dH2O
如何选择最合适的DNA聚合酶
Taq酶 PCR用耐热 DNA聚合酶
pfu酶
Hotstart Taq酶 Taq plus 混合酶 Long Taq Taq platinum
PCR常见问题、 原因分析及其对策
PCR技术简介 PCR常见问题、原因分析及其解决方案
提高PCR反应特异性的策略 定量PCR常见问题 临床PCR检测的常见问题
PCR标准反应体系
• DNA模板
• 引物
• 反应缓冲液 • Mg 2+浓度 • dNTPs • dH2O • 耐热聚合酶
反应体系对PCR扩增的影响
荧光定量PCR常见问题
溶解曲线不止一个主峰:
引物设计不佳:设计特异性引物; 引物浓度不适:降低引物浓度; 退火温度低:调整退火温度;
镁离子浓度过高:降低镁离子浓度;
模板中有基因组污染:注意提取过程; 耗材仪器不匹配; 反应体系污染等:设置阳性阴性对照。
荧光定量PCR常见问题
扩增效率低:
如何选择最合适的DNA聚合酶 -----根据PCR实验需求
特异性-----基因组扩增、RT-PCR
保真性-----基因筛选、测序、克隆 长片段扩增-----构建基因图谱、测序等 扩增效率-----复杂模板扩增(GC含量高、二级结构) PCR试剂盒-----复杂模板扩增、大规模基因检测
PCR常见问题之一-----无扩增产物
PCR常见问题之四-----假阳性
现象:空白对照出现目的扩增产物
原 因
靶序列或扩增产物的交叉污染
PCR实验室常见问题及经验分享

PCR实验室常见问题及经验分享一、没有ct值二、ct值过晚三、阴性对照扩增有信号四、标准曲线不佳五、熔解曲线峰不特异六、扩增曲线异常七、扩增效率低聚合酶链式反应(PCR)是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的最大特点是能将微量的DNA大幅增加。
一、没有ct值检测结果遇到没有Ct值情况,排查是否有以下问题:1、循环数不够(一般不超过45循环,不仅背景值提高,定量也不准);2、PCR程序设置错误,检测荧光信号的步骤有误。
一般SG法采用72℃延伸时采集,TaqMan法则一般在退火结束时或延伸时采集信号,另外荧光采集是否选中;3、引物或探针降解。
可通过PAGE电泳检测引物和探针是否降解;4、模板量可能降解或上样量不足(不超过500ng,根据试剂盒说明书即可),对未知浓度的样本应从系列稀释样本的最高浓度做起;如果发生模板降解,应考虑样本准备中杂质的引入及反复冻融的情况,建议将模板样本小量分装储备,避免反复冻融;5、引物探针是否合适(尤其是引物跨越内含子,以确保扩增基因组DNA;上下游引物Tm值超过4℃以上也会影响扩增)。
二、ct值过晚在相对定量中,Ct值一般控制在15—25之间比较好,如果在绝对定量中,对低拷贝数的样品,Ct值会增大,但是一般不宜超过40循环,否则定量不准确。
因此,判断Ct值出现过晚是否属于非正常情况,需要根据具体实验设计和目的进行。
1、扩增效率低。
引物之间或者引物和探针的比例不合适,需要进行优化;引物或探针设计不合理,需要重新设计;2、PCR程序不合适,改用三步法进行反应,或者优化退火/延伸温度,可以适当降低退火温度;退火/延伸时间短(可以在推荐的时间条件下延长10s);3、MgCl2浓度不合适,增加镁离子浓度等。
PCR各种反应成分的降解或加样量的不足;4、PCR产物太长。
PCR产物设计超过500bp;5、模板存在抑制物。
用高纯度模板进行PCR检测或将模板进行稀释。
PCR常见问题分析及对策
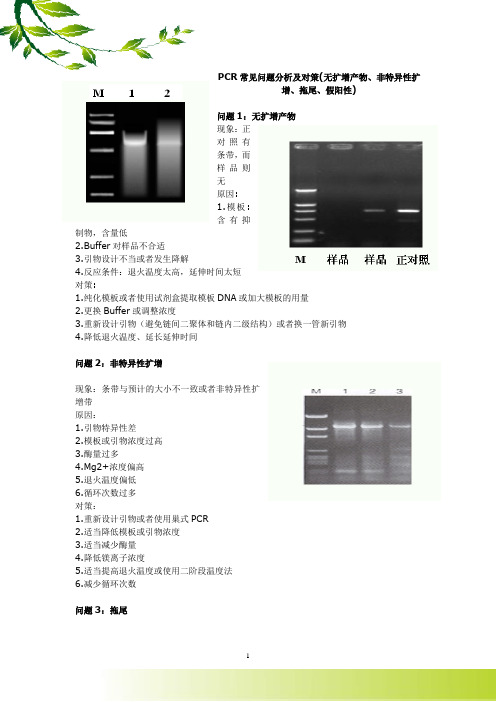
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。
PCR扩增失败的原因分析

PCR扩增失败的原因分析2010-12-13 16:48:31| 分类:默认分类|字号订阅PCR扩增失败原因分析,PCR产物电泳2010-05-15 16:07一模板质量问题:1)模板提取不完整,其中不含你的目的基因,或目的基因含量太低。
可以跑个电泳看看提取的DNA,PCR阳性样品与阴性样品是否有明显差别。
如果确定是这种问题,可以增加模板量试试,但不一定行得通。
2)模板里面残留某种试剂成份,可能抑制Taq聚合酶的活性,如果是这种情况,可以用试剂盒把模板再纯化一下,或将模板做个梯度稀释以确定最佳的模板量。
3)为什么跑电泳会出现拖带呢?1. 有可能的因为你的电压调的太高了。
电泳跟很多因素有关,其中就有一个是电压,在适当的电压范围内增加是可以加快迁移速率,但是要是超到一个临界值反而有害。
你可以适当的调低点看看。
2.有时候发现上样量太多的话会有拖带。
你看能否回收之后,按1:50 或1:100 等稀释后,再当成模板扩一次怎么样。
二引物问题1)样品自身的基因型差异导致扩增失败。
也就是说你的引物与某些基因型的样品结合的好,而和另一些基因型结合不好。
可以换一对更保守的引物试试。
祝顺利!2)普通PCR所用的一对引物中有一个引物加多了,为正常的三倍只要引物特异性比较好,那么不会产生大的影响。
如果恰巧是加多的这条引物不是很特异的话,也许会扩出来非特异带。
在制备单链探针时候就采取这样的不对称pcr,没关系的三 Taq酶处于失活状态。
因为活性降低了能出现二聚体。
tap酶种类高特异性Taq酶高度特异性地扩增所需的片段是PCR最基本的要求,影响PCR特异性的因素很多,包括模板、引物性质及质量、反应条件的控制等等,而高特异性Taq 酶的出现大大减少了摸条件这一繁琐的实验过程,也为PCR产物快速有效的纯化(PCR产物直接纯化)打下了基础。
这类酶最典型的代表是热启动Taq酶。
大家都知道,在PCR第一个循环变性之前,有一个升温的过程,引物和模板会有一些非特异性配对,如果这时Taq酶发挥活性,就很容易产生非特异性扩增,由于循环初期模板量非常少,产生的非特异性条带经过后面的指数扩增,就会严重干扰目的片段的扩增,甚至导致特异性条带不能扩出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PCR实验常见失败原因、对策分析及体系优化PCR虽然为一个简单的实验,但在实际过程中可能会出现各种问题。
产生问题的原因可能来源于以下几个方面:实验操作,试剂质量,PCR反应过程中各种试剂的含量,以及反应条件,温度设置等,本文对各个方面进行了讨论,大家遇到问题后可以对号入座的查一下。
当然,具体问题的解决还依靠实验者就可能的原因逐项排除,并不断的摸索才能彻底解决。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
或100ul,应用多大体积进行PCR扩增,是根据科研和临床检测不同目的而设定,在做小体积如20ul 后,再做大体积时,一定要模索条件,否则容易失败。
物理原因:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
有时还有必要用标准的温度计,检测一下扩增仪或水溶锅内的变性、退火和延伸温度,这也是PCR失败的原因之一。
靶序列变异:如靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
假阳性出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及样进枪头等均应一次性使用。
必要时,在加标本前,反应管和试剂用紫外线照射,以破坏存在的核酸。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
其次是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
其对策有:必要时重新设计引物。
减低酶量或调换另一来源的酶。
降低引物量,适当增加模板量,减少循环次数。
适当提高退火温度或采用二温度点法(93℃变性,65℃左右退火与延伸)。
出现片状拖带或涂抹带PCR扩增有时出现涂抹带或片状带或地毯样带。
其原因往往由于酶量过多或酶的质量差,dNTP浓度过高,Mg2+浓度过高,退火温度过低,循环次数过多引起。
其对策有:减少酶量,或调换另一来源的酶。
②减少dNTP的浓度。
适当降低Mg2+浓度。
增加模板量,减少循环次数。
克隆PCR产物1)克隆PCR产物的最优条件是什么?最佳插入片段:载体比需实验确定。
1:1(插入片段:载体)常为最佳比,摩尔数比1:8或8:1也行。
应测定比值范围。
连接用5ul 2X连接液, 50ng质粒DNA,1Weiss单位的T4连接酶,插入片段共10ul。
室温保温1小时,或4℃过夜。
在这2种温度下,缺T-凸出端的载体会自连,产生蓝斑。
室温保温1小时能满足大多数克隆要求,为提高连接效率,需4℃过夜。
2)PCR产物是否需要用凝胶纯化?如凝胶分析扩增产物只有一条带,不需要用凝胶纯化。
如可见其他杂带,可能是积累了大量引物的二聚体。
少量的引物二聚体的摩尔数也很高,这会产生高比例的带有引物二聚体的克隆,而非目的插入片段。
为此需在克隆前做凝胶纯化。
3)如果没有回收到目的片段,还需要作什么对照实验?A)涂布未转化的感受态细胞。
如有菌落,表明氨苄失效,或污染上带有氨苄抗型的质粒,或产生氨苄抗型的菌落。
B)转化完整质粒,计算菌落生长数,测定转化效率。
例如,将1ug/ul质粒1:100稀释,1ul用于100ul感受态细胞转化。
用SOC稀释到1000ul后,用100ul铺板。
培养过夜,产生1000个菌落。
转化率为:产生菌落的总数/铺板DNA的总量。
铺板DNA的总量是转化反应所用的量除以稀释倍数。
具体而言转化用10ng DNA,用SOC稀释到1000u后含10 ng DNA,用1/10铺板,共用1 ng DNA。
转化率为:1000克隆X10(3次方)ng /铺板1 ng DNA ug=10(6次方)cfu/ ug转化pGEM-T应用10(8次方)cfu/ ug感受态细胞如没有菌落或少有菌落,感受态细胞的转化率太低。
C)如用pGEM-T正对照,或PCR产物,产生>20-40蓝斑(用指定步骤10(8次方)cfu/ ug 感受态细胞),表明载体失去T。
可能是连接酶污染了核酸酶。
T4 DNA连接酶(M1801,M1804,M1794)质量标准好无核酸酶污染,不应用其它来源的T4 DNA连接酶替换。
D)用pGEM-T或pGEM-T Easy载体,连接pGEM-T正对照,转化高频率感受态细胞(10(8次方)cfu/ug),按照指定的实验步骤,可得100个菌落,其中60%应为白斑,如产生>20-40蓝斑, 没有菌落或少有菌落,连接有问题。
4)对照实验结果好,却没有回收到目的片段,实验出了什么问题?A)连接用室温保温1小时,能满足大多数克隆,为提高效率,需4℃过夜。
B)插入片段带有污染,使3`-T缺失,或抑制连接,抑制转化。
为此,将插入片段和pGEM-T 正对照混合,再连接。
如降低了对照的菌落数,插入片段需纯化,或重新制备。
如产生大量的蓝斑,插入片段污染有核酸酶,使pGEM-T或pGEM-T Easy载体3`-T缺失。
C)插入片段不适于连接。
用凝胶纯化的插入片段,因受UV过度照射,时有发生。
UV过度照射会产生嘧啶二聚体,不利于连接,DNA必需重新纯化。
D)带有修复功能的耐热DNA聚合酶的扩增产物末端无A,后者是pGEM-T或pGEM-T Easy 载体克隆所需。
加Taq DNA聚合酶和核苷酸可在末端加A。
详情查pGEM-T pGEM-T Easy 载体技术资料(TM042)。
E)高度重复序列可能会不稳定,在扩增中产生缺失和重排,如发现插入片段高频率地产生缺失和重排,需用重组缺陷大肠杆菌菌株,如SURE细胞PCR反应体系与反应条件标准的PCR反应体系:10×扩增缓冲液10ul4种dNTP混合物各200umol/L引物各10~100pmol/L模板DNA 0.1~2ugTaq DNA聚合酶 2.5uMg2+ 1.5mmol/L加双或三蒸水至100ulPCR反应五要素:参加PCR反应的物质主要有五种即引物、酶、dNTP、模板和Mg2+ 引物:引物是PCR特异性反应的关键,PCR 产物的特异性取决于引物与模板DNA互补的程度。
理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板DNA在体外大量扩增。
设计引物应遵循以下原则:①引物长度:15-30bp,常用为20bp左右。
②引物扩增跨度:以200-500bp为宜,特定条件下可扩增长至10kb的片段。
③引物碱基:G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。
A TGC最好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列。
④避免引物内部出现二级结构,避免两条引物间互补,特别是3'端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
⑤引物3'端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致PCR失败。
⑥引物中有或能加上合适的酶切位点,被扩增的靶序列最好有适宜的酶切位点,这对酶切分析或分子克隆很有好处。
⑦引物的特异性:引物应与核酸序列数据库的其它序列无明显同源性。
引物量:每条引物的浓度0.1~1umol或10~100pmol,以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。
酶及其浓度目前有两种Taq DNA聚合酶供应,一种是从栖热水生杆菌中提纯的天然酶,另一种为大肠菌合成的基因工程酶。
催化一典型的PCR反应约需酶量2.5U(指总反应体积为100ul时),浓度过高可引起非特异性扩增,浓度过低则合成产物量减少。
dNTP的质量与浓度dNTP的质量与浓度和PCR扩增效率有密切关系,dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。
dNTP溶液呈酸性,使用时应配成高浓度后,以1M NaOH或1M Tris。
HCL的缓冲液将其PH调节到7.0~7.5,小量分装,-20℃冰冻保存。
多次冻融会使dNTP降解。
在PCR反应中,dNTP应为50~200umol/L,尤其是注意4种dNTP 的浓度要相等( 等摩尔配制),如其中任何一种浓度不同于其它几种时(偏高或偏低),就会引起错配。
