阿莫西林(中间产品检验原始记录资料)
阿莫西林(中间产品检验原始记录资料)

原料检验记录编号:SOR-ZL10202
炽灼残渣检验记录
批号:检验时间:年月日
天平编号:SB-JY-001 天平室温度:天平室相对湿度:% 高温电阻炉编号:SB-JY-010 炽灼温度:放冷至室温时间:分钟
水分(费休氏法)检验记录
比旋度测定法检验记录
检验室温度:℃检验室相对湿度: %
主要仪器:天平编号:SB-JY-001 旋光仪编号: SB-JY-014
检验人:复核人:
高效液相色谱法检验记录
产品批号:检验时间:年月日
天平编号:SB-JY-001 检验室温度:℃检验室相对湿度:% 高效液相色谱仪编号:SB-JY-008 测定波长:nm
对照品名称:阿莫西林对照品含量(C0):%
检验人:复核人:。
阿莫西林实验报告-模板

温度(℃):相对湿度(%):
实验项目
阿莫西林
实验目的
阿莫西林原料含量测定
检验依据
《中国兽药典》2015年版一部P141阿莫西林含量测定
实验仪器及编号
Agilent 1260()Agilent 1100()
分析天平Sartarious()
试剂及试药
磷酸二氢钾:
氢氧化钾:
乙腈:
纯化水
1、对照品:25mg→50ml(溶剂:流动相)
DZ1:
DZ2:
2、样品:25mg→50ml(溶剂:流动相)
Y1:
Y2:
系统适用性
主峰保留时间(min):分离度(R):
理论塔板数(N):拖尾因子:
分析方法
外标法
保存路径
实验结果
实验分析及结论
检验人:复核人:审核人:
日期:日期:日期:
色谱条件
色谱柱:Gemini 2.5mm×250mm×2.5µm
流速(ml/min):1.0柱温(℃):25
检测波长(nm):254进样量(µl):20
洗脱方式:等度洗脱
流动相A:0.05mol/L磷酸二氢钾溶液(用2mol/L氢氧化钾溶液调PH5.0)
——乙腈=97.5:
阿莫西林胶囊

4、系统适用性试验在正式测定样品前要做系统适用性试验,即用规定的对照品对仪器进行试验和调整,以检查该系统的理论塔板数、分离度、重复性、拖尾因子是否符合药典规定。
实验阿莫西林胶囊的含量测定
一、药品检验原始记录
检验日期温度相对湿度
检品名称剂型规格
生产厂家批号效期
检验依据检验目的
检验人:校对人:
二、药品检验报告检品名称生产单位 Nhomakorabea剂型
规格
批号
有效期
包装
检验数量
检验目的
检验项目
检验日期
报告日期
检验依据
检验结论:
检验报告人:;审核人:
药品分析检验报告设计表(第三组)
课题
6、取阿莫西林系统适用性对照品约25mg,置50ml量瓶中用流动相溶解并稀释至刻度,摇匀,滤过.精密量取20ul注入液相色谱仪,记录色谱图。
7、另取阿莫西林对照品适量,同法测定,按外标法以峰面积计算即得。
标示量%=CR
(三)、实验后清洗分析结束,先关检测器,再用经过滤和脱气的适当溶剂清洗色谱系统,正向柱一般用正己烷,反向柱一般用甲醇,如使用过含酸、碱或盐的流动相,则将水相换为同比例纯水,再适当提高甲醇比例,最后用甲醇依次冲洗,各种溶剂一般冲洗20~30倍柱体积,特殊情况延长。冲洗结果,逐渐降低流速至零,关泵。进样器用甲醇冲洗。
(二)、操作方法
1、泵的操作及色谱柱的平衡
(1)用流动相冲洗过滤器,再把过滤器浸入流动相中,打开泵的排液阀,设置高流速后启动泵,进行冲泵排气,直到管线内无气泡为止,关泵或将流速阀调至分析数值,关闭排液阀。
SC-GY-g阿莫西林胶囊工艺规程

海南海力制药有限公司目的:建立0.25g阿莫西林胶囊工艺规程,使产品生产规范化、标准化,保证生产的产品质量稳定、均一和有效。
范围:适用于0.25g阿莫西林胶囊的生产过程和中间控制。
职责:生产技术部负责本规程的起草、修订、培训。
质量管理部、质量保证部、质量控制部、生产车间、工程部负责本规程的审核。
生产负责人、质量负责人负责本规程的批准。
质量管理部负责监督本规程的实施。
质量保证部、质量控制部、生产车间人员负责执行本规程。
内容:1.制定依据:0.25g阿莫西林胶囊注册申报资料《中国药典》2010版二部参考文献:《药品生产质量管理规范》(2010年修订)《药品GMP指南——口服固体制剂》(2011年)2.产品概述:2.1药品名称2.1.1通用名称:阿莫西林胶囊2.1.2拼音名称:Amoxilin Jiaonang2.1.3英文名称:Amoxicillin Capsules2.2产品代码:CP0012.3类别:本品为抗菌素类药。
2.4剂型:本品为胶囊剂2.5规格:0.25g2.6主要成分:阿莫西林2.7性状:本品内容物为白色至黄色粉末或颗粒。
2.8贮藏:遮光,密封保存。
2.9包装规格:铝塑包装12粒/板×3板/盒×300盒/箱;10粒/板×2板/盒×300盒/箱;10粒/板×5板/盒×300盒/箱;12粒/板×15板/盒×100盒/箱。
2.10有效期:24个月2.11药品批准文号:国药准字H460207053.基本处方与生产批量备注:(1)因阿莫西林有高致敏性,每批按整袋(13袋,每袋25kg,共325kg)计发料,不做退库。
(2)辅料用量:万粒用量×批量(按原料用量折算批量后再计算,保留1位小数。
)3.2生产批量:3.2.1根据阿莫西林原料的水分及含量,按325kg折算,保留1位小数。
3.2.2批量(万粒)计算公式:325 ×(1-水分)×干品含量×1000÷0.25÷100004.生产工艺流程图D级洁净区一般生产区5.生产条件及主要设备6.产品的法定质量标准和内控标准7.操作过程及工艺条件7.1制剂前准备7.1.1人员:生产人员必须是身体健康状况符合制药要求并经专业培训考核合格的人员,能熟练地操作本岗位的设备。
产品检验原始记录

产品检验原始记录日期:XXXX年XX月XX日检验员:XXX一、产品基本信息产品名称:XXXXX生产日期:XXXX年XX月XX日生产批次:XXXXX生产线号:XXXXX包装规格:XXXXX二、检验项目和要求序号检验项目检验要求1外观检查外包装应完好无损,内包装应清洁无异味;产品表面应无明显划痕、锈蚀等瑕疵。
2规格尺寸产品尺寸应符合标准规定。
3功能性能产品应具备正常的功能性能,能够满足使用要求。
4安全性能产品应符合相关的安全标准,无伤害人体的物质和设计缺陷。
三、检验步骤和结果1.外观检查-检查外包装:外包装完好无损,无破损,符合要求。
-检查内包装:内包装清洁无异味,符合要求。
-检查产品表面:产品表面无明显划痕、锈蚀等瑕疵,符合要求。
2.规格尺寸-使用测量工具对产品进行测量。
-比较测量结果与标准规定,确认产品尺寸是否符合要求。
3.功能性能-连接电源,进行基本功能测试。
-检查产品是否能够正常工作,是否满足预期的功能要求。
4.安全性能-检查产品是否符合相关的安全标准,如防火性能、电气安全等。
-检查产品是否存在可能伤害人体的物质和设计缺陷。
四、检验结论根据对产品的检验结果进行综合评估1.外观检查:合格2.规格尺寸:合格3.功能性能:合格4.安全性能:合格五、总结与建议经过本次产品检验,产品符合相关的质量标准和要求,具备正常的外观、规格、功能和安全性能。
建议在生产过程中继续保持良好的品质控制,确保产品的稳定性和一致性。
六、备注七、检验员签名:。
阿莫西林可溶性粉检验报告

烟台金海药业有限公司
成品检验报告
编号:检(2013) C017-001第1页共1页检品名称阿莫西林可溶性粉编码JH-ZJ-06-C017-00
商品名/ 规格100g:5g
批号20130401 包装100g/袋
批数量/ 检品数量100g/袋×3袋
生产单位烟台金海药业有限公司检验日期2013年4月1日
检验项目全检报告日期2013年4月2日
检验依据《阿莫西林可溶性粉成品质量标准》
检验项目[性状] [鉴别]
[检查] 水分
溶解性
外观均匀度装量[含量测定]
检验标准
应为白色或类白色粉末
供试品溶液主峰的保留时间
应与对照品溶液主峰的保留
时间一致
含水分不得过5.0%
应符合规定
应符合规定
应符合规定
本品含阿莫西(C16H19N3O5S)
应为标示量的92.0%~108.0%
检验结果
为白色粉末
供试品溶液主峰的保
留时间与对照品溶液主
峰的保留时间一致
为2.6%
符合规定
符合规定
符合规定
为100.6%
(以下空白)
项目结论
符合规定
符合规定
符合规定
符合规定
符合规定
符合规定
符合规定
结论:本品按《阿莫西林可溶性粉成品质量标准》检验,结果符合规定。
检验人:复核人:质检负责人:。
阿莫西林

阿莫西林AmoxilinAmoxicillinC16H19N3O5S·3H2O 419.46 本品为(2S,5R,6R)-3,3-二甲基-6-﹝(R)-(-)-2-氨基-2-(4-羟基苯基)乙酰氨基﹞-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸三水合物。
按无水物计算,含C16H19N3O5S不得少于95.0%。
【性状】本品为白色或类白色结晶性粉末;味微苦。
本品在水中微溶,在乙醇中几乎不溶。
比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml中约含2㎎的溶液,依法测定(附录53页),比旋度为+290°至+315°。
【鉴别】(1)取本品与阿莫西林对照品各约0.125g,分别加4.6%碳酸氢钠溶液溶解并稀释制成每1ml中约含阿莫西林10mg的溶液,作为供试品溶液与对照品溶液;另取阿莫西林对照品和头孢唑啉对照品各适量,加 4.6%碳酸氢钠溶液溶解并稀释制成每1ml中约含阿莫西林10mg和头孢唑啉5mg的溶液作为系统适用性试验溶液。
照薄层色谱法(附录33页)试验,吸取上述三种溶液各2μl,分别点于同一硅胶GF254薄层板上,以乙酸乙酯-丙酮-冰醋酸-水-(5:2:2:1)为展开剂,展开,晾干。
置于紫外灯254nm下检视。
系统适用性试验溶液应显两个清晰分离的斑点,供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色相同。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱一致。
以上(1)、(2)两项可选做一项。
【检查】酸度取本品,加水制成每1ml中含2mg的溶液,在50℃水浴中微温使溶解后,依法测定(附录56页),pH值应为3.5~5.5。
溶液的澄清度取本品5份,各1.0g,分别加0.5mol/L盐酸溶液10ml,溶解后立即观察,另取本品5份,各1.0g,分别加2mol/L氨溶液10ml溶解后立即观察,溶液均应澄清。
10实验十阿莫西林胶囊的质量检验

三、有关物质检查
色谱条件
m.p D :0.05mol/L磷酸二氢钾溶液(pH5.0)
m.p B :乙腈
Time(min) 0 15 45 55
m.p D 97.5 97.5 80 80
m.p B 2.5 2.5 20 20
56
70
97.5
97.5
2.5
2.5
有关物质检查
样品溶液的配制(2mg/ml)
实验原理
三. RP-HPLC色谱法(略)
实验内容
一. 鉴别
二. 含量测定
三. 有关物质检查
一、鉴别
在含量测定条件下记录的色谱图中,供试品溶液 主峰的保留时间应与对照品溶液主峰的保留时间 一致。
二、含量测定
对照品溶液制备:精密称取阿莫西林对照品约 25mg,置50ml量瓶中,用流动相溶解定容成浓度 为0.468mg/ml溶液。 供试品溶液制备:取本品10片,取胶囊内容物, 精密称定,研细,精密称取适量(约相当于阿莫 西林25mg),置50ml量瓶中,用流动相稀释定容 成每1ml约含0.5mg的溶液,用 0.45μm 滤膜滤过, 取续滤液,精密吸取20μl注入液相色谱仪,记录 色谱图; 按外标一点法以峰面积计算出供试品中 C16H19N3O5S的含量。
实验十
阿莫西林胶囊的质量检验
实验目的
掌握内酰胺类化合物的结构;
熟悉高效液相色谱法的定性、定量方法;
掌握β-内酰胺类抗生素的性质及有关物质检查; 掌握HLPC测定含量的方法。
实验原理
一. 阿莫西林结构 本品主要成分为β-内酰胺类抗生素阿莫西林,本品 含阿莫西林(C16H19N3O5S)应为标示量的 90.0%~110.0%。
色谱条件
阿莫西林按 Ph Eur 6 0检验规程及12种杂质结构、名称

SOP-B/QU/06/569 1/8 阿莫西林按Ph.Eur.6.0 蓝色部分为有关物质检测1.分子式C16H19N3O5S·3H2O 分子量419.4。
2.CAS编码61336-70-7 3.定义按无水物计算阿莫西林三水酸含有不低于95.0不高于102.0的2S5R6R-6-2R-2-氨基-2-4-羟苯基乙酰氨基-33-二甲基-7-氧代-4-硫杂-1-氮杂双环3.2.0-庚烷-2-羧酸三水酸。
4.性状白色或类白色结晶性粉末微溶于水难溶于乙醇96不溶于脂肪油。
溶于稀酸和稀的碱金属类氢氧化物溶液。
5.检验操作规程5.1.鉴别5.1.1.本品的红外光吸收图谱应与阿莫西林三水合物标准品的图谱一致。
5.1.2.在含量项下记录的色谱图中供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.2.溶液的澄清度1供试品溶液的制备称取供试品1.0g加0.5mol/L 盐酸溶液10mL后使溶解称取供试品1.0g加稀氨水10mL后使溶解。
将供试品分别与标准比浊液置于比浊用玻璃管中在暗室内同置于澄明度观测仪黑色背景上从水平方向沿径向观察与标准比浊液比较其浑浊程度。
在进行比较时如供试品溶液管的浊度接近标准管时应交换位置观察。
5.3.酸度1样品溶液称取供试品0.1g量取新沸放冷的纯化水50mL在50℃水浴中微热用搅拌棒搅匀。
5.4.比旋度5.4.1.1.溶液制备取供试品100mg精密称定于小烧杯中用纯化水转移至50mL容量瓶中使其溶解并定容至刻度。
5.5. 有关物质5.5.1.测定方法采用高效液相色谱法测定。
5.5.2.仪器与材料高效液相色谱仪、电子天平、超声波清洗仪、溶剂过滤器、酸度计、18色谱柱、烧杯、量筒、50mL容量瓶、25mL容量瓶、100mL容量瓶、5mL移液管、2mL移液管、注射器、0.45μm 微孔滤膜。
5.5.3.试剂与试液5.5.3.1.乙腈色谱纯、5.5.3.2.2mol/L氢氧化钠溶液称定氢氧化钠8g用纯化水溶解至100mL摇匀。
阿莫西林可溶性粉(成品)检验记录

检查
装量
量
样品号
1
2
3
药+包装重(g)
包装重(g)
药重(g少于标示量的98%平均装量不少于标示量
项目结论
干燥失重
天平室温度:℃湿度:%
干燥条件
60℃减压干燥3小时
检品号
1
2
称量瓶重W0(g)
瓶+药重W1(g)
干燥后瓶+药重W2(g)
计算公式
W1- W2
干燥失重=×100%
有限公司
成品检验记录首页
文件编号: 00第1页共3页
检品名称
阿莫西林可溶性粉
检验单号
商品名称
请验部门
生产日期
年月日
生产批号
生产总量
取样数量
规格
取样人
送检日期
年月日
报告日期
年月日
检验依据
《阿莫西林可溶性粉内控质量标准(成品)》
性
状
本品应为白色或类白色结晶性粉末;
检验结果:
鉴
别
在含量测定项下纪录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
标准规定:应为标示量的92.0%-108.0%。
项目结论:
检验结论:本品按《阿莫西林可溶性粉内控质量标准(成品)》检验,结果规定。
备注
复核人:检验人:
有限公司
成品检验报告单
文件编号:00第3页共3页
检品名称
阿莫西林可溶性粉
检验单号
商品名
请验部门
西药粉剂车间
生产日期
生产批号
生产总量
取样数量
规格
取样人
送检日期
W1- W0
ZT-R-QC-3057-01 阿莫西林可溶性粉中间产品检验原始记录

中 间 产 品 检 验 原 始 记 录 第1页品 名 阿莫西林可溶性粉 检验单号 来 源 本公司固体制剂车间批 号 检验数量 规 格检品项目取样日期 年 月 日 检验依据 企业内控质量标准检验日期年 月 日检验项目及结果【性状】本品为 (白色或类白色粉末)。
【检查】溶解性 取本品50mg ,加水100ml ,搅拌, (应溶解)。
水分 取本品适量,照《水分测定标准操作规程》(ZT-SOP-QC-011-01, 第一法)检查,含水分不得过5.0%。
计算公式: %100%⨯⨯-=WF B A )(水分式中:A 为供试品所消耗费休氏试液的体积,ml ;B 为空白所消耗费休氏试液的体积,ml ; F 为每1ml 费休氏试液相当于水的重量,mg ; W 为供试品的重量,mg 。
A 1: A 2:B : W 1: W 2: F :检验项目及结果外观均匀度 取供试品适量,置光滑纸上,平铺约5cm 2,将其表面压平,在明亮处观察, (应色泽均匀,无花纹、色斑)。
检验人: 复核人:中 间 产 品 检 验 原 始 记 录 第2页品 名阿莫西林可溶性粉批 号含量测定 照《高效液相色谱法标准操作规程》(ZT-SOP-QC-007-01)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅为填充剂;0.05mol/L 磷酸二氢钾溶液(用2mol/L 氢氧化钾溶液调节pH 至5.0)-乙腈(97.5:2.5)为流动相;检测波长为254nm 。
取阿莫西林系统适用性对照品约25mg ,置50ml 量瓶中,用流动相溶解并稀释至刻度,摇匀,取20μl 注入液相色谱仪,记录的色谱图应与标准图谱一致。
测定法 取本品适量,精密称定,加流动相溶解并稀释成每1ml 中含0.5mg 的溶液,取20μl 注入液相色谱仪,记录色谱图;另取阿莫西林对照品适量,同法测定。
按外标法以峰面积计算出供试品中C 16H 19N 3O 5S 的含量。
(含阿莫西林C 16H 19N 3O 5S 应为标示量的95.0%~105.0%) 计算公式: %100%%⨯⨯⨯⨯⨯=标示量标示量供对对对供W A C W A式中:A 供为供试品峰面积; W 供为供试品取样量,g ; A 对为对照品峰面积; W 对为对照品取样量,g ; C%对为对照品的含量。
阿司匹林肠溶片检验记录

成品检验记录第1页共4页检验号:品名阿司匹林肠溶片规格批号数量取样日期年月日来源报告日期年月日依据性状:本品为。
(规定:本品为肠溶包衣片,除去包衣后显白色。
)结论:鉴别:(1)、取本品细粉 g(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液滴,即显。
(规定:显紫堇色。
)结论:(2)、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间对照品溶液的主峰的保留时间。
(规定:保留时间应一致。
)结论:检查:1、重量差异:限度为±7.5%,超出重量差异限度的药片不得多于2片,并不得有1片超出限度1倍。
使用仪器:电子天平测定:取供试品20片,依法检查20片重: g 平均片重:片重范围:×7.5%=结论:2、脆碎度:减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
(内控标准:0.8%)使用仪器:电子天平脆碎度仪测定:取本品片,第一次称重g,转速为25转∕分钟,转4分钟后,第二次称重g计算:结论:检验人:复核人:阿司匹林肠溶片检验记录成品检验记录续页第2页共4页结论:3、释放度:使用方法:释放度测定法{中国药典2010版二部附录XD第二法(1)},采用溶出度测定法第一法装置;高效液相色谱法。
使用仪器:智能药物溶出仪酸度计高效液相色谱仪电子天平电机转速:转/分钟介质温度:℃供试品片酸度计定位:P H 6.86磷酸盐缓冲液酸度计校对:P H 4.00邻苯二甲酸氢钾缓冲液酸液中:介质:0.1mol/L盐酸溶液介质量:ml 释放时间:分钟缓冲液:介质:在酸液中加入0.2mol/L磷酸钠溶液200ml,PH为(规定:6.8±0.05)释放时间:分钟色谱条件:色谱柱:柱长:柱温:流速:检测波长:柱压:流动相:乙腈—四氢呋喃—冰醋酸—水(20:5:5:70)对照品来源:对照品:阿司匹林对照 g 批号:配制日期:水杨酸对照 g 批号:配制日期:1、酸中释放量:每片阿司匹林释放量应小于阿司匹林标示量的10%。
阿莫西林检验记录

原辅料检验记录首页
文件编号: 00第 1 页 共3页
原辅料名称
阿莫西林
检验单号
批 号
供货单位
供货数量
请验部门
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
《阿莫西林内控质量标准》
性
状
本品应为白色或类加水制成每1ml中含2mg的溶液,依法测定,比旋度应为+290°至+315°。
检验结论:本品按《阿莫西林内控质量标准》检验,结果规定.
有限公司
原辅料检验记录报告单
文件编号:00第3页 共3页
原辅料名称
阿莫西林
检验单号
批 号
供货单位
供货数量
请验单位
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<阿莫西林内控质量标准>>
检验项目标准规定检验结果项目结论
检验结果:
鉴
别
1在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液的主峰保留时间一致。
检验结果:
2本品的红外线吸收图谱应与对照品的图谱一致。
检验结果:
溶液的澄清度
取本品5份,各1.0g,分别加0.5mol/L的盐酸溶液10ml,及2mol/L的氨溶液10ml溶解后,立即观察,溶液均应澄清。如显浑浊,与2号浊度标准液比较,不得更浓。
检验结果:
PH
值
仪器型号
PHS-25A
室温
仪器编号
MHT-001
阿莫西林原料药质量标准BP
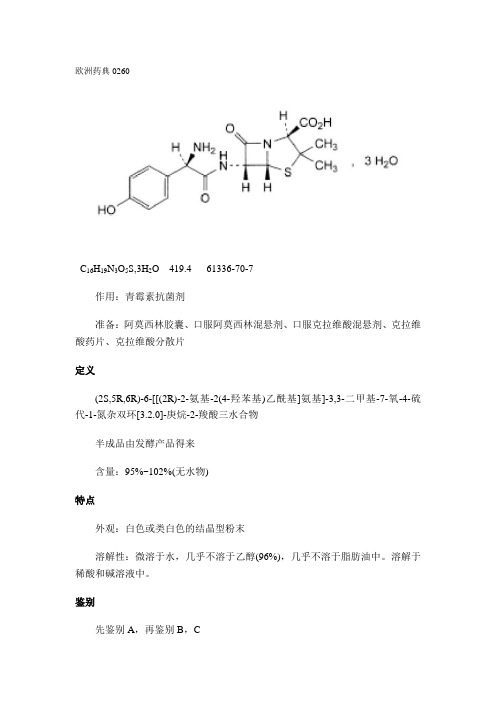
欧洲药典0260C16H19N3O5S,3H2O 419.4 61336-70-7作用:青霉素抗菌剂准备:阿莫西林胶囊、口服阿莫西林混悬剂、口服克拉维酸混悬剂、克拉维酸药片、克拉维酸分散片定义(2S,5R,6R)-6-[[(2R)-2-氨基-2(4-羟苯基)乙酰基]氨基]-3,3-二甲基-7-氧-4-硫代-1-氮杂双环[3.2.0]-庚烷-2-羧酸三水合物半成品由发酵产品得来含量:95%~102%(无水物)特点外观:白色或类白色的结晶型粉末溶解性:微溶于水,几乎不溶于乙醇(96%),几乎不溶于脂肪油中。
溶解于稀酸和碱溶液中。
鉴别先鉴别A,再鉴别B,CA.红外分光光度法(2.2.24)对照:阿莫西林三水合物标准品B.薄层色谱法(2.2.27)试验溶液:溶解待测物质25mg于10ml碳酸氢钠溶液中。
对照溶液(a):溶解阿莫西林三水合物标准品25mg于碳酸氢钠溶液中。
对照溶液(b):溶解阿莫西林三水化合物标准品25mg和氨苄青霉素三水化合物标准品25mg于10ml碳酸氢钠溶液中板:薄层色谱使用硅胶板流动相:混合丙酮和154g/l的醋酸铵溶液(两者体积比为10:90),醋酸铵溶液预先用冰醋酸调节pH到5.0.进样量:1ul进程:超过15cm干燥:在室温环境下检测:放置于碘酒蒸汽下,直到出现点,在日光下观察系统适应性:对照溶液(b):--色谱出现两个明显分离的点。
结果:用试验溶液在薄层色谱上获得的主要的点和对照溶液获得的点位置、颜色、大小相似。
C.在150mm长、直径为15mm的试管中放2mg。
用0.05ml水润湿并加入2ml 硫酸甲醛试剂。
搅拌混合试管中的液体;溶液几乎无色。
将试管放入水浴锅1min;会变成黑黄色。
试验溶液S:超声或者缓缓加热,溶解0.1g于充满CO2的水中,并且用50ml相同溶剂溶解。
溶液的外观:溶液不比标准悬浊液II更乳白。
溶解1g于10ml,0.5mol的盐酸中。
单独溶解1g在10ml的稀氨溶液中。
阿莫西林胶囊质量标准

阿莫西林胶囊质量标准本品含阿莫西林(C16H19N3O5S)应为标示量的90.0%~110.0%。
【性状】本品内容物为白色至黄色粉末或颗粒。
【鉴别】(1)取本品内容物适量(约相当于阿莫西林0.125g),加4.6%碳酸氢钠溶液使溶解并稀释制成每1ml中约含阿莫西林10mg的溶液,滤过,作为供试品溶液,照阿莫西林项下的鉴别(1)项试验,显相同的结果。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰面积的保留时间一致。
【检查】有关物质取本品的内容物适量,精密称定,加流动相A溶解并定量稀释成每1ml中约含阿莫西林2.0mg的溶液,滤过,取续滤液,照阿莫西林项下的方法测定。
单个杂质峰面积不得大于对照品溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照品溶液面积的5倍(5.0%)。
阿莫西林聚合物取本品内容物,混匀,精密称取适量(约相当于阿莫西林0.2g),置10ml量瓶中,加2%无水碳酸钠溶液5ml使溶解并用水稀释至刻度,摇匀,滤过,立即取续滤液作为供试品溶液,照阿莫西林项下的方法试验。
含阿莫西林聚合物以阿莫西林计,不得过0.2%。
水分取本品的内容物,照水分测定法(附录Ⅷ M第一法 A)测定,含水分不得过16.0%。
溶出物取本品,照溶出度测定法(附录Ⅹ C第一法),以水900ml为溶出介质,转速为每分钟100转,依法操作,经45分钟时,取溶液适量,滤过,精密量取续滤液适量,用水定量稀释制成每1ml中约含阿莫西林130μg的溶液,照紫外-可见分光光度法(附录Ⅳ A),在272nm的波长处测定吸光度,另取装量差异项下的内容物,混合均匀,精密称取适量(约相当于平均装量),按标示量加水溶解并定量稀释制成每1ml中约含阿莫西林130μg的溶液,滤过,取续滤液,同法测定,计算每粒的溶出量。
限度为80%,应符合规定。
其他应符合胶囊剂项下有关的各项规定(附录ⅠE)。
【含量测定】取装量差异项下的内容物,混合均匀,精密称取适量(约相当于阿莫西林0.125g),加流动相溶解并定量稀释制成每1ml中约含阿莫西林0.5mg 的溶液,滤过,取续滤液,照阿莫西林项下的方法测定,即得。
阿莫西林克拉维酸钾研究资料

药学研究资料综述一、药品名称:通用名:阿莫西林克拉维酸钾(4:1)干混悬剂英文名:Amoxicillin and Clavulanate Potassium for Suspension汉语拼音: Amoxilin Kelaweisuanjia Ganhunxuanji本品为复方制剂,其组分为阿莫西林和克拉维酸钾,两者之比为4:1。
规格:156.25mg(阿莫西林125mg与克拉维酸31.25mg)二、处方工艺:根据《中国药典》2000年版二部及国家药品标准新药转正标准第32册152页“阿莫西林克拉维酸钾(4:1)干混悬剂”项下[WS1-(X-017)-2003Z],本品为阿莫西林钠克拉维酸钾(4:1)均匀混合制成的干混悬剂:1、处方:阿莫西林克拉维酸钾(4:1) 156.25g(阿莫西林125 g与克拉维酸31.25g)微粉硅胶 300g羧甲淀粉钠 100g微晶纤维素 62.5g草莓香精 20g干燥蔗糖粉加至2000 g制成 1000包2、详细制备工艺(1)蔗糖于65℃烘干,备用。
(2)将各原辅料粉碎过80目筛,备用。
(3)按处方量准确称取除蔗糖粉外的各原辅料,混合均匀后,按等量递加法再与处方量干燥蔗糖粉混合均匀。
(4)中间体送检含量,确定装量。
(5)药粉按装量分装于复合膜袋内。
(6)成品全检,包装,入库。
3、工艺处方研究:按《中国药典》2000年版二部及国家药品标准新药转正标准第32册152页阿莫西林克拉维酸钾(4:1)干混悬剂项下[WS1-(X-017)-2003Z],经对辅料的选择;以药粉流动性、装量差异、沉降体积比、粒度、再分散性、含量为目的指标,对本品进行处方筛选,并对含量与溶出度;样品微粉学试验的堆密度、休止角、测装量差异、粒度、沉降体积比、溶化性;临界相对湿度考察进行了考察,结果显示本处方组方合理,适合大生产要求。
影响因素试验:影响因素试验是在较为激烈的条件下进行的。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件以及运输建立质量控制方法提供科学依据。
(最新)阿莫西林原料药质量报(精品)

品 名:阿莫西林原料药 数 车 间
产品批号 桶 (千克)
报表日期:年月日 量 生产日期 外 观
% % (pH)
%
含量
水分
酸度
粒度 松密度
内 控 质量标准 优级品
603车间 603车间 603车间 603车间 603车间 603车间 603车间 603车间 603车间 603车间 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
结论
产品质量指标日统计(07年05月)
当日报检 总批数 合 格品累计 批数 桶数 产量(kg) 优级品累计 批数 批数 不合格品累计 桶数 优级品率(%) 累计 一次合格率 (%) 当 日 累计 单项优级品率% 含量 当 日 累计 总产量(kg)
产量 (kg) 当日
报表部门:质管认证部
部门经理:
报表人:
白色或类白 ≥97.0 12.0~15.0 3.5~5.5 色颗粒 白色或类白 ≥98.0 12.0~14.0 3.5~5.5 色颗粒
≥85 —
有关物质 聚合 溶出度 (%) 物 %(抽 单一杂 g/ml g/ml 总杂质 % 质 检) ≤ ≥0.50 ≥0.75 ≤1.5 ≤3.0 ≥90 0.15 ≤ ≤1.0 ≤2.0 ≥93 — — 0.10 振实密 度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原料检验记录编号:SOR-ZL10202
炽灼残渣检验记录
批号:检验时间:年月日
天平编号:SB-JY-001 天平室温度:天平室相对湿度:% 高温电阻炉编号:SB-JY-010 炽灼温度:放冷至室温时间:分钟
水分(费休氏法)检验记录
比旋度测定法检验记录
检验室温度:℃检验室相对湿度: %
主要仪器:天平编号:SB-JY-001 旋光仪编号: SB-JY-014
检验人:复核人:
高效液相色谱法检验记录
产品批号:检验时间:年月日
天平编号:SB-JY-001 检验室温度:℃检验室相对湿度:% 高效液相色谱仪编号:SB-JY-008 测定波长:nm
对照品名称:阿莫西林对照品含量(C0):%
检验人:复核人:。
