弱电解质的电离平衡(公开课)ppt
合集下载
强弱电解质及电离平衡ppt课件

定:平衡时分子、离子的浓度不再变化
变:条件改变时,电离平衡发生移动 —勒夏特列原理
强电解质和弱电解质
弱电解质电离的特点
1.电离过程是吸热的。
2.弱电解质的电离属于可逆过程,分子、离子共存。
3.弱电解质在溶液中的电离都是微弱的。
如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。
【结论】
• HCl 分子在水中完全电离;
• CH3COOH 分子在水中部分电离,且非常微弱。
强电解质和弱电解质
强电解质
电解质
在水溶液里全部电离成离子
①强酸:HCl、H2SO4等;②强碱:NaOH、Ca(OH)2等
③绝大多数盐:如NaCl、BaSO4等
④活泼金属氧化物:Na2O、CaO等
弱电解质
在水溶液里只有部分分子电离成离子
选项
强电解质
弱电解质
非电解质
A
NaCl
HF
Cl2
B
NaHSO4
NaHCO3
CCl4
C
Ba(OH)2
HCl
Cu
D
AgCl
H2 S
C2H5OH
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项
中,表明已达到电离平衡状态的是( D
)
A.CH3COOH的浓度达到1 mol·L-1
NH3、SO2、CO2 ;
3.电解质的导电:导电的条件是溶于水或熔融状态;
4.导电的本质是自由离子的定向移动;
5.导电能力与离子浓度和离子所带电荷有关。
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,
变:条件改变时,电离平衡发生移动 —勒夏特列原理
强电解质和弱电解质
弱电解质电离的特点
1.电离过程是吸热的。
2.弱电解质的电离属于可逆过程,分子、离子共存。
3.弱电解质在溶液中的电离都是微弱的。
如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。
【结论】
• HCl 分子在水中完全电离;
• CH3COOH 分子在水中部分电离,且非常微弱。
强电解质和弱电解质
强电解质
电解质
在水溶液里全部电离成离子
①强酸:HCl、H2SO4等;②强碱:NaOH、Ca(OH)2等
③绝大多数盐:如NaCl、BaSO4等
④活泼金属氧化物:Na2O、CaO等
弱电解质
在水溶液里只有部分分子电离成离子
选项
强电解质
弱电解质
非电解质
A
NaCl
HF
Cl2
B
NaHSO4
NaHCO3
CCl4
C
Ba(OH)2
HCl
Cu
D
AgCl
H2 S
C2H5OH
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项
中,表明已达到电离平衡状态的是( D
)
A.CH3COOH的浓度达到1 mol·L-1
NH3、SO2、CO2 ;
3.电解质的导电:导电的条件是溶于水或熔融状态;
4.导电的本质是自由离子的定向移动;
5.导电能力与离子浓度和离子所带电荷有关。
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,
弱电解质的电离平衡完整版课件

化合物
• 在________和____________下都不能导电的________。
水溶液
熔融状态
化合物
• 3.强电解质
• 在水溶液中能够____电离的电解质。如____、____、大多数
____。
完全
强酸 强碱
• 盐4.弱电解质
• 在水溶液中只能____电离的电解质。如____、____、____。
实验探究十 电解质溶液导电性的影响因素
• 电解质的强弱取决于电解质的电离能力,而溶液的导电能力的强 弱除与电解质的电离能力有关外,还取决于其溶液中离子的电荷数。一 般判断溶液导电能力的强弱看以下两个方面:(1)溶液的导电能力大小 主要取决于溶液中离子浓度的大小,离子浓度越大,导电能力就越强; 反之,导电能力就越弱。
• D.HNO2(K=4.6×10-4) • 【答案】B
• 【解析】根据电离平衡常数的意义,K值越大,溶液中c(H+)越 大。多元酸主要看第一步电离,即看K1。
强电解质与弱电解质的比较
• 1.在溶液中的电离
2.与化合物类型的关系
3.常见的强、弱电解质
• 【例1】下列关于强、弱电解质的叙述正确的是( ) • A.强电解质都是离子化合物,弱电解质都是共价化合物 • B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 • C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质 分子
• 【体验1】有关电解质的下列叙述,正确的是( ) • A.盐酸的导电性比醋酸强 • B.K2O的水溶液能导电,所以K2O是电解质 • C.强电解质中一定含离子键 • D.离子导电必须能自由移动 • 【答案】D
弱电解质的电离平衡
• 1.电离平衡的特征
• 影2.响影因响素因素
化学选修五 弱电解质的电离平衡(公开课课件)

(3)根据物质的类别判断弱电解质。
弱酸、弱碱、水。
H2CO3、HClO、H2S、HF、CH3COOH NH3·H2O Fe(OH)3等
3
【实验探究】
等体积、等浓度的盐酸、醋酸与镁条(用砂纸打磨)的反应。 观察、比较气球鼓起的快慢等现象。思考等浓度的盐酸、醋
酸溶液中的H+浓度的大小关系。
4
一、弱电解质的电离平衡
稀释时浓度的变化——主要微粒浓度都减小。
19
CH3COOH
CH3COO- + H+ Δ H>0 平衡移 动方向 向右
项目 加水稀释 升高温度 加NaOH 加H2SO4 加醋酸铵固体 加冰醋酸
[H+] 减小
H+数目 增多
Ka 不变
向右
向右 向左
增大
减小 增大
增多
减少 增多
增大
不变 不变
向左
向右
பைடு நூலகம்
减小
增大
15
归纳: CH3COOH
CH3COO¯ + H+ Δ H>0
n(H+) [H+] 电离
平衡移动的 电离平衡
方向
升温
常数Ka
程度
正向
增大
增大
增大
增大
加水稀释 加冰醋酸 通HCl气体 NaOH固体
CH3COONa Na2CO3
正向
正向 逆向 正向 逆向 正向
不变
不变 不变 不变 不变 不变
增大
增大 增大 减小 减小 减小
CH3COOH
电离 结合
CH3COO- + H+
5
1.定义: 在一定条件(如温度、浓度)下,当电解质分子电离成离 子和离子重新结合成分子的速率相等时,各种微粒的浓度 保持不变,电离过程就达到了平衡状态——电离平衡。 2.特征: 逆、动、等、定、变。
弱酸、弱碱、水。
H2CO3、HClO、H2S、HF、CH3COOH NH3·H2O Fe(OH)3等
3
【实验探究】
等体积、等浓度的盐酸、醋酸与镁条(用砂纸打磨)的反应。 观察、比较气球鼓起的快慢等现象。思考等浓度的盐酸、醋
酸溶液中的H+浓度的大小关系。
4
一、弱电解质的电离平衡
稀释时浓度的变化——主要微粒浓度都减小。
19
CH3COOH
CH3COO- + H+ Δ H>0 平衡移 动方向 向右
项目 加水稀释 升高温度 加NaOH 加H2SO4 加醋酸铵固体 加冰醋酸
[H+] 减小
H+数目 增多
Ka 不变
向右
向右 向左
增大
减小 增大
增多
减少 增多
增大
不变 不变
向左
向右
பைடு நூலகம்
减小
增大
15
归纳: CH3COOH
CH3COO¯ + H+ Δ H>0
n(H+) [H+] 电离
平衡移动的 电离平衡
方向
升温
常数Ka
程度
正向
增大
增大
增大
增大
加水稀释 加冰醋酸 通HCl气体 NaOH固体
CH3COONa Na2CO3
正向
正向 逆向 正向 逆向 正向
不变
不变 不变 不变 不变 不变
增大
增大 增大 减小 减小 减小
CH3COOH
电离 结合
CH3COO- + H+
5
1.定义: 在一定条件(如温度、浓度)下,当电解质分子电离成离 子和离子重新结合成分子的速率相等时,各种微粒的浓度 保持不变,电离过程就达到了平衡状态——电离平衡。 2.特征: 逆、动、等、定、变。
弱电解质的电离平衡ppt课件

1. 知250C时,0.1mol/L的氨水的电离度为 1.33%,求此氨水中OH-的浓度
NH3·H2O NH4+ +
起始: 电离: 平衡:
OH-c x
(c-x)
0
0
x
x
x
x
α=
x c
×100%
c(OH-)= c· α
c(OH-)= 0.1mol/L ×1.33% = 1.33 ×10-3mol/L
H2O
7
11
那么H以2下S 反响5能.7×够1发0-生的1是.2×10- A. NaHCO3+NaH8S→Na2CO153+H2S
B. H2S+Na2CO3→NaHS+NaHCO3
C. Na2S+H2O+CO2→H2S+Na2CO3
D. H2S+NaHCO3→NaHS+H2CO3
交流与讨论 1.强电解质溶液的导电才干一定比弱电解质溶 液的导电才干强吗?
弱用“可逆〞强用“等 〞;
多元弱酸分步写,
多元弱碱一步“逆〞
(4) Al(OH)3
练习1、知:〔1〕在250C时,1mol/L醋酸中电离
出来的氢离子浓度仅为0.004mol/L左右,该溶液
中醋酸的电离度为多少?
α=
已电离的醋酸浓度 醋酸的初始浓度
×100%
=
0.004mol/L 1mol/L
×100% =
H2O
H+ + OH-
c(H+)·c(OH-)
K= c(H2O)
是定值
水的离子积常数 KW c(H+)·c(OH-) 水的离子积 250=C时, KW= 1.0×10 -14
水的离子积常数与哪些要素有关? 只与温度有关
NH3·H2O NH4+ +
起始: 电离: 平衡:
OH-c x
(c-x)
0
0
x
x
x
x
α=
x c
×100%
c(OH-)= c· α
c(OH-)= 0.1mol/L ×1.33% = 1.33 ×10-3mol/L
H2O
7
11
那么H以2下S 反响5能.7×够1发0-生的1是.2×10- A. NaHCO3+NaH8S→Na2CO153+H2S
B. H2S+Na2CO3→NaHS+NaHCO3
C. Na2S+H2O+CO2→H2S+Na2CO3
D. H2S+NaHCO3→NaHS+H2CO3
交流与讨论 1.强电解质溶液的导电才干一定比弱电解质溶 液的导电才干强吗?
弱用“可逆〞强用“等 〞;
多元弱酸分步写,
多元弱碱一步“逆〞
(4) Al(OH)3
练习1、知:〔1〕在250C时,1mol/L醋酸中电离
出来的氢离子浓度仅为0.004mol/L左右,该溶液
中醋酸的电离度为多少?
α=
已电离的醋酸浓度 醋酸的初始浓度
×100%
=
0.004mol/L 1mol/L
×100% =
H2O
H+ + OH-
c(H+)·c(OH-)
K= c(H2O)
是定值
水的离子积常数 KW c(H+)·c(OH-) 水的离子积 250=C时, KW= 1.0×10 -14
水的离子积常数与哪些要素有关? 只与温度有关
《弱电解质电离平衡》课件

3 举例
乙酸、甲酸、碳酸等都是弱电解质。
弱电解质电离的平衡
电离平衡常数
描述了弱电解质的电离反应, 是反应物浓度和产物浓度的比 值,通常用Kc表示。
反应式
弱电解质的电离反应式一般为 HA + H2O ⇔ A- + H3O+
影响因素
温度、离子强度、化学品浓度 等都会影响弱电解质电离的平 衡。
离子强度和离子活度
根据平衡常数计算pH值比较麻烦,可以通 过Henderson-Hasselb alch方程直接计算pH 值。
总结
弱电解质电离平衡的重要性
弱电解质电离平衡在生命科学和化学领域非常重要,我们必须加深对其实质的理解。
缓冲作用在生命科学中的应用
缓冲溶液是生命科学研究中不可或缺的重要试剂,被广泛应用于生化、药学、医学等领域。
1
离子活度与离子强度的关系
2
Байду номын сангаас
离子活度是指溶液中反应组分实际浓度
与理论浓度之比,通常用ai表示。离子活
度与离子强度呈指数函数关系。
3
离子强度的定义
离子强度是所有离子的总浓度之和,通 常用I表示。
离子活度的计算方法
离子活度可以由各种离子运动率的反比 例关系计算,运动率低的离子活度高。
pH的概念和计算方法
《弱电解质电离平衡》 PPT课件
本课件介绍弱电解质电离平衡的原理和应用,包括离子强度和离子活度的概 念,pH的计算方法,以及缓冲溶液的作用和制备方法。
什么是弱电解质?
1 定义
弱电解质是指在水溶液中只部分离解的物质,电离度较低。
2 特征
弱电解质的离子度随浓度的变化而变化;化学反应较慢,达到化学平衡需要较长的时间。
弱电解质的电离平衡(公开课)ppt

练习:在0.1mol/L的CH3COOH溶液中 CH3COOH CH3COO-+H+
K
α
n(H+)
C(H+)
加热
加水
锌粒
加醋酸钠
加HCl
加NaOH
不变
增大
不变
增大
减小
减小
减小
减小
增大
增大
不变
减小
增大
减小
不变
增大
减小
不变
减小
减小
增大
增大
增大
增大
加水C(H+)一定减少吗?
导电性
加 盐 酸
加 NaOH
加H3COONa
加CH3COOH
加 水
正向移动
增大
增大
减少
逆向移动
增大
减少
增大
正向移动
减少
增大
减少
逆向移动
减少
增大
增大
正向移动 Biblioteka 增大 增大 增大
正向移动
减少
减少
减少
CH3COOH CH3COO--+ H+
知识回顾 :2、化学平衡常数 K
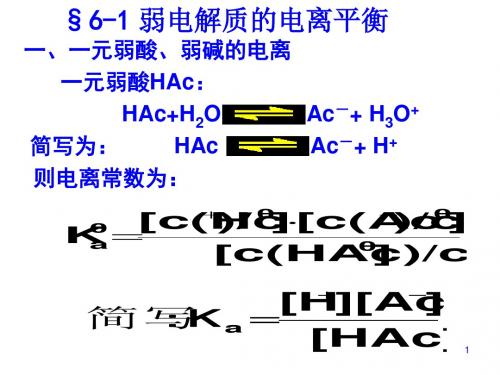
二、弱电解质电离程度的表示:
1、电离平衡常数K:
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( M+).c( OH- )
c(MOH)
对于一元弱酸:HA H++A-,平衡时
对于一元弱碱:MOH M++OH-,平衡时
(1)、K表达式:
01
02
(2)、电离平衡常数意义:
弱电解质的电离平衡PPT课件(上课用)23

9、成功的道路上,肯定会有失败;对 于失败 ,我们 要正确 地看待 和对待 ,不怕 失败者 ,则必 成功;怕 失败者 ,则一 无是处 ,会更 失败。 10、一句简单的问候,是不简单的牵 挂;一声 平常的 祝福, 是不平 常的感 动;条消 息送去 的是无 声的支 持与鼓 励,愿 你永远 坚强应 对未来 ,胜利 属于你!
25、我学习了一生,现在我还在学习, 而将来 ,只要 我还有 精力, 我还要 学习下 去。— —别林 斯基 2、人生就有许多这样的奇迹,看似比 登天还 难的事 ,有时 轻而易 举就可 以做到 ,其中 的差别 就在于 非凡的 信念。 3、影响我们人生的绝不仅仅是环境, 其实是 心态在 控制个 人的行 动和思 想。同 时,心 态也决 定了一 个人的 视野和 成就, 甚至一 生。
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
99.真正的发现之旅不只是为了寻找 全新的 景色, 也为了 拥有全 新的眼 光。― ―[马塞 尔·普 劳斯特]
100.这个世界总是充满美好的事物 ,然而 能看到 这些美 好事物 的人, 事实上 是少之 又少。 ――[罗 丹]
101.称赞不但对人的感情,而且对 人的理 智也发 生巨大 的作用 ,在这 种令人 愉快的 影响之 下,我 觉得更 加聪明 了,各 种想法 ,以异 常的速 度接连 涌入我 的脑际 。――[托尔斯 泰]
102.人生过程的景观一直在变化, 向前跨 进,就 看到与 初始不 同的景 观,再 上前去 ,又是 另一番 新的气 候―― 。[叔本 华]
25、我学习了一生,现在我还在学习, 而将来 ,只要 我还有 精力, 我还要 学习下 去。— —别林 斯基 2、人生就有许多这样的奇迹,看似比 登天还 难的事 ,有时 轻而易 举就可 以做到 ,其中 的差别 就在于 非凡的 信念。 3、影响我们人生的绝不仅仅是环境, 其实是 心态在 控制个 人的行 动和思 想。同 时,心 态也决 定了一 个人的 视野和 成就, 甚至一 生。
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
99.真正的发现之旅不只是为了寻找 全新的 景色, 也为了 拥有全 新的眼 光。― ―[马塞 尔·普 劳斯特]
100.这个世界总是充满美好的事物 ,然而 能看到 这些美 好事物 的人, 事实上 是少之 又少。 ――[罗 丹]
101.称赞不但对人的感情,而且对 人的理 智也发 生巨大 的作用 ,在这 种令人 愉快的 影响之 下,我 觉得更 加聪明 了,各 种想法 ,以异 常的速 度接连 涌入我 的脑际 。――[托尔斯 泰]
102.人生过程的景观一直在变化, 向前跨 进,就 看到与 初始不 同的景 观,再 上前去 ,又是 另一番 新的气 候―― 。[叔本 华]
《弱电解质电离平衡》课件

《弱电解质电离平衡》ppt课件
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
弱电解质的电离平衡-完整版课件

如图所示,导线插入相同浓度的不同溶液时,灯泡的 亮度不同,为什么会出现这种现象?若将上述溶液稀 释相同倍数,亮度的变化又不同,出现这种现象又是 为什么呢?这节课我们就来学习相关内容。
1.了解弱电解质的电离平衡常数的概念和电离平衡 常数与电离程度的关系。 2.理解影响弱电解质电离平衡的因素对电离平衡移 动的影响。(重点) 3.了解常见弱酸、弱碱的电离平衡常数大小,能比 较它们的电离能力强弱。
加NaOH
增大
减小 减小 增大 减小
锌粒
增大
减小 减小 增大 减小
升温
增大
增大 增大 增大 减小
1.弱电解质的电离平衡 2.弱电解质电离程度的表示 3.影响电离平衡的因素
(1)定义
(2)特点 (1)电离度 (2)电离平衡常数
(1)温度:越高越电离
(2)浓度:越稀越电离
1.(双选)醋酸溶液加水稀释,在稀释过程中 ( BD )
阿伦尼乌斯与电离理论 阿伦尼乌斯的最大贡献是1887
年提出电离学说,它突破了当时的科 学界普遍认为离子是在电流的作用 下产生的金科玉律, 提出“电解质 在溶液中能自动电离出正、负离子 ; 溶液越稀,电离程度就越大”。
这一学说是物理化学发展初期的重大发现,对 溶液性质的解释起过重要的作用。它是物理和化学 之间的一座桥梁。
4.21×10-3
0.100 0.09866 1.34×10-3 1.34×10-3 1.82×10-5
1.34×10-2
二、弱电解质电离程度的表示
1.电离度 (1)概念:
当弱电解质在溶液中达到平衡时,溶液中已经电
离的电解质分子数占原来总分子数的百分数。 (2)适用范围:处于电离平衡状态的弱电解质。
弱电解质浓度越大,电离度越小。 电离平 衡常数的大小与溶液的浓度无关。 越稀越电离
1.了解弱电解质的电离平衡常数的概念和电离平衡 常数与电离程度的关系。 2.理解影响弱电解质电离平衡的因素对电离平衡移 动的影响。(重点) 3.了解常见弱酸、弱碱的电离平衡常数大小,能比 较它们的电离能力强弱。
加NaOH
增大
减小 减小 增大 减小
锌粒
增大
减小 减小 增大 减小
升温
增大
增大 增大 增大 减小
1.弱电解质的电离平衡 2.弱电解质电离程度的表示 3.影响电离平衡的因素
(1)定义
(2)特点 (1)电离度 (2)电离平衡常数
(1)温度:越高越电离
(2)浓度:越稀越电离
1.(双选)醋酸溶液加水稀释,在稀释过程中 ( BD )
阿伦尼乌斯与电离理论 阿伦尼乌斯的最大贡献是1887
年提出电离学说,它突破了当时的科 学界普遍认为离子是在电流的作用 下产生的金科玉律, 提出“电解质 在溶液中能自动电离出正、负离子 ; 溶液越稀,电离程度就越大”。
这一学说是物理化学发展初期的重大发现,对 溶液性质的解释起过重要的作用。它是物理和化学 之间的一座桥梁。
4.21×10-3
0.100 0.09866 1.34×10-3 1.34×10-3 1.82×10-5
1.34×10-2
二、弱电解质电离程度的表示
1.电离度 (1)概念:
当弱电解质在溶液中达到平衡时,溶液中已经电
离的电解质分子数占原来总分子数的百分数。 (2)适用范围:处于电离平衡状态的弱电解质。
弱电解质浓度越大,电离度越小。 电离平 衡常数的大小与溶液的浓度无关。 越稀越电离
弱电解质的电离平衡讲义PPT课件( 20页)
悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
•
16、人生在世:可以缺钱,但不能缺德;可以失言,但不能失信;可以倒下,但不能跪下;可以求名,但不能盗名;可以低落,但不能堕落;可以放松,但不能放纵;可以虚荣,
H3O + + A-
0
0
X
X =α•c
α•ca α• ca
返回1
6
代入Ka式:K
c α c α
a
a
a
c c α
a
a
展
开得: K (c c α c )2α 2
aa
a
a
近似处理,忽略X对ca的影响, ca―ca•α≈ ca
则: Ka ca ca 2 2
对于碱 :
对弱碱:
[OH ]Kb Kb24Kbcb
2
4
条件: c/Kb <500
10
• 例5-1 计算0.10mol/LHAc 溶液的pH值。
•
已 知:Ka=1.8×10-5。
解:由c/ Ka=0.10/(1.8×10-5) >500,近似计
算
[H] caKa
0.11.81 501.3 4 1 30 mL o 1
•
7、生命的美丽,永远展现在她的进取之中;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江
河的美丽,是展现在它波涛汹涌一泻千里的奔流中。
