酶活性浓度的测定技术一
连续监测法测定酶活性浓度 医学课件

以色素原GCNA为底物,甘氨酰甘氨酸为受体,GGT催化γ谷氨酰基团从GCNA转移至甘氨酰甘氨酸上,并游离出2-硝基 -5-氨基苯甲酸。后者的生成量与样品中的GGT活性成正比关 系,故测定405nm处的吸光度增量可计算出GGT的活性。
GCNA 双甘氨酸 pGHG7T.72 硝基 5 氨基苯甲酸 L 谷氨酰 甘氨酰甘氨酸
第14页
第二十四章 连续监测法测定酶活性浓度
(三)方法学评价
②2-硝基-5-氨基苯甲酸在410nm的摩尔消光系数为 7.96×103(pH为7.70),受pH和温度影响较大。若选择 401nm或405nm时需注意校正。
③由于产物摩尔消光系数较小,样品用量大,样品体积 分数0.0909,为了样品和反应液在37℃平衡,故需要孵育时 间180s和底物启动模式。
(一)测定方法概述
γ-L-谷氨酰对硝 基苯胺为底物
L-γ-谷氨酰-α(β) -萘胺为底物
方法灵敏度低, 底物溶解度差, 受溶血干扰较 大
可以连续监 测,有较好 的灵敏度和 准确性,但 底物溶解度 差
L-γ-谷氨酰-3-羧 基-4-硝基苯胺为
底物
IFCC推荐方 法
第12页
第二十四章 连续监测法测定酶活性浓度
CNPF AFU CNP(黄色) L - 岩藻糖
第22页
第二十四章 连续监测法测定酶活性浓度
(三)方法学评价
CNPF法所采用CNP的解离常数(pKa)5.5与AFU的最适pH相 近,缩短了反应时间,无需样本空白,实现了AFU的连续监测 法测定。提高pH可提高CNP的离子化率,但过高的pH会影响 酶活性;该方法操作简便,测定时间短,灵敏度及抗干扰性都 有所提高。溶血仍有干扰。
酶活性和质量测定方法及其评价

1.酶活性测定方法(1)按反应时间分类法:20世纪50年代以前大都使用固定时间法。
这种方法是以酶催化反应的平均速度来计算酶的活性,现多已不用。
50年代中期开始采用连续监测法。
这种方法用自动生化分析仪上完成,可以测酶反应的初速度,其结果远比固定时间法准确,在高浓度标本尤为明显,但本法也受到反应时间,反应温度,试剂等的影响,应加以注意。
1)定时法:通过测定酶反应开始后某一时间段内(t1到t2)产物或底物浓度的总变化量来求取酶反应初速度的方法,称为两点法,其中t1往往取反应开始的时间。
在酶反应一定时间后,往往通过加入强酸、强碱、蛋白沉淀剂等,使反应完全停止,所以也叫中止反应法。
2)连续监测法:又称为动力学法或速率法、连续反应法。
在酶反应过程中,用仪器监测某一反应产物或底物浓度随时间的变化所发生的改变,通过计算求出酶反应初速度。
3)平衡法:通过测定酶反应开始至反应达到平衡时产物或底物浓度总变化量来求出酶活力的方法,又叫终点法。
(2)按监测方法分类法:可分为①分光光度法;②旋光法;
③荧光法;④电化学方法;⑤化学反应法;⑥核素测定法;⑦量热法。
2.酶质量测定法随着免疫技术的发展,出现了利用酶的抗原性,通过抗原、抗体反应来直接测定酶的质量,直接用质量单位ng/ml、μg/L来表示酶含量的高低。
免疫学方法与测定活性方法相比,其优点是灵敏度和特异性高,不受体液中其他物质的影响,特别是抑制剂和激活剂的影响,当血液中有酶抑制剂存在,或因基因缺陷,合成了无活性的酶蛋白时,可以测出灭活的酶蛋白量,有利于疾病诊断和科学研究。
如肌酸激酶同酶MB(CKMB)质量测定较活性测定对疾病的诊断价值高。
酶活性的测定

式中
A—对照KMnO4滴定毫升数; B—酶反应后KMnO4滴定毫升数;
VT—酶液总量(ml); V1—反应所用酶液量(ml);
W—样品鲜重(g);
1.7mg
1.7—1ml H2O2。
0.1mol/L旳KMnO4相当于
紫外分光光度法:
H化测2O氢量2在,吸2使光40反率nm应旳波溶变长液化下吸速有光度强度即烈可(吸A测2收40出),随过过反氧氧应化化时氢氢间酶酶而旳能降活分低性解。。过根氧据 以1min内A240降低0.1旳酶量为1个酶活单位(u)。
硫酸盐缓冲液,盐酸羟胺,黄嘌呤,黄嘌 呤氧化酶,醋酸等。
试验环节:
计算措施:
每毫升反应液中SOD 抑止率达50%时相应 旳SOD 量为一种SOD 活力单位(U),待测 样品中旳SOD 活力由下式计算:
SOD克制率(%)=(A2-A1)/A2×100% SOD 活力(U/ml)=(A2-A1)
据此,可根据H2O2旳消耗量或O2旳生成量测定该酶活力大小。 在反应系统中加入一定量(反应过量)旳H2O2溶液,经酶促反 应后,用原则高锰酸钾溶液(在酸性条件下)滴定多出旳H2O2
。
即可求出消耗旳H2O2旳量。
酶表活达性 :用每克鲜重样品1min内分解H2O2旳毫克数
酶活(mgH2O2/gFW·min)=
测定茶树鲜叶APX活性旳最佳条件
PVPP旳加入量为鲜叶重旳1.5倍,提取液pH 为7.8,反应液pH为7.0,底物AsA浓度为 0.5mmol/L。
注意事项:
(1)因为测定反应是经过加液量控制在60s内,使产生旳A290光值下 降呈良好旳线性关系。
1.试剂: 0.1mol/L Tris-HCl 缓冲液
(pH8.2
酶活性测定方法

一、过氧化物酶(POD)活性的测定POD测定参照李合生等(2003)的愈创木酚法方法进行测定,略加改动。
测定:称取样品0.5g,加入5mL 1/15mol/L PH=7.0的磷酸缓冲溶液,冰浴研磨成匀浆,4℃条件下12000r/min离心15min,上清液为粗酶液。
然后在试管中加pH 7.0的磷酸缓冲液2 ml,愈创木酚(0.2%)0.5ml,浓度为0.15%的H2O2 0.5ml,取0.3ml的酶提取液加入到试管中,空白以缓冲液代替。
在470nm下测定其吸光度,加入酶液时开始计时,每隔30s读数一次,连续记录5分钟。
以每分钟每克鲜重增加0.1的酶量作为一个酶活性单位。
△470 ×V TPOD活性=0.01×t×Vs×W式中:△470----反应时间内吸光度值的变化;V T ----提取酶液的总体积(ml)t----反应的时间(min)Vs ----测定时取用酶液体积(ml)W----样品鲜重(g)二、多酚氧化酶(PPO)活性的测定多酚氧化酶活性测定参照朱广廉等(1990)的方法,略加改动。
酶液制备:称取样品0.5g,加入5mL 0.1mol/L PH=6.0的磷酸缓冲溶液,冰浴研磨成浆,4℃条件下12000r/min离心15min后上清液即为粗酶液。
PPO活性测定:反应试管中分别加入0.1 mL酶液+3.9 mL磷酸缓冲液+ 1 mL 1m mol/L的邻苯二酚。
混匀后于30℃保温10 min,迅速加入2 mL质量分数为20%的三氯乙酸终止反应,立即于525nm下测定其吸光度值,计算酶活。
PPO活性= O D×V T0.01×t×0.5g×V s= O D×V T0.005OD——反应时间内吸光值的变化;V T ----提取酶液的总体积(ml)Vs ----测定时取用酶液体积(ml)T———反应时间(min);三、吲哚乙酸氧化酶(IAAO)活性的测定参照张志良等(1990)人的方法并稍作改动。
生化基础物质检测—酶活性检测

反应进程曲线(速率
时间(s)
法) 317 334 351 368 385 402
吸光度(A) 1.253 1.204 1.178 1.146 1.126 1.097
据此计算此酶的∆A/min
419 1.048
1.450
1.400
1.350
延滞期
1.300
预孵育期
终点法
1.250 1.200
速率法
线性期
指示酶
Ex
Ea
Ei
A
B
C
P
待测物质 中间产物
终产物
酶偶联反应的原理:
在应用酶偶联法测定时,关键在于确定恒态期,因为只有 恒态期才能代表酶活性。如酶促反应底物动力学所述,恒态期 可以通过测定指示酶的Km和Vmax等动力学因数加以计算确定
常用指示酶及其指示反应
1.脱氢酶 用作工具酶的脱氢酶都是以NAD(P)H为辅酶的脱
反应如下:
色原物质
Trinder反应:
POD
2H2O2 + 4-AAP + 酚
醌亚胺(红色) + 2H2O
应用:GOD、COD、GPO、甘油氧化酶、尿酸酶(属于氧化酶类)
等都可以将各自的底物氧化为过氧化氢,因此都可以与POD偶联,通 过Trinder反应加以测定
酶偶联法测定ALT的吸光度变化图
吸光度(A)
氢酶,例如LDH、MDH、G-6-PD、GLDH等,它们催化下 列反应:
P + NAD(P)H + H+ PH2 + NAD(P)+ 可对NAD(P)H在紫外吸收或紫外激发荧光进行测定
应用:ALT、AST、CK等酶活性测定
2.过氧化物酶(POD)
医学检验--血清酶催化活性浓度和代谢物浓度检测技术

血清酶催化活性浓度和代谢物浓度检测技术酶反应动力学原理(影响酶反应的因素)酶反应动力学主要研究酶催化反应的过程与速率,以及各种影响酶催化速率的因素,定量时的观察对象是总单位时间内底物的减少或产物增加的量。
影响酶作用的因素包括底物的浓度、酶反应的最适pH、最适温度、酶的抑制作用,另外还包括试剂中表面活性剂的作用等因素。
1.底物浓度的影响在检测试剂中底物浓度、辅因子、活化剂、复构剂的种类和浓度均对酶的测定至关重要。
其中以底物的种类和浓度最为重要。
底物浓度影响遵循米氏方程:ν=V[S]/K m+[S]当底物浓度远远小于K m,增加底物浓度,反应速度增加。
当底物[S]>>K m时,公式近似为ν=V,反应速度不再增加,故此时反应速度为最大反应V。
从理论上说只有测定的是酶最大反应V,反应速度才和酶量成正比。
(1)底物的种类若所测的酶专一性不强,可作用于多种底物,K m最小的底物往往是此酶的生理底物。
(K m 表示酶和底物的亲和力,K m越小亲和力越大)如该酶测定主要用于临床诊断工作,首先应考虑有效诊断价值的底物。
选择K m小的底物测定酶活性,在最大反应速度时底物浓度也将最低。
这意味着试剂成本可能较低,不易出现底物难溶解的困难。
(2)选择底物的合适浓度确定底物种类后,重要的是选择底物的合适浓度。
米氏方程在选择酶测定底物浓度有着重要的指导作用。
计算出某一酶的K m后就可以计算出不同底物浓度和K m间的比值,将其代入米氏方程就可以计算出此时酶促反应速度相当于最大反应速度的百分比。
上述只能适应用于单一底物的酶。
2.反应体系的最适pH、缓冲液的种类和浓度测定酶活性浓度时一定要选择在最适pH。
因为此处酶反应速度最大,测定灵敏度最高。
此处酶活性变化的斜率最小,如反应体系中出现pH变化时,对测定结果影响最小。
pH还可以影响酶的稳定性。
为使反应体系能稳定在最适pH范围,实际检测时多采用不同类型、不同浓度的缓冲液。
3.温度的控制温度对酶活性影响具有双重性。
酶质量浓度的测定

常用的显色系统
脱氢酶偶联的指示反应:如AST、CK等
检测结果
显色后的区带一般用光密度计或荧光计扫描定量分
析。
正常和病理状况时血清LD 同工 酶的琼脂糖凝胶电泳分离图谱
为广泛。目前所采用的电泳方法大致可分为显 微电泳、自由界面电泳和区带电泳三大类。 临床上以区带电泳最为常用。
区带分离
用电泳法进行区带分离的原理与其他蛋白电泳
相似。可用的支持物虽多,但目前的实验室多 用醋酸纤维素薄膜(简称醋纤膜)、琼脂糖凝 胶、聚丙烯酰胺凝胶作为电泳支持介质。 国内外的一些自动化电泳分析系统则多采用分 辨率更高的琼脂糖凝胶作为支持介质,采用高 压或常压电泳进行各种同工酶及其亚型的分离 与鉴定。
或酶活性浓度的酶称为工具酶。 常用的工具酶有氧化还原酶类、转移酶类和水 解酶类,但以氧化还原酶类更多见,因为其产 物最易被直接监测而成为指示酶。
共通反应途径
在临床生物化学检验中,许多项目的测定往往
使用有工具酶的参与的类似的反应原理,即所 谓共通(或通用)反应途径。
两类常用的通用反应途径
NAD(P)+或NAD(P)H偶联的脱氢酶及其指示反应 偶联H2O2的工具酶及其指示反应
酶活性浓度的单位
酶活性浓度的单位
酶活性单位
惯用单位,国际单位(IU),Katal单位; 酶活性浓度以每单位体积所含的酶活性单位数 表示。U/L。
酶活性浓度单位
正常上限倍数
正常上限升高倍数(upper limits of normal,
注意
由于酶浓度测定方法的不同,报告方式也有差
异 酶活性浓度单位常以U/L报告, 酶质量(mass)浓度单位常直接用ng/ml或 g/L报告。
土壤酶活性测定方法

土壤酶活性测定方法一、蔗糖酶: 3,5-二硝基水杨酸比色法1. 试剂配制(1)2N氢氧化钠200mL:称取16g 氢氧化钠,用蒸馏水溶解,定溶于200mL容量瓶中。
(2)3,5-二硝基水杨酸溶液1000mL:称5g二硝基水杨酸,溶于200mL2N氢氧化钠和500mL蒸馏水中,再加300g酒石酸钾钠,用蒸馏水稀释至1000mL(不超过7天)。
(3)1/15M 磷酸氢二钠1000mL:23.867g N a2HPO4·12H2O溶于1000mL蒸馏水中。
(4)1/15M 磷酸二氢钾1000mL:9.078g KH2PO4溶于1000mL蒸馏水中。
(5)pH5.5磷酸缓冲液100mL:5 mL磷酸氢二钠(1/15M)加95mL磷酸二氢钾(1/15M) (6)8%蔗糖1000mL:称取80g蔗糖,用水溶解,稀释至1000mL。
(7)甲苯。
(8)标准葡萄糖溶液(1mg/mL)1000mL:取少量葡萄糖在真空干燥箱中,于55℃条件下真空干燥至恒重。
然后取1.00g葡萄糖溶于100ml蒸馏水中成标准葡萄糖母液(10mg还原糖/ml)。
取此母液10ml, 用蒸馏水定容至100mL即成标准葡萄糖液(1mg/ml);2. 操作步骤(1)标准曲线绘制:分别取标准葡萄糖液0.4mL,0.8 mL,1.2mL, 1.6mL, 2.0mL,2.8mL, 3.2mL于50 mL比色管中,另取一管做空白对照。
用蒸馏水补足至10mL。
加入3.0mL 3,5-二硝基水杨酸,沸水浴5min,随即在自来水流下冷却。
最后用蒸馏水稀释至50mL,并在分光光度计上于波长508nm处进行比色。
比色后,以光密度值为纵坐标,葡萄糖浓度为横坐标绘制成标准曲线。
(2)土壤蔗糖酶活性测定:称5.00g土样,置于50mL三角瓶中,注入15.0mL 8%蔗糖溶液,5.0mL pH5.5磷酸缓冲液和5滴甲苯。
摇匀混合物后,放入恒温箱,在37℃下培养24h。
酶活力的测定

4. 抑制剂和激活剂
抑制剂和激活剂是影 响酶活力的其他因素 。抑制剂会抑制酶的 活性,而激活剂则会 增强酶的活性。在测 定酶活力时,需要排 除抑制剂和激活剂的 影响,并进行适当的 样品处理和数据处理 以确保实验结果的准 确性
酶活力的测定
酶活力的测定
三、实验步骤与操作要点
酶活力测定的实验步骤包括样品准备、反应体系配制、温度控制、时间记录、产物或底物 浓度测定等。在操作过程中需要注意以下几点
酶活力是指酶催化特定化学反应的能力, 通常以单位时间内转换底物的摩尔数来 表示
通过测定酶活力,可以了解酶的性质、 作用机制以及底物特异性等方面的信息一、酶活力测 定的基本原理
酶活力测定的基本原 理是利用酶催化的化 学反应速率与酶浓度 成正比的性质,通过 测定反应速率来推算 酶的浓度和活力。常 用的方法有终点法、 动力学法和连续监测 法
酶活力测定结果受到多种因素 的影响,包括温度、pH值、底 物浓度、抑制剂和激活剂等。 为了获得准确的测定结果,需 要严格控制实验条件,并进行 适当的样品处理和数据处理
酶活力的测定
1. 温度
温度是影响酶活力的 重要因素之一。大多 数酶在一定的温度范 围内具有最佳活性, 温度过高或过低都会 影响酶的活性。因此 ,在测定酶活力时, 需要选择适当的温度 ,并进行温度控制以 确保实验结果的准确 性
酶活力的测定
四、时间记录
时间记录是酶活力测定的关键步骤之一。在酶促反应过程中,需要准确记录反应时间,以 便计算反应速率和产物生成量。在时间记录过程中,需要注意控制反应时间,避免过长或 过短的反应时间对实验结果的影响
酶活力的测定
五、产物或底物浓 度测定
产物或底物浓度的测定是酶活力 测定的关键步骤之一。通过测定 产物或底物的浓度,可以计算出 酶的活性。在浓度测定过程中, 需要注意选择适当的测定方法, 并进行准确的浓度计算。常用的 浓度测定方法有分光光度法、色 谱法等
酶活测定方法

酶活测定方法还原法酶与底物在特定的条件下反应,酶可以促使底物释放出还原性的基团。
在此反应体系中添加化学试剂,酶促反应的产物可与该化学试剂发生反应,生成有色物质。
通过在特定的波长下比色,即可求出还原产物的含量,从而计算出酶活力的大小。
色原底物法通过底物与特定的可溶性生色基团物质结合,合成人工底物。
该底物与酶发生反应后,生色基团可被释放出来,用分光光度法即可测定颜色的深浅,在与已知标准酶所做的曲线比较后,即可求出待测酶的活力。
粘度法该法常用于测定纤维素酶、木聚糖酶和β-葡聚糖酶的活力。
木聚糖和β-葡聚糖溶液通常情况下可形成极高的粘度,当酶作用于粘性底物时木聚糖和β-葡聚糖会被切割成较小的分子使其粘度大为降低。
基于Poiseuille定律我们知道,只要测定一定条件下溶剂和样品溶液的运动粘度,便可计算特性粘数,并以此来判断酶的活力。
高压液相色谱法酶与其底物在特定的条件下充分反应后,在一定的色谱条件下从反应体系中提取溶液进行色谱分析,认真记录保留时间和色谱图,测量各个样的峰高和半峰高,计算出酶促反应生成物的含量,从而换算出酶活力的数值。
免疫学方法常用于酶活性分析的免疫学方法包括:免疫电泳法、免疫凝胶扩散法。
这两种方法都是根据酶与其抗体之间可发生特定的沉淀反应,通过待测酶和标准酶的比较,最终确定酶活力。
免疫学方法检侧度非常灵敏,可检侧出经过极度稀释后样品中的酶蛋白,但其缺点是不同厂家生产的酶产品需要有不同特定的抗体发生反应。
琼脂凝胶扩散法将酶作用的底物与琼脂混合熔融后,倒入培养皿中或载波片上制成琼脂平板。
用打孔器在琼脂平面上打出一个约4-5mm半径的小孔。
在点加酶样并培养24h以后,用染色剂显色或用展开剂展开显出水解区,利用水解直径和酶活力关系测定酶活力。
蛋白酶活力的测定随着生物技术的发展及环保要求的提高,越来越多的酶制剂应用于制革生产中。
比如浸水,脱毛,软化,脱脂等工序都用到大量的酶制剂,从酶的作用性质来看制革生产中用到的主要是蛋白酶和脂肪酶。
第五章诊断酶学 - 酶活性浓度的测定技术

ALT双试剂法测定中,首先使血清与缺
此时反应的方向少由αN-酮A戊DH二转酸的变底为物N溶A液D混,合随,反37应°进C保行,A 应随之而下降,通过温检5m测,反将应样产品中物所A含在的34内0源nm性处α-酮A的酸消变化速 率,可以检测指示酶耗反完应。。然后再加入α-酮戊二酸启动ALT
即POD催化下, H2O2氧化芳香族胺色素原生成有色色 素,此类色素原供氢体包括:OT、DAB、ODA、TMB。
34
2. NAD(P)+或NAD(P)H偶联的脱氢酶及其指示反应
许多氧化还原反应,尤其是作为工具酶如LD、GLD、 G6PD等参与时,常将底物的H去除后传递给NAD (P)+形成 NAD(P)H。借助NAD(P)H340nm处特征性的光吸收,借此用 分光光度法检测。
通过测定被加速化学反
应的反应速率,来间接
反映酶的浓度
S
E
P
E+S
ES
E+P
V=
ds dt
或
V=
dp dt
14
3. 酶活性浓度
即酶所催化的化学反应的反应速率,用 酶促反应中单位时间内底物的减少量或产物 的生成量来计算。
注意:只有当酶所催化的反应速度仅与 [E] 成正比,而不受其它因素影响时,即在酶促 反应的零级期,才能根据酶所催化的化学反 应速率来确切表示酶活性浓度的大小。
A Ex B Ei P
始发反应
指示反应 辅助酶
A Ex B Ea C Ei P
辅助反应
被测酶 始发反应 指示反应 指示酶 辅助酶 辅助反应 酶偶联体系
酶活性浓度的测定技术

▪ 结合各种工具酶的偶联反应,如应用NAD(P)H和 NAD(P)+吸收光谱差异建立的测定各种脱氢酶活 性浓度的方法,使分光光度法得到了进一步发展, 几乎可应用于各种血清酶活性的测定。随着各种 自动生物化学仪和配套用试剂盒的普及应用,这 一方法在临床酶学测定中起着十分重要的作用。
3.荧光法和放射性核素法 对于一些酶浓度 ห้องสมุดไป่ตู้低的标本,用普通的分光光度法往往测 不出来,此时可考虑改用灵敏度较高的荧 光法或放射性核素法。
▪ 随后在过量的底物存在下,反应速率加快 并达到一个反应速率稳定的阶段,即酶促 反应以恒定的速率进行,不受底物浓度的 影响,这段反应称为线性反应期(1inear phase)或零级反应期(zero order)。产物 [P] 和底物 [S] 与时间t成线性关系。
▪ 随着时间的延长,由于种种因素,如底物 因酶反应消耗而浓度下降,产物浓度上升 出现逆反应,反应产物可能有抑制酶反应 作用或酶的热失活等,使酶促反应变慢, 即反应速率下降,偏离线性,这段时间称 为一级反应期(first order)。
▪ 反应速率与底物 [S] 成正比,产物[P] 与时 间t不成线性关系。如果反应速率受两种或 两种以上物质浓度的影响,则反应可为一 级、二级或多级反应,一般将这段反应时 间统称为非线性反应期。图6-3显示单试剂 速率法酶促反应进程曲线。
1.直接法 这类方法是在不终止酶促反应条件下,直接通过测定反应体系中底物或产物理化特性的变化如吸光度、荧光、旋光性、pH
酶活性浓度的测定技术
第四节 酶活性浓度的测定技术
▪ 体液中酶的测定是临床生物化学检验的一项重要 内容。二十世纪50年代人们用分光光度法建立了 连续监测酶活性浓度方法,到60年代特别是80年 代以后,由于各种工具酶和酶分析试剂盒的生产 与普及,自动和半自动生物化学分析仪的引进和 应用,使得各种体液酶的测定在方法学与临床应 用方面有了长足的进步与发展。
测定酶活性浓度的两大类方法
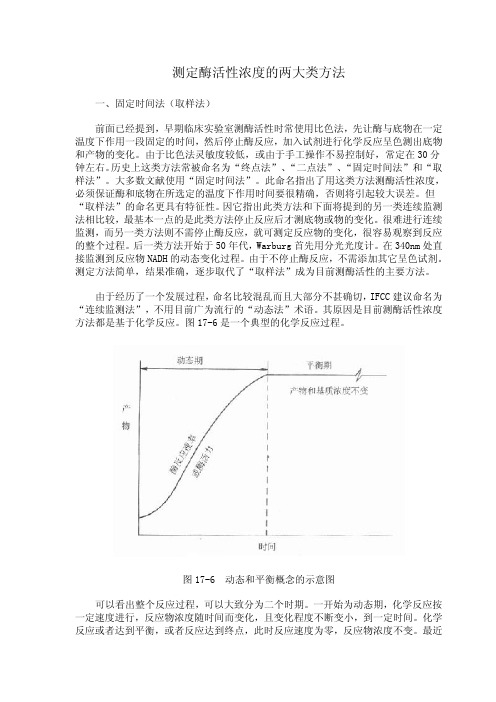
理论上的 V0 在实际工作中是不存在的,必须让酶和底物作用一段时间,消耗掉一 定量的底物,才能测出反应速度,一般说,如消耗底物在 5%内所测到的反应速度都 可认为是初速度,如底物浓度很高时,底物消耗在 20%以内的反应往往还在线性反应 期。
是不是所有类型的酶偶联反应都可用来测酶活性浓度?回答是否定的。因为测酶 的活性浓度是依据测定酶反应速度——△A/△t 或△B/△t 求出。在酶偶联法,此值 无法直接求出,而是通过测定指示酶反应△C/△t 间接求出,要使酶偶联法测得的酶 活性浓度准确可靠,则 Vind=Vx。换言之,指示酶的最大反应速度必须等于或接近测 定酶的最大反应速度。
只有当反应如曲线 A 时,用“固定时间法”才能测出真实的酶活性,实际工作中 是很少见的,图中曲线 B 代表了最常见的反应情况,在一个很短的线性反应期后在大 部分测定期间内主要为非线性反应期。曲线 C 说明在测定期间包括了延滞期,曲线 D 则不仅包括了延滞期,还包括非线性期,在这些反应中如用固定时间法来测定,结果 是不够准确的,一般是偏低的,而且酶浓度愈高,偏离程度愈大。
从理论上说,用酶偶联反应测酶活性浓度时,最好条件应是测定酶反应为限速反 应。动力学上为零级反应,而指示酶为一级反应,酶反应速度与指示酶底物浓度相关。
(二)指示酶、辅助酶的种类和浓度
指示酶、辅助酶的种类:常规化验中常用的酶偶联法中,多以脱氢酶为指示酶, 在常规化验中的自动分析仪几乎无一例外都有 340nm 波长,通过 NAD(P)H 系统可以很 方便地监测到指示酶反应。但从理论上说,往往可以有不止一种偶联方法,只要设法 使偶联反应中最后一个是指示酶反应,前面已提到测 CK 可以正向逆向二个方向建立 二种不同酶偶联的反应。又如在丙氨酸转氨基酶(ALT)测定法中,正向反应后产生 丙酮酸和谷氨酶,目前最常用的是用乳酸脱氢酶与丙酮酸偶联反应,伴有 NADH 下降。 但也可以用谷氨酸脱氢酶与谷氨酸作用,伴有 NADH 生成。
酶活性测定

实验一植物抗氧化酶活性的测定植物抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等。
它们普遍存在于植物的各种组织中,可以通过催化植物体内的活性氧,防止发生氧化反应。
所以抗氧化酶活性与植物的代谢强度及逆境适应能力有密切关系,经常被用来衡量植物的抗性强弱和衰老程度。
一、超氧化物岐化酶活性测定超氧物歧化酶(SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基()的酶,它催化下列反应:2反应产物H2O2可被过氧化氢酶进一步分解或被过氧化物酶利用。
因此SOD有保护生物体免受活性氧伤害的能力。
已知此酶活力与植物抗逆性及衰老有密切关系,故成为植物逆境生理学的重要研究对象。
【原理】本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有可氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生,可将氮蓝四唑还原为蓝色的甲。
后者在560nm处有最大吸收,而SOD可清除从而抑制了甲的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
一个酶活性单位定义为将NBT的还原抑制到对照一半(50%)时所需的酶量,据此可以计算出酶活性大小。
【仪器与用具】高速台式离心机;分光光度计;微量进样器;荧光灯(反应试管处光照强度为4000lx);试管数支;黑色硬纸套。
【试剂】1.50mmol/L磷酸缓冲液(pH7.8)。
2.提取介质50mmol/L pH7.8磷酸缓冲液(内含1%聚乙烯吡咯烷酮)。
3.130mmol/L甲硫氨酸(Met)溶液:称取1.9399g Met用磷酸缓冲液定容至100ml。
4.750μmol/L氮蓝四唑(NBT)溶液:称取61.33m g NBT用磷酸缓冲液定容至100ml,现配先用,避光保存。
5.100μmol/L EDTA-Na2溶液:取37.21m g EDTA-Na2用磷酸缓冲液定容至1000ml。
6.20μmol/L核黄素溶液:取7.53m g核黄素定容至1000ml避光保存。
酶活性测定方法

酶活性测定方法一、过氧化物酶(POD)活性的测定POD测定参照李合生等(2003)的愈创木酚法方法进行测定,略加改动。
测定:称取样品0.5g,加入5mL 1/15mol/L PH=7.0的磷酸缓冲溶液,冰浴研磨成匀浆,4℃条件下12000r/min离心15min,上清液为粗酶液。
然后在试管中加pH 7.0的磷酸缓冲液2 ml,愈创木酚(0.2%)0.5ml,浓度为0.15%的H2O2 0.5ml,取0.3ml的酶提取液加入到试管中,空白以缓冲液代替。
在470nm下测定其吸光度,加入酶液时开始计时,每隔30s读数一次,连续记录5分钟。
以每分钟每克鲜重增加0.1的酶量作为一个酶活性单位。
△470 ×V TPOD活性=0.01×t×Vs×W式中:△470----反应时间内吸光度值的变化;V T ----提取酶液的总体积(ml)t----反应的时间(min)Vs ----测定时取用酶液体积(ml)W----样品鲜重(g)二、多酚氧化酶(PPO)活性的测定多酚氧化酶活性测定参照朱广廉等(1990)的方法,略加改动。
酶液制备:称取样品0.5g,加入5mL 0.1mol/L PH=6.0的磷酸缓冲溶液,冰浴研磨成浆,4℃条件下12000r/min离心15min后上清液即为粗酶液。
PPO活性测定:反应试管中分别加入0.1 mL酶液+3.9 mL磷酸缓冲液+ 1 mL 1m mol/L的邻苯二酚。
混匀后于30℃保温10 min,迅速加入2 mL质量分数为20%的三氯乙酸终止反应,立即于525nm 下测定其吸光度值,计算酶活。
PPO活性= O D×V T0.01×t×0.5g×V s= O D×V T0.005OD——反应时间内吸光值的变化;V T ----提取酶液的总体积(ml)Vs ----测定时取用酶液体积(ml)T———反应时间(min);三、吲哚乙酸氧化酶(IAAO)活性的测定参照张志良等(1990)人的方法并稍作改动。
酶活力测定的原理和方法

柱法测定:
• 将一定量的固定化酶装进具有恒温装置 的反应柱中,让条件适宜的底物溶液, 以一定的速率流过酶柱,收集流出的反 应液。按常规方法测定底物的消耗量或 产物的生成量。测定方法与游离酶反应 液的测定方法相同。
连续测定
• 利用连续分光光度法等方法可对固定化酶反应 液进行连续测定,从而连续测定酶活力。测定 时,可将振荡反应器中的反应液用泵连续引到 连续测定仪(例如,双束紫外分光光度计等) 的流动比色杯中进行连续分光测定。或者使固 定化酶柱流出的反应液连续流经流动比色杯进 行连续分光测定。
酶反应的中止
• 使酶停止作用常使用强酸、强碱、三氯 乙酸或过氯酸,亦可用SDS(十二烷基硫 酸钠)使酶失活,或迅速加热使酶变性 等。酶反应的底物或产物一般可用化学 法,放射性化学法,酶偶联法进行测定。
三、连续法测定酶活力
• 连续法测定酶活力,不需要取样中止反应,而 是基于反应过程中光谱吸收,气体体积、酸碱 度、温度、粘度等的变化用仪器跟踪监测反应 进行的过程,记录结果,算出酶活性。连续法 使用方便,一个样品可多次测定,且有利于动 力学研究,但很多酶反应还不能用该法测定。
酶反应速度和底物浓度的关系
V 反应速度
Vmax
1/2Vmax 混合级反应
零级反应
一级反应
Km
[S] 底物浓度
米氏方程
• v=Vmax[S]/(Km+[S]) • Km为酶反应速度达到最大反应速度一半 时的底物浓度,为酶的特征常数。 • 同一酶对不同底物Km不同。 • Km最小的底物为该酶的最适底物。
酶活性检测

④分光光度法利用底物和产物光吸收性质的不同,可直接测定反应混合物中底物的减少量或产物的增加量。
几乎所有的氧化还原酶都使用该法测定。
如还原型辅酶Ⅰ(NADH2)和辅酶Ⅱ(NADPH2)在340nm有吸收,而NAD和NADP在该波长下无吸收,脱氢酶类可用该法测定。
该法测定迅速简便,自动扫描分光光度计的使用对酶活力的快速准确的测定提供的极大的方便。
酶在食品加工中的作用就像一把双刃剑,我们要趋利避害。
酶的积极作用我们要加强,在食品加工过程中添加酶制剂,使其作用充分发挥;消极作用我们要尽量避免,可以通过加热等方法将酶灭活,消除其不利影响。
为了将酶更好地应用于食品加工,研究酶的性质是十分必要的。
而紫外-可见分光光度法是研究酶性质的重要方法之一。
下面我们来介绍用-可见分光光度计测定酶活的具体方法。
紫外-可见分光光度法测定酶活:1. β一半乳糖苷酶β一半乳糖苷酶,又称乳糖酶(Lactase)。
能水解乳糖来降低乳制品的乳糖含量,从而提高乳制品的可消化性,用于低乳糖牛奶和非结晶型浓缩牛奶的生产及奶酪风味的改变,同时还可用于生产低聚半乳糖。
【酶活测定】以ONPG为底物测定β-半乳糖苷酶活力。
【酶活定义】以ONPG为底物,37℃保温酶解,每分钟释放lμmol/L邻硝基酚的酶量,定义为1个酶活力单位。
2. 超氧化物歧化酶超氧化物歧化酶(Superoxide Dismutase,简称SOD)是一种十分重要的生物体防止氧化损伤的酶类,是生物体内超氧阴离子清除剂,保护细胞免受损伤。
SOD广泛存在于各类生物体内,所有好氧微生物细胞中都含有SOD。
自1969年Mccord等人首次发现了SOD 生物活性后,医学界对其医疗作用做了许多研究,证明它具有抗衰老、抗肿瘤、抗辐射、抗缺血、提高人体免疫力等作用,被专家称为21世纪最有前途的药用酶。
欧美国家已开始将其应用于医疗、食品、保健、化妆品等领域。
【酶活测定】在25℃4.5ml 50mmol/L pH8.3的K2HPO4- KH2PO4缓冲液中加入待测SOD样液,再加入10ul 50mmol/L的连苯三酚,迅速摇匀,倒人光径lcm 的比色杯,在325nm波长下每隔30s测一次A值。
酶活性的测定方法

生物样品预处理预冷解剖用具,采用颈后断头的方法将鱼杀死,立即取肝脏、腮、脑,操作均在4℃下进行,用预冷的0.15 mol/L KCl 溶液洗去血丝,用滤纸吸干后称重。
将肝、脑组织放入预冷的Tris-HCl缓冲液(0.1 mol/L Tris-HCl, pH 7.4, 0.15 mol/L KCl)匀浆(匀浆比(W/V)1:5),腮组织放入组织匀浆(匀浆缓冲液含40mmol/L咪唑,250mmol/L蔗糖,5mmol/L EDTA,pH7.0),匀浆比为1:40,匀浆速率为10000g,以15s为周期,重复3次。
分别取1ml匀浆液放入1.5ml离心管进行离心,4℃下离心(9000g,20min),取上清液-80℃下保存,待测。
(1)250mL 0.15 mol/L KCl:取2.7956g(2)Tris-HCl缓冲液:125mL 0.1 mol/L Tris(1.5143g)+ 105mL 0.1 mol/L HCl+ KCl(0.15*0.23*74.55=2.5720g)(Na++K+)-ATPase活性的测定1、试剂(1)匀浆液(250ml):40mmol/L咪唑0.6808g+250mmol/L蔗糖21.3931g +5mmol/LEDTA 0.3653g(2)反应缓冲液(250ml):80mmol/L咪唑 1.3616g+4mmol/LMgCl2 0.2033 g+40mmol/LKCl 0.7455g(3)16mmol/L Na2ATP(10ml):0.0988g(4)30%三氯乙酸(TCA)9g TCA+21mlH2O(5)定磷试剂(硫酸亚铁-钼酸胺试剂100ml):10ml 5mol/LH2SO4+1.3556 g钼酸铵+90mlH2O每10ml加入FeS040.5g(FeS04·7H2O 0.0941g),25ml加入FeSO4·7H2 O 0.2353g,临用前配制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 间接法
直接法虽然简单,但只有底物与产物 之间,在理化性质等方面有显著差异时, 才能使用直接法。故至今也只有很少一部 分酶能用直接法进行测定。目前可采用两 类间接法进行酶学测定。
一类方法是在原来反应体系中加入一些试剂, 这些试剂只和酶反应物迅速作用,产生可被仪器检 出的物质变化,但同时又不和酶作用也不影响酶活 性。典型的例子是血清ChE的丁酰硫代胆碱测定法。
临床常规酶学分析所用的酶偶联法中, 多以脱氢酶为指示酶。通过监测其反应物 NADH或NADPH于340nm处吸光度的变化速率, 可以很容易地监测指示酶反应。
用酶偶联法测定酶活性浓度时,并不是一开始反应 就全部反映了测定酶活性。这是因为在偶联反应中存在 几个时相:一是预孵育期,反应一开始只存在底物 A, 不存在指示酶的反应,在此时相中使存在于样品中的干 扰物质充分进行反.应,将试剂中的NADH变为NAD+。二 是延滞期,加入底物启动反应,在启动后的一段短时间 内,产物 B开始出现并逐渐增加,处于较低水平,指示 酶反应速度也较低,不能代表测定酶的反应速率Vx,这 一时期称为延滞期。随着产物B增加到一定程度时,Ex和 Ei反应速率相同,达到了稳态期。此阶段 340nm波长处 吸光度才会有明显的线性变化。最后由于底物消耗,反 应速度又复减慢。
4.其他方法:
二、酶活性浓度的测定
测定酶的催化活性浓度是临床酶学分析最为常用的方法,具有 迅速、灵敏、成本低等特点。可根据酶促反应进程曲线,采用合理的 方法进行酶活性浓度的测定。
(一) 酶促反应进程
(二) 酶活性浓度测定方法
酶活性浓度测定就是要使酶促反应的初 速度(v) 达到最大速度Vmax,即在过量底物存在 下的零级反应期的速度,此时反应速度与酶浓度 [E]之间有线性关系。如按反应时间将酶活性浓 度测定方法进行分类,可分为定时法(fixed time assay)和连续监测法(continuous monitoring assay)两大类。
连续监测法测定结果常较定时法高, 且因在酶促反应初始阶段底物最充裕,而 产物的抑制作用、可逆反应、酶变性等均 很小,因而测定结果也较取样法准确。
3.平衡法
通过测定酶促反应开始至反应达 到平衡时产物或底物浓度的总变化量 来求出酶活性浓度的方法,称为终点 法。与定时法不同的是,平衡法是在 酶促反应平衡期([S]或[P]不变)任何 一点进行测定,无需终止反应。目前 此法已少使用。
如果一些酶促反应找不到合适的指示 酶与其直接偶联,此时往往还可在始发反应 和指示反应之间加入另一种酶,将二者连接 起来,此反应称为辅助反应。模式为:
A Ex B EaC Ei D
一般习惯将最后一个酶称指示酶Ei,其他外加 的酶称为辅助酶(Ea)。个别情况还可能使用两 种或以上的辅助酶。将这一连串酶促反应称为 酶偶联体系。
利用NAD(P)Байду номын сангаас在340nm处的吸光度的变化测定各种 脱氢酶的方法是应用最广的一类方法。NAD(P)H在 260nm波长和340nm波长处有吸收峰,而氧化型NAD+/ NADP+只在260nm波长处有吸收峰,这是因为分子中有 腺嘌呤的缘故。340nm波长处吸光度的变化可以反映 反应体系中NAD(P)H量的增减。还可利用一类人工合 成的所谓“色素原”底物,其本身为无色或微黄色, 酶作用后生成有色化合物,如目前应用硝基苯酚和硝 基苯胺的衍生物进行水解酶和一些还原酶的测定。
连续监测法
这类测定方法简单,优点是可将多点的 测定结果连接成线,很容易找到成直线的区 段,可以观察到是否偏离零级反应,因而可 选择线性反应期来计算酶活性,不需终止反 应。通常截取反应开始后较短的时间,就能 近似地建立这种反应量与反应时间的线性关 系,不过这种时间范围因酶种类和反应条件 而异,必须用实验方法进行确定。
三、连续监测法测定酶活性浓度
随着科学技术的不断进步与发展,各 种自动生物化学分析仪的广泛使用,连 续监测法已逐步取代定时法而成为临床 实验室测定酶活性浓度最常用的方法。
(一)连续监测法的种类 1.直接法 2. 间接法
1.直接法
这类方法是在不终止酶促反应条件下,直 接通过测定反应体系中底物或产物理化特性的 变化如吸光度、荧光、旋光性、pH、电导率、 粘度等,从而计算出酶活性浓度。其中以分光 光度法应用最为广泛,也是方法学上最成熟的 一种。
1.定时法
这是早期测定酶活性浓度的方法。
大多是使酶作用一段时间,然后加入强酸、 强碱、蛋白沉淀剂等终止酶促反应,测定这段时 间内底物的减少量或产物的生成量,计算酶促反 应平均速度。这类方法有多种命名,如“取样 法”、“终点法”或“两点法”。
用定时法测定酶活性浓度,必 须保证酶和底物在所选定的温度下 作用时间要很精确,否则会引起较 大误差。这种方法的优点是比较简 单,因测定时酶促反应已被终止, 故比色计或分光光度计无需保温设 备,显色剂的选择也可不考虑对酶 活性的影响。缺点是无法知道在整 个酶促反应进程中是否都是零级反 应。
另一类是目前应用最多,最为广泛的酶偶联法, 即在原反应体系中加入另一些酶试剂,所进行的酶 促反应和被测酶反应偶联起来。
(二)酶偶联反应
最简单的酶偶联反应(单底物反应且只 有一个工具酶)模式为:
A Ex B EiC
被测定酶(Ex)催化的反应称为始发反应; 产生被检测物质产物C(如NADH)的反应称为指 示反应,相应的偶联酶(第二个酶)酶称指示 酶(Ei)。
2.连续监测法
连续测定酶反应过程中某一反应产物或底物的浓度随时 间变化的多点数据,求出酶反应初速度,间接计算酶活性浓度的 方法称为连续监测法。
2.连续监测法
连续测定酶反应过程中某一反应产物或 底物的浓度随时间变化的多点数据,求出酶 反应初速度,间接计算酶活性浓度的方法称 为连续监测法。与定时法不同的是,这类方 法勿需停止酶促反应,不需添加其他呈色试 剂,就可测定反应物的变化,很容易观察到 反应的整个过程。
3.荧光法和放射性核素法:
对于一些酶浓度很低的标本,可考虑改用灵敏度 较高的荧光法或放射性核素法。荧光法取决于酶促反 应生成荧光物质的速率,此速率与酶浓度成正比,并 通过荧光光度计进行测定,根据荧光强弱的变化换算 出酶的活性。例如,还原型的NAD(P)H有强烈的荧光, 故所有以NAD(P)+为辅酶的氧化还原酶类均可用荧光法 进行测定。核素法因有污染且操作烦杂,目前应用较 少。
