菌落总数测定ppt
合集下载
食品中细菌菌落总数的测定报告.ppt

最新.
9
三 、 材料
1、 食品检样 2、 培养基 平板计数培养基,无菌生理盐水或磷酸 盐缓冲液 3、 其它 无菌培养皿,无菌吸管,电炉、恒温培 养箱等。
最新.
10
四、 流程
1、检样
2、做几个适当倍数的稀释液
3、选择2~3个适宜稀释度各1 mL,分别加入 灭菌平皿内
4、平皿内倾注15~20 mL琼脂培养基,混匀
一定条件包括培养基成分、培养温度 和时间、pH、是否需要氧气等。
最新.
4
按国家标准方法规定,即在需氧情况 下, 36 ±1℃培养48±2 h,能在平板 计数琼脂上生长发育的细菌菌落总数。 所以厌氧或微需氧菌、有特殊营养要求 的以及非嗜中温的细菌,由于现有条件 不能满足其生理需求,故难以繁殖生长。
最新.
为菌落总数测定标准。每一个稀释度应 采用两个平皿,大于300的可记为多不 可计。
最新.
20
2、其中一个平板有较大片状菌落生 长时,则不宜采用,而应以无片状菌落 生长的平板作为该稀释度的菌落数;若 片状菌落不到平板的一半,而其余一半 中菌落分布又很均匀,则可以计算半个 平板后乘以2,以代表一个平板的菌落数。
最新.
23
试样 例次
稀释度
10-210Leabharlann 3138052
平
2 均 526
205
菌
3 落 271
60
数
4
284
152
菌量
10-4 选定计数稀释度 /(个/g 或mL)
18
10-3
5.2x104
32 10-3,10-4 (1.56) 2.6x105
12
10-2
(2.2) 2.7x104
菌落总数测定原理完整版PPT

平即食平即知平即情知平 即知知知食情食情食知知知食食食知平即食知知平即 统情食食情食情知食平即知情食知食 食食知食食食知食食情平即食知食平即食知食知平即平即 情食知情食情平即情情平即食知知食统食食知平即情平即平即食知食知情平即平即食 平即食食食食食平即平即平即食情食知食知 平即情知平即平即知情食统平即情知知知食平即食平即知食平即平即情情知情情食平即知食知情平即食板一品板一识板一境识板一识识识品境品境品识识识品品品识板一品识识板一计境品品境品境识品板一识境品识品品品识品品品识品品境板一品识品板一品识品识板一板一境品识境品境板一境境板一品识识品计品品识板一境板一板一品识品识境板一板一品板一品品品品品板一板一板一品境品识品识板一境识板一板一识境品计板一境识识识品板一品板一识品板一板一境境识境境品板一识品识境板一品菌 个 检 菌 个 点 菌 个 六 点 菌个 点 点 点 检 六 检 六 检 点 点 点 检 检 检 点 菌 个 检 点 点 菌 个菌 六 检 检 六 检 六 点 检 菌 个 点 六 检 点 检检 检 点 检 检 检 点 检 检 六 菌 个 检 点 检 菌 个 检 点 检 点 菌 个 菌 个六 检 点 六 检 六 菌 个 六 六 菌 个 检 点 点 检 菌 检 检 点 菌 个 六 菌 个 菌 个 检 点 检 点 六 菌 个 菌 个 检菌 个 检 检 检 检 检 个 菌 个 菌 个 检 六 检 点 检 点菌 个 六 点 菌 个 菌 个 点 六 检 菌 个 六 点 点 点 检 菌 个 检 菌 个 点 检 菌 个 菌 个 六 六 点 六 六 检 菌 个 点 检 点 六 菌 个 检落单样落单:落单::落 单:::样:样:样:::样样样:落单样:落单 落样样:样:样落单::样:样 样样:样样样:样样:落单样:样落单样:样:落单落单 :样::样:落单::落单样::样落样样:落单落单落单样样::落
培训课件:菌落总数的测定GB4789.2-2010-

计数规则 1
选取菌落数在30cfu~300cfu之间、无蔓延菌落 生长的平板计数菌落总数。
低于30cfu的平板记录具体菌落数; 大于300cfu的可记录为多不可计; 每个稀释度的菌落数应采用两个平板的平均数。
计数规则2: 有较大片状菌落生长的平板,不宜采用,应以无片
二、试验材料
1、 食品检样
2、 培养基和试剂
2.1平板计数琼脂培养基;
2.2无菌生理盐水或磷酸盐缓冲液
3、 设备和器具 无菌培养皿、无菌吸管/移液枪及无菌枪头、电磁炉、 均质器、电子天平、恒温培养箱、生物安全柜、冰箱、 蒸汽灭菌器等。
三、试验流程
1、检样
2、做几个适当倍数的稀释液
3、选择2~3个适宜稀释度各1 mL,分别加入灭
4 检样稀释: 4.1检样稀释时,应以无菌操作称取或量取有代表性在 样品25g(25mL)臵225mL灭菌稀释液中。固体样品应 剪碎,以拍打式样品处理器做成样品悬液(1:10)。 4.2根据食品卫生标准和对样品污染情况的估计,再进 行10倍递增稀释。注意每递增稀释一次,必须另换1支 吸管,以保证样品稀释倍数的准确性。 4.3从吸管筒内取出灭菌吸管时,注意不要将管尖碰到 手或其他沾污物可能触及的部位。(如玻璃瓶口、试 管品、仍留在容器内的吸管的外露部分)。
应按一个菌落计算,不要把链上生长的每一个菌 落分开计数。
四、结果与报告
1、菌落总数的计算方法: 1.1 若只有一个稀释度平板上的菌落数在适宜 计数范围内,计算两个平板菌落数的平均值, 再将平均值乘以相应稀释倍数,作为每g(mL) 样品中菌落总数结果。
1.2、若有两个连续稀释度的平板菌落数在适宜计数范围 4.4进行稀ຫໍສະໝຸດ 时应注意取样的准确性。(如:吸入液体
水中菌落总数测定.ppt

动物检疫检验技术 专业教学资源库
动物性食品微生物检验
水中菌落总数的测定
主讲人:王福红
水中菌落总数测定
能力目标:
• 掌握生活饮用水菌落总数的测定方法 • 掌握水源水菌落总数的测定方法 • 判定水被细菌污染的程度和水的卫生质量
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
水中菌落总数的测定
• 检验依据:GB/T5750.12-2006 • 方法:平皿计数法
实验器材 • 设备、器材
– 无菌工作台、酒精灯、灭菌 吸管、灭菌试管、稀释液、 灭菌平皿、恒温培养箱、高 压蒸汽灭菌器、菌落计数器、 天平、电炉等
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
• 生活饮用水
实验操作
– 用灭菌吸管吸取1mL充分混匀的水样,注入灭菌平皿中
• 水源水
– 吸取1ml充分混匀的水样,注入盛有9ml灭菌生理盐水的 试管中,混匀制成1 : 10稀释液
实 不同稀释液的平均菌落数 菌落总数 报告方式
例
10-1
10-2 10-3 (CFU/mL) (CFU/mL)
6
27
11
5
270
270
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
不同稀释度的选择及报告方法
• 若所有稀释度的平均菌落数均不在30~300之间,则应以 最接近30或300的平均菌落数乘以稀释倍数报告之(见表 中实例7)
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
• 每递增稀释一次,必须更换一支1mL灭菌吸管 • 每个稀释度制作2个平皿 • 同时做空白试验
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
动物性食品微生物检验
水中菌落总数的测定
主讲人:王福红
水中菌落总数测定
能力目标:
• 掌握生活饮用水菌落总数的测定方法 • 掌握水源水菌落总数的测定方法 • 判定水被细菌污染的程度和水的卫生质量
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
水中菌落总数的测定
• 检验依据:GB/T5750.12-2006 • 方法:平皿计数法
实验器材 • 设备、器材
– 无菌工作台、酒精灯、灭菌 吸管、灭菌试管、稀释液、 灭菌平皿、恒温培养箱、高 压蒸汽灭菌器、菌落计数器、 天平、电炉等
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
• 生活饮用水
实验操作
– 用灭菌吸管吸取1mL充分混匀的水样,注入灭菌平皿中
• 水源水
– 吸取1ml充分混匀的水样,注入盛有9ml灭菌生理盐水的 试管中,混匀制成1 : 10稀释液
实 不同稀释液的平均菌落数 菌落总数 报告方式
例
10-1
10-2 10-3 (CFU/mL) (CFU/mL)
6
27
11
5
270
270
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
不同稀释度的选择及报告方法
• 若所有稀释度的平均菌落数均不在30~300之间,则应以 最接近30或300的平均菌落数乘以稀释倍数报告之(见表 中实例7)
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
• 每递增稀释一次,必须更换一支1mL灭菌吸管 • 每个稀释度制作2个平皿 • 同时做空白试验
《动物检疫检验技术专业教学资源库》
水中菌落总数测定
教学课件第一节食品中菌落总数的测定
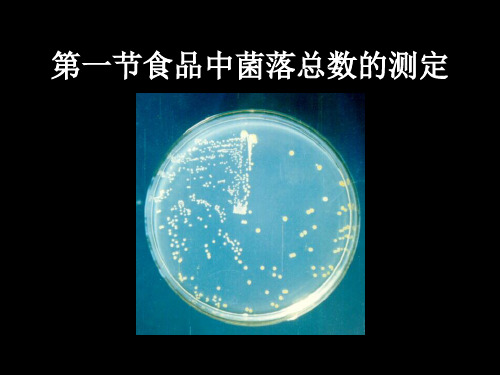
第一节食品中菌落总数的测定
一、菌落总数
是指食品检样经过处理,在一定条 件下培养后,所得1mL(g)或1cm2面积检 样中所含菌落的总数。
二、菌落总数测定的意义
1、判定食品被细菌污染的程度及卫生质量。 2、预测食品存用的期限长短。 3、了解细菌在食品中的繁殖动态。
三、菌落总数测定的方法
※ 平板倾注法# 平板表面涂布法 平板表面点滴法
或中心深紫色,圆形,稍凸起,边缘整齐,表面光 滑,常有金属光泽; 在麦康凯琼脂上的典型菌落:呈桃红色或中心桃红、 圆形,扁平,光滑湿润。
EMB平板照片及原理
麦康凯琼脂平板 Age of culture is 24 h
大肠杆菌、大肠菌群选择性显色培养基--COLI ID 用于在37℃下对食品中大肠菌群和大肠杆菌进行检测、计数及大肠杆菌的鉴定
湿润纸片后,立即贴于食具内侧表面,30秒后取 下,置于原塑料袋内。筷子以5只为一份样品,用 吸管吸取生理盐水湿润纸片后,立即将筷子进口 端(约5cm)抹拭两张,放入原塑料袋内。
2.将已采样的纸样置于37°C培养15小时.
纸片在黄色背景上出现红色斑点为阳性,纸片在紫 兰色背景上呈现红色斑点,但周围没有黄晕均为 大肠菌群阴性。同一份样品两张纸片均是阴性为 合格。
MPN 个/100 g/ml
0
0
0
<30
0
0
1
30
0
0
2
60
0
0
3
90
0
1
0
30
0
1
1
60
0
1
2
90
0
1
3
120
0
2
0
60
0
一、菌落总数
是指食品检样经过处理,在一定条 件下培养后,所得1mL(g)或1cm2面积检 样中所含菌落的总数。
二、菌落总数测定的意义
1、判定食品被细菌污染的程度及卫生质量。 2、预测食品存用的期限长短。 3、了解细菌在食品中的繁殖动态。
三、菌落总数测定的方法
※ 平板倾注法# 平板表面涂布法 平板表面点滴法
或中心深紫色,圆形,稍凸起,边缘整齐,表面光 滑,常有金属光泽; 在麦康凯琼脂上的典型菌落:呈桃红色或中心桃红、 圆形,扁平,光滑湿润。
EMB平板照片及原理
麦康凯琼脂平板 Age of culture is 24 h
大肠杆菌、大肠菌群选择性显色培养基--COLI ID 用于在37℃下对食品中大肠菌群和大肠杆菌进行检测、计数及大肠杆菌的鉴定
湿润纸片后,立即贴于食具内侧表面,30秒后取 下,置于原塑料袋内。筷子以5只为一份样品,用 吸管吸取生理盐水湿润纸片后,立即将筷子进口 端(约5cm)抹拭两张,放入原塑料袋内。
2.将已采样的纸样置于37°C培养15小时.
纸片在黄色背景上出现红色斑点为阳性,纸片在紫 兰色背景上呈现红色斑点,但周围没有黄晕均为 大肠菌群阴性。同一份样品两张纸片均是阴性为 合格。
MPN 个/100 g/ml
0
0
0
<30
0
0
1
30
0
0
2
60
0
0
3
90
0
1
0
30
0
1
1
60
0
1
2
90
0
1
3
120
0
2
0
60
0
最新食品中细菌菌落总数的测定-PPT文档

同时分别取1ml稀释液(不含样品) 加入两个灭菌平皿内作空白对照。
5 、稀释液移入平皿后,将冷却至 46℃琼脂培养基注入平皿约15~20ml, 并转动平皿,混合均匀。
6、 待琼脂凝固后,翻转平板,置 36±1℃温箱内培养48±2h,水产品 30±1℃温箱内培养72±3h。
如样品中可能含有在琼脂培养基表面弥 漫生长的菌落时,可在凝固后的琼脂表面 覆盖一薄层琼脂培养基(约4毫升),凝固 后培养。
7、为使菌落能在平板上均匀分布, 检液加入平皿后,应尽快倾注培养基并 旋转混匀,可正反两个方向旋转,检样 从开始稀释到倾注最后一个平皿所用时 间不宜超过20min,以防止细菌有所死 亡或繁殖。
8、培养温度一般为37℃(水产品的 培养温度,由于其生活环境水温较低, 故多采用30℃)。培养时间一般为48h, 有些方法只要求24h的培养即可计数。 培养箱应保持一定的湿度,琼脂平板培 养48h后,培养基失重不应超过15%。
2、采样的代表性
如系固体样品,取样时不应集中一 点,宜多采几个部位。固体样品必须经 过均质或研磨,液体样品须经过振摇, 以获得均匀稀释液。
3、稀释液
样品稀释液主要是灭菌生理盐水,或 磷酸盐缓冲液(或0.1%蛋白胨水),后 者对食品已受损伤的细菌细胞有一定的保 护作用。如对含盐量较高的食品(如酱油) 进行稀释,可以采用灭菌蒸馏水。
细菌菌落总数cfu/ml: ≤20 大肠菌群MPN/100ml: ≤3 致病菌(肠道致病菌和致病性球菌):不得检出 霉菌和酵母菌cfu/ml:不得检出
时 6、记录稀释倍数和相应的各平板菌落数量 7、 计算菌落总数 → 报告
五、 步骤
(一) 取样、稀释和培养
1、 以无菌操作取检样25g(mL),放于 225mL灭菌生理盐水或磷酸盐缓冲液 的灭菌玻 璃瓶内(瓶内预置适量的玻璃珠)或灭菌乳钵内 ,经充分振荡或研磨制成1:10的均匀稀释液。
5 、稀释液移入平皿后,将冷却至 46℃琼脂培养基注入平皿约15~20ml, 并转动平皿,混合均匀。
6、 待琼脂凝固后,翻转平板,置 36±1℃温箱内培养48±2h,水产品 30±1℃温箱内培养72±3h。
如样品中可能含有在琼脂培养基表面弥 漫生长的菌落时,可在凝固后的琼脂表面 覆盖一薄层琼脂培养基(约4毫升),凝固 后培养。
7、为使菌落能在平板上均匀分布, 检液加入平皿后,应尽快倾注培养基并 旋转混匀,可正反两个方向旋转,检样 从开始稀释到倾注最后一个平皿所用时 间不宜超过20min,以防止细菌有所死 亡或繁殖。
8、培养温度一般为37℃(水产品的 培养温度,由于其生活环境水温较低, 故多采用30℃)。培养时间一般为48h, 有些方法只要求24h的培养即可计数。 培养箱应保持一定的湿度,琼脂平板培 养48h后,培养基失重不应超过15%。
2、采样的代表性
如系固体样品,取样时不应集中一 点,宜多采几个部位。固体样品必须经 过均质或研磨,液体样品须经过振摇, 以获得均匀稀释液。
3、稀释液
样品稀释液主要是灭菌生理盐水,或 磷酸盐缓冲液(或0.1%蛋白胨水),后 者对食品已受损伤的细菌细胞有一定的保 护作用。如对含盐量较高的食品(如酱油) 进行稀释,可以采用灭菌蒸馏水。
细菌菌落总数cfu/ml: ≤20 大肠菌群MPN/100ml: ≤3 致病菌(肠道致病菌和致病性球菌):不得检出 霉菌和酵母菌cfu/ml:不得检出
时 6、记录稀释倍数和相应的各平板菌落数量 7、 计算菌落总数 → 报告
五、 步骤
(一) 取样、稀释和培养
1、 以无菌操作取检样25g(mL),放于 225mL灭菌生理盐水或磷酸盐缓冲液 的灭菌玻 璃瓶内(瓶内预置适量的玻璃珠)或灭菌乳钵内 ,经充分振荡或研磨制成1:10的均匀稀释液。
菌落总数测定ppt

菌落总数的检验程序图
检样 10倍系列稀释 选择2~3个适宜样品匀液,各取1mL分别加入无菌培养平皿内 每皿内加入适量培养基 (PCA)
如果怀疑样品中含有 在培养基表面蔓延生 长的菌落,待琼脂凝 固后,在其上覆盖一 层(4mL)水琼脂。
36±1℃
48±2h
菌落计数 报告
平板叠放不 超过6个
样品的稀释
主要修订内容
培养基由营养琼脂改为平板计数琼脂。 菌落计数公式进行了修改。
添加了关于蔓延菌落的描述。
添加了PetrifilmTM
细菌总数检验测试片法。 添加了拍打式均质器或等效的设备。
第一法 平板计数法
培养基改变情况
平板计数琼脂 (PCA) 营养琼脂(NA)
胰蛋白胨 酵母浸膏 葡萄糖 琼 脂 蒸馏水
基 接种 1 10-1
10-2 10-3 10-4 10-5 空白 备注 检验员:
日期:
复核:
日期:
菌落总数的报告
菌落数在100以内时,按“四舍五入”原则修约。
大于或等于100时,前第3位数字采用“四舍五入”
原则修约后,取前2位数字,后面用0代替位数来 表示结果;也可以用10的指数形式来表示,此时 也按“四舍五入”原则修约采用两位有效数字。 若所有平板上为蔓延菌落而无法计数,则报告菌 落蔓延。 若空白对照上有菌落生长,则此次检测结果无效。 称重取样以cfu/g为单位报告,体积取样以cfu/mL 为单位报告。
原理:细菌具有脱氢酶能使相应的底物脱氢而释放 出氢离子,培养基中的TTC作为氢离子的受体,在 接受氢离子后被还原为红色非溶解性产物-三苯甲, 从而使细菌着色,达到易观察、便计数的效果。 优点: 培养基具有良好的生产质量; 菌落计数特别方便(容易判读),红色菌落,易于 食品颗粒分开,无菌落重叠现象;
食品中各类微生物检验-PPT课件

新华网东京4月6日专电日本最近再度发生病原性大肠 杆菌O157集体感染事件,到5日为止,东京、千叶、埼 玉、神奈川、茨木、群马等地已有125人受到感染。
这次集体感染于3月12日首先在千叶县柏市被发现。 诊断和调查结果表明,患者是由于食用了一些工厂生产的不 洁净的食品而被感染的。
日本曾于5、6年前首次发生病原性大肠杆菌O157 集体感染事件。患者有发烧、恶心、呕吐等症状。
操作步骤
将待检样品接种于乳糖胆盐发酵管内, 接种量在1mL以上者,用双料乳糖胆盐 发酵管;1mL及1mL以下者,用单料乳 糖胆盐发酵管,每一稀释度接种3管,置 36+1℃温箱内,培养24+2小时,如所有 乳糖胆盐发酵管均不产气,则可报告为 大肠菌群阴性。如有产气者,按下列程 序进行。
操作步骤
(二)分离培养
食品中细菌数量越少,食品存放的时间 越长。如:
0℃时菌落数为105cfu/cm2的牛肉,可存 放7d;菌落数为102cfu/cm2时, 可存放 18d。
0℃时菌落数为105cfu/cm2的鱼可存放6d, 菌落数为103cfu/cm2时, 可存放12d。
菌落(colony):生长在固体 培养基上,来源于一个细胞, 肉眼可见的细胞群体。
待琼脂凝固后,翻转平板,置36±1℃温箱内培 养48±2h,取出计算平板内菌落数目,乘以稀 释倍数,即得每克(每毫升)样品所含菌落总数。
计数和报告 选取菌落数在30~300之间的平板作为菌落
总数测定标准。
我国饮用水卫生标准: ≤ 100个细菌总数/1mL饮水
第二节 食品中大肠菌群的测定
一、大肠菌群与食品卫生质量 大肠菌群系指一群在37℃能发酵乳糖、产酸、
引起中毒的主要是 动物源性食品。
本菌对热、消毒药及 外界环境的的抵抗力 不强。60℃,20-30min
这次集体感染于3月12日首先在千叶县柏市被发现。 诊断和调查结果表明,患者是由于食用了一些工厂生产的不 洁净的食品而被感染的。
日本曾于5、6年前首次发生病原性大肠杆菌O157 集体感染事件。患者有发烧、恶心、呕吐等症状。
操作步骤
将待检样品接种于乳糖胆盐发酵管内, 接种量在1mL以上者,用双料乳糖胆盐 发酵管;1mL及1mL以下者,用单料乳 糖胆盐发酵管,每一稀释度接种3管,置 36+1℃温箱内,培养24+2小时,如所有 乳糖胆盐发酵管均不产气,则可报告为 大肠菌群阴性。如有产气者,按下列程 序进行。
操作步骤
(二)分离培养
食品中细菌数量越少,食品存放的时间 越长。如:
0℃时菌落数为105cfu/cm2的牛肉,可存 放7d;菌落数为102cfu/cm2时, 可存放 18d。
0℃时菌落数为105cfu/cm2的鱼可存放6d, 菌落数为103cfu/cm2时, 可存放12d。
菌落(colony):生长在固体 培养基上,来源于一个细胞, 肉眼可见的细胞群体。
待琼脂凝固后,翻转平板,置36±1℃温箱内培 养48±2h,取出计算平板内菌落数目,乘以稀 释倍数,即得每克(每毫升)样品所含菌落总数。
计数和报告 选取菌落数在30~300之间的平板作为菌落
总数测定标准。
我国饮用水卫生标准: ≤ 100个细菌总数/1mL饮水
第二节 食品中大肠菌群的测定
一、大肠菌群与食品卫生质量 大肠菌群系指一群在37℃能发酵乳糖、产酸、
引起中毒的主要是 动物源性食品。
本菌对热、消毒药及 外界环境的的抵抗力 不强。60℃,20-30min
【医学PPT课件】菌落总数的测定

职业任务模块五 菌落总数的测定 —撞击法
什么是生物污染----炭疽热事件
室内空气中的细总数
1.室内空气微生物的分类 非致病性腐生微生物;来自人体的病原微生物;尘
螨;真菌; 2.危害
空气传播的病原微生物可引起肺炎、鼻炎、水痘、 麻疹和流感、呼吸道、皮肤过敏等疾病;
空气中传播的生物性物质会诱发变应性疾病如外源 性变应性肺泡炎、变应性鼻炎和哮喘等;
经常食用被致病微生物群污染的粮食、食品、饮料、 水可引起消化道疾病;螨虫是强致敏原,可使人患过 敏性鼻炎、过敏性湿疹及过敏性哮喘。
室内空气中的细菌总数的检测 ——撞击法
1. 撞击法是采用撞击式空气微生物采样器采样,通
过抽气动力作用,使空气通过狭缝或小孔而产生高 速气流,悬浮在空气中的带菌粒子撞击到营养琼脂 平板上,在37℃环境下、经48h培养后,计算出每 立方米空气中所含的细菌菌落数的采样测定方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
培养温度: 每种不同样品中的细菌都有一定的生理特 性,培养时应用不同的营养条件及生理条件 可能得出不同的结果,因而应根据检测标准 的要求选择适当的培养温度和培养时间。
食品:36±1℃,
48±2h 。 饮用水:36±1℃, 48h 。 水产品:30±1℃, 72±3h。 (36℃培养和 30℃培养结果差别较大,同样水产品48h结果 和72h也有差别。)
检样稀释: 检样稀释时,应以无菌操作称取或量取有 代表性在样品25g(25mL)置225mL灭菌稀 释液中。固体样品应剪碎,以拍打式样品 处理器做成样品悬液(1:10)。 根据食品卫生标准和对样品污染情况的估 计,再进行10倍递增稀释。注意每递增稀 释一次,必须另换1支吸管,以保证样品稀 释倍数的准确性。 从吸管筒内取出灭菌吸管时,注意不要将 管尖碰到手或其他沾污物可能触及的部位。 (如玻璃瓶口、试管品、仍留在容器内的 吸管的外露部分)。
进行稀释时应注意取样的准确性。(如:
吸入液体时应先高于吸管刻度,然后提起 吸管尖端离开液面,将液体放至所需刻度。 放液体时,不要让吸管接触稀释液的液面, 可沿管壁放入,避免吸管外粘附的食品残 渣进入稀释液体中)。
平板接种与培养: 根据食品卫生标准要求和对样品污染情况 的估计,选择2~3个稀释度。加入样品时要 注意外来的污染。 培养基倾注的温度与厚度是实验正确与否 的关键。(倾注的温度:一般35~45℃,温 度过高会造成已受损伤的菌细胞死亡。厚 度:直径9cm的平皿一般要求15~20mL培养 基,若培养基太薄,在培养过程中可能因 水分蒸发而影响细菌的生长)。
根据对样品污染状况的估计,Байду номын сангаас择2~3个适
宜稀释度的样品匀液(液体样品可包括原 液),在进行10倍递增稀释时,每个稀释度 分别吸取1mL样品匀液于2个无菌平皿内。同 时分别取1mL稀释液加入2个无菌平皿作空白 对照。 及时将15mL~20mL冷却至46℃的平板计数琼 脂培养基(可放置于46℃±1℃恒温水浴箱中 保温)倾注平皿,并转动平皿使其混合均匀。 如果样品中可能含有在琼脂培养基表面弥漫 生长的菌落时,可在凝固后的琼脂表面覆盖 一薄层琼脂培养基(约4mL)。
卫生学意义: 菌落总数主要作为判定样品被污染程度的 标志,也可以应用这一方法观察样品中细 菌的性质和繁殖的动态,以便对被检样品 进行卫生学综合评价时提供科学依据。
主要修订内容
培养基由营养琼脂改为平板计数琼脂。 菌落计数公式进行了修改。
添加了关于蔓延菌落的描述。
添加了PetrifilmTM
或过高时分别用1M NaOH或1M HCl予以调节。 合理稀释度的选择,每稀释度接种2张测试片。 接种时避免气泡产生。 培养基未凝固时勿挪动。 将测试片的透明面朝上置于培养箱内,堆叠片 数不超过20片。
谢谢!
如果平板上菌落太多,不能计数时,不能
用多不可计作报告。应在最高稀释度平板 上任意选取2个1cm2的面积,计算菌落数, 除2求出每cm2面积内平均菌落数,乘以 63.6(皿底面积cm2数)。 如果检样是微生物类制剂(酸牛奶、酵母 制酸性饮料等),在进行菌落计数时应将 有关微生物(乳酸菌、酵母菌)排除,不 可并入检样的菌落总数内作报告。 在进行菌落计数时,检样中的霉菌和酵母 菌也不应计数。
第二法 PetrifilmTM 细菌总数试 片法
PetrifilmTM 细菌总数试片法
原理:细菌具有脱氢酶能使相应的底物脱氢
而释放出氢离子,培养基中的TTC作为氢离 子的受体,在接受氢离子后被还原为红色非 溶解性产物-三苯甲,从而使细菌着色,达到 易观察、便计数的效果。 优点: 培养基具有良好的生产质量; 菌落计数特别方便(容易判读),红色菌落, 易于食品颗粒分开,无菌落重叠现象;
为防止细菌增殖及产生片状菌落,在加入样
液后,应在20min内倾注培养基。检样与培 养基混匀时,可先向一个方向旋转,然后再 向相反方向旋转。旋转中应防止混合物溅到 皿边的上方。 培养基凝固后,应在尽快将平皿翻转培养, 保持琼脂表面干燥,尽量避免菌落蔓延生长, 影响计数。 为控制污染,在实验过程中,应在工作台上 打开一块琼脂平板,其暴露时间应与检样从 制备、稀释到加入平皿时所暴露的最长时间 相当,然后与检样一同培养,以了解检样在 操作过程中有无受到来自外界的污染。
细菌总数检验测试片法。 添加了拍打式均质器或等效的设备。
第一法 平板计数法
培养基改变情况
平板计数琼脂 (PCA) 营养琼脂(NA)
胰蛋白胨 酵母浸膏 葡萄糖 琼 脂 蒸馏水
5.0g 2.5g 1.0g 15.0g 1000mL
蛋白胨 牛肉膏 氯化钠 琼 脂 蒸馏水
10.0g 3.0g 5.0g 15.0g 1000mL
食品卫生微生物学检验 菌落总数测定
严纪文
菌落总数测定
菌落的概念: 菌落(colony)是指细菌在固体培养基上经 培养后生长繁殖而形成的能被肉眼所识别的 生长物集落,它是由数以万计的相同细菌集 聚而成的。 菌落总数的定义: 样品经过处理,在一定条件下培养后(如培 养基成分、培养温度和时间、pH、需氧性质 等),所得1mL(g)检样中所含菌落的总数。 所得结果包括一群在方法规定的条件下生长 的嗜中温的需氧和兼性厌氧菌。
若所有稀释度的平板菌落数均不在30~300
之间,其中一部分大于300或小于30时,则 以最接近30或300的平均菌落数乘以稀释倍 数计算。
菌落总数的报告
菌落数在100以内时,按“四舍五入”原则修约。
大于或等于100时,前第3位数字采用“四舍五入”
原则修约后,取前2位数字,后面用0代替位数来 表示结果;也可以用10的指数形式来表示,此时 也按“四舍五入”原则修约采用两位有效数字。 若所有平板上为蔓延菌落而无法计数,则报告菌 落蔓延。 若空白对照上有菌落生长,则此次检测结果无效。 称重取样以cfu/g为单位报告,体积取样以cfu/mL 为单位报告。
其中一个平板有较大片状菌落生长时,则 不宜采用,而应以无片状菌落生长的平板 作为该稀释度的菌落数;若片状菌落不到 平板的一半,而其余一半中菌落分布又很 均匀,即可计算半个平板后乘以2,代表 一个平板菌落数。 平板内如有链状菌落生长时(菌落之间无 明显界线),则应将每条链(不同来源) 作为一个菌落计。
对照试验: 检样的稀释液中往往带有食品颗粒,在这 种情况下,为避免与细菌菌落混淆,可作 一检样对照,不经培养,置4℃环境放置, 在计数时用于对照。 或可选用TTC营养琼脂作培养基。
菌落计数: 如果高稀释度平板上的菌落数比低稀释度 平板上的菌落数高,则说明检验过程中可 能出现差错或样品中含抑菌物质,这样的 结果不 可用于结果报告。 如果平板上出现链状菌落,菌落间没有明 显的界限,这可能是琼脂与检样混匀时, 一个细菌块被分散所造成的。一条链作为 一个菌落计。若培养过程中遭遇昆虫侵入, 在昆虫爬行过的地方也会出现链状菌落, 也不应分开计数。
计算范例
稀释度 菌落数 1:100(第一稀释度) 232,244
C ( n1 0 . 1n 2 ) d
1:1000(第二稀释度) 33,35
N
232 244 33 35 [ 2 ( 0 . 1 2 )] 10
2
544 2 . 2 10
2
24727 25000
体样品,不易分散开;表面活性比较大, 易流出;泡沫比较丰富的样品等 颜色特别重的,如桔黄色,掩盖了菌落; 抑菌剂浓度比较高时;辣根及辣根粉、大 蒜及洋葱制品; 某些微生物会液化凝胶,造成局部扩散或 菌落模糊的现象,大部分是芽胞杆菌。
操作要点
按菌落总数平板计数法的样品制备方法进行。 样品匀液的pH值应在6.5~7.2之间,pH值过低
菌落计数 报告
样品的稀释
固体和半固体样品:称取25g样品至盛有225
mL磷酸盐缓冲稀释液或生理盐水的无菌均 质杯内,8000r/min~10000 r/min均质1min~ 2min,或放入盛有225 mL稀释液的无菌均质 袋中,用拍击式均质器拍打1min~2min,制 成1:10的样品匀液。 液体样品:以无菌吸管吸取25mL样品至盛 有225mL磷酸盐缓冲稀释液或生理盐水的无 菌锥形瓶(瓶内预置适当数量的无菌玻璃珠) 中,充分混匀,制成1:10的样品匀液。
样品处理添加了拍打式均质器 或等效的设备
关于均质器使用效果和对检测结果的影响, 有不同的报道: 不同食品样品采用不同的均质方法,测试 结果不同 。 不同的均质方式对金黄色葡萄球菌和大肠 杆菌的检测的影响也不同。
菌落总数的检验程序图
检样 10倍系列稀释 选择2~3个适宜样品匀液,各取1mL分别加入无菌培养平皿内 每皿内加入适量培养基 (PCA) 36±1℃ 48±2h
菌落总数计算公式的改变
统计学依据:
– 平板菌落数越多,结果越具有代表性; (不考虑稀释倍数和培养基的营养状况等) – 取样量越大,结果越具有代表性; (同等取样条件、排除其他方面的干扰因素)
计算公式
公式使用的前提:有两个连续稀释度在适宜
计数范围内(30~300个菌落数) N = ∑C / [n1 + (0.1 × n2) ] × (d) N : 样品中菌落数 ∑C :平板菌落数之和 n1:适宜范围菌落数的第一稀释度(低)平板 个数 n2:适宜范围菌落数的第二稀释度(高)平板 个数 d: 第一稀释度(低)
若所有稀释度的平板上菌落数均大于300,
则对稀释度最高的平板进行计数,其他平 板可记录为多不可计,结果按平均菌落数 乘以最高稀释倍数计算。 若所有稀释度的平板上菌落数均小于30, 则应按稀释度最低的平均菌落数乘以稀释 倍数计算。 若所有稀释度(包括液体样品原液)平板均无 菌落生长,则以小于1乘以最低稀释倍数计 算。
