李狄-电化学原理-第六章-电子转移步骤控制动力学.答案
电子转移步骤动力学
F 平 i F KcO exp( ) RT F平 i F KcR exp( ) RT
16
15
交换电流密度
在平衡电位下,还原反应速度与氧化反应速度相等,用 i 0 表示
交换电流密度
F 平 F 平 交换电流密度的影响因素: i 0 F KcO exp( ) F KcR exp( ) RT RT
ic i 0 exp(
F
RT
c )
26
高过电位下的电化学极化规律
取对数:
高过电位下的电化学极化规律
电极反应以一定的速度进行时,电化学过电位的大小取决于电极 反应性质(i0、α、β体现)和反应温度T。
c
2.3RT 2.3RT log i 0 log ic F F
对于阳极极化公式:
还原反应
氧化反应
8
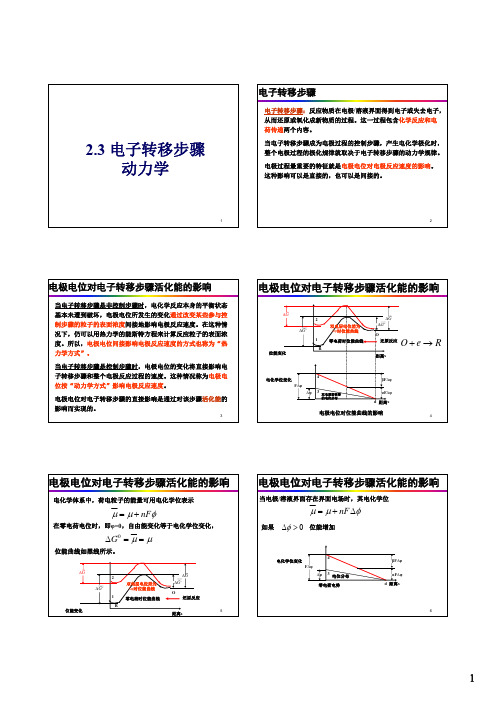
电极电位对电子转移步骤反应速度的影响
根据化学动力学,反应速度与反应活化能之间的关系为:
v kc exp(
对于电极反应
G ) RT
v为反应速度,c为反应粒子的浓度,∆G为反应活化能,k为指前因子。
电极电位对电子转移步骤反应速度的影响 * G 还原反应 i F kcO exp( ) RT * G 氧化反应 i F kcR exp( ) RT
交换电流密度
电极反应
Oe R
传递系数 交换电流密度 电极反应速度常数
当电极电位等于平衡电位时,电极上没有净反应发生,即没有 宏观的物质变化和外电流通过,但微观上仍有物质交换。电极 上的氧化反应和还原反应处于动态平衡
ii
在平衡电位下
传递系数:表示电极电位对还原反应活化能和氧化反应活化能 影响的程度,其数值决定于电极反应的性质
第6章电子转移步骤动力学

电
化
学
原
理
6.1电极电位对电子转移步骤反应速度的影响
当电子转移步骤是非控制步骤时,电化学反应 本身的平衡状态基本未遭破坏,电极电位所发 生的变化通过改变某些参与控制步骤的粒子的 表面浓度而间接地影响电极反应速度。这种情 况下,仍可以用热力学的能斯特方程来计算反 应粒子的表面浓度。所以,电极电位间接影响 电极反应速度的方式也称为“热力学方式”。
F
0 RT
K即为电极反应速度常数
F
0 RT
如果
G
0
2
G
1
0
G
G G nF
0
1
传递系数
表示电极电位对还原反应活化能 和氧化反应活化能影响的程度
d
F
4
x
F
F
3
x
电
化
学
原
理
2、把电极反应看作是电子在相间转移的过程,分析电极电位对反 应活化能的影响规律
铂电极浸入含Fe2+离子和Fe3+离子的溶液 电极反应为
0 j FKco
0 j FKcR
0 F j j exp RT
0 j j exp
F
RT
对上式取对数得到:
0 2.3 RT RT 2.3F log j F log j 0 2.3 RT 2.3 RT F log j F log j
电
化
学
原
理
⑵银电极刚刚浸入硝酸银溶液的瞬间,或者是零电荷电位下的Ag+ 离子的位能曲线。
O*
电子转移步骤动力学完整版

三种前提假设: (1) 溶液中参与反应的Ag+离子位于外亥姆荷茨平面 ,电极上参与反应的Ag+离子位于电极表面的晶格中,活 化态位于这二者之间的某个位置。 (2) 电极/溶液界面上不存在任何特性吸附,也不存在 除了离子双电层以外的其他相间电位。也就是说,我们只 考虑离子双电层及其电位差的影响。 (3)溶液总浓度足够大,以致于双电层几乎完全是紧 密层结构,即可认为双电层电位差完全分布在紧密层中, ψ1=0
第六章 电子转移步骤动力学
电子转移步骤(电化学反应步骤)系指反应物质在电极/溶液界 面得到电子或失去电子,从而还原或氧化成新物质的过程。 这一单元步骤包含了化学反应和电荷传递两个内容,是整个 电极过程的核心步骤。因此,研究电子转移步骤的动力学规 律有重要的意义。尤其当该步骤成为电极过程的控制步骤, 产生所谓电化学极化时,整个电极过程的极化规律就取决于 电子转移步骤的动力学规律。对该步骤的深入了解,有助于 人们控制这一类电极过程的反应速度和反应进行的方向。
对式取对数,整理,得电子转移步骤的基本动 力学公式:
对图6.3的解释
Βιβλιοθήκη 曲线1:纯化学反应活化能变化 曲线3:界面电场电压降 曲线4:有界面电场后的电功(nFE) 曲线2:曲线1与曲线4的加和(电化学位)。
另外:对曲线4,分成了α、β两部分,对于还 原反应,为αnFE ,对于氧化反应,为βnFE 。 α+β=1,传递系数。
问题: 有界面电场后,还原反应与氧化反应的活化能(自 由能)有什么变化?
电化学动力学的第一组方程 根据化学动力学,反应速度与反应活化能之 间的关系为:
阿累尼乌斯方程
斯万特·奥古斯特·阿累尼乌斯(Svante August Arrhenius) 瑞典物理化学家,1859年2月19日生于瑞乌普萨拉附近的维克城 堡。电离理论创立者。学术成果:解释溶液中的元素是如何被 电解分离的现象,研究过温度对化学反应速度的影响,得出著 名的阿累尼乌斯公式。还提出了等氢离子现象理论、分子活化 理论和盐的水解理论。对宇宙化学、天体物理学等也有研究。 获得1903年诺贝尔化学奖。
电化学基本原理与应用-第6章

第六章电荷转移步骤动力学与电化学极化主要内容6.1 电化学极化概述6.2 电化学步骤的基本动力学方程6.3 电化学步骤的基本动力学参数6.4 稳态电化学极化动力学方程6.5 ψ效应16.6 混合控制动力学规律6.7 电化学极化与浓差极化的比较6.1 电化学极化概述6.1.1 电化学极化经验公式—Tafel公式6.1.2 影响电化学极化的主要因素6.1 电化学极化概述液相传质过程发生于“电极/溶液”表面附近的液层中,即扩散层中。
电化学步骤(电荷转移步骤)则发生于“电极/溶液”界面上。
由于电极过程中,电化学步骤的速度缓慢,而引起电极电位偏离其平衡电极电位的现象,称为“电化学极化”或“活化极化”。
产生的过电位称为“电化学过电位”。
6.1.1 电化学极化经验公式—Tafel公式1905年,根据析氢反应的大量研究结果,Tafel首先提出了电化学极化过电位与极化电流密度之间的关系,即著名的Tafel公式。
Tafel公式显示,η不仅与电流密度I有关,还与a、b有关。
而a、b则与电极材料性质、表面结构、电极的真实表面积、溶液的组成及温度有关。
η+=a lgIb6.1.1 电化学极化经验公式—Tafel公式发生电化学极化时η与lgI的关系6.1.2 影响电化学极化的主要因素(1)电流密度。
(2)电极材料,不同的电极材料a值不同,反应能力完全不同。
需要寻找具有高催化活性的材料。
(3)电极的真实表面积,表面积越大电极的反应能力越大,可减小电极的极化。
如采用多孔电极。
(一般真实表面积与表观表面积之间有较大差距。
)6.1.2 影响电化学极化的主要因素(4)电极的表面状态,电化学极化非常强烈的依赖于电极表面的状态。
各种活性物质的特性吸附可极大的改变电极反应的速度。
如电镀添加剂、缓蚀剂等。
(5)温度,一般温度升高,过电位降低,反应速度加快。
6.2 电化学步骤的基本动力学方程6.2.1 电极电位对反应活化能的影响6.2.2 电极电位对反应速度的影响6.2.1 电极电位对反应活化能的影响电极电位对于电极反应速度的影响有两种方式:热力学方式与动力学方式。
电化学思考课后答案第六章

思考题3. 从理论上推导电化学方程式(巴特勒-伏尔摩方程),并说明该理论公式与经验公式的一致性。
答:电化学极化处于稳定状态时,外电流密度必定等于(j j =v w),也就是等于电子转移步骤的净反应速度(即净电流密度j 净)。
由于电子转移步骤是控制步骤,因而j 净也应是整个电极反应的净反应速度。
这样,根据电子转移步骤基本公式,易得稳态电化学极化时电极反应的速度与电极电位之间关系。
即j=j 净。
将公式 j 净= 0F F RT RT j e e a b j j -D D 轾犏-犏臌 代入上式,则 0F F RT RT j j e e a b j j -D D 轾犏=-犏臌(1) 式(1)就是单电子电极反应的稳态电化学方程式,也称巴特勒-伏尔摩方程。
若电极反应净速度预用正值表示时,可用j c 代表阴极反应速度,用j a 表示阳极反应速度,将式(1)分别改写为0c c F F RT RT c j j j j e e a b h h -轾犏=-=-犏臌v w (2) 0a a F F RT RT a j j j j e e b a h h -轾犏=-=-犏臌w v (3)当过电位很大时,相当于双曲线函数x 值很大,即式(2)中有如下关系c c F F RT RT e ea b h h -?可以忽略(2)中右边第二个指数项,即 0c F RT c j j e a h -» (4)两边取对数02.3 2.3log c c RT RT j j F Fh a a =-+ (5) 同理,对于阳极极化为0a F RT a j j eb h -» (6) 02.3 2.3log a a RT RT j j F Fh b b =-+ (7) 式(5)和式(7)即为高过电位时巴特勒-伏尔摩方程近似公式。
与电化学极化的经验公式——塔菲尔公式(log a b j h =+)相比,可看出两者是完全一致的。
这表明电子转移步骤的基本动力学公式和巴特勒-伏尔摩方程的正确性得到了实践的验证。
电化学基本原理电子转移步骤动力学

• 当电极/溶液界面存在界面电场时, 例如电极的绝对电位为△φ ,且△φ >o时, Ag+离子的位能曲线变化如图 所示。
• 曲线1为零电荷电位时的位能曲线。 曲线3为双电层紧密层中的电位分布。这 时,电极表面的Ag+离子受界面电场的影
• 多个电子参与的电极反应,则往往是通过几个电子转移步骤 连续进行而完成的。
• 单电子反应 扩展到 多电子的电极反应。
• 电极反应的特点是反应速度与电极电位有关。
• 第五章中讨论的浓度极化,可以说是通过改变电极电位来改变某些 反应粒子的浓度,从而间接地影响有这些粒子参加的电极反应速度。
• 而本章讨论的电化学极化,实质上是通过改变电极电位来改变电化 学反应的活化能,直接影响着电极反应的速度。所以电化学极化对 电极反应速度的影响比浓度极化要来得大。
• 式中,
和
已分别表示还原反应
和氧化反应的活化能;α和β为小于1、大于零
的常数,分别表示电极电位对还原反应活化能
和氧化反应活化能影响的程度,称为传递系数
或对称系数。
• 因为
+
α+β =l。
=
,所以。
F
• 用同样的分析方法可以得到:
1
如果电极电位为负值,即△φ <
0时,氧化反应的活化能增大而
还原反应活化能减小。
分别表示还
G 0
• 没有离子双电层时,根据上述假设,电极/溶液之间的内 电位差△φ为零.即电极的绝对电位等于零。
• 己知电化学体系中,荷电粒子的能量可用电化学位表示,根据 • 在零电荷电位时, Ag+离子的电化学位等于化学位。因而在没
李狄-电化学原理-第六章-电子转移步骤控制动力学全解

当 cO c R时, 平= 0, 在平衡电位 下:
F 0 , F 0 . F KcO exp F Kc R exp RT RT
∵ cO c R
F F 0, 0. 令:K K exp K exp RT RT
第六章 电子转移步骤动力学
重点要求
稳态电化学极化规律 电子转移步骤的基本动力学参数及其稳 态测量原理 双电层结构对电子转移步骤的影响 电化学极化与浓差极化共存时的动力学 规律
第一节 电极电位对电化学步骤反应速度的影响
位能图:表示金 属离子处在金属/ 溶液界面不同位 置时,位能高低 的一种示意图。 活化能:活化态 与离子平均能量 之差
0
∵ 1
F 0 RT i 或 0 i ∴ i Fi RT
与经验公式的比较
对比公式
i
可得:
RT 1 0 nF i
定义极化电阻:
RT d Rr 0 di 0 nFi
五. 弱极化区的极化规律
在这个极化区域内,B-V方程不可简化, 必须用完整得B-V公式描述动力学规律:
电极电位对电极反应绝对速度的影响
第二节 电子转移步骤的基本动力学参数 一.电极过程的传递系数 、 物理意义:表示电极电位对还原反应和氧 化反应活化能影响的程度。
G G nF
0
G G nF
0
注:单电子转移步骤中 0.5 所以又 称为对称系数。
F F i=i i i0 exp exp RT RT
电子转移步骤的动力学

上图示出了电极反应绝对反应速度的对数值随电极电位呈 线性变化。
6-2 对子转移步骤地基本动力学参数 一 平衡电位与交换电流密度
平衡电位是电化学热力学的一个特征值,当φ=φ平 时,电极/溶液界面达到平衡,因此选其作为电位的 零点 是非常合适的。
O+ne⇋R
其反应活化能表征 如下:
0 G G nF ( 平)(还原) 0 G G nF ( 平)(氧化) 0 0 G ,G 分别为 平时的还原与氧化
zA:频率因子; R:气体常数; T:开尔文温度, Δ GA:A生成B的活化能,是催化剂的函数与温度无关。 电极反应同样满足上述速度方程,所不同之处是 反应速度受到电极/溶液界面电场的影响,即:ΔGA 受到电位的影响,是电位的函数,故电位反应又称为 电催化反应。
1.离子电荷在两相间迁移时,电位对反应 活化能的影响 以Ag/AgNO3电极体系为例讨论之
电极电位由φ变到 φ+ Δ φ,T、P不变
晶格态Ag+的平均位能由G1 → G1’(G1+FΔ φ) 溶剂化Ag+的平均位能仍为G2 设增加电位Δ φ全部降在水合离子半径d的 区域,则Δ φ呈线性变化。此时, Ag+穿越该区 域时将产生一个附加的位能,其变化也呈线性。 (1 mol Ag+所带电量为1F) 2线即为:当电极电位由φ变到 φ+ Δ φ时, Ag+在两相间迁移产生的附加位能线。
以 Ag+ + e ⇋ Ag 反应为例说明之 上述反应可以等效为: Ag+(溶液) ⇋ Ag+(晶格)
即该电极过程可视为Ag+在两相间的迁移过程。 在迁移过程中,Ag+形态及能态均将发生变化。 由于这一迁移正好穿越了电极/溶液界面,因而 电极电位的存在及其变化必将对迁移过程产生影 响。
电化学原理-(李狄-著)北航出版社-课后5-9章习题参考答案

第五章1、在电极界面附近的液层中,是否总存在三种传质方式?为什么?每种传质方式的传质速度如何表示?答:电极界面附近的液层通常是指扩散层,可以同时存在着三种传质方式(电迁移、对流和 扩散),但当溶液中含有大量局外电解质时,反应离子的迁移数很小,电迁移传质作用可以忽略不计,而且根据流体力学,电极界面附近液层的对流速度非常小,因此电极界面附近液 层主要传质方式是扩散。
三种传质方式的传质速度可用各自的电流密度J 来表示。
电迁移: 对流:扩散:2. 在什么条件下才能实现稳态扩散过程?实际稳态扩散过程的规律与理想稳态扩散过程有 什么区别?答:一定强度的对流的存在是稳态扩散过程的前提。
区别:在理想稳态扩散条件下,扩散层有确定的厚度,其厚度等于毛细管的长度l ;而在真实体系中,由于对流作用与扩散作用的重叠,只能根据一定的理论来近似求得扩散层的厚度。
理想稳态扩散: 实际稳态扩散: 3. 旋转圆盘电极和旋转圆环圆盘电极有什么优点?它们在电化学测量中有什么重要用途? 答: 旋转圆盘电极和旋转圆环圆盘电极上各点的扩散层厚度是均匀的,因此电极表面各处的电流密度分布均匀。
这克服了平面电极表面受对流作用影响不均匀的缺点。
它们可以测量并分析极化曲线,研究反应中间产物的组成及其电极过程动力学规律。
4. 试比较扩散层、分散层和边界层的区别。
扩散层中有没有剩余电荷?答:紧靠电极表面附近,有一薄层,此层内存在反应粒子的浓度梯度,这层叫做扩散层;电极表面的荷电粒子由于热运动而倾向于均匀分布,从而使剩余电荷不可能完全紧贴着电极表面分布,而具有一定的分散性,形成所谓分散层;靠近电极表面附近的液流层叫做边界层,越接近电极表面,其液流流速越小。
电极/溶液界面存在着离子双电层时,金属一侧的剩余电荷来源于电子的过剩或缺贫。
双电层一侧区可以认为各种离子浓度分布只受双电层电场影响,不受其它传质(包括扩散)过程的影响。
因此扩散层中没有剩余电荷。
5. 假定一个稳态电极过程受传质步骤控制,并假设该电极过程为阴离子在阴极还原。
电化学原理_(李狄_著)北航出版社_课后1-7章习题参考答案

电化学原理第一章习题答案1、解:2266KCl KCl H O H O 0.001141.31.010142.31010001000c K K K K cm 11λ−−−−×=+=+=+×=×Ω溶液 2、解:E V Fi i =λ,FE V i i λ=,,, 10288.0−⋅=+s cm V H 10050.0−⋅=+s cm V K 10051.0−⋅=−s cm V Cl 3、解:,62.550121,,,,2−−⋅Ω=−+=eq cm KCl o HCl o KOH o O H o λλλλ2O c c c ,c 1.004H H +−====设故,2,811c5.510cm 1000o H O λκ−−−==×Ω4、(1)121,,Cl ,t t 1,t 76.33mol (KCl o KCl o Cl cm λλλλλ−−−−+−+−=++=∴==Ω⋅∵中)121121121,K ,Na ,Cl 73.49mol 50.14mol 76.31mol (NaCl o o o cm cm cm λλλ++−−−−−−−=Ω⋅=Ω⋅=Ω⋅同理:,,中)(2)由上述结果可知: 121Cl ,Na ,121Cl ,K ,mol 45.126mol 82.142−−−−⋅Ω=+⋅Ω=+−+−+cm cm o o o o λλλλ,在KCl 与NaCl 溶液中−Cl ,o λ相等,所以证明离子独立移动定律的正确性;(3) vs cm vs cm u vs cm u F u a o o l o l o i o /1020.5,/1062.7,/1091.7,/24N ,24K ,24C ,C ,,−−−×=×=×==++−−λλ5、解:Cu(OH)2== Cu 2++2OH -,设=y ;2Cu c +OH c −=2y 则K S =4y 3因为u=Σu i =KH 2O+10-3[y λCu 2++2y λOH -]以o λ代替λ(稀溶液)代入上式,求得y=1.36×10-4mol/dm 3所以Ks=4y 3=1.006×10-11 (mol/dm 3)36、解: ==+,令=y ,3AgIO +Ag −3IO Ag c +3IO c −=y ,则=y S K 2,K=i K ∑=+(y O H K 2310−+Ag λ+y −3IO λ)作为无限稀溶液处理,用0λ代替,=+y O H K 2310−3AgIO λ则:y=43651074.1104.68101.11030.1−−−×=××−×L mol /;∴= y S K 2=3.03810−×2)/(L mol 7、解:HAc o ,λ=HCl o ,λ+NaAc o ,λ-NaCl o ,λ=390.7,121−−⋅Ωeq cm HAc o ,λ=9.02121−−⋅Ωeq cm ∴α0/λλ==0.023,==1.69αK _2)1/(V αα−510−×8、解:由欧姆定律IR=iS KS l ⋅=K il,∵K=1000c λ,∴IR=1000il cλ⋅=V 79.05.0126101010533≈××××− 9、解:公式log ±γ=-0.5115||||+Z −Z I (设25)C °(1)±γ=0.9740,I=212i i z m ∑,I=212i i c z ∑,=()±m ++νm −−νm ν1(2)±γ=0.9101,(3)±γ=0.6487,(4)±γ=0.811410、解:=+H a ±γ+H m ,pH=-log =-log (0.209+H a 4.0×)=1.08电化学原理第二章习题答案1、 解:()+2326623Sb O H e Sb H O ++++ ,()−236H H +6e + ,电池:2322323Sb O H Sb H O ++解法一:00G E nF ∆=−83646F =0.0143V ≈,E=+0E 2.36RT F 2232323log H Sb O Sb H OP a a a ==0.0143V0E 解法二:0602.3 2.3log log 6Sb Sb H H RT RT a a F Fϕϕϕ+++=+=+; 2.3log H RTa Fϕ+−=∴000.0143Sb E E ϕϕϕ+−=−===V2解:⑴,(()+22442H O e H O +++ )−224H H +4e + ;电池:22222H O H O +2220022.3log 4H O H O P P RT E E E Fa =+= 查表:0ϕ+=1.229V ,0ϕ−=0.000V ,001.229E V ϕϕ+−∴=−= ⑵视为无限稀释溶液,以浓度代替活度计算()242Sn Sn e ++−+ ,(),电池:32222Fe e Fe ++++ 23422Sn Fe Sn Fe 2+++++ +23422022.3log 2Sn Fe Sn Fe C C RT E E F C C ++++=+=(0.771-0.15)+220.05910.001(0.01)log 20.01(0.001)××=0.6505V ⑶(),,(0.1)Ag Ag m e +−+ ()(1)Ag m e Ag +++ (1)(0.1)Ag m Ag m ++→电池:(1)0(0.1)2.3log Ag m Ag m a RT E E F a ++=+,(其中,=0) 0E 查表:1m 中3AgNO 0.4V γ±=,0.1m 中3AgNO 0.72V γ±=, 2.310.4log0.0440.10.72RT E V F×∴==× 3、 解:2222|(),()|(),Cl Hg Hg Cl s KCl m Cl P Pt ()2222Hg Cl Hg Cl e −−++ ,()222Cl e Cl −++ ,222Hg Cl Hg Cl 2+ 电池:222200002.3log 2Cl Hg Hg Cl P a RT E E E F a ϕϕ+−=+==−∵O 1.35950.2681 1.0914(25C)E V ,∴=−=设 由于E 与无关,故两种溶液中的电动势均为上值Cl a −其他解法:①E ϕϕ+=−−0,亦得出0E ϕϕ+=−−②按Cl a −计算ϕ+,查表得ϕ甘汞,则E ϕϕ+=−甘汞 4、 ⑴解法一:23,(1)|(1)()H Pt H atm HCl a AgNO m Ag +=()222H H e +−+ 222,()Ag e Ag +++ g ,2222H Ag H A ++++ 电池:有E ϕϕϕ+−=−=+,02.3log()AgAgAg RTE m Fϕγ++±∴=−。
电子转移步骤动力学

三、金属和溶液中电子能级的分布
T 0K 时,EF 附近的能级是部分充满的,只有在这个区 域的电子可以自由移动、参加电极反应。
•通常将 EF 看 作是反应电子的 平均能级;也是 金属中自由电子 的能级;也是自 由电子在金属中 的电化学位。
T 0K T 0K
EF
3、 溶 液 中 的 电 子 能 级 分 布
平衡电位时:
还原反应电子跃迁速度
五、平衡电位下和电极极化时的电子跃迁
• 平衡电位时:
j
j
j0
•电极极化时
EF发生变化
EF0
(O
/
R
不变
)
j j
jc
j
j
ja j j
五、平衡电位下和电极极化时的电子跃迁
• 电极电位影响反应活化能和反应速度的实质 电极极化 EF 移动 电子发生隧道跃迁的条件变化 电子达到激发态所需的能量变化 电子转移步骤的活化能变化 电极反应速度变化
• 前述中,假设电极电位的改变只引起紧密层电
位差发生变化。认为分散层中电位差的变化为
零。
( 1)
• 在稀溶液中、零电荷电位附近和有表面活性剂 吸附时, 1 电位及其变化对电化学反应速度影 响很大,称为 1 效应。
§6.5 双电层结构对电化学反应速度的影响
一、双电层结构对电化学反应速度影响的机理 二、考虑了 1 效应的基本动力学公式 三、 1电位对不同电化学反应的影响
O粒子基态 电子能级
R粒子基态 电子能级
充满
费米能级 F(E)=0.5
价电子的能 级分布函数
3、溶液中的电子能级分布
•
溶液中标准O/R体系的费米能级定义为
E0 F(O/ R)
第六章 电子转移步骤动力学

平衡电极电位是热力学参数,可用于判断电极反 应进行的方向、可能性及反应进行的程度。
能斯特方程的推导
当
平 ,电极反应处于平衡状态
v j
w j
j0
v FKcO
exp
d
(2)零电荷电位下, Ag+的位能曲线
电极电位下的位能曲线 位能
w 当电极/溶液界面存在界 G
面电场时,电极绝对电
位为△﹥0时下的位能 曲线如右图
w G0
Ag
FM F
Ag+…
1
vv
Ag+
G G0 F
ww
G G0 F
1、交换电流密度的影响因素
j0
v FKcO
exp
F平
RT
w FKcR
exp
F平
RT
(1)电极体系的影响
kv、kw
v G0
w G0 j0
都是取决于电极反应本性的。
这表明,交换电流密度的大小与电极反应性质有密
切的关系。
包括两种因素:电极反应、电极材料
值越小,反应就越容易进行;
可逆性就大;
极化就小。
j 0与电极体系的动力学性质
动力学 性质
j0→0
j0小
j0大
j0→∞
极化性 能
可逆性
理想极化 易极化
难极化
理想不极 化
完全不可 逆
可逆性小
第6章 电荷传递动力学

1a——Ag+ 自晶格中逸出时的位能变化 1b——Ag+脱离水溶液时的位能变化
用外电流将电极电位改变Dj
阳极化
假设yl电位没有变化
4
Ag+自水溶液逸出 时的势能变化
改变电极电势后 Ag+在两相转移时 势能的变化情况
附加的银势能 的变化
第六章_电子转移步骤动力学

氧化态 还原态
一、电极电位对电子转移步骤活化能的影响(7) • 由图可见:
r r0 ∆G = ∆G + αF∆φ s s0 ∆G = ∆G − β F∆φ
(6.2)
还原反应活化能增加
(6.3)
氧化反应活化能减少
一、电极电位对电子转移步骤活化能的影响(8) 小结: 有界面电场时,反应粒子达到活化态需要多作 功 δ nF ∆ φ 。还原反应 δ = α 氧化反应 δ = β 用零标电位表示电极电位对活化能的影响:
• 用电流密度表示的还原反应和氧化反应速度
j = nFv
还原反 应速度 氧化反 应速度
(4.3)
v v ∗ v ∆G j = F k c O exp( − ) RT w w ∗ w ∆G j = F k c R exp( − ) RT
(6.12)
(6.13)
1、电子转移步骤基本动力学公式推导(2)
0.1mol / LAgNO 3
4、注意
•
w v j 、j 同一电极上微观氧化反应速度和还
原反应速度。
w v • 稳态时电极上净反应速度为 j 、j 之差。
• 电极上净反应速度为外电流。 • 区别电化学体系中的阴极和阳极。它们 是宏观上发生还原反应和氧化反应的电
w v 极,它们均存在各自的 j 、j 。
已知
(6.32)
(6.33)
二、交换电流密度与电极反应的动力学特性
v w 4、根据 j 、j 求电极反应的净反应速度 j净
v w j净 = j − j
αF βF j净 = j exp(− ∆ϕ ) − exp( ∆ϕ ) RT RT
0
(6.34)
j 0 大,反应易进行,可逆性大,电极不易极化。 j 0 小,反应不易进行,可逆性小,电极易极化。
电化学原理简答题

第三章电极/溶液界面的结构与性质1.为什么电毛细曲线是具有极大值的抛物线形状?溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。
2.标准氢电极的表面剩余电荷是否为零?不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\偶极子双电层\金属表面电位。
3.影响双电层结构的主要因素是什么?为什么?静电作用和热运动。
静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。
4.什么叫Ψ1电位?能否说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关? Ψ1电位的符号是否总是与双电层总电位的符号一致?为什么?距离电极表面d处的电位叫Ψ1电位。
不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。
当发生超载吸附时Ψ1电位的符号与双电层总电位的符号不一致。
5.简要概括电极/溶液界面发展的四个阶段、优缺点及其主要内容。
①亥姆赫兹紧密双电层模型:主要内容:将双电层比作是平行板电容器优点:a能够解释界面张力随电极电位变化b能够解释微分电容曲线上所出现的平台区域缺点:a解释不了界面电容随电极电位和溶液总浓度的变化规律b解释不了在稀溶液中,零电荷电位下微分电容最小等实验事实②Gouy和Chapman分散层模型:主要内容:溶液中的离子在静电作用和热运动作用下,按位能场中粒子的波尔兹曼分配律分布,完全忽略紧密层,只考虑分散层。
优点:a能较好解释微分电容最小值的出现b能较好解释电容随电极电位的变化规律缺点:a理论计算微分电容值与实验事实相差太大b解释不了微分电容曲线上的“平台区”的出现③Stern模型(双电层静电模型):主要内容:双电层由紧密层和分散层两部分组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
, Ag
O
*
R*
A
G 0
O
d
x
界面电场对活化能的影响
G G nF
0
G
0
G
0
G
G
G G nF
0
1
传递系数
d
F
x
F
F
x
二. 电极电位对电化学反应速度的影响
设:电化学反应步骤为控制步骤,此时
c c
s i
0 i
0
混合控制下的极化曲线
AB段:
i
电 为主 id
1 id 2
扩散控制
ic 0.1id
D
C
BC段: ic 0.1 ~ 0.9id
两种因素同时存在 CD段: i 0.9i c d 浓 为主
0
A
1
2
B
* 1
2
三. 电化学极化规律与浓差极化规律的比较
动力学性质
极化规律
浓差极化
代入,得:
G 0 nF nF i nF kcO exp nF KcO exp RT RT
其中:
nF i nF KcR exp RT
G 0 K k exp RT
体 系 能 量
G G
始态
终态 反应途径
一. 电极反应的位能图
以单电子反应
Ag e
Ag 为例,
做如下假设: 反应在紧密层进行 ; Ag 将反应看作 在界面的转移 ; 无特性吸附 ; 反应离子浓度足够大。
OO: 脱水化膜自
溶液逸出时的位能 变化; , RR :Ag 自晶格中逸 出的位能变化; G 0 Ag RAO: 在相间转 移的位能曲线; R
1
得:
F F i净=i i i0 exp exp RT RT
3.用 i 描述电化学过程进行的难易程度
0
在一定的过电位 下:
i大 i小
0
0
i净大 i净小
电极反应易进行 电极反应难进行
定义:电极过程恢复平衡态的能力或去极 化作用的能力为电极反应过程的可逆性。
log i
平
log i o log i 0
2.3RT 斜率= nF
logi
log i
电极电位对电极反应绝对速度的影响
第二节 电子转移步骤的基本动力学参数 一.电极过程的传递系数 、 物理意义:表示电极电位对还原反应和氧 化反应活化能影响的程度。
G G nF
0
G G nF
2.3RT a log i 0 F
2.3RT b F
四. 低过电位下的电化学极化规律
当 很小时,B-V方程按级数展开,并略 去高次项,得:
F F i i 1 1 RT RT
0
∵ 1
F 0 RT i 或 0 i ∴ i Fi RT
0
注:单电子转移步骤中 0.5 所以又 称为对称系数。
二.交换电流密度
物理意义:平衡电位下氧化反应和还原反 应的绝对速度。
nF平 0 i nF KcO exp i RT
nF平 i nF KcR exp i0 RT
由于单电子反应 1
∴
RT K RT cO 平= ln ln F F cR K
2. 用 i 表示电化学反应速度
F i i exp RT 且 F 0 i i exp RT
0
0
由:
0.5
id i log i
i i log d id
电化学极化
a b log i i
无影响
存在 1 效应 影响显著 正比于电极真实 面积
搅拌的影响
双电层结构 的影响 电极材料及 表面状态 电极真实面 积的影响
id i 搅拌速度
无影响 无影响 与表观面积称正比,与 真实面积无关
影响 i 大小的因素
0
与反应速度常数有关
与电极材料有关 与反应物质浓度有关 与温度有关
电化学反应动力学特性与 i 的关系
0
1.描述平衡状态下的动力学特征
i i i
0
nF 平 F 平 F KcO exp RT F Kc R exp RT
三.(标准)电极反应速度常数 K
K 的导出:
由
0,
RT cO 知: 平= ln nF c R
0,
当 cO c R时, 平= 0, 在平衡电位 下:
F 0 , F 0 . F KcO exp F Kc R exp RT RT
G 0 K k exp RT
令:
i 0 nF K cO i 0 nF K c R
则:
nF i i exp RT nF 0 i i exp RT
0
将上式取对数整理后:
2.3RT 2.3RT 0 log i log i nF nF 2.3RT 2.3RT 0 log i log i nF nF
第六章 电子转移步骤动力学
重点要求
稳态电化学极化规律 电子转移步骤的基本动力学参数及其稳 态测量原理 双电层结构对电子转移步骤的影响 电化学极化与浓差极化共存时的动力学 规律
第一节 电极电位对电化学步骤反应速度的影响
位能图:表示金 属离子处在金属/ 溶液界面不同位 置时,位能高低 的一种示意图。 活化能:活化态 与离子平均能量 之差
∵ cO c R
F F 0, 0. 令:K K exp K exp RT RT
K的物理意义:标准电极电位和反应物
浓度为单位浓度时的电极反应绝对速度。
K 的应用: 以 K 代替 i 0描述动力学特征,将不包含浓 度 c i的影响:
六. 用稳态极化曲线法测量动力学参数 c
log j
log jc
0
log j
log ja
a
log j 0
log j
具体求法:
~ log i 两线交 Tafel区外推得 ~ log i 、 0 点即 log i ; (=0) 外推到 平 处,与 x 轴交点 0 log i 为 ,从而可求 i 0 ; 2.3RT Tafel区斜率 tg b nF ;
传质处于准平衡态
G 由化学动力学知: v kc exp RT
根据Frarday定律 得:
G i nF kcO exp RT
G i nF kcR exp RT
将
G G 0 nF
G G 0 nF
0
cO
s
∴
i ic 1 i d
F 0 i exp RT
或
ic RT id c ln 0 ln i i i F F d c RT
二.电极极化特点的分析
ic id : 0 由上式知 ,几乎不发生极化。
=i
二.电化学极化公式
1. 公式的导出
i i控=i净
稳态时:
i净=i i
F F exp ∴ i=i i i0 exp RT RT
巴特勒-伏尔摩方程
阴极反应速度:
F F ic=i i i0 exp c exp c RT RT
忽略B-V方程右边后一指数项: F ic i0 exp
RT 2.3RT 2.3RT 0 log i log ic 取对数: F F
与经验公式的比较
对阴极反应:
2.3RT a log i 0 F
2.3RT b F
对阳极反应:
阳极反应速度:
F F ia=i i i0 exp a exp a RT RT
电化学极化曲线 c
j
ja
j
j0
j0
jc
a
三. 高过电位下的电化学极化规律
当 很大时:
F F exp c exp c RT RT
稳态时
s s c c F F 0 R i i i i O exp exp s 0 RT cR RT cO
阴极极化时:
F ic i i s exp cO RT i s 0 ∵ c c 1 i d
线性区斜率
2.3RT 1 0 nF i
第四节 电化学极化与浓差极化共存时的规律
一. 稳态极化的动力学规律 特点:电极表面附近液层浓度梯度不可忽 略 c s c 0。
F 0 i i s exp cO RT
s cO
s F c 0 R i i s exp cR RT
与经验公式的比较
对比公式
i
可得:
RT 1 0 nF i
定义极化电阻:
