片剂中抗坏血酸(Vc)含量的测定(直接碘量法)
直接碘量法测定药片中维生素C的含量

直接碘量法测定药片中维生素C的含量11化学曾凯平11218022一实验目的1.掌握碘标准溶液的配制注意事项。
2. 通过维生素C的测定了解直接碘量法的过程。
二实验原理维生素C又叫抗坏血酸,分子式C6H4O6。
由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,其反应式为:碱性条件下可使反应向右进行完全,但因维生素C还原性很强,在碱性溶液中尤其易被空气氧化,在酸性介质中较为稳定,故反应应在稀酸(如稀乙酸、稀硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直接称取,需采用间接配制法;通常用基准As2O3对I2溶液进行标定。
As2O3不溶于水,溶于NaOH:As2O3+6NaOH═2Na3AsO3+3H2O由于滴定不能在强碱性溶液中进行,需加H2SO4中和过量的NaOH,并加入NaHCO3使溶液的pH=8。
I2与亚砷酸之间的反应为:AsO32-+I2+H2O═AsO43-+2I-+2H+三器皿和试剂酸式滴定管;NaHCO3、KI、I2(以上为AR),As2O3(于105 C 干燥至恒重),6mol·L-1NaOH,0.5mol·L-1H2SO4,10%HAc,1%淀粉溶液,维生素C片剂。
四实验步骤1. 0.1mol·L-1I2标准溶液的配制称取10.8gKI,溶于10mL蒸馏水中,再用表面皿称取I2约6.5g,溶于上述KI溶液,加1滴浓盐酸,加水稀释至300mL,摇匀,用玻璃漏斗过滤,贮存于棕色试剂瓶中并置于暗处。
2.0.1mol·L-1I2标准溶液的标定准确称取基准As2O30.15g,加6mol·L-1NaOH溶液10mL,微热使溶解,加水20mL,加甲基橙指示剂1滴,加0.5mol·L-1H2SO4试液至溶液由黄色变为粉红,再加NaHCO32g、水30mL、淀粉指示剂2mL,用碘标准溶液滴定至蓝色,半分钟内不褪色,计算I2的浓度。
抗坏血酸药品中维生素C含量的测定(碘量法)

抗坏血酸药品中维生素C 含量的测定一、实验目的1.掌握碘标准溶液的配制注意事项;2.通过维生素C 的测定了解直接碘量法和间接碘量法的过程;3.掌握碘量法测定抗坏血酸药品中维生素C 含量的原理和方法。
二、实验用品 1.仪器全自动分析天平;台秤;碘量瓶;玻璃棒;洗瓶;试剂瓶;烧杯;酸式滴定管;量筒;胶头滴管;容量瓶;移液管;洗耳球。
2.试剂分析纯O H O S 23225Na ⋅,分析纯2I ;7221-r mol 017.0O C K L ⋅标准溶液;)s (KI 、KI 溶液100-1L g ⋅,使用前配制;淀粉指示剂1-g 5L ⋅;)(s a 32CO N ;l HC 溶液1-mol 6L ⋅;败坏血酸片。
三、实验原理抗坏血酸又名维生素C ,分子式686O H C 。
由于分子中的烯二醇基具有还原性,能被2I 定量地氧化成二酮基,其反应式为:碱性条件下可使反应向右进行完全,但因维生素C 还原性很强,在碱性溶液中尤其易被空气氧化,在酸性介质中较为稳定,故反应应在稀酸(如稀乙酸、稀硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸后,立即用碘标准溶液进行滴定。
根据滴定消耗的2I 标准溶液的体积,便可计算出抗坏血酸药品中维生素C 的含量。
计算公式:%100m %100m m 68622⨯=⨯=药品药品维生素O H C I I C M V C W2I 标准溶液的配制和标定:由于通常使用的市售2I 试剂纯度不高,故需先配成近似浓度,然后在进行标定。
2I 微溶于水而易溶于KI 溶液中,但在稀的KI 溶液中溶解得很慢,故配制2I 溶液时应先在较浓的KI 溶液中进行,待溶解完全后再稀释到所需浓度。
2I 溶液可以用32s O A 为基准物对I 2溶液进行标定,但32s O A (俗称砒霜)有剧毒,故用322a O S N 标准溶液进行标定。
322a O S N 标准溶液的配制和标定:固体试剂O H O S N 23225a ⋅通常含有一些杂质,且易风化和潮解,因此,322a O S N 标准溶液采用标定法配制。
碘量法测维生素C含量

I2 溶液的标定用Na2S2O3标准溶液: 基本反应式:2S2O32-+I2=S4O62-+2I-
I2溶液(0.05mol/L): Na2S2O3标准溶液(0.01mol/L) 淀粉溶液(2g/L) HAc(1+1) 固体Vc样品(维生素片剂) 重铬酸钾(A.R) KI溶液(约200g/L)
维生素C含量的测定:
Na2S2O3标准溶液浓度:
实验序号 记录项目 M药片质量/g V消耗I2体积/ml ω维C含量/% ω维C平均含量/% 1 2
I2标准溶液的浓度:
3
1. 配制I2标准溶液时,为什么要加过量KI?可否 将称得的I2和KI一起加水至一定体积? 2 .溶解样品时,为什么要用新煮沸并冷却的蒸馏 水? 3.加醋酸的目的是什么?
碱性条件下可使反应向右进行完全,但因维生素 C还原性很强,在碱性溶液中尤其易被空气氧化, 在酸性介质中较为稳定,但是在强酸性溶液中I也易被氧化。 故反应应在稀酸(pH为3—4)(如稀乙酸、稀 硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸 后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直 接称取,需采用间接配制法;用Na2S2O3标准溶 液标定I2 溶液。 标定Na2S2O3溶液: 6I-+Cr2O72-+14H+=2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I- n(K2C2O7): 6n(Na2S2O3)=1:6
I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶 解得很慢,所以配制I2溶液时不能过早加水稀释,应 先将I2和KI混合,用少量水充分研磨,溶解完全后 再加水稀释。 I与KI间存在如下平衡:I2+I- =I3- 游离I2容易挥发损失,这是影响碘溶液稳定性的原因 之一。因此溶液中应维持适当过量的I-离子 ,以减 少I2的挥发。空气能氧化I-离子,引起I2浓度增加: 4 I-+O2+4H+ =2I2+2H2O 此氧化作用缓慢,但能为光,热,及酸的作用而加 速,因此I2溶液应处于棕色瓶中置冷暗处保存。I2能 缓慢腐蚀橡胶和其他有机物,所以I应避免与这类物 质接触。
实训x:直接碘量法测定维生素C片的含量

实训x :直接碘量法测定维生素C 片的含量一、目的要求:通过实训掌握直接碘量法测定Vc 片含量的原理及其操作。
熟悉片剂通过滴定分析测定含量时的处理方法。
二、原理:维生素C(C 6H 8O 6),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因此当滴定到溶液出现蓝色时即为终点。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
该反应产物HI 为酸性,醋酸酸性条件下不利于反应向右进行,但由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
三、操作步骤:直接碘量法:取本品10片,精密称定,研细,精密称取适量(约相当于维生素C0.2g ),置100ml 锥形瓶中,加新沸过的冷水100ml 与稀醋酸10ml 的混合液适量,振摇使维生素C溶解并稀释至刻度,迅速滤过,精密量取续滤液50ml ,加淀粉指示液1ml ,立即用碘滴定液(0.05mol ·L -1)滴定,至溶液显蓝色并持续30秒钟不褪。
每1ml 碘 滴定液(0.05mol ·L -1)相当于8.806mg 的C 6H 8C 6。
平行测定3份,计算含量。
四、计算:维生素C 含量以标示量来计算,按下式计算: F (I 2)×V (I 2)×T (C 6H 8O 6)×W 平%(C 6H 8O 6)=—————————————————×100% m ×规格F-----滴定液浓度有效因数V-----供试品消耗碘滴定液的体积 T-----滴定度W 平-----平均片重g m------供试品取用量g 五、注意点:1、在稀醋酸酸性介质中,维生素C 受空气中氧的氧化速度减慢,但供试品溶于稀醋酸后仍应立即进行滴定。
2、溶剂使用新沸过的冷水以减少水中溶解氧对测定的影响。
维生素C的含量测定(直接碘量法)
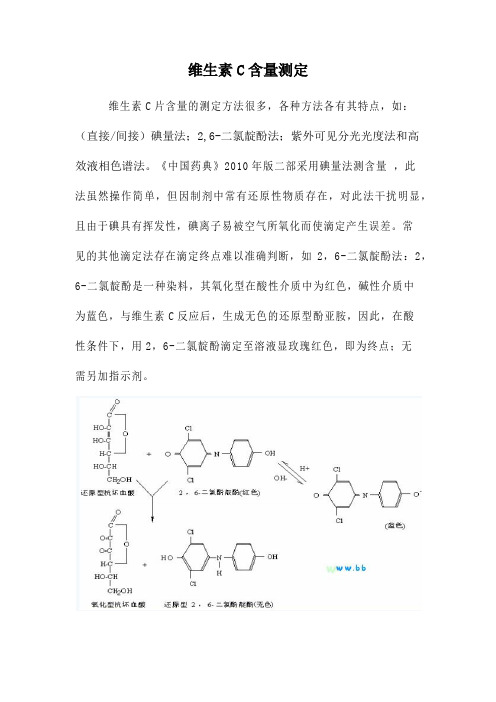
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。
维生素C药片中Vc含量的测定

维生素C 药片中含量的测定(碘量法)一、实验目的1、 掌握直接碘量法测定的原理及其操作。
2、 掌握碘标准溶液的配制及标定。
3、 掌握维生素C 的测定方法。
二、实验原理 (一)碘量法碘量法是以I 2的氧化性和I -的还原性为基础的滴定分析方法。
在一定条件下,用碘离子来还原,定量的析出碘单质,然后用2S 2O 3 标准溶液来滴定析出的I 2。
这种方法叫做间接碘量法。
本实验采用间接碘量法测碘的浓度。
以淀粉为指示剂,2S 2O 3 标准溶液来滴定析出的I 2,以蓝色消失为终点,即可算出碘的浓度。
维生素C 又称抗坏血酸,分子式C 6H 8O 6。
具有还原性,可被I 2定量氧化,因而可用I 2标准溶液直接测定。
其滴定反应式:(二)碘溶液的配制与标定OHOOHO CH OH CH 2OH +I 2OOOO C H OH CH 2OH +2HIHOAcI 2微溶于水而易溶于溶液,但在稀的溶液中溶解得很慢,所以配制I 2溶液时不能过早加水稀释,应先将I 2和混合,用少量水充分研磨,溶解完全后再加水稀释。
I 2 溶液的标定可以用2O 3或2S 2O 3标定,因为2O 3是剧毒物质,我们用2S 2O 3来标定。
(三)硫代硫酸钠溶液的配制与标定2S 2O 3一般含有少量杂质,在9-10间稳定,所以在2S 2O 3溶液中加入少量的23,2S 2O 3见光易分解可用棕色瓶储于暗处,经一周后,用K 2C 2O 7做基准物间接碘量法标定2S 2O 3溶液的浓度。
根据K 2C 2O 7标准溶液的物质的量浓度和滴定消耗的体积,就可计算出溶液中2S 2O 3的浓度。
其过程为:K 2C 2O 7与先反应析出I 2:析出的I 2再用标准的2S 2O 3溶液滴定:从而求得2S 2O 3的浓度。
这个标定2S 2O 3的方法为间接碘量法。
碘量法的基本反应式:2S 2O 32-+I 24O 62-+2I - 标定2S 2O 3溶液时有:6I -+2O 72-+14H +=23++3I 2+7H 2O 2S 2O 32-+I 24O 62-+2I -2S 2O 3标定时有(K 2C 2O 7): n(2S 2O 3)=1:6三、实验药品及仪器 实验药品和试剂:I 2分析纯 溶液100g ·1 2S 2O 3·5H 2O 溶液 0.01701K 2C 2O 7溶液 淀粉指示剂5 g ·1 23 固体 溶液 6 1 冰醋酸 维生素C 药片 主要仪器:分析天平、天平、量筒、烧杯、酸式碱式滴定管、表面皿、容量瓶(250)、锥形瓶(250)、碘量瓶(250)、移液管(25)、洗瓶等常规分析仪器 四、实验步骤(一)、2S 2O 3 溶液的配制及标定1、配制0.10 2S 2O 3溶液500 称取132S 2O 3·5H 2O ,溶于500新煮沸的蒸馏水中,加入0.123,保存于棕色瓶中,放置一周后进行标定。
vc片中维生素c的测定

VC片中维生素C的测定1. 引言维生素C,也称为抗坏血酸,是一种重要的水溶性维生素。
它在人体内具有许多重要的功能,包括抗氧化、参与胶原蛋白合成和免疫调节等。
准确测定VC片中维生素C的含量对于保证产品质量和满足消费者需求至关重要。
本文将介绍一种常用的方法——碘滴定法来测定VC片中维生素C的含量。
该方法基于VC与碘溶液反应生成碘化物的化学反应,通过测定反应前后溶液中未反应的碘量来计算VC含量。
2. 实验步骤2.1 材料准备•VC片样品•碘标准溶液•淀粉指示剂•硫酸•蒸馏水•称量瓶、容量瓶、烧杯等实验器具2.2 碘滴定法测定步骤步骤1:制备标准曲线1.准备一系列不同浓度的VC标准溶液。
2.取一定体积的VC标准溶液,加入烧杯中。
3.加入适量的碘标准溶液,使反应完全。
4.加入淀粉指示剂,继续滴定至溶液呈现蓝黑色。
5.记录滴定所需的碘标准溶液体积。
步骤2:测定样品1.取一定质量的VC片样品,加入称量瓶中。
2.加入适量蒸馏水,使VC片完全溶解。
3.加入硫酸,使样品酸化。
4.将样品转移至容量瓶中,并用蒸馏水稀释到刻度线处。
5.取一定体积的稀释后的样品溶液,加入烧杯中。
6.加入适量的碘标准溶液,使反应完全。
7.加入淀粉指示剂,继续滴定至溶液呈现蓝黑色。
8.记录滴定所需的碘标准溶液体积。
3. 数据处理与结果分析3.1 标准曲线绘制根据步骤2中制备的标准曲线数据(VC标准溶液浓度与滴定所需的碘标准溶液体积),绘制标准曲线图。
横坐标为VC标准溶液浓度,纵坐标为滴定所需的碘标准溶液体积。
3.2 样品测定结果计算根据步骤2中测定样品时记录的滴定所需的碘标准溶液体积,结合标准曲线,计算出样品中维生素C的含量。
3.3 结果分析将样品测定结果与产品规格要求进行比较,评估样品是否符合要求。
如果样品中维生素C的含量低于规定范围,则可能需要调整生产工艺或增加添加量。
4. 实验注意事项1.实验过程中应注意安全操作,避免接触皮肤和吸入有害气体。
直接碘量法测定维生素c含量

直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。
碘量法测定维生素C片剂的含量

碘量法测定维生素C片剂的含量方法概要碘量法是利用的I2氧化性和I-的还原性为基础的一种氧化还原方法。
基本半反应:I2 + 2e = 2 I-I2的S 小:20 ℃为1.33×10-3mol/L而I2 (水合) + I-=I3-(配位离子) K = 710过量I-存在时半反应。
适用pH : 2 ~ 9:淀粉指示剂在弱酸介质中最灵敏,PH〉9时,I2易发生歧化反应,生成IO、IO3,而IO、IO3不与淀粉发生显色反应,当PH〈2时,淀粉易水解成糊精,糊精遇I2显红色,该显色反应可逆性差。
淀粉指示剂最好在用前配制,不宜久存,若在淀粉指示剂中加入少量碘化汞或氯化锌,甘油、甲酰胺等防腐剂,可延长贮存时间。
配制时将淀粉混悬液煮至半透明,且加热时间不宜过长,并应迅速冷却至室温。
实验原理用I2标准溶液可以直接测定维生素C等一些还原性的物质。
维生素C分子中含有还原性的二烯醇基,能被I2定量氧化成二酮基,反应式如下由于反应速率较快,可以直接用I2标准溶液滴定。
通过消耗I2溶液的体积及其浓度即可计算试样中维生素C的含量。
直接碘量法可测定药片中维生素C的含量等物质的量关系:n(Vc)==n(I2)仪器和试剂(1)仪器分析天平,250ml锥形瓶,100ml量筒,10ml量筒,酸式滴定管,滴定支管架,25ml移液管。
(2)试剂医药维生素C药片,HAc(2 mol/L),淀粉(0.5%),Na2S2O3标准溶液(0.1 mol/L),I2标准溶液(0.1 mol/L)。
实验步骤1.0.05 mol·L-1 I2标准溶液的配制与标定将3.3g I2与5g KI置于研钵中,在通风柜中加入少量水(切不可多加!)研磨,待I2全部溶解后,将溶液转入棕色瓶中,加水稀释至250mL,摇匀。
用移液管移取25.00mL Na2S2O3标准溶液于250mL锥形瓶中,加50mL水、5mL0.5%淀粉溶液,用I2标准溶液滴定至稳定的蓝色,30s内不褪色即为终点。
直接碘量法测定维生素C含量

一.实验目的1.掌握碘标准溶液的配制和标定方法;2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g -。
Vc 具有还原性,可被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
三.主要试剂1.2I 溶液(约1L •0.05mol -):称取3.3g 2I 和5g KI ,置于研钵中,加少量水,在通风橱中研磨。
待2I 全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL ,充分摇匀,放阴暗处保存。
2.322O S Na 标准溶液(1L •0.1127mol -)3.HAc (1L •2mol -)4.淀粉溶液5.维生素C 片剂6.KI 溶液四.实验步骤1.2I 溶液的标定用移液管移取20.00mL 322O S Na 标准溶液于250mL 锥形瓶中,加40mL 蒸馏水,4mL 淀粉溶液,然后用2I 溶液滴定至溶液呈浅蓝色,30s 内不褪色即为终点。
平行标定3份,计算12L •)/m ol (I -c 。
2.维生素C 片剂中Vc 含量的测定准确称取2片维生素C 药片,置于250mL 锥形瓶中,加入100mL 新煮沸过并冷却的蒸馏水,10mLHAc 溶液和5mL 淀粉溶液,立即用2I 标准溶液滴定至出现稳定的浅蓝色,且在30s 内不褪色即为终点,记下消耗的)/m L (I 2V 。
平行滴定3份,计算试样中的Vc 的质量分数。
五.数据记录与处理1.I 溶液的标定2.维生素C 片剂中Vc 含量的测定六.实验总结 标定得)L •04825(mol .0)(I 12-=c ,测得%52.84)Vc (=ω。
维生素C药片中Vc含量的测定(碘量法)

1、配制2mol/L醋酸溶液。量取6mL冰醋酸稀释至50mL
2、维生素C的提取。取10片药剂,准确称量其质量。研成细粉末并混均匀,准确称取粉末约0.6g(三份)。置于锥形瓶中,操作一定要快,加50mL蒸馏水稀释,马上进行下一步滴定。(若颜色太深可加蒸馏水稀释)
3、维生素C的测定。向锥形瓶中加入10mL2mol/LHAc溶液,2mL淀粉溶液,立即用标准碘液(酸式滴定管)进行滴定至溶液刚好呈现蓝色,30s内不褪色即为终点.记下体积,平行滴定三次,,计算Vc的含量。
C% %
M(药片)=176.13g/mol
六、注意事项
1、实验中所用指示剂为淀粉溶液。I2与淀粉形成蓝色的加合物,灵敏度很高。温度升高,灵敏度反而下降。淀粉指示剂要在接近终点时加入。
2、用心煮沸并冷却的蒸馏水:否则Na2S2O3因氧气和二氧化碳和微生物的作用而分解,使滴定时消耗Na2S2O3溶液的体积偏大。
2
3
V(I2) / mL
V(Na2S2O3) 初读数/ mL
V(Na2S2O3) 终读数/ mL
V(Na2S2O3) / mL
c (I2)=0.5×C(Na2S2O3)×25.00/V(I2)
表三:维生素C药片Vc含量的测定
1
2
3
m(药片)/ g
V(I2) 初读数/ mL
V(I2) 终读数/ mL
V(I2) / mL
Na2S2O3标定时有:n(K2C2O7): n(Na2S2O3)=1:6
三、实验药品及仪器
实验药品和试剂:
I2分析纯KI溶液100g·L-1Na2S2O3·5H2O溶液0.0170mol.L-1K2C2O7溶液淀粉指示剂5 g·L-1Na2CO3固体 HCl溶液 6mol.L-1冰醋酸维生素C药片
实训项目-碘量法测定维生素C的含量

实训项目十五碘量法测定维生素C的含量
一、实训目标
1.掌握碘标准溶液的配制和标定方法;
2.学会正确判断淀粉指示剂的滴定终点;
3.了解直接碘量法测定维生素C的原理和方法。
三、实训仪器和试剂
1.仪器棕色滴定管(25mL)、锥形瓶(250mL)、移液管(25mL)、量筒、研钵。
2.试剂0.05mol·L-1I2标准溶液、淀粉溶液、2mol·L-1HAc、固体维生素C样品。
四、实训步骤
1.实训内容
I2标准溶液的配制与标定、维生素C的含量测定及结果计算。
1
M=176.12g• mol-1。
注:
维生素
C
五、实训提示
1.在配制I2标准溶液时,将I2加入浓KI溶液后,必须搅拌至I2完全溶解后,才能加水稀释。
若过早稀释,碘极难完全溶解。
2.碘有腐蚀性,应在干净的表面皿上称取,避免碰到皮肤。
3.维生素C溶解后,易被空气氧化而引入误差。
所以应称取1份滴定1份,不要3份同时称取。
六、实训思考
1.溶解样品时为什么要用新煮沸并冷却的纯化水?
2.加醋酸的目的是什么?
(冯伟)
2。
片剂中抗坏血酸(Vc)含量的测定(直接碘量法)

西北大学基础化学实验
wVc =
四、有关常数
M K 2Cr2O 7 = 294.18 g·mol-1
MVc = 176.12 g·mol-1
西北大学基础化学实验
五、注意事项
1. 终点变色都很敏锐,小心滴过量。 2. 用K2Cr2O7标定Na2S2O3时,用H2O冲洗 表面皿且用H2O稀释后,慢摇快滴至黄绿 色。 3. 称量Vc时,注意勿将Vc从称量瓶口撒 出,慢盖瓶盖。
西北大学基础化学实验
二、实验步骤
1. Na2S2O3溶液的标定:移取25.00 mL K2Cr2O7于锥形瓶中, 加入5 mL (1+1) HCl、5 mL 200g ·L-1 KI,盖上表面皿于暗 处反应5分钟后,用水冲洗表面皿,加入60~80 mL H2O稀 释。立即用Na2S2O3滴定至黄绿色,加入2 mL淀粉溶液, 继续用Na2S2O3滴定至亮绿色即为终点。(平行三份) 2. I2溶液的标定:移取25.00 mL Na2S2O3于锥形瓶中,加入 50 mL H2O、2 mL淀粉溶液,用I2溶液滴定至稳定的蓝色 即为终点。(平行三份) 3. 片剂中Vc含量的测定:减量法准确称取Vc 粉末0.2~0.3 g 于锥形瓶中,用100 mL H2O、10 mL HAc溶解后,加入2 mL淀粉溶液,用I2溶液滴定至稳定的蓝色即为终点。(平 行两份)
西北大学基础化学实验
西北大学基础化学实验
三、结果表示
用片剂中Vc的质量百分含量(Vc%)表示,保留四位 有效数字。 计算公式:
mK 2Cr2O7 × 3 × 2 × 1000 M K 2Cr2O7 × 4 × V Na 2S2O3
维生素C药片中Vc含量的测定(碘量法)

七、思考题
1、 测定维生素C的溶液中为什么要加稀HAC?
2、 溶样时为什么要用新煮过的并冷却的蒸馏水?
3、 为减少误差一次溶解三片好,还是滴定完后在溶解下一片好?
八、参考文献
1、 《分析化学实验》 第三版 华中师范大学、东北师范大学、陕西师范大学、北京师范大学编,高等教育出版社,2001。
2、 《碘量法测维生素C含量》 豆丁网。
主要仪器:
分析天平、天平、量筒、烧杯、酸式碱式滴定管、表面皿、容量瓶(250mL)、锥形瓶(250mL)、碘量瓶(250mL)、移液管(25mL)、洗瓶等常规分析仪器
四、实验步骤
(一)、Na2S2O3溶液的配制及标定
1、配制0.10mol/LNa2S2O3溶液500mL 称取13gNa2S2O3·5H2O,溶于500mL新煮沸的蒸馏水中,加入0.1gNa2CO3,保存于棕色瓶中,放置一周后进行标定。
(二)、标准碘溶液的配制及标定
1、配制0.050mol/LI2溶液300 mL 称取4.0gI2放入小烧杯中,放入8gKI,加水少许,用玻璃棒搅拌至I2全部溶解后,转入500 mL烧杯,加水稀释至300mL。摇匀,贮存于棕色瓶。
2、I2溶液的标定 用移液管取25.00mLI2溶液置于250mL锥形瓶中,加50mL水,用Na2S2O3标准溶液滴定至溶液呈浅黄色时,加入2 mL淀粉指示剂,继续用Na2S2O标准溶液滴定至蓝色恰好消失,即为终点。平行滴定三次,计算标准溶液浓度。
碘量法测VC

直接碘量法测VC一.实验目的1.掌握碘标准溶液的配制和标定方法;2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g 。
Vc 具有还原性,可被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
使用淀粉作为指示剂,用直接碘量法可测定水果中维生素C 的含量。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下: 2S 2O 32-+I 2 = S 4O 62-+2I-器材和药品1.器材 天平(0.1mg ),碱式滴定管(50 mL)、酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
从此以下未整理2.药品 果汁、K 2Cr 2O 7(基准试剂),Na 2S 2O 3(0.02mol·L-1),I 2(0.01 mol·L-1),KI (20%)、HCl,(6mol·L-1),HAc (2mol·L-1),淀粉指示剂(0.5%)。
Na2CO3固体 以上试剂未说明均为分析纯,水为蒸馏水所需试剂的用量及配制方法:1、 0.1 mol·L-1Na 2S 2O 3标准溶液的配制称取25g Na 2S 2O 3·5H 2O ,溶于1000mL 新煮沸并冷却的蒸馏水中,加入0.2gNa2CO3使溶液呈碱性,以防止Na 2S 2O 3的分解,保存于棕色瓶中,放置10天后过滤,再标定.放置长时间后,再用前应重新标定。
2、K 2Cr 2O 7标准溶液的配制准确称取基准试剂K 2Cr2O 7 0.26—0.28g 于小烧杯中,加入少量蒸馏水溶解后,移入200ml 容量瓶中,用蒸馏水稀释至刻度,摇匀.3、0.1 mol·L-1Na2S2O3标准溶液的标定用移液管吸取上述标准溶液20. 00ml 于250ml 碘瓶中,加8ml 6 mol·L HCl,5-8ml 20%KI 溶液,盖上表面皿,在暗处放5分钟后,加100ml 水,立即以用待标定的Na2S2O3溶液滴定至淡黄色,再加入2ml 0.5%淀粉溶液, 继续滴至溶液呈亮绿色为终点.平行滴定3次。
维生素C片中抗坏血酸的测定

2.2Na2S2O3标准溶液的标定
Na2S2O3·5H2O容易风化,潮解,因此不能直接配制标准浓度的溶液,只能用间接法配制,为了获得浓度较稳定的标准Na2S2O3溶液,配制时,必须用新煮沸并冷却的蒸馏水,以抑制蒸馏水中CO2。微生物与Na2S2O3作用而分解,同时蒸馏水必须保持微碱性,防止Na2S2O3在酸性溶液中分解。
准确量取一定体积的溶液,加入一定量的粉指示剂,立即用已标定的I2溶液进行滴定,直至溶液由无色变为蓝色,并且持续30s内不褪色即为终点。该反应的化学方程式如下:
C6H8O6+I2===C6H6O6+2HI
2.4 计算公式
根据以下公式计算结果:
根据所求得的维生素C的量,即可计算出药品中维生素C的相对含量:
经过查阅资料,将六种测定维生素C片中抗坏血酸的含量的方法介绍如下:
方法一:碘量法
维生素C为一酸性己糖内酯,有L,D型异构体,易溶于水或酒精,又称抗坏血酸Vc,分子式是C6H8O6。维生素C分子中的烯二醇具有很强的还原性,能被I2定量地氧化成二酮基。在空气中极易被氧化,尤其在碱性介质中更甚,而在酸性条件下较为稳定。因此在测定时加HAc溶液使溶液呈弱碱性,减少维生素C的副反应。因而可用直接用I2标准溶液测定。
维生素C具有很强的还原性。它可分为还原型和脱氢型(氧化型)。根据它具有的还原性质可测定其含量。[1]
近年来已报道的测定维生素C的含量的方法众多,遗憾的是一般的方法灵敏度低、仪器复杂、操作烦琐。据查资料得知现在普遍采用光度法、荧光法、色谱法、电化学分析法等实验方法,实验结果比较准确。但考虑到本分析化学之课程要求,又鉴于本实验条件,仍然采用直接碘量法这一经典的测定方法。[2]
设计性实验方案:碘量法测定维生素C片的含量

碘量法测定维生素C片的含量一.实验原理维生素C具有抗坏血酸的效应,是强还原性物质,利用I2的氧化性,用淀粉作指示剂,采用I2作标准溶液进行直接滴定,其滴定原理:抗坏血酸分子中的二烯醇基可被I2氧化成二酮基,当抗坏血酸分子中的二烯醇基被I2完全氧化后,则I2与淀粉指示剂作用,使溶液变蓝,所以当滴定到溶液出现蓝色时为终点[1]。
其滴定反应式为C6H8O6+I2=C6H6O6+2HI由于Vc的还原性很强,较易被溶液和空气中的氧气氧化,在碱性介质中这种氧化作用更强,因此,滴定宜在酸性介质中进行,以减少副反应的发生,考虑到I-在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
二.实验方法1.仪器与试剂仪器:烧杯(250ml),酸式滴定管(25ml),碘量瓶(100ml)3个,移液管(1ml),量杯(10ml),万分之一天平,移液管(50ml)试剂:维生素C片剂、稀醋酸(10ml)、新沸过的冷水(100ml)、淀粉指示液:取可溶性淀粉0.5g,加水5ml搅拌后,缓缓倾入100ml沸水中,随加随搅拌,继续煮沸2分钟,放冷,倾取上层清液,即得。
本液应临用新制。
碘滴定液(0.05mol/L):I2=253.81 12.69g→1000ml[配置]取碘13.0g,加碘化钾36g与水50ml溶解后,加盐酸3滴与水适量使成1000ml摇匀,用垂熔玻璃滤器滤过。
[标定] 精密量取本液25ml,置碘瓶中,加水100ml与盐酸溶液(9→100)1ml,轻摇混匀,用硫代硫酸钠滴定液(0.1mol/L)滴定至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失。
根据硫代硫酸钠滴定液(0.1mol/L)的消耗量,算出本液的浓度,即得。
2.含量测定取本品20片,精密称定,研细,精密称取适量(约相当于维生素C 0.2g),置100ml量瓶中,加新沸过的冷水100ml与稀醋酸10ml的混合液适量,振摇使维生素C溶解并稀释至刻度,摇匀,迅速过滤,精密量取续滤液50ml,加淀粉指示液1ml,立即用碘滴定液C(0.05mol/lL)滴定,至溶液显蓝色并持续30秒钟不褪色,每1ml碘滴定液(0.05mol/L)相当于8.806mg 的C6H806。
vc片中维生素c的测定

VC片中维生素C的测定1. 引言维生素C,也称为抗坏血酸,是一种重要的水溶性维生素。
它在人体内具有多种生理功能,包括抗氧化、免疫调节和胶原蛋白合成等。
因此,准确测定VC片中维生素C的含量对于保证产品质量以及人体健康具有重要意义。
本文将介绍一种常用的方法——碘滴定法来测定VC片中维生素C的含量。
该方法简单、快速且准确度较高,在实际应用中被广泛采用。
2. 实验原理碘滴定法是通过VC片中的维生素C与标准碘溶液反应来测定其含量。
具体原理如下:1.维生素C在酸性条件下可以被氧化成二价离子态。
2.碘溶液(I2)可以与二价离子态的维生素C发生反应生成双碘化物离子(I3-)。
3.双碘化物离子与淀粉试剂反应生成蓝紫色络合物。
4.反应过程中,维生素C与碘溶液的摩尔比为1:1,因此可以通过滴定过程中消耗的碘溶液体积来确定维生素C的含量。
3. 实验步骤3.1 准备工作•将所需试剂(包括标准碘溶液、硫酸、淀粉试剂等)准备好,并按照实验室安全规范操作。
•使用天平称取一定质量的VC片样品。
3.2 碘滴定法测定VC片中维生素C的含量1.将称取好的VC片样品放入锥形瓶中,加入适量硫酸溶液使其完全溶解。
2.在反应瓶中加入适量蒸馏水稀释样品,使其成为合适浓度。
3.加入几滴淀粉试剂,使其呈现蓝紫色。
4.使用标准碘溶液进行滴定。
开始滴定时,刚开始出现蓝紫色络合物,然后随着滴定过程逐渐变为无色。
5.记录标准碘溶液滴定的体积(V1)。
4. 数据处理与结果分析4.1 数据处理1.计算标准碘溶液的浓度(C2):根据标准碘溶液的质量和体积,计算其浓度。
2.计算维生素C样品中维生素C的质量(m):m = C2 * V1。
3.根据样品中维生素C的质量和样品质量,计算维生素C的含量。
4.2 结果分析通过上述实验步骤和数据处理,我们可以得到VC片中维生素C的含量。
根据实验结果,我们可以评估VC片产品的质量,并与标准值进行比较。
5. 实验注意事项•在操作过程中要注意安全,避免接触到有毒试剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西北大学基础化学实验
二、实验步骤
1. Na2S2O3溶液的标定:移取25.00 mL K2Cr2O7于锥形瓶中, 加入5 mL (1+1) HCl、5 mL 200g ·L-1 KI,盖上表面皿于暗 处反应5分钟后,用水冲洗表面皿,加入60~80 mL H2O稀 释。立即用Na2S2O3滴定至黄绿色,加入2 mL淀粉溶液, 继续用Na2S2O3滴定至亮绿色即为终点。(平行三份) 2. I2溶液的标定:移取25.00 mL Na2S2O3于锥形瓶中,加入 50 mL H2O、2 mL淀粉溶液,用I2溶液滴定至稳定的蓝色 即为终点。(平行三份) 3. 片剂中Vc含量的测定:减量法准确称取Vc 粉末0.2~0.3 g 于锥形瓶中,用100 mL H2O、10 mL HAc溶解后,加入2 mL淀粉溶液,用I2溶液滴定至稳定的蓝色即为终点。(平 行两份)
西北大学基础化学实验
西北大学基础化学实验
三、结果表示
用片剂中Vc的质量百分含量(Vc%)表示,保留四位 有效数字。 计算公式:
mK 2Cr2O7 × 3 × 2 × 1000 M K 2Cr2O7 × 4 × V Na 2S2O3
c Na 2S2O3 =
c I2
c Na 2S2O3 × 25.00 = 2 ×V I2
c I 2 × VI 2 × M Vc 1000 × ms × 100%
西北大学基础化学实验
wVcБайду номын сангаас=
四、有关常数
M K 2Cr2O 7 = 294.18 g·mol-1
MVc = 176.12 g·mol-1
西北大学基础化学实验
五、注意事项
1. 终点变色都很敏锐,小心滴过量。 2. 用K2Cr2O7标定Na2S2O3时,用H2O冲洗 表面皿且用H2O稀释后,慢摇快滴至黄绿 色。 3. 称量Vc时,注意勿将Vc从称量瓶口撒 出,慢盖瓶盖。
片剂中抗坏血酸(Vc)含量的测定 含量的测定 片剂中抗坏血酸 (直接碘量法 直接碘量法) 直接碘量法
西北大学基础化学实验
一、主要试剂 二、实验步骤 三、结果表示 四、有关常数 五、注意事项
西北大学基础化学实验
一、主要试剂
1. 0.05 mol·L-1 I2溶液:3.3 g I2 + 5 g KI研磨后, 用H2O溶解→ 250 mL。 2. 0.1 mol·L-1 Na2S2O3溶液:7.5 g Na2S2O3·5H2O溶于水 →300 mL。 3. K2Cr2O7标准溶液:减量法准确称取K2CrO7 0.45~0.55 g,溶于水后转入100 mL容量瓶中 定容。
