有机化学课 图文课件ppt第3章
合集下载
有机化学课件(药学专业)-第三章

顺、反命名法
命名原则:两个相同的原子或原子团处于 键 或脂环平面同侧的异构体称为顺式,处于异侧称为反 式。 a b e e 反 顺 C C C C 式 b 式 b a b
H3C C H C H CH3
H3C C Br C
Cl Br
顺–2–丁烯
顺-1-氯-1,2-二溴丙烯
课堂练习: 命名
H C H3C C CH2
(一)卤代反应
α-H的反应机理
α-H的反应的副反应
为了减少该副反应的发生,更好的得到取代反应 产物,应该在低浓度的氯(溴)的存在下反应。
NBS 溴代(自由基取代)
七、聚合反应
第四节
烯烃的制备
生物活性:不相同
问题:下列化合物是否存在顺反异构?
CH3 C=C H Cl H C2H5 D C=C CH3 H
CH2-CH-CH3 CH-CH3
三、命名法 (一)普通命名法 (二)系统命名法
1. 直链烯烃的命名
1) 选主链(含双键、最长碳链) 1 2 3 CH3-CH=C-CH2CH2CH2CH3 2) 编号(双键优先) 3) 命名(标明双键位置)
(1) O3
CH3 CH3 C O + C O CH3 (2)Zn+H2O CH3CH2
用途:根据臭氧化物还原水解的产物来推断烯烃 的结构;用于从烯烃制备某些醛或酮。
(三)环氧化反应
环氧化反应是立体专一性的顺式加成反应,生成 的环氧化物仍保持原来烯烃的构型。
H3C H CH3 H RCOOOH H3C CH3 H C C H O
2、溴鎓离子机理
Step1: H H
C C
H C C
H
+ Br-Br
有机化学课件 第三章 烯烃3
应经历溴 离子、反式加成。 • 反应经历溴鎓离子、反式加成。
Br H C C CH3 H H3C H C Br
+
H3C C C
H
H C
Br2
CH3
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
CH3 CH3 C CH=CH2 CH3 CH3 CH3 C CH CH3 + CH3 H3C Cl CH3 C CH CH3 Cl CH3 83%
HCl
17%
反应经历碳正离子中间体。 反应经历碳正离子中间体。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。
试比较下列分子或离子的超共轭效应大小。 [讨论] (1) 试比较下列分子或离子的超共轭效应大小。 讨论]
1) CH3CH=CH2 CH3CH2CH=CH2 (CH3)2CHCH=CH2 A B C 2) (CH3)3C (CH3)2CH CH3CH2 CH3 A B C D
+ + + +
(2) 试静态分析烯烃双键碳原子上电子云密度的大小。 试静态分析烯烃双键碳原子上电子云密度的大小。
碳正离子稳定性次序: 碳正离子稳定性次序: 3o C+ > 2o C+ > 1oC+ >CH3+
G
C
+
G
C
+
给电子基,使正电荷分散,碳正离子稳定: 给电子基,使正电荷分散,碳正离子稳定: 吸电子基,使正电荷更集中 碳正离子不稳定 碳正离子不稳定; 吸电子基,使正电荷更集中,碳正离子不稳定;
有机化学ppt课件第三章

共性:同烷烃相似,光照或加热下发生自由基取代反应。 (难氧化)
特性: 小环的开环加成
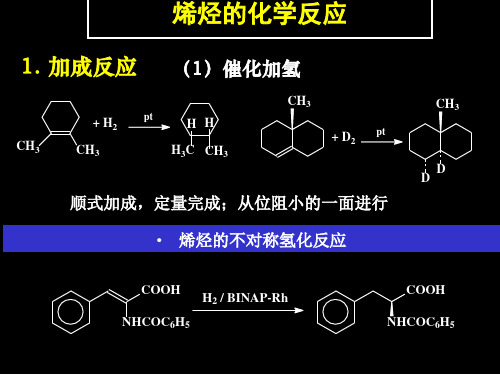
(1)加氢:
+H2
Ni 400C,常压
CH3CH2CH3
+H2
Ni
1000C,常压 CH3CH2CH2CH3
+H2
Pt 3000C,常压
C H3 C H2 C H2 C H2 C H3
精选课件ppt
9
(2)加溴
+Br2 室温 +Br2 光照
(3)环丙烷衍生物开环位置:取代最多的C与取代最少 的C之间; 加成位置:符合马氏规则。
eg.
Br2
+HBr
CH3
(CH3)2CCHCH2Br Br CH3
(C H3)2C C H C H3
Br
马氏规则:H加成到含H较多的C上,X加成到含H较少的C上。
精选课件ppt
11
3.3 环烷烃的来源和用途
3.4 环的张力
1.环丙烷及环丁烷的结构
2.拜尔张力学说(A.von Baeyer, stain theory) 3.环烷烃的燃烧热 4.张力能
环
产 Enb 非键性相互作用:非键合的两原子或原子团距
生
离小于其范氏半径之和(强烈排斥)
张 力
El 键长变化:两成键原子间距离偏离正常键长;
的 Eθ 键角变化:键角偏离平衡值
BrCH2 CH2 CH2 Br Br
+Br2
光照 或3000C
Br
(3)加溴化氢
+HBr +HBr +HBr
CH3CH2CH2Br
不反应 不反应
精选课件ppt
10
有机化学课件(李景宁主编)第3章-单烯烃
总目录
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
1. 构造异构(constitutional isomerism)
构造异构——分子式相同,原子或基团在分子 中连接次序不同。
碳干异构:
位置异构:(官能团变位)
CH3 CH2 CH CH2
CH3 CH2 CH CH2
CH3 C CH2 CH3
CH3 CH CH CH3
a > b;c > d
a > b,c > d
优先基团同侧-(Z) 优先基团异侧-(E)
总目录
Cl >H,Br >CH3 (E)-
I >CH3,Br >H (Z)-
(E)
(Z)
总目录
(E)-2,2,4-三甲基-3-己烯 (E)-2,2,4-trimethyl-3-hexene
(E)-3,4-二甲基-2-戊烯 顺-3,4-二甲基-2-戊烯 (E)-3,4-dimethyl-2-pentene
因为内能:烯烃 > 烷烃,所以氢化反应放热
总目录
烯烃
氢化热 kJ.mol-1
137.2 125.1 126.8 119.7
115.1
总目录
烯烃
氢化热 kJ.mol-1
126.8
119.2
112.5
111.3
总目录
(1)稳定性:反式 > 顺式 (2)C=C连接的烷基越多越稳定 • 稳定性:
• R2C=CR2 > R2C=CHR > RCH=CHR ≈ R2C=CH2 > RCH=CH2 > CH2=CH2
总目录
注意:
• 顺、反与Z、E是两种不同的表示烯烃几 何构型的方法,在大多数情况下,不存 在对应关系。即顺式不一定是Z构型,而 反式不一定是E构型。例如:
【有机化学】第三章立体结构化学【课件PPT】

H
D
(2) 构型的确定 一对对映体的两个结构互为镜象,确定哪个 为右旋、哪个为左旋,不能由分子的结构式确 定,只能由旋光仪来确定
(3) 构型的标记 标记——根据分子中各基团的空间排列 按一定原则进行标记
D/ L法:
将手性分子与一对对映体甘油醛进行比较,与D-甘油 醛构型相似称为D-型,L-甘油醛构型相似则称为L-型。
例
手性碳
C
【练习】
请指出下列分子中的手性碳原子
CH3CH2-OH
3 2* 1 CHC3HC3H-C(OHH-C)COOOOHH
OH
判断下列化合物是否有手性碳? 是否是手性分子?
有两个手性碳却不是手性分子!
含一个手性碳原子的分子一定是个手性分子。 含多个手性碳原子的分子不一定是个手性分子. 不能仅从分子中有无手性原子来判断其是否为手性分子
存在一对对映异构体
例如:乳酸 CH3C*H( OH )COOH
右旋
[α
15
]D =
2.6。
m.p 53
左旋
[α
15
]D =
2.6。
m.p 53
外消旋体 [ α
15
]D =
0
m.p 18
反应停(thalidomide)事件
O
O
O
N
N H OO
(S)-thalidomide
N
O
N OO H
(R)-thalidomide
GC用手性柱
HPLC用手性柱
9、环状化合物的立体异构
环烷烃在结构上与烯烃双键相似,成环σ键不能 自由绕键轴旋转,当环上有两个或更多的取代基时, 就会有顺反异构产生;若环上有手性碳原子时,还会 产生对映异构体。
D
(2) 构型的确定 一对对映体的两个结构互为镜象,确定哪个 为右旋、哪个为左旋,不能由分子的结构式确 定,只能由旋光仪来确定
(3) 构型的标记 标记——根据分子中各基团的空间排列 按一定原则进行标记
D/ L法:
将手性分子与一对对映体甘油醛进行比较,与D-甘油 醛构型相似称为D-型,L-甘油醛构型相似则称为L-型。
例
手性碳
C
【练习】
请指出下列分子中的手性碳原子
CH3CH2-OH
3 2* 1 CHC3HC3H-C(OHH-C)COOOOHH
OH
判断下列化合物是否有手性碳? 是否是手性分子?
有两个手性碳却不是手性分子!
含一个手性碳原子的分子一定是个手性分子。 含多个手性碳原子的分子不一定是个手性分子. 不能仅从分子中有无手性原子来判断其是否为手性分子
存在一对对映异构体
例如:乳酸 CH3C*H( OH )COOH
右旋
[α
15
]D =
2.6。
m.p 53
左旋
[α
15
]D =
2.6。
m.p 53
外消旋体 [ α
15
]D =
0
m.p 18
反应停(thalidomide)事件
O
O
O
N
N H OO
(S)-thalidomide
N
O
N OO H
(R)-thalidomide
GC用手性柱
HPLC用手性柱
9、环状化合物的立体异构
环烷烃在结构上与烯烃双键相似,成环σ键不能 自由绕键轴旋转,当环上有两个或更多的取代基时, 就会有顺反异构产生;若环上有手性碳原子时,还会 产生对映异构体。
高二有机化学(选修):第三章第二节《醛》PPT课件

【巩固练习】
B 4.关于乙醛的下列反应中,乙醛被还原的是( )
A.乙醛的银镜反应 B.乙醛制乙醇 C.乙醛与新制氢氧化铜的反应 D.乙醛的燃烧反应
【巩固练习】
D 5.下列物质中不能发生银镜反应的是( )
A. B.CH3CHO C.葡萄糖 D.
【巩固练习】
6.橙花醛是一种香料,其结构简式为
(CH3)2C=CHCH2CH2C(CH3) =CHCHO
1、与银氨溶液反应
C2H5CHO + 2Ag(NH3)2OH △ C2H5COONH4 + 3NH3 + 2Ag↓+ H2O
2、与新制氢氧化铜悬浊液反应
C2H5CHO + 2Cu(OH)2 + NaOH △ Cu2O↓ + 3H2O
C2H5COONa +
3、与氢气反应 催化剂
C2H5CHO + H2
1mol–CHO被氧化,就应有2molAg被还原
2、化学性质
④注意事项 (1)试管内壁必须洁净; (2)银氨溶液要现配现用; (3)碱性环境,水浴加热; (4)加热过程中不能摇动试管; (5)用稀HNO3清洗试管内壁的银镜。
2、化学性质
(ⅱ)与新制Cu(OH)2悬浊液反应
①新制Cu(OH)2悬浊液的配制 在试管里加入10%的NaOH溶液2mL,滴入2%的 CuSO4溶液4~6滴。
╳ ╳ 不能写成-COH 或-CH=O
肉桂醛
CH=CH—CHO 苯甲醛
CHO
醛 由烃基跟醛基相连而构成的化合物
1、分子结构
结构 决定 性质
根据乙醛的结构,预测乙醛的性质
H HC
O 不饱和
CH
H
有机化学第三章共56页

在含双键主链的编号遵守 “双键的位次尽可 能小 ”的原则外,若有选择时,编号由Z型双键开 始(Z优先于E):
1
23
7
65
4
4
56 7
32 1
Chapter 3
2. 含 C=N 双键化合物的顺反异构 有机化合物亚胺、肟、腙,羰基缩氨基脲等
3. 含 N=N 双键化合物的顺反异构 偶氮化合物,N上两个基团在π键同侧的为Z式:
H Cl
Me Et (III)
Cl H
Et Me (IV)
mirror
对映体的特点:
除了对偏振光振动平面的旋转方向不同外,对映体的 其他物理性质是相同的;
除了对旋光性的试剂作用不同外,对映体的其他化学 性质是相同的;
三、手性的生物学重要性
全部在研药物的66%是有手性的,其中51%是 单一对映异构体药物。 2019年,全球销售的4750亿美元药品中, 2050亿美元的制剂是单一对映异构体药物。 Chapter 3
(I)
(II)
Chapter 3
F
手性碳标记
H C* Cl
Br
例: CH3C* HC*HCH3 Cl Cl
CH3C* HC* HCH2CH3 Cl Cl
判断分子的手性: 分子与其镜像重合称为非手性分子; 分子与其镜像不重合称为手性分子。
二、对映异构现象
对映异构体 ( enantiomers ) Chapter 3
CH2=CHCH3 和环丙烷 两个化合物。
Chapter 3
C2H6O C4H8O2
OH and CH3 O CH3
Ethanol
Methoxymethane
O
OH and
人教版高中化学选修5有机化学基础第三章第一节醇酚第1课时-PPT精选文档

新课标人教版高中化学课件系列
选修5 有机化学基础 第三章 烃的含氧衍生物
第一节 醇 酚 第1课时
2019/6/10
1
烃的含氧衍生物
据我国《周礼》记载,早在周朝就有酿酒 和制醋作坊,可见人类制造和使用有机物有很 长的历史。
从结构上看,酒、醋、苹果酸、柠檬酸等 有机物,可以看作是烃分子里的氢原子被含有 氧原子的原子团取代而衍生成的,它们被称为 烃的含氧衍生物。
分子式 C2H6O
结构式
HH H—C—C—O—H
HH
结构简式
CH3CH2OH 或C2H5OH
官能团
—OH (羟基)
2019/6/10
17
乙醇
3. 乙醇的物理性质 1)无色、透明、有特殊香味的液体; 2)沸点78℃; 3)易挥发; 4)密度比水小; 5)能跟水以任意比互溶; 6)能溶解多种无机物和有机物。
建议(3):采用远程滴加乙醇的方法向反应釜内加入 乙醇,并设置放气管,排放乙醇与金属钠 反应产生的氢气和热量。
处理反应釜中金属钠的最安全、合理的方法是
第(3)种方案,向反应釜中慢慢加入乙醇,由于
乙醇与金属钠的反应比水与钠的反应缓和,热效应
11
醇
表3-1图 沸点/℃
醇的沸点远 高于烷烃。
100 醇
●
●
●
50
0 30
-50 烷
-100 ●
40 50 ●60相对分子质量
●
结论: 相对分子质量相近的醇和烷烃,醇的沸点远远
高于烷烃
2019/6/10
12
醇
醇分子间形成氢键示意图:
R
R
R
O HH
O H
O
O
H
选修5 有机化学基础 第三章 烃的含氧衍生物
第一节 醇 酚 第1课时
2019/6/10
1
烃的含氧衍生物
据我国《周礼》记载,早在周朝就有酿酒 和制醋作坊,可见人类制造和使用有机物有很 长的历史。
从结构上看,酒、醋、苹果酸、柠檬酸等 有机物,可以看作是烃分子里的氢原子被含有 氧原子的原子团取代而衍生成的,它们被称为 烃的含氧衍生物。
分子式 C2H6O
结构式
HH H—C—C—O—H
HH
结构简式
CH3CH2OH 或C2H5OH
官能团
—OH (羟基)
2019/6/10
17
乙醇
3. 乙醇的物理性质 1)无色、透明、有特殊香味的液体; 2)沸点78℃; 3)易挥发; 4)密度比水小; 5)能跟水以任意比互溶; 6)能溶解多种无机物和有机物。
建议(3):采用远程滴加乙醇的方法向反应釜内加入 乙醇,并设置放气管,排放乙醇与金属钠 反应产生的氢气和热量。
处理反应釜中金属钠的最安全、合理的方法是
第(3)种方案,向反应釜中慢慢加入乙醇,由于
乙醇与金属钠的反应比水与钠的反应缓和,热效应
11
醇
表3-1图 沸点/℃
醇的沸点远 高于烷烃。
100 醇
●
●
●
50
0 30
-50 烷
-100 ●
40 50 ●60相对分子质量
●
结论: 相对分子质量相近的醇和烷烃,醇的沸点远远
高于烷烃
2019/6/10
12
醇
醇分子间形成氢键示意图:
R
R
R
O HH
O H
O
O
H
有机化学课件第三章

Lindlar催化剂 炔烃比烯烃更容易进行催化氢化
CH3 CH3 Pd-CaCO3 H2C CHC CHCH2CH2OH HC C C CHCH2CH2OH + H2 喹啉 80%
选择性 还原
C2H5C CC2H5 + H2 P-2 催化剂
C2H5 C C H 97%
C2H5 H
CH3CH2C C(CH2)3CH3
H
+
C
第二步
C
+
HA
C
C
+
H
A
碳正离子中间体
H
+
C C
H
A C C
+
A
+
C
C A
碳正离子的结构
稳定性
+ C
sp2
平面型,
sp3
角椎型
炔烃加成反应历程
C
C
+
HA H
C
C
+
+A
乙烯形 C+,sp杂化
C H
C+ຫໍສະໝຸດ +AHC
C A
a.卤化氢
CH2 CH2 + HCl AlCl3 130~250 C CH3 CH2Cl
Na, 液NH3, -78 C
o
H
(CH2)3CH3 C C H 97%~99%
CH3CH2
(2) 氢化热与烯烃的稳定性
烯烃 CH2 CH2 氢化热 / kJ· mol-1 137.2 125.9 126.8 118.8 112.5 111.3 119.7 115.5
结论: 反式异构体的稳定性较高 双键碳原子连接烷基数目越多, 烯烃越稳定
《有机化学第三章》PPT课件

2.催化剂的分类 ①异相催化剂:催化剂不溶于有机溶剂,如: Pt黑,Ni粉 ②均相催化剂:催化剂溶于有机溶剂,如: 三苯基膦与氯化铑的络合物
3.氢化热
亲电-加--成-由反亲响电试剂的进攻引起的加成反 响
亲电试剂----具有亲电性能的试剂
烯烃双键具有供电子的性质!
烯烃与卤素的加成反响过程中,发生了 共价键的异裂而形成离子,它是离子型的亲 电加成反响.
H2 CH2 CBr+ Nhomakorabea Br--
H2 C
Cl-
溴翁离子
马氏规那么
一、烯烃的亲电加成反响历程 〔一〕酸性试剂HZ的加成 1.机理:
HCl的加成反响历程
(甲基〔或烷基〕是排斥电子的基团)
CH3 C
H
CH3 C
H
CH3 C
H
H
C CH3
顺-2-丁烯
反-2-丁烯
3.3 physical properties of alkenes
在室温〔25℃〕和0.1MPa压力 下: 2-4 个碳原子的是气体;
5-18 个碳原子的是液体; 十八 个碳原子以上的是蜡状固体
直链烯烃的沸点比带有支链的异构体的略高 一些。
500-600
℃
CH2
CH
CH2
自由基取代反响反响历程:
Cl 自由基取代反响
Cl—Cl 2Cl*
Cl*+H-CH3-CH=CH2*CH2-CH3-CH=CH
*CH2-CH3-CH=CH2+Cl2 Cl-CH2-CH=C
• N- 溴 代 丁 二 酰 亚 胺 〔NBS=Nbromosuccinimide〕 是 一 个 可 以 专 一 性地在烯烃a-氢上加以溴化的试剂,在 有机合成上非常有用,反响经过一个自 由基过程。
3.氢化热
亲电-加--成-由反亲响电试剂的进攻引起的加成反 响
亲电试剂----具有亲电性能的试剂
烯烃双键具有供电子的性质!
烯烃与卤素的加成反响过程中,发生了 共价键的异裂而形成离子,它是离子型的亲 电加成反响.
H2 CH2 CBr+ Nhomakorabea Br--
H2 C
Cl-
溴翁离子
马氏规那么
一、烯烃的亲电加成反响历程 〔一〕酸性试剂HZ的加成 1.机理:
HCl的加成反响历程
(甲基〔或烷基〕是排斥电子的基团)
CH3 C
H
CH3 C
H
CH3 C
H
H
C CH3
顺-2-丁烯
反-2-丁烯
3.3 physical properties of alkenes
在室温〔25℃〕和0.1MPa压力 下: 2-4 个碳原子的是气体;
5-18 个碳原子的是液体; 十八 个碳原子以上的是蜡状固体
直链烯烃的沸点比带有支链的异构体的略高 一些。
500-600
℃
CH2
CH
CH2
自由基取代反响反响历程:
Cl 自由基取代反响
Cl—Cl 2Cl*
Cl*+H-CH3-CH=CH2*CH2-CH3-CH=CH
*CH2-CH3-CH=CH2+Cl2 Cl-CH2-CH=C
• N- 溴 代 丁 二 酰 亚 胺 〔NBS=Nbromosuccinimide〕 是 一 个 可 以 专 一 性地在烯烃a-氢上加以溴化的试剂,在 有机合成上非常有用,反响经过一个自 由基过程。
人教版化学选修五第三章-第四节-有机合成优秀课件PPT

4)还原反应:有机物加氢或去氧的反应, 如:烯烃、苯、醛、油脂等与氢气的加成 反应。
5、消去反应:有机化合物在一定条件下,从一 个分子中脱去一个小分子(如H2O),而形成不饱和 化合物的反应。如乙醇的分子内脱水。
6、酯化反应:醇和含氧酸起作用,生成酯和水
的反应叫做酯化反应。 7、水解反应:如:①酯的水解反应:酯与水发
(2)有机反应的基本类型
1)取代反应:甲烷、苯、醇的卤代,苯的硝 化、磺化,醇与活泼金属反应,醇的分子间 脱水,酯化反应,酯的水解反应等。
2)加成反应:烯烃、苯、醛、油脂等分子中含有 C C或C O 可与H2、HX、X2、H2O等加成 。
3)氧化反应:有机物加氧或去氢的反应, 如:醛基的氧化、醇的催化氧化。
第三章 烃的含氧衍生物
第四节
有机合成
学习目标
1. 熟悉各类有机物的性质和 相互转化关系;
2. 初步认识逆向合成是有机合成?
以有机反应为基础的有机合成, 是有机化学的一个重要内容。它是 利用简单易得的原料,通过有机化 学反应,生成具有特定结构和功能 的有机化合物。
件!)
(2)加成反应:烯烃、
(2)炔烃一比一加
炔烃和苯等 (与卤素单质或卤化
成
氢加成)
思考与交流
3.引入羟基的方法有哪些? (1)取代反应:
①卤代烃的水解(条件!) ②酯的水解(条件!) (2)加成反应: ①烯(炔)烃与水加成 ②醛或酮与氢气加成(还原)
3、有机合成遵循的原则
1)起始原料要廉价、易得、低毒、低污 染——通常采用4个C以下的单官能团 化合物和单取代苯。
90.0%
C 85.6%
COOH
总产率= 93.0%×81.7%×90.0%×85.6%
5、消去反应:有机化合物在一定条件下,从一 个分子中脱去一个小分子(如H2O),而形成不饱和 化合物的反应。如乙醇的分子内脱水。
6、酯化反应:醇和含氧酸起作用,生成酯和水
的反应叫做酯化反应。 7、水解反应:如:①酯的水解反应:酯与水发
(2)有机反应的基本类型
1)取代反应:甲烷、苯、醇的卤代,苯的硝 化、磺化,醇与活泼金属反应,醇的分子间 脱水,酯化反应,酯的水解反应等。
2)加成反应:烯烃、苯、醛、油脂等分子中含有 C C或C O 可与H2、HX、X2、H2O等加成 。
3)氧化反应:有机物加氧或去氢的反应, 如:醛基的氧化、醇的催化氧化。
第三章 烃的含氧衍生物
第四节
有机合成
学习目标
1. 熟悉各类有机物的性质和 相互转化关系;
2. 初步认识逆向合成是有机合成?
以有机反应为基础的有机合成, 是有机化学的一个重要内容。它是 利用简单易得的原料,通过有机化 学反应,生成具有特定结构和功能 的有机化合物。
件!)
(2)加成反应:烯烃、
(2)炔烃一比一加
炔烃和苯等 (与卤素单质或卤化
成
氢加成)
思考与交流
3.引入羟基的方法有哪些? (1)取代反应:
①卤代烃的水解(条件!) ②酯的水解(条件!) (2)加成反应: ①烯(炔)烃与水加成 ②醛或酮与氢气加成(还原)
3、有机合成遵循的原则
1)起始原料要廉价、易得、低毒、低污 染——通常采用4个C以下的单官能团 化合物和单取代苯。
90.0%
C 85.6%
COOH
总产率= 93.0%×81.7%×90.0%×85.6%
清华大学有机化学李艳梅老师课件第3章ppt模板

键能键能
CH CC
C Cl C Br CI CS
H
CH3CH2CH2CH2 CH2C H
H
415KJ/mol 345.6KJ/mol
相较相对大对较大
330KJ/mol
285KJ/mol
218KJ/mol
272KJ/mol
特点2:可以反应
H
CH3 CH2 CH2 CH2 CH2 C H 裂解 H取代
IR
普通峰: C-C伸缩 1200-700(w) C-H伸缩 2960-2850(s)
特殊峰:
1380 1380 1370
1380 1370
n4 724-722 cm-1 (m)
少于四个亚甲基时,吸收峰向高波数移动
MS UV
* 真空紫外
3.4 Chemical properties
特点一:较稳定
轨道对称性匹配原理: 原子轨道重叠时,重叠部分必须有相同符号才可成 键,使能降低;符号相反则为反键,能量升高
类比:周环反应
对超共轭作用的共振解释
“试题一”的结论:相邻甲基上电子的传递作用,也就是 超共轭作用,是导致乙烷交叉式更稳定的真正、唯一原因。
Organic Chemistry (T.W.Graham Solomons, Craig B. Fryhle, (John Wiley&Sons, Inc, 2004, 8th Ed.,p156 《有机化学》(胡宏纹等,高等教育出版社,2006年第3版,p22) 周公度,《大学化学》,16(5),51-52,2001年5月
3.4.1 Oxidation 氧化反应
A. Auto oxidation 自动氧化 O2
R R CH
R
X
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
称为官能团异构。例如:
上述两个烯烃分子的碳链中双键的位置发生了改变。
3.1 烯烃的命名和异构
2. 顺反异构
在2-丁烯分子中,由于分子中碳碳双键不能自由旋转,甲基、 氢、甲基、氢四个基团在空间上会有如下两种排布方式:
这种由于烯烃分子中碳碳双键不能自由旋转而使得两个双键碳原 子所连接的原子或基团在空间的排布不同所引起的同分异构现象称为 顺反异构。
若烯烃分子中有两个或两个以上双键,且每一个双键碳 原子上都有Z或E两种构型,则需要标出所有这些双键的构型。 例如:
3.1 烯烃的命名和异构
3.1.2 烯烃的同分异构 1. 烯烃的构造异构
(1)碳链异构
在烯烃分子中由于碳骨架不同所引起的同分异构现 象称为碳链异构。例如:
3.1 烯烃的命名和异构
(2)官能团异构 在烯烃分子中由于双键位置不同所引起的同分异构现象
的结构。乙烯分子中的碳碳双键并不是由两个单键形成的,而
σ
π键构成的。现代物理方法表明乙烯
分子中所有的原子都在同一个平面上,每个碳原子和三个原子
相连,键长和键角如下:
3.2 烯烃的结构
杂化轨道理论根据这些事实,设想乙烯碳原子成键时,碳 原子是以一种原子轨道杂化方式进行杂化,即由一个s轨道和 两个p轨道进行杂化,组成三个等同的sp2杂化轨道,这三个 sp2杂化轨道的对称轴在同一个平面上,彼此成120°角。我们 把这种杂化方式称为sp2杂化。
自从1897年人们发现烯烃可以在镍的存在下氢化生 成烷烃以来,烯烃的催化氢化已经有了很大的发展,无论 在科学研究上还是在工业生产上都有着重要的应用。烯烃 的氢化是定量进行的,因此可以根据烯烃吸收氢气的体积 算出烯烃分子中双键的数目。
3.4 烯烃的化学性质
2. 亲电加成
(1)与酸的加成
强酸分子可以解离出质子(即H+是亲电试剂),可以 与烯烃进行亲电加成反应。而弱的有机羧酸,如乙酸、甲 酸、醇和水等只有在强酸(如硫酸)催化下才能与烯烃发 生亲电加成反应。其反应通式如下:
有机化学
第3章 单 烯 烃
烯烃的命名和异构 烯烃的结构
烯烃的物理性质 烯烃的化学性质 自然界中的烯烃
3.1 烯烃的命名和异构
3.1.1 烯烃的命名 1. 烯烃的系统命名
(1)选主链
选择包含双键在内的最长碳链为主链;如果有多条 链等长时,则选择含取代基最多的链为主链,根据主 链碳原子的个数(如烷烃一样)命名时称为“某烯”。 例如:
3.2 烯烃的结构
sp2杂化轨道的形状和sp3杂化轨道的形状相似,也是不对 称的葫芦形,一头大一头小,只是小的一头比sp3杂化轨道略 小,大的一头比sp3杂化轨道的一头略大。三个sp2杂化轨道的 对称轴分布在同一个平面上,并以碳原子为中心,分别指向三 角形的三个顶点,对称轴的夹角约为120°,每个碳原子剩下一 个未参与杂化的2p轨道,仍保持原来的形状,其对称轴垂直于 三个sp2杂化轨道的对称轴所在的平面,如图3-1所示。
并不是所有的烯烃都存在顺反异构,只有符合下述条件的烯烃才 会存在顺反异构:
①双键上的两个碳原子都连有两个不同的原子或基团; ②双键的两个碳原子上有一对或两对相同的原子或基团。
3.2 烯烃的结构
烯烃分子中存在碳碳双键,这是与烷烃分子在结构上最大
的差别,因此研究烯烃的结构主要就是研究双键的结构。烯烃
中最简单的分子就是乙烯,我们可以通过乙烯来了解烯烃双键
3.1 烯烃的命名和异构
(2)给主链碳原子编号
从靠近双键的一端起开始给主链碳原子编号, 并尽可能地给双键以最小的编号。例如:
3.1 烯烃的命名和异构
(3)标位次
标出双键碳原子中位次较小的一个,书写时放在母体 烯烃名称的前面。需要注意的是,1-烯烃中的“1”往 往省去,所以单烯烃的名称前面没有数字表明其为“1
3.3 烯烃的物理性质
表3-1 一些常见烯烃的物理常数
3.3 烯烃的物理性质
续表
3.4 烯烃的化学性质
3.4.1 烯烃的加成反应
1. 催化Leabharlann 化在催化剂的存在下,烯烃与氢气作用生成烷烃的反应 称为催化氢化。这个反应常用的催化剂有铂黑、钯粉、 Raney Ni等。乙烯与氢气的催化氢化反应方程式如下:
图3-1 2 乙烯分子σ键和π键的形成
3.2 烯烃的结构
σ
π键组
成的。与σ键相比,π键具有以下特点:
①π键不如σ键牢固,也不能自由旋转,因为形成π键
的两个p轨道是从侧面重叠的,而不是沿着p轨道的轴向
重叠;
②π键电子云沿键轴上下分布,不集中,易极化,因
而易发生反应;
③π键不能独立存在,必须与σ键同时存在。
,其他跟烷烃的命名原则相同。例如:
3.1 烯烃的命名和异构
2. 烯烃的顺反异构命名
当双键上的每个碳原子连有两个不同的原子或基团且双 键的两个碳原子上有一对或两对相同的原子或基团时可在烯烃 名字前面加“顺”或“反”字,即为“顺反命名法”。当两个 双键碳原子上相同基团在双键的同一侧时,称为“顺式”,反之, 称为“反式”。例如:
图3-1 sp2杂化轨道的形状及 在空间的伸展方向
3.2 烯烃的结构
在乙烯分子中每个碳原子各以一个sp2杂化轨道头碰头重 叠形成一个C-Cσ键外,又各以两个sp2杂化轨道和四个氢原子 的1s轨道重叠,形成四个C-Hσ键,这样形成的五个σ键均在同 一个平面上,如图3-2所示。每个碳原子还剩有一个对称轴垂 直于这个平面的p轨道,这两个p轨道肩并肩侧面重叠,组成一 个新的轨道,称为π键。
3.3 烯烃的物理性质
烯烃的物理性质随着碳原子数的增加而递变。 在常温下,含有2~4个碳原子的烯烃是气体, 5~18个碳原子的烯烃是液体,19个碳原子以上的 为固体。它们的熔点、沸点和相对密度都随着相对 分子质量的增加而上升,但是烯烃的相对密度都小 于1,均为无色,不溶于水,易溶于有机溶剂。乙 烯略带甜味,液态烯烃有汽油的气味。常见烯烃物 理性质如表3-1所示。
3.1 烯烃的命名和异构
如果双键碳原子上所连接的四个原子或基团均不相同时, 需要采用Z/E命名法。
系统命名法中的次序规则可应用于这里来判断每个双键 碳原子上所连接的原子或基团中哪个为较优基团,若两个双键 碳原子上所连接的较优基团在双键的同一侧,则称为“Z”式, 反之则为“E”式。例如:
3.1 烯烃的命名和异构
上述两个烯烃分子的碳链中双键的位置发生了改变。
3.1 烯烃的命名和异构
2. 顺反异构
在2-丁烯分子中,由于分子中碳碳双键不能自由旋转,甲基、 氢、甲基、氢四个基团在空间上会有如下两种排布方式:
这种由于烯烃分子中碳碳双键不能自由旋转而使得两个双键碳原 子所连接的原子或基团在空间的排布不同所引起的同分异构现象称为 顺反异构。
若烯烃分子中有两个或两个以上双键,且每一个双键碳 原子上都有Z或E两种构型,则需要标出所有这些双键的构型。 例如:
3.1 烯烃的命名和异构
3.1.2 烯烃的同分异构 1. 烯烃的构造异构
(1)碳链异构
在烯烃分子中由于碳骨架不同所引起的同分异构现 象称为碳链异构。例如:
3.1 烯烃的命名和异构
(2)官能团异构 在烯烃分子中由于双键位置不同所引起的同分异构现象
的结构。乙烯分子中的碳碳双键并不是由两个单键形成的,而
σ
π键构成的。现代物理方法表明乙烯
分子中所有的原子都在同一个平面上,每个碳原子和三个原子
相连,键长和键角如下:
3.2 烯烃的结构
杂化轨道理论根据这些事实,设想乙烯碳原子成键时,碳 原子是以一种原子轨道杂化方式进行杂化,即由一个s轨道和 两个p轨道进行杂化,组成三个等同的sp2杂化轨道,这三个 sp2杂化轨道的对称轴在同一个平面上,彼此成120°角。我们 把这种杂化方式称为sp2杂化。
自从1897年人们发现烯烃可以在镍的存在下氢化生 成烷烃以来,烯烃的催化氢化已经有了很大的发展,无论 在科学研究上还是在工业生产上都有着重要的应用。烯烃 的氢化是定量进行的,因此可以根据烯烃吸收氢气的体积 算出烯烃分子中双键的数目。
3.4 烯烃的化学性质
2. 亲电加成
(1)与酸的加成
强酸分子可以解离出质子(即H+是亲电试剂),可以 与烯烃进行亲电加成反应。而弱的有机羧酸,如乙酸、甲 酸、醇和水等只有在强酸(如硫酸)催化下才能与烯烃发 生亲电加成反应。其反应通式如下:
有机化学
第3章 单 烯 烃
烯烃的命名和异构 烯烃的结构
烯烃的物理性质 烯烃的化学性质 自然界中的烯烃
3.1 烯烃的命名和异构
3.1.1 烯烃的命名 1. 烯烃的系统命名
(1)选主链
选择包含双键在内的最长碳链为主链;如果有多条 链等长时,则选择含取代基最多的链为主链,根据主 链碳原子的个数(如烷烃一样)命名时称为“某烯”。 例如:
3.2 烯烃的结构
sp2杂化轨道的形状和sp3杂化轨道的形状相似,也是不对 称的葫芦形,一头大一头小,只是小的一头比sp3杂化轨道略 小,大的一头比sp3杂化轨道的一头略大。三个sp2杂化轨道的 对称轴分布在同一个平面上,并以碳原子为中心,分别指向三 角形的三个顶点,对称轴的夹角约为120°,每个碳原子剩下一 个未参与杂化的2p轨道,仍保持原来的形状,其对称轴垂直于 三个sp2杂化轨道的对称轴所在的平面,如图3-1所示。
并不是所有的烯烃都存在顺反异构,只有符合下述条件的烯烃才 会存在顺反异构:
①双键上的两个碳原子都连有两个不同的原子或基团; ②双键的两个碳原子上有一对或两对相同的原子或基团。
3.2 烯烃的结构
烯烃分子中存在碳碳双键,这是与烷烃分子在结构上最大
的差别,因此研究烯烃的结构主要就是研究双键的结构。烯烃
中最简单的分子就是乙烯,我们可以通过乙烯来了解烯烃双键
3.1 烯烃的命名和异构
(2)给主链碳原子编号
从靠近双键的一端起开始给主链碳原子编号, 并尽可能地给双键以最小的编号。例如:
3.1 烯烃的命名和异构
(3)标位次
标出双键碳原子中位次较小的一个,书写时放在母体 烯烃名称的前面。需要注意的是,1-烯烃中的“1”往 往省去,所以单烯烃的名称前面没有数字表明其为“1
3.3 烯烃的物理性质
表3-1 一些常见烯烃的物理常数
3.3 烯烃的物理性质
续表
3.4 烯烃的化学性质
3.4.1 烯烃的加成反应
1. 催化Leabharlann 化在催化剂的存在下,烯烃与氢气作用生成烷烃的反应 称为催化氢化。这个反应常用的催化剂有铂黑、钯粉、 Raney Ni等。乙烯与氢气的催化氢化反应方程式如下:
图3-1 2 乙烯分子σ键和π键的形成
3.2 烯烃的结构
σ
π键组
成的。与σ键相比,π键具有以下特点:
①π键不如σ键牢固,也不能自由旋转,因为形成π键
的两个p轨道是从侧面重叠的,而不是沿着p轨道的轴向
重叠;
②π键电子云沿键轴上下分布,不集中,易极化,因
而易发生反应;
③π键不能独立存在,必须与σ键同时存在。
,其他跟烷烃的命名原则相同。例如:
3.1 烯烃的命名和异构
2. 烯烃的顺反异构命名
当双键上的每个碳原子连有两个不同的原子或基团且双 键的两个碳原子上有一对或两对相同的原子或基团时可在烯烃 名字前面加“顺”或“反”字,即为“顺反命名法”。当两个 双键碳原子上相同基团在双键的同一侧时,称为“顺式”,反之, 称为“反式”。例如:
图3-1 sp2杂化轨道的形状及 在空间的伸展方向
3.2 烯烃的结构
在乙烯分子中每个碳原子各以一个sp2杂化轨道头碰头重 叠形成一个C-Cσ键外,又各以两个sp2杂化轨道和四个氢原子 的1s轨道重叠,形成四个C-Hσ键,这样形成的五个σ键均在同 一个平面上,如图3-2所示。每个碳原子还剩有一个对称轴垂 直于这个平面的p轨道,这两个p轨道肩并肩侧面重叠,组成一 个新的轨道,称为π键。
3.3 烯烃的物理性质
烯烃的物理性质随着碳原子数的增加而递变。 在常温下,含有2~4个碳原子的烯烃是气体, 5~18个碳原子的烯烃是液体,19个碳原子以上的 为固体。它们的熔点、沸点和相对密度都随着相对 分子质量的增加而上升,但是烯烃的相对密度都小 于1,均为无色,不溶于水,易溶于有机溶剂。乙 烯略带甜味,液态烯烃有汽油的气味。常见烯烃物 理性质如表3-1所示。
3.1 烯烃的命名和异构
如果双键碳原子上所连接的四个原子或基团均不相同时, 需要采用Z/E命名法。
系统命名法中的次序规则可应用于这里来判断每个双键 碳原子上所连接的原子或基团中哪个为较优基团,若两个双键 碳原子上所连接的较优基团在双键的同一侧,则称为“Z”式, 反之则为“E”式。例如:
3.1 烯烃的命名和异构
