化学耗氧量的测定-重铬酸钾法
COD的测定

化学耗氧量(COD)的测定溶解氧(DO )Dissolved Oxygen 溶解于水中的分子态氧 mg/L化学需氧量(COD )Chemical Oxygen Demand 氧化水中有机物(或其它还原性物质)所需化学氧化剂的量,以氧的 mg/L 计。
1) 实验原理化学耗氧量是指天然水中可被高锰酸钾或重铬酸钾氧化的有机物的含量。
化学耗氧量测定的常用方法为高锰酸钾法、重铬酸钾和碘酸盐法。
高锰酸钾法(简记CODMn ),适用于测定一般地表水。
重铬酸钾法(简记CODCr )对有机物反应较完全,适用于分析污染较严重的水样。
本实验为高锰酸钾法,其原理如下:在酸性(或碱性)条件下,高锰酸钾具有很高的氧化性V O H Mne H MnO 51.1458224=------+==+++-θϕ水溶液中多数的有机物都可以氧化,但反应过程相当复杂,只能用下式表示其中的部分过程: 2244424245642564CO O H SO Mn SO K C SO H KMnO+++==++过量的KMnO4用过量的Na2C2O4或H2C2O4还原,再用KMnO4溶液 滴至微红色为终点,反应如下: OH CO SO Mn SO K SO Na SO H O C Na KMnO2242444242422481025852++++==++当水样中含有Cl- 量较高(大于100mg )时,会发生如下反应: 222458210162Cl O H MnClHMnO ++==+++---使结果偏高。
为了避免这一干扰,可改在碱性溶液中氧化,反应为: --++==++OH CO MnO O H C MnO 4342342224然后再将溶液调成酸性,加入Na2C2O4或H2C2O4 ,把MnO2和过量的KMnO4还原,再用KMnO4滴至微红色终点。
由上述反应可知,在碱性溶液中进行氧化,虽然生成MnO2,但最后仍被还原成Mn2+,所以酸性溶液中和碱性溶液中所得的结果是相同的。
COD的测定(高锰酸钾法和重铬酸钾法)-高锰酸钾标准溶液配制标定及注意事项

环境监测中化学需氧量(COD)的测定一、水体污染地球上大约有13.9亿立方千米的水,其中97.2%在海洋中,2.15%是冰山和冰川,人们可以利用的淡水只约占0.65%。
人类就是依靠这些水来维持生命和从事生产的。
在这些天然水中含有K+、Na+、Ca2+、Mg2+、Cl-、SO42-、HCO3-、CO32-等离子。
如果使不属于水体的物质进入水体,而且进入的数量已经达到破坏水体原有用途的程度,就叫水污染。
造成水污染的原因是多方面的。
根据污染源可分为城市生活废水污染、工业废水污染、农田流水污染(喷洒的农药、施用的化肥被雨水冲刷流入水体)、固体废物污染(工业废渣中的有毒物质,经水溶解后进入水体)及工业烟尘废气污染(烟尘废气落入水体或被雨水淋洗流入水体)等。
污染水体的物质一般可分为以下几类:1.无机污染物:包括酸、碱、无机盐等。
2.有机污染物:包括碳水化合物、脂肪、蛋白质、碳氢化合物、合成洗涤剂等。
3.有毒物质:包括重金属(铅、铬、汞、镉等)盐类、氰化物、氟化物、砷化物、酚类、多环芳烃、多氯联苯、有机农药等。
4.致病微生物:包括各种病毒、细菌、原生物等。
5.耗氧污染物:有些有机物和无机物,能消耗水中溶解的氧气,使水发黑变臭,危害水生生物的生存。
6.植物营养物质:有些物质中含有植物生长所需要的氮、磷、钾等营养元素(如含磷洗衣粉、化肥、饲料等),这些物质能促使水中藻类疯长,从而消耗水中的氧气,危害鱼类的生长,造成水质恶化。
此外,还有石油工业带来的油污染、热电厂造成的热污染、核电厂带来的放射性污染等,不仅污染水体,危及水生动物,还会危害人体健康。
二.化学需氧量(Chemical Oxygen Demand,COD)化学需氧量(COD)是水体质量的控制项目之一,它是量度水中还原性污染物的重要指标。
水中还原性物质包括有机物和亚硝酸盐、硫化物、亚铁盐等无机物。
水体中能被氧化的物质在规定条件下进行化学氧化过程中所消耗氧化剂的量,换算成以O2作为氧化剂时1L 水样所消耗O2的质量(mg/L),通常记为COD。
水质 COD的测定方法和注意事项(重铬酸盐法)
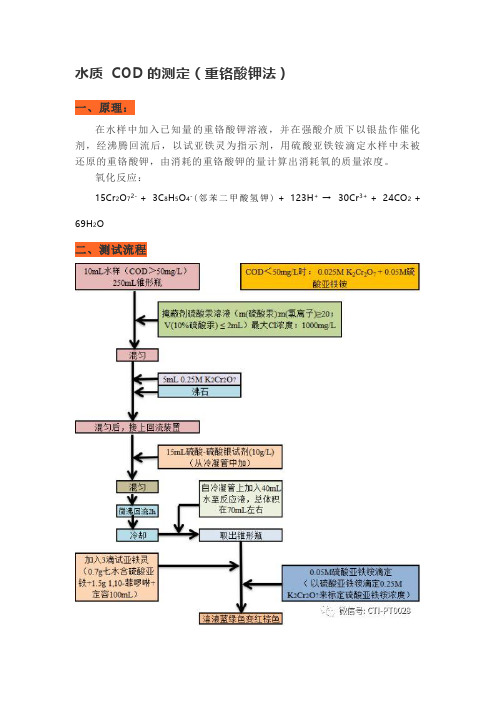
水质COD的测定(重铬酸钾法)一、原理:在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的重铬酸钾的量计算出消耗氧的质量浓度。
氧化反应:15Cr2O72- + 3C8H5O4-(邻苯二甲酸氢钾) + 123H+→30Cr3+ + 24CO2 + 69H2O二、测试流程三、注意事项:1.水样保存:应加入浓硫酸至pH<2,置于4°C下保存,保存时间不超过5d。
2.水样前处理:①氯离子浓度测试:硝酸银滴定,根据氯离子浓度,确定加入硫酸汞体积。
氯离子浓度>1000mg/L时,水样需稀释。
3.试验条件:①背景值控制:保证实验用水和试剂的纯度,实验用具使用前酸洗,锥形瓶可用马弗炉灼烧或铬酸清洗。
②加热:从沸腾开始保持2小时,但要防止爆沸(造成测试误差)。
③冷却:加热结束后,在电炉上冷却30mins,从冷凝管中加水,取下锥形瓶冷却至室温(不能有明显的温感)。
④滴定终点:当溶液的颜色先变为蓝绿色再变到红褐色即达到终点(30s内不褪色),几分钟后可能还会重现蓝绿色(指示剂暴露在空气中被氧化)。
4.影响因素:①氯离子干扰:氯离子被重铬酸钾氧化而影响测试结果。
消除方法:<1000mg/L时,用HgSO4进行掩蔽,生成[HgCl4]2- 稳定配合物。
>1000mg/L时,水样先稀释,再用HgSO4进行掩蔽。
②还原性物质干扰:硫化物、亚铁离子和亚硝酸盐等还原性物质干扰。
HJ 828-2017测试的COD不仅包含有机物耗氧量,也包含还原性无机物的耗氧量。
③催化剂:硫酸银作用是使由有机物氧化形成的有机酸(R-COOH),进一步被催化氧化形成水和CO2,即。
④氧化能力:酸性重铬酸钾溶液对于大部分有机化合物的氧化率为95-100%(反应中条件氧化还原电位E可以达到1.55V-1.42V)。
但是苯、嘧啶等结构稳定的有机物,其氧化率不到20%。
4、化学需氧量的测定

化学需氧量的测定定义:化学需氧量是指在规定的条件下,用氧化剂处理水样时,与消耗的氧化剂相当的氧的量,以氧mg/L表示。
一、重铬酸钾快速法1 主题内容与适用范围本标准规定了测定化学耗氧量的重铬酸钾快速法。
本标准适用于天然水、炉水、冷却水和除盐水等水样的化学需氧量的测定。
化学需氧量(以氧计)的测定范围为0~50mg/L,浓度大于50mg/L时应稀释后测定。
2 方法概要本方法基于在适当提高硫酸浓度的条件下,以提高重铬酸钾的氧化率和缩短回流时间,达到快速测定化学需氧量的目的。
测定中加入适量硝酸银和硝酸铋,以消除氯离子的干扰。
3 试剂3.1 硫酸银-硫酸溶液;3.2 试亚铁灵指示剂;3.3 重铬酸钾标准溶液:0.025mol/L;3.4 硫酸亚铁铵溶液:0.01mol/L;3.5 硝酸银溶液:10%(m/V);3.6 硝酸铋溶液;3.7 二次蒸馏水:为使空白试验和稀释用的水不含有机物,应以每升普通蒸馏水中加入约5mL硫酸(密度1.84g/mL)和0.2g纯高锰酸钾(使水保持紫红色),再蒸馏一次以制得二次水。
4 分析步骤4.1 用移液管吸取10.00mL水样置于回流的磨口锥形瓶中,加1mL硝酸银溶液[10%(m/V)],摇匀,再加1mL硝酸铋溶液,摇匀(当氯离子含量在500~3000mg/L时,应各加2mL)。
4.2 用移液管加入5.00mL 0.025mol/L重铬酸钾溶液,再加入几颗碎瓷块或沸石(预先用硫酸和重铬酸钾煮沸,洗净),装上球形冷凝器和通入冷却水。
4.3 从冷凝器顶端管口慢慢加入20mL硫酸银-硫酸溶液,摇匀,用电炉加热,回流10min(从沸腾算起),停止加热。
4.4 稍冷后从冷凝器顶端管口慢慢加入70mL二次蒸馏水洗涤管壁。
取下锥瓶置于冷水浴中冷却至室温。
4.5 加2滴试亚铁灵指示剂,过剩的重铬酸钾用0.01mol/L硫酸亚铁铵溶液滴定至颜色从蓝绿色变至红棕色即为终点。
4.6 另取10.00mL 二次蒸馏水按4.1~4.5条步骤进行空白试验。
实验一水样中化学耗氧量(COD)的测定(精)

实验一:水样中化学耗氧量(COD)的测定化学耗氧量(COD)是反映水质受有机物污染情况的一个重大指标,大多采用高锰酸钾煮沸消解法和重铬酸钾加热回流法进行测定。
本试验通过用酸性高锰酸钾煮沸消解法,对学校池塘内的水样进行化学耗氧量(COD)测定,首先酸性高锰酸钾和还原性物质作用,再用草酸钠还原剩余的高锰酸钾,并以返滴定法用高锰酸滴定钾草酸钠过量部分,用实际消耗高锰酸钾的量测得水样中的化学耗氧量(COD)为4.5377mg/L。
一、实验目的1. 测定自来水和蒸馏水化学耗氧量(COD)的测定,分析得出自来水的水质。
2.对水中化学耗氧量(COD)与水体污染的关系有所了解。
二、实验原理化学耗氧量是指天然水中可被高锰酸钾或重铬酸钾氧化的有机物的含量。
化学耗氧量测定的常用方法为高锰酸钾法、重铬酸钾和碘酸盐法。
本实验为高锰酸钾法,其原理如下:在酸性(或碱性)条件下,高锰酸钾具有很高的氧化性,2KMnO4+5 Na2C2O4+8H2SO4=2MnSO4+8H2O+10CO2↑+5Na2SO4+K2SO4水溶液中多数的有机物都可以氧化,但反应过程相当复杂,只能用下式表示其中的部分过程:过量的KMnO4用过量的Na2C2O4还原,再用KMnO4溶液滴至微红色为终点,反应如下:三、实验步骤1.准确取水样100.00ml于锥型瓶中。
2.加入5ml 1:3 溶液。
3.加入0.01mol/l (1/5)的溶液10.00 ml。
4.加几粒沸石,立即加热。
(此时溶液仍为紫色,若溶液的红色消失,说明污物多,应补加溶液),记下的总体积V1。
从冒第一个大气泡开始计时,煮沸十分钟。
5.冷却1min,准确加入15.00 标准溶液,充分摇匀,此时溶液应由红色转为无色。
6.用0.01mol/l (1/5)滴定至淡红色,记下所用的的体积V2,平行三次。
7.另取100蒸馏水代替水样,用上述方法求空白值,加以扣除。
取一份已到终点的溶液加入15.00ml溶液,立即用滴定至浅红色,30s不褪色,计下V KK=15.00/ V K体积(V1+V2)/ml)七、实验结果与讨论自来水中耗氧量为:mg/Ml查询资料得:清洁地面水中有机物的含量较低,COD小于3~4mg·L-1。
水质化学耗氧量测定操作规程

水质化学耗氧量测定操作规程(重铬酸盐法)原理:在水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后。
以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度。
在酸性重铬酸钾条件下,芳香烃及嘧啶难以被氧化,其氧化率较低。
在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化。
试剂及仪器:1、硫酸银(Ag2SO4),化学纯。
2、硫酸汞(HgSO4),化学纯。
3、硫酸(H2SO4),ρ=1.84g/mL。
4、硫酸银──硫酸试剂:向1L硫酸中加入10g硫酸银,放置1~2天使之溶解,并混匀,使用前小心摇动。
5、浓度为c(1/6K2Cr2O7)=0.250moL/L的重铬酸钾标准溶液:将12.258g在105℃干燥2h后的重铬酸钾溶于水中,稀释至1000mL。
6、浓度为c〔(NH4)2Fe(SO4)2·6H2O〕≈0.10moL/L的硫酸亚铁铵标准滴定溶液:溶解39g硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O于水中,加入20mL浓硫酸,待溶液冷却后稀释至1000mL。
每日临用前,必须用重铬酸钾标准溶液准确标定此溶液的浓度。
取10.00mL重铬酸钾标准溶液置于锥形瓶中,用水稀释至约100mL,加入30mL浓硫酸,混匀,冷却后,加3滴试亚铁灵指示剂,用硫酸亚铁铵滴定溶液的颜色由黄色变为褐色,即为终点。
记录下硫酸亚铁铵的消耗量(mL)。
硫酸亚铁铵标准滴定溶液浓度的计算:C[(NH)Fe(SO)·6HO]=10.00×0.25042422V式中:V──滴定时消耗硫酸亚铁铵的体积,mL。
7、1,10-菲绕啉指示剂溶液:溶解0.7g七水合硫酸亚铁铵(NH4)2Fe(SO4)2·7H2O于50mL水中,加入1.5g1,10-菲绕啉,搅动至溶解,加水稀释至100mL。
8、防爆沸玻璃珠。
9、邻苯二甲酸氢钾标准溶液,c(KC8H5O4)=2.0824mmoL/L:称取105℃干燥2h的邻苯二甲酸氢钾0.4251g溶于水,并稀释至1000mL,混匀。
重铬酸钾法测定地表水中的化学需氧量

重铬酸钾法测定地表水中的化学需氧量化学需氧量(COD)大小,是对水质被污染情况进行评价的一项重要指标,本实验采用重铬酸钾法测定水样中的COD数值。
并对泰安市大汶河的一断面进行了测定和分析,其结果发现,该断面水质的COD稍有超标,應采取合理的措施予以防治和治理。
标签:COD;重铬酸钾法;地表水;水质评价化学需氧量(COD),指在一定的条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量,它是表示水中还原性物质多少的一个重要指标。
水体的COD 数值越大,说明水体受到有机物污染的成都越严重。
COD的测定有多种方法,主要为酸性高锰酸钾氧化法和重铬酸钾氧化法。
就这两种方法而言,高锰酸钾法虽然操作简便,测定时间短,但不稳定,再现性较差;重铬酸钾法对有机物氧化比较完全,重现性好,更适用于各种水样中有机物总量的测定。
本实验采用重铬酸钾法来测定水中的COD,为判断水体被还原物质污染程度提供理论依据。
1 实验方法(1)对于COD值小于50 mg/L的水样,采用浓度较低的重铬酸钾标准溶液(如0.0250 mol/L)进行氧化,水样经过加热回流以后,再用低浓度的还原剂标准溶液如硫酸亚铁铵(0.010 mol/L)进行回滴。
对于被重度污染的水体,可按体积比1/10的量,选取所需试样盒试剂的体积,放入10×150 mm硬质的玻璃试管中,摇匀后,再用酒精等加热至沸5~10分钟,观察溶液是否变成蓝绿色。
如成蓝绿色,应再多加少许实验材料,重复上述试验,最终至溶液不变蓝绿色为止。
通过上述步骤,确定水样适当的稀释倍数。
(2)水样的测定:取水样20 mL于锥形瓶中,加入10.0 mL重铬酸钾标准溶液和几粒防止爆沸的玻璃珠或者沸石,摇匀。
将锥形瓶接到回流装置的冷凝管下端,然后通自来水起冷凝作用。
从冷凝管的上端慢慢加入30 mL的硫酸银-硫酸试剂,用以防止沸点低的有机物逸出,然后不断震摇锥形瓶,使之混合均匀。
于溶液沸腾开始计时,保持回流状态两个小时。
水样中化学耗氧量的测定

实验一 水样中化学耗氧量的测定水中化学耗氧量的大小是水质污染程度的主要指标之一。
因水中含有无机还原性物质(如NO 2–、S 2-、Fe 2+等)外,还可能含有少量有机物质。
如有机物腐烂促使水中微生物繁殖,则污染水质,影响人体健康。
如果工业用此水也不利,因为COD 量高的水常呈现黄色,并有明显的酸性,对蒸汽锅炉有侵蚀作用,所以水中COD 量的测定是很重要的。
化学耗氧量的测定,目前多采用KMnO 4和K 2Cr 2O 7二种方法。
KMnO 4法适合测定地面水、河水等污染不十分严重的水质,此方法简便、快速。
K 2Cr 2O 7法适合于测定污染较严重的水。
而K 2Cr 2O 7法氧化率高,重现性好。
(一) 酸性KMnO 4法一、原理:在酸性溶液中,加入过量的KMnO 4溶液,加热使水中有机物充分与之作用后,加入过量的Na 2C 2O 4使与KMnO 4充分作用。
剩余的C 2O 42-再用KMnO 4 溶液返滴定,反应式如下: 4KMnO 4 + 6H 2SO 4 + 5C = 2K 2SO 4 + 4MnSO 4 + 5CO 2 + 6H 2O2MnO 4- + 5C 2O 42- + 16H + = 2Mn 2+ + 8H 2O + 10CO 2↑水样中若含Cl -量大于300 mg/L ,将使测定结果偏高,可加纯水适当稀释,消除干扰。
或加入Ag 2SO 4,使Cl -生成沉淀。
通常加入Ag 2SO 4 1.0 g ,可消除200 mg Cl -的干扰。
水样中如有Fe 2+、H 2S 、NO 2-等还原性物质干扰测定,但它们在室温条件下,就能被KMnO 4氧化,因此水样在室温条件下先用KMnO 4溶液滴定。
除去干扰离子,此MnO 4-的量不应记数。
水中耗氧量主要指有机物质所消耗的M n O 4-的量。
取水样后应立即进行分析,如有特殊情况要放置时,可加入少量硫酸铜以抑制生物对有机物的分解。
必要时,应取与水样同量的蒸馏水,测定空白值,加以校正。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学耗氧量的测定——重铬酸钾法
一、实验目的
1、初步了解环境分析的重要性及水样的采集和保存方法。
2、对水中化学耗氧量(COD)与水体污染的关系有所了解。
3、掌握重铬酸钾法测定水中COD的原理及方法。
二、实验原理
化学耗氧量又称COD,是指在一定条件下,用强氧化剂处理水样时所消耗氧化剂的量,以mg/L来表示。
水的化学耗氧量越大,则说明水中的有机物含量越高。
化学耗氧量的测定随水样中的还原物质及测定方法不同,其测定值也不同。
这是因为在测定化学耗氧量的过程中,免不了有部分无机物(如Fe2+)参与反应。
重铬酸钾测定化学耗氧量的工作原理是:在强酸性溶液中,用重铬酸钾将水中的有机物和还原性物质氧化:
2Cr2O72-+16H++3C=3Cr3++3CO2↑+8H2O
为了使上述氧化反应进行得彻底充分,将反应溶液加热、煮沸、回流,并添加Ag2S04催化,使直链脂肪属化合物完全氧化。
过量的重铬酸钾以1,10-邻二氮菲-亚铁作指示剂,用硫酸亚铁铵的标准溶液回滴:
2Cr2O72-+14H++6Cl-=3Cr3++3Cl2↑+7H2O
根据消耗硫酸亚铁铵的量,和加入水样中的重铬酸钾的量,计算出水样中还原性物质的消耗量。
为了避免高含量Cr(Cl->30mg/L时)影响测定结果,可在回流前向水样中加入硫酸汞(HgS04),使Cl-与之生成HgCl-而消除。
重铬酸钾氧化率高,再现性较好,适用于测定水中有机物的总量,所以用重铬酸钾法测得的耗氧量,有时也称化学需氧量(记作CODcr)。
理由是此法测得的数据接近于水中有机物完全氧化的耗氧量。
因此有时用重铬酸钾法测得的耗氧量要比高锰酸钾法大2~3倍。
三、试剂
硫酸银(s)、硫酸汞(s)、0.25mol/L K2Cr2O7、1,10-邻二氮菲-亚铁、0.1 mol/L硫酸亚铁铵
四、实验步骤
1. 0.1 mol/L 硫酸亚铁铵标准溶液标定
准确移取10.00mL 0.25mol/L K 2Cr 2O 7溶液置于锥形瓶中,用水稀释至约100mL ,加入30mL 硫酸,混匀,加3滴1,10-邻二氮菲-亚铁试液作指示剂,用 0.1 mol/L 硫酸亚铁铵标准溶液滴定,使溶液从蓝绿色变为红棕色即为终点。
平行测定3次取平均值。
6Fe (NH 4)2(SO4)2+K 2Cr 2O 7+7H 2SO 4=3Fe 2 (SO 4)3+Cr 2 (SO 4)3+K 2SO 4+6(NH 4)2SO 4+7H 2O
2.稀释重铬酸钾和硫酸亚铁铵
分别准确移取10.00mL 0.25mol/L K 2Cr 2O 7和0.1 mol/L 硫酸亚铁铵溶液置于250mL 容量瓶中,用水稀释定容至刻度,摇匀。
待滴定水样和做空白试验用。
2.水样中耗氧量的测定
取水样20mL (有鸣潭取的),置于250mL 锥形瓶中,加30mL 浓H 2SO 4,再准确加入10.00mL0.025 mol·L -1 K 2Cr 2O 7标准溶液和几颗防爆沸玻璃珠,立即加热至沸,若此时由红棕色变为蓝色,说明水样中有机物含量较多,应补加适量K 2Cr 2O 7标准溶液至试液呈现稳定的红棕色。
从冒第一个大泡开始计时,用小火准确煮沸30min(注意1:严格控制煮沸时间,也即氧化-还原反应进行的时间,才能得到较好的重现性。
),取下锥形瓶,冷却后用水稀释至140mL 。
加3滴1,10-邻二氮菲-亚铁试液作指示剂,用 0.01 mol/L 硫酸亚铁铵标准溶液滴定过量的K 2Cr 2O 7溶液,使溶液从黄色→蓝绿色→红棕色即为终点。
平行测定3次取平均值。
3.空白样耗氧量的测定
另取20mL 蒸馏水代替水样,同时操作,求得空白值,计算耗氧量时将空白值减去(即:水样中实际化学耗氧量ρ(o 2)=测定化学耗量-测定空白值)。
五、数据记录与处理
式中,C ——硫酸亚铁铵标准溶液的浓度0.01mol/L;
V 1——空白试验所消耗的硫酸亚铁铵标准溶液的体积,mL ;
V 2——水样中所消耗的硫酸亚铁铵标准溶液的体积,mL ;
8000——1/4O 2摩尔质量以mg/L 为单位的换算值。
()L mg O mol g V V C /V 1000/00.8COD 221水样
)(⨯⨯-=。
