缺血性脑卒中的动物模型完整版
SHRSP脑卒中的理想动物模型

SHRSP大鼠是脑卒中自发性高血压模型动物,是从SHR大鼠中通过选择交配,再经继代近亲繁殖培育而成的.SHRSP大鼠的脑卒中发病率达90%以上,表现为脑出血或脑梗塞,病灶周围脑血管管壁肥厚并有玻璃样变性.血浆高血压蛋白酶原活性升高,相对分子质量变大,血压升高是促使脑卒中发生和发展的前提.经HFC负荷试验,血液中总胆固醇升高5.9~9.7倍,肾病变加重,出现肾小球泡沫细胞.高血压症状持续的时间越长这种细胞出现的频率越高,高血压造成的肾毛细血管损伤加大了脂质的通透性,而高血脂是促进肾病变发展的重要因素.泡沫细胞好发于正在硬化的肾小球,这种选择性分布的特点人与大鼠是一致的,故有可能作为本病的模型使用.。
脑缺血动物模型

脑缺血动物模型的制作目录一、简介二、前言三、脑缺血动物模型的分类四、脑缺血动物模型的制作1. 仪器和设备2. 四血管结扎全脑缺血模型3. 大脑中动脉结扎模型4. 光化学脑梗塞动物模型5. 自发性高血压鼠的脑卒中模型6. 血管内栓线技术的局灶脑缺血模型五、脑缺血模型的测量指标六、影响脑缺血损害的相关因素1. 脑缺血的程度2. 体温和脑温3. 麻醉4. 血液因素和其它七、参考文献一、简介一个生理上可控的和可复制的脑缺血动物模型是研究其病理机制和试验新的疗法所必需的。
本节介绍脑缺血动物模型的制作方法。
首先介绍脑缺血动物模型的分类,然后分别介绍几种常用脑缺血模型的制作,包括四血管结扎全脑缺血模型、大脑中动脉结扎和光化学梗塞局部脑缺血模型等。
同时,结合模型的应用,介绍缺血模型的测量指标和相关影响因素。
二、前言脑血管疾病是导致我国中老年人死亡的第一号疾病,也是世界性卫生战略研究重点之一。
在脑血管疾病中以缺血性疾病的发病率占据首位。
通常在轻度缺血/缺氧的情况,脑的补偿机制保护着中枢神经系统免受损伤,但当缺血程度加重时,便会发生不可逆的神经损害,导致系列的临床症状,甚至死亡。
临床上,脑血管意外、心肌梗塞、休克、新生儿窒息和脑外伤都可引起神经元的缺血性损害。
因此积极探讨脑缺血的损害机制及防治措施,具有重要的科学意义[1]。
一个生理上可控的和可复制的动物模型对于系统地、全面地研究脑缺血的病理生理过程和试验新的治疗方法是非常必要的。
首先,尽管临床上脑缺血的发病率很高,可以提供较多的病例。
但是,人类脑缺血是非常多样性的,其表现形势、病因和缺血区的解剖学定位,有着很大的不同。
这种多样性防碍了进行统计学分析和设置对照的可能性。
其次,精确的组织病理学分析、生物化学和生理学研究、常常需要侵入性的外科程序和直接的脑组织取样分析。
第三,发生在缺血性脑损伤早期事件的观察(几分钟甚至几秒钟),只能在实验动物身上才能做到。
最后,由于缺血是一种供血异常,血管因素在其中发挥了重要作用,而血管因素的改变无法用组织细胞培养或脑片孵育的方法来模拟。
脑卒中动物模型实验原理

脑卒中动物模型实验原理
1.1 缺血性脑卒中
2.1.2 线栓法
实验动物:MCAO大鼠、MCAO小鼠
模型特点:利用线栓闭塞大脑动脉血管,无需开颅,缺血时间和部位易控制,并发症少,是目前使用最广泛的脑卒中模型。
获取方法:可直接购买商品化模型
2.1.2 光化学法
实验动物:大鼠、小鼠
模型特点:无需开颅,重复性较高,病灶部位可控,但缺乏缺血半暗带,无法模拟部分病例的生理变化,适用于慢性脑缺血研究。
获取方法:系统给与光敏剂后,利用高强度光源照射,以激活脑区的光敏剂,产生脑水肿和血小板微血栓,造成局部梗死。
2.1.3 开颅电凝法
实验动物:大鼠、小鼠
模型特点:缺血效果稳定,出血量少,是目前公认的标准大脑中动脉闭塞模型,但开颅存在一定风险。
获取方法:右侧颞下入路进行开颅,采用双极电凝将大脑中动脉闭塞后切断。
1.2 出血性脑卒中
2.2.1 自体注入法
实验动物:ICH大鼠
模型特点:采集自体股动脉血注射至大鼠右侧基底节制作ICH模型,操作简便,出血部位稳定,与人类脑出血病理过程相似。
2.2.2 自发脑出血
实验动物:大鼠
模型特点:将高血压与出血性脑卒中有机结合,适用于高血压引起的脑出血病理生理机制研究。
获取方法:对SHR(自发性高血压)大鼠进行大脑中动脉结扎处
理
2.2.3 胶原酶注入法
实验动物:大鼠、小鼠
模型特点:操作简便,重复性高,与临床脑出血病理生理相似性高,但实验影响因素较多,稳定性较差。
获取方法:将胶原酶通过微量注射器注射入动物尾壳核内。
脑缺血动物模型的制备方法

• 苯巴比妥钠对体温和呼吸影响最大, 不太适合作这种模型。
3. 栓线的性能和深度:
• 栓线的粗细: • 栓线的性质: • 栓线插入的深度:
• 4. 体温和脑温: • 5. 梗死时间:
1、1.5 h无梗死灶, 2h只在基底节出现梗死灶; 4h面积增大; 12h面积趋于稳定; 24h的面积与2h无差异,但死亡率增加。
• 2.自发性脑卒中模型:
采用自发性高血压大鼠或通过 肾动脉狭窄或包裹肾脏的方法造成 动物肾性高血压,随着鼠龄的增长 而产生自发性脑卒中。
• 3. 椎基底动脉脑缺血模型:
将豚鼠麻醉,仰卧位固定。暴 露枕部颅底,手术显微镜下磨出一 个 57mm 的 骨 窗 , 游 离 基 底 动 脉 , 并穿一条“0”号丝线,其上方一个 重0.5g金属球,造成基底动脉血流 部分阻断,进而形成急性脑干缺血 模型。
• 1987 年 Dietrich 等 用 波 长 560nm 的光束经颅骨表面照射已经静脉 注射过光化学诱导剂玫瑰红B的 鼠脑的特定部位,复制出大脑皮 质血栓性梗死模型。
• 1.5 微栓子栓塞阻断法:
分离一侧的CCA、ECA、ICA,将 无菌干燥研碎筛滤的血凝块、炭素 颗粒、塑料颗粒等作为溶栓剂,由 ECA注入栓子后结扎ECA,开放CCA, 栓子由ICA进入MCA,造成以MCA供血 区脑组织损伤为主的缺血模型。
大 鼠 线脑 插底 入动 部脉 位环 及 拴
动物模型成功的标志:
• 清醒后出现同侧霍 纳氏征(Homer,瞳 孔缩小)、对侧肢 体瘫痪或向对侧旋 转、甚至是出现惊 厥。打开大鼠大脑 后可见阻塞侧的大 脑半球肿胀、苍白, 体积明显大于对侧。
• TTC(四氮唑红)染色:
大鼠缺血模型

大鼠和小鼠的优势
1. 大鼠品种多,易于饲养,价格低廉 2. 纯种鼠属近亲交配,基因型相似,脑血管解剖和生理机能也相 似 3. 大鼠脑血管解剖和生理机能接近于人类 4. 脑血管损伤部位恒定,实验重复性好 5. 动物存活时间长,利于脑缺血相关病理改变过程的研究 6. 脑体积大小适宜,易施低温固定技术和组织生化分析 7. 有关系列大鼠的生理、药理和生化方面的实验资料可供分析比 较 8. 克服了体外实验无法实施再灌流的缺陷 9. 沙土鼠缺乏后交通动脉及完整的基底动脉环,两侧大脑供血相 对独立,通过闭塞一侧或双侧CCA即可复制效果明显的同侧或 双侧脑缺血模型
栓线法
由 ECA 插入 4 -0 尼龙线进入 ICA , 阻断 MCA起 始端而导致局灶性脑缺血。通过提拉插线可以造成 再灌流损伤模型。
优点:该法手术创伤小, 动物易长时间存活血栓形
成过程与人类相似可选择皮层梗塞部位
缺点:较早地导致终末动脉及微血管永久性闭塞 ,
不利于扩血管及促进侧支循环作,切开皮肤, 暴露颅骨,静脉注射光敏材料虎红酸钠,用特 定冷光源(500--600nm)照射切口处颅骨,光 线透过颅骨与血管内的光敏物质接触,激发光 化学反应而产生单线态氧,直接损伤血管内皮 细胞而诱导血栓形成。 优点:不开颅,手术创伤小,动物易长时间存 活,血栓形成过程与人类近似,适用于抗血小 板、抗血栓及内皮细胞保护药物的急慢性动物 实验研究。 缺点:较早地导致终未动脉及微血管永久性闭 塞,不利于扩血管及促进侧支循环作用的研究
开颅法、光学法、栓塞法、栓线法。
开颅法
麻醉动物,耳眼连线的中点垂直切开皮肤,通过钝
性分离颞肌,开颅后暴露MCA,用电凝器横过嗅束旁 的MCA使其凝闭,用10号手术丝线结扎MCA,造成MCA 支配区局灶性脑缺血模型。
动物脑缺血模型建立.pptx

临床表现
早期:缺血性症状,多表现为局灶 神经功能缺损 晚期:出血性症状,多表现为脑室 内出血,脑室旁出血
2.发病特点
3.发病原因:
3.发病特点
正常人群中每1000人每年发病为0.31~ 0.64人,中老年人比较常见。随着年龄的 增长发病率呈指数递增,75岁以上年发病 率达每1000人2.93。
(4)大鼠脑缺血模型
二血管阻断法 全脑缺血模型: 四动脉阻断法
三动脉阻断法
栓塞法 栓线法 局灶性脑缺血(MCAO)模型 光化学法、 开颅法
四动脉阻断法
戊巴比妥钠腹腔麻醉, 腹卧固定大鼠,颈后正中切开 , 暴露第一颈椎的两侧 翼板小孔, 用单极电凝针插入其中 ,烧灼双侧推动脉 , 使之永久闭塞 ,24 h后 再仰卧位 , 局麻喉部 , 在喉头与胸骨间 3 cm处正中切口 ,分离暴露二侧CCA , 手术缝合线打活结 结扎 , 阻断两侧 CCA使缺血 30 min , 松开活结 ,造成大鼠 全脑缺血再灌流模型。
二.动物脑缺血模型
• 1986年,Koizumi等首先采用血管内栓塞堵 塞脑中动脉开口建立大鼠局灶性脑缺血模 型(MCAO)。 • 1989年,Longa等采用血管内栓线阻塞法制 备该模型。 • 之后发展了双侧颈总动脉结扎法、开颅机 械闭塞法、微栓子栓塞阻断法、化学刺激 诱导血栓性闭塞法、光化学诱导血栓形成 法等。
1.脑缺血动物模型分类:
A.根据动物种类分类:
可分为猩猩,猴子,狗,猫,猪,兔子,大鼠,小鼠等脑缺血模 型。
B.根据缺血范围分类:
全脑缺血和局灶性缺血。
完全阻断或骤然降低大脑 的血流,造成全脑缺血。 暂时广泛地影响各个脑区, 病理改变发生在易损区。
全脑缺血模型 :
永久性闭塞
大脑中动脉闭塞小鼠模型

大脑中动脉闭塞小鼠模型卒中是一种常见的神经系统致命疾病。
88%的缺血性卒中系因血管闭塞。
因为大多数缺血组中发生在大脑中动脉支配区,所以大脑中动脉为卒中小鼠模型重点。
堵塞大脑中动脉的管腔内单线模型用来模仿持久或短暂的闭塞。
这个技术不需要颅骨切除术,切除部分颅骨的外科手术会影响颅内压及体温。
这一技术已广泛应用于模拟持久和短暂局部缺血症状的小鼠。
方案:大脑中动脉闭塞模型1、将5.0单缝线剪成20mm一段,将一端加热烧圆,用显微尺测量直径。
我们最终选直径0.21—0.22mm的缝线,用于25-30g体重小鼠。
2、高压蒸汽灭菌法消毒所有手术用品。
70%乙醇消毒手术台和器械。
3、用5%异氟醚麻醉8-12周小鼠。
诱导麻醉后,将异氟醚调至1.5%小剂量维持。
4、将小鼠仰卧位至于加热板上。
插入一直肠探针,监测并维持小鼠体温在36.5-37.5℃之间。
5、颈部术区备皮。
用70%酒精清洁术区。
6、在立体显微镜下颈部正中1cm切口,拉钩暴露手术部位并找到右侧颈总动脉、颈外动脉、颈内动脉,并将其与周围神经及筋膜分离。
7、进一步分离ECA远端,用双极电凝器凝固ECA和STA,于凝固点切断ECA和STA8、在ECA根部松放两根8.0丝线,在颈总动脉分叉处放置一个血管夹。
9、在ECA残端做一小切口,测量并记录圆头5.0单缝线的长度,插入小口内并向前送入夹子处。
缩紧两丝线,确保单缝线刚好能顺利进入。
10、移除血管分叉处的血管夹,轻轻向前送入单缝线,从ECA到ICA,大概超过CCA分叉处9-10mm,堵住MCA。
整个手术大概花用30-45分钟。
11、缝合颈部切口,将小鼠放置35℃保温箱中苏醒,然后放回笼中。
小鼠苏醒大概需要5-10分钟。
若需短暂性大脑中动脉闭塞模型,可在0.5-2小时后将小鼠再麻醉然后将缝线退到ECA根部。
12、诱导MCAO24小时后,5%异氟醚麻醉小鼠,颈髓离断法取出大脑。
冠切成四个2mm片,室温下将每片放置2% 2,3,5-氯三苯四唑(TTC)磷酸缓冲液中,以测定缺血面积大小。
大鼠大脑中动脉缺血模型

大鼠大脑中动脉缺血模型
大鼠大脑中动脉缺血模型是一种用于研究脑血管疾病的实验动物模型。
该模型通过阻塞大鼠大脑中动脉,使特定区域的脑组织缺氧,从而模拟脑卒中等脑血管疾病的病理过程。
该模型的建立常用的方法有两种:颅骨开窗法和线栓法。
颅骨开窗法是通过手术在大鼠头部挖取窗口,暴露出脑表面的动脉,然后用丝线或微疏松的阻塞物将动脉堵塞,造成脑缺血。
线栓法则是将一根细线或者硬化的凝血物插入大鼠颈动脉,将其推进至前大脑动脉分支处,从而阻塞动脉血流。
这种模型可以模拟脑血管疾病引起的脑缺血损伤,包括缺血区域的神经元死亡、神经胶质细胞激活、炎症反应等。
研究人员可以通过该模型观察脑缺血后的病理变化和分子机制,评估各种药物或治疗方法对脑缺血的治疗效果。
需要注意的是,动物实验必须符合伦理规范和相关法律法规,研究人员应尽量减少动物的痛苦和不适。
同时,在进行实验前需要仔细设计实验方案,选择适当的动物模型和操作方法,以确保实验结果的可靠性和准确性。
大鼠脑缺血模型制作

大鼠脑缺血模型制作大鼠脑缺血是一种神经病理学状态,常用于研究脑缺血和再灌注相关的疾病,如中风和心脑血管疾病。
制作大鼠脑缺血模型可以帮助研究者深入了解脑缺血的机制,并探索治疗方法。
下面将介绍一种常用的大鼠脑缺血模型制作方法。
材料准备:1.正常健康的大鼠(约250-300g)2.异氟醚(用于麻醉大鼠)3.氧化氮(用于麻醉大鼠)4.0.9%氯化钠溶液(生理盐水,用于预先裂解血栓)5.弹簧夹(用于阻断大脑供血)6.血管夹(用于再灌注)7.生理盐水或PBS(用于清洗伤口和冲洗大脑)操作步骤:1.麻醉大鼠-以适当的浓度向氧化氮罩中送气,让大鼠吸入异氟醚麻醉。
-确定大鼠是否处于麻醉状态,如失去帕金森反射。
-为了确保大鼠的安全性和麻醉质量,要定期监测大鼠的许多生理参数,如呼吸频率、血氧饱和度和体温。
2.颅窗手术-将大鼠固定在手术台上,用5%碘伏消毒实验区域的皮肤。
-在头部进行剃发和消毒。
- 用手术刀在头部切开皮肤,在颅骨上切开一个直径约 1 cm的圆洞。
-清除头骨上的组织,暴露出颅骨。
-用电动开骨钻在颅骨上进行微抖动,直到打开一个圆洞。
通过控制速度和钻头的压力来避免损伤脑组织。
-用细钳将头皮撕开,暴露出脑膜。
3.制作脑缺血-用生理盐水或PBS洗涤脑膜,以确保大脑的清洁。
-用弹簧夹仔细阻断大脑的供血。
通常选择大脑的前动脉(MCA)或双侧MCA,使大脑区域发生缺血。
-检查大鼠是否出现神经功能缺陷,如软瘫、不对称性和意识丧失等。
-记录缺血时间,通常在20-30分钟之间。
-选择再灌注时间,通常是60分钟。
4.再灌注-在再灌注前,用生理盐水或PBS冲洗大脑。
通过防止缺血时间和再灌注时间的太长,以减少实验操作引起的伤害。
-用血管夹将阻断的血管解除,实现再灌注。
-观察大鼠是否恢复神经功能,例如排尿、动作和体位等。
-保持大鼠体温适宜,定期监测大鼠身体参数。
5.实验后处理-在实验结束后,用生理盐水或PBS冲洗伤口。
-给大鼠提供足够的水和食物,让其恢复。
非人灵长类动物缺血性脑卒中病模型技术原理介绍

非人灵长类动物缺血性脑卒中病模型技术原理介绍
病症介绍:脑卒中是非常严重的健康和社会问题,具有发病率高、致残率高、复发率高、死亡率高以及医疗花费比例高等特点。
模型优势:非人灵长类食蟹猴作为人类的近亲,其形态结构,生理机能和生化代谢方面同人类非常相似,用灵长类进行试验研究的结果外推到人类误差最小。
我们将利用现有大批量食蟹猴的优势,使动物实验中的各处理因素和影响因素统一化,减少模型的差异对实验结果的影响,尽可能地提高与人类脑卒中发病过程的一致性,同时对新药的药理、药效进行更加客观、准确的评估,并及时淘汰疗效不佳、毒性大的候选药物,从而提高新药研发成功的几率、降低新药研发周期和成本。
急性缺血性脑梗死动物模型研究进展

急性缺血性脑梗死动物模型研究进展急性缺血性脑梗死是由于脑血管疾病引起的脑部血液供应不足引起的一种严重疾病,在临床上具有高发性和高致残率。
研究该病的动物模型对于疾病的发病机制和治疗方法的探究非常重要。
本文将综述近年来急性缺血性脑梗死动物模型的研究进展。
常用的急性缺血性脑梗死动物模型包括原发性或继发性大鼠中颈动脉结扎(MCAO)模型、大鼠近远端闭塞(intraluminal filament)模型、大鼠主动脉阻断(BCAO)模型以及小鼠中颈动脉结扎(MCAO)模型等。
这些模型具有操作简便、易于复制和可调控性强的优点,已经成为研究急性缺血性脑梗死的主要工具。
近年来,急性缺血性脑梗死动物模型的研究主要集中在以下几个方面:1.病理机制的研究:研究者通过动物模型可以模拟人类急性缺血性脑梗死过程,进而研究其发病机制。
例如,一些研究表明,缺血-再灌注损伤、氧化应激、炎症反应等因素在脑梗死中起到重要作用。
研究者通过模型动物的脑组织与血液、细胞等方面的分析,揭示了这些因素的作用机制,为疾病的早期诊断和治疗提供了理论基础。
2.治疗方法的研究:急性缺血性脑梗死目前主要通过溶栓治疗和血管重建治疗来改善患者的预后。
而动物模型在研究这些治疗方法的有效性、剂量、时间窗等方面起到了重要作用。
例如,一些研究使用动物模型验证了溶栓药物的疗效,探讨了最佳的给药时间和剂量,为临床实践提供了参考。
3.新治疗方法和药物的评价:研究者通过急性缺血性脑梗死动物模型,不断探索新的治疗方法和药物的疗效。
例如,一些研究发现神经保护因子、活性氧清除剂、炎症抑制剂等具有一定的治疗潜力,为临床应用提供了新的方向。
综上所述,急性缺血性脑梗死动物模型研究在揭示疾病发生机制、评价治疗方法和探索新的治疗方向等方面发挥着重要作用。
随着研究技术和方法的不断更新,相信动物模型研究将进一步推动急性缺血性脑梗死的基础研究和临床应用。
全脑缺血动物模型制作步骤及方法

全脑缺血动物模型制作步骤及方法1两动脉阻断法(occlusion of bilaterial carotis communis artery) (1)复制方法 SD大鼠,雌雄不拘,体重为250~300g。
经腹腔注射水合氯醛(350~400mg/kg体重的剂量)或戊丨巴丨比丨妥丨钠(50~60mg/kg体重的剂量)麻醉后,仰卧位固定,剃除颈部毛发,手术区域皮肤常规消毒。
颈前正中切口,分离双侧颈总动脉(carotis communis artery, OCA),夹闭双侧CCA,同时合并低血压以减少脑血流量,造成急性脑缺血。
由于啮齿动物(沙土鼠除外)脑血液循环有较人类丰富的侧支循环,仅结扎双侧CCA不足以明显降低脑血流量(CBF),因此结合降压药三丨甲噻吩、酚妥拉明或静脉放血等方法使动脉血压降低至50mmHg(6.7kPa),使CBF降低至正常的5%~15%。
放血方法:由颈静脉插管至右心房,供放血并连续记录EEG。
采用抽血的方法放血,失血达80mmHg(10.7kPa)时结扎双侧颈动脉,再继续抽血,使血压降至6.7kPa。
(2)模型特点此方法的优点是操作简便,用一次性手术即可完成,阻断可逆,可人为控制动物呼吸。
采用这种方法复制的模型,能进行缺血再灌流损伤的研究,模拟了临床上休克、心功能不全、脑血管严重狭窄或阻塞合并血液低灌流引起的脑循环障碍,造成不同程度的脑组织缺血损伤。
因而,对于探讨人类缺血性脑损伤的发病规律,评价抗脑缺血药物的疗效等有价值。
缺点是:①模型不能在清醒动物上复制,无法研究血管狭窄后行为学的变化。
②常因存在侧支循环而造成缺血不,部位不宜确定。
③脑缺血时限长,有时导致脑缺血后抽搐、癫癎等并发症的发生。
且由于低血压状态,可干扰其他器官、组织的供血和实验结果。
此方法除可用于大鼠外,也可用于兔、猫和猴的性脑缺血。
2四动脉阻断法(occlusion of four blood vessels)(1)复制方法 SD大鼠,雌雄不拘,体重为250~300g。
脑缺血动物模型研究.. PPT课件

同济大学附属东方医院神经内科
黄东雅
急性期脑梗塞治疗理念的演变
改善或增加缺血区的供血: 稀释血液,
降低血粘度,改善循环 “时间窗”治疗 溶解血栓、恢复血供、 挽救半暗带区脑组织: 3-6h内溶栓治疗 抗血小板聚集治疗 卒中单元(stroke unit) 神经保护剂
脑梗塞治疗理念的演变历程
在过去的15年中被世界所公认:
3小时内静脉溶栓 卒中单元 阿斯匹林 开颅减压术
动物试验
临床随机对照试验
概 述
缺血性脑血管病 ( I CVD) 约占全部脑血
管病的 80%, 具有发病率、致残率、病死率 高的特点 , 已成为严重危害人类健康的疾病 之一。由于临床研究的种种限制 , 脑缺血动 物模型已成为研究脑血管病损伤机制和防治
5. 动物存活时间长,利于脑缺血相关病理改变过程的研究
6. 脑体积大小适宜,易施低温固定技术和组织生化分析 7. 有关系列大鼠的生理、药理和生化方面的实验资料可供分析比较
8. 克服了体外实验无法实施再灌流的缺陷
9. 沙土鼠缺乏后交通动脉及完整的基底动脉环,两侧大脑供血相对 独立,通过闭塞一侧或双侧CCA即可复制效果明显的同侧或双侧
物种的分类
常用模式动物
常用模式动物
尽管一些体积较大的动物,如猩猩、猴、 猫、狗、兔、猪 都曾用于脑缺血研究,但是 大多数实验室选择大鼠或沙土鼠作为研究对 象。
大鼠和小鼠作为模式生物的优势
1. 大鼠品种多,易于饲养,价格低廉
2. 纯种鼠属近亲交配,基因型相似,脑血管解剖和生理机能也相似
3. 大鼠脑血管解剖和生理机能接近于人类 4. 脑血管损伤部位恒定,实验重复性好
特征时,发育的普遍原理也就得以建立。 5. 这些生物帮助我们理解生命一般规律的生物被称为 “模式生物”
脑缺血动物模型具体步骤及详细方法

脑缺血动物模型具体步骤及详细方法原型物种人来源脑缺血再灌注(MCAO线栓法)模式动物品系Balb/c 小鼠,SPF级,雄性,健康,体重25g~30g实验分组随机分组:对照组,模型组,阳性药物组和药物组,每组15只实验周期24 hours, 3 days or 7 days建模方法1. 3%戊巴比妥钠麻醉小鼠,颈部备皮,消毒,插入肛温探头,保持体温在37±0.5℃。
2. 颈部正中切口,暴露右侧颈总动脉,颈内动脉和颈外动脉。
使用7-0丝线在距离颈总动脉分叉2mm处结扎颈外动脉远心端,在颈外动脉穿入另一根7-0丝线,在靠近颈总动脉分叉处打一个活结。
3. 使用动脉夹夹闭颈总动脉。
在距离颈总动脉分叉处1.5mm处的颈外动脉上剪一个小口,将一根头端处理过的0.18mm直径的尼龙线从小口中插入,进入颈内动脉,并向内插入大脑中动脉,尼龙线的插入深度距离颈总动脉分叉处约9±1mm。
4. 缺血后60min拔掉线栓,用7-0丝线结扎外动脉近心端,用5-0丝线缝合颈部伤口,活力碘消毒伤口,将小鼠放在加热垫上,待清醒后放入恒温抚养箱饲养。
5. 术后24h,对小鼠进行神经功能评分,然后麻醉小鼠,取大脑进行TTC染色和病理染色。
应用疾病模型1.神经功能缺失体征评分参考Longa及Bederson的5分制法在动物麻醉清醒后24h进行评分,分值越高,说明动物行为障碍越严重。
0分:无神经损伤症状1分:不能完全伸展对侧前爪2分:向对侧转圈3分:向对侧倾倒4分:不能自发行走,意识丧失2.TTC染色麻醉小鼠后,取小鼠脑组织,放入-20℃冰箱冷冻30min。
用PBS配置1% TTC(W/V),37℃水浴至TTC溶解,将冻好的脑组织切片,置于10ml TTC 溶液中,37℃恒温孵育10min。
不时翻动脑片,使组织均匀染色。
正常脑组织染色后呈鲜红色,而梗死区呈苍白色。
取脑后用4%多聚甲醛溶液固定,蔗糖溶液脱水后,经OCT包埋做冰冻切片,切片10um,做尼氏染色,可做梗死面积的评价。
大鼠脑缺血模型及缺血再灌注模型
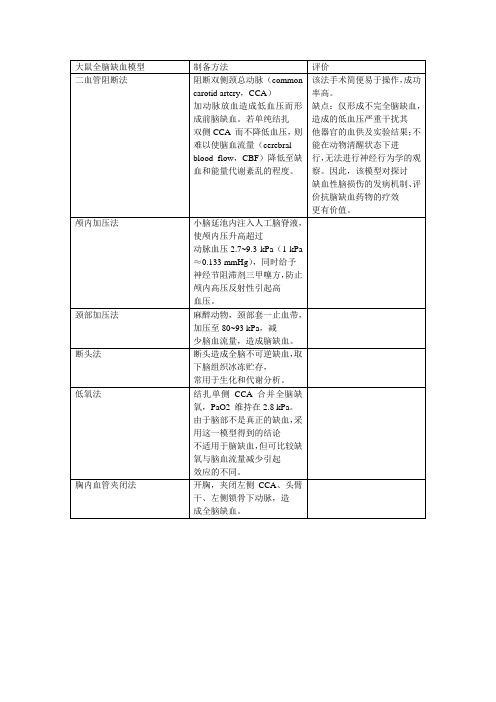
制备方法
评价
二血管阻断法
阻断双侧颈总动脉(common carotid artery,CCA)
加动脉放血造成低血压而形成前脑缺血。若单纯结扎
双侧CCA而不降低血压,则难以使脑血流量(cerebral
blood flow,CBF)降低至缺血和能量代谢紊乱的程度。
该法手术简便易于操作,成功率高。
血模型。缺点:需要开颅,创伤性大,闭塞血管后无法
进行再灌性损伤研究。
光化学法
曾报道,Watson等首次建立了光化学法诱导脑皮
层梗塞的动物模型。立体定位仪固定大鼠头部,暴露颅
骨,尾静脉注射光敏材料荧光素,用560 nm波长的特
定光源照射局部头颅,光线透过颅骨与血管内的染料
接触,激发光化学反应,引起照射部位皮层血管内皮细
制备方法
评价
四血管阻断法
1979年,Pulsinelli等[26]通过阻断双侧CCA及椎
动脉血流成功建立了四血管闭塞法大鼠全脑缺血模
型。手术分两个阶段:麻醉动物,颈前正中切口,分离
CCA,将无损动脉夹轻放于双侧CCA周;同时枕部切口暴露第一颈椎翼小孔,电凝双侧椎动脉,造成永久性
闭塞。24 h后夹闭双侧CCA,造成明显的脑缺血。以
足,这是其又一个比较突出的优点。
二血管阻断法
Smith等[30]通过夹闭双侧CCA合并低血压以减
少脑血流量,造成急性脑缺血。脑组织缺血程度可以通
过测定CBF反映出来。大鼠脑血液循环有较人类丰富
的侧支循环,仅结扎双侧CCA不足以明显降低CBF,
必须结合降压药三甲噻吩、酚妥拉明等降低动脉血压
至6.7 kPa,使CBF降低至正常的5%~15%。
采用这种方法复制的缺血再灌注损伤
小鼠MCAO总结

小鼠MCAO总结小鼠MCAO(大脑中动脉结扎)是一种常用的动脉结扎模型,用于研究缺血性脑卒中。
在该模型中,通过结扎小鼠颈部的大脑中动脉,导致大脑供血不足,从而引发脑组织缺血和神经细胞死亡。
本文将对小鼠MCAO的实验步骤、方法以及该模型的应用进行总结和分析。
首先,进行小鼠MCAO实验的前提是具备动物实验的合理伦理和实验条件。
对于伦理问题,需要获得相关实验动物伦理委员会的批准,并遵守国家和地区的法律法规以及世界卫生组织的相关指导原则。
对于实验条件,需要具备适当的动物设施,例如温度和湿度适宜的动物房、合适的饲养和免疫条件等。
接下来是小鼠MCAO的实验步骤。
首先,需要选择适合的小鼠品系和年龄。
常用的小鼠品系包括C57BL/6和Wistar。
选择小鼠的年龄一般在8-12周之间,因为在这个年龄段,小鼠的大脑动脉易于结扎。
然后,对小鼠进行术前准备,例如麻醉、剃毛和消毒等。
麻醉可以选择使用异氟醚、氯胺酮等。
在实施术中,首先需要进行颈部的切开,然后定位大脑中动脉。
一般通过显微镜或放大镜来观察和定位。
之后,使用一根丝线或者闭夹器进行结扎,以阻断大脑中动脉的血流。
结扎的位置一般选择在颈动脉与大脑中动脉的分叉处。
结扎时间一般为30分钟至1小时,可以根据实验需求来决定。
至于恢复期,可以选择24小时、72小时或更长的时间。
MCAO模型的评价标准主要有神经行为学、组织学和分子生物学等方面。
神经行为学评价包括笼中循环、运动协调、行动能力评估等。
组织学评价主要是通过HE染色或免疫组化等方法,观察和统计脑组织的损伤程度、核染色和胶质增生等指标。
分子生物学评价主要是通过检测相关蛋白或基因的表达水平来评价大脑组织的病理改变。
小鼠MCAO模型是研究缺血性脑卒中的重要模型,具有较好的再现性和可操作性。
其主要应用包括:研究病理生理机制,例如缺血再灌注损伤、神经炎症反应、胶质增生等;评估潜在的治疗方法,例如药物和干细胞治疗等;评估神经保护剂或治疗方式的效果,例如针刺、脉冲电磁场等;研究缺血性脑卒中的早期诊断和预防方法,例如影像学、生物标志物等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
缺血性脑卒中的动物模
型
HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
缺血性脑卒中研究中的动物模型
想要进行一项基础研究,动物模型必不可少。
缺血性脑卒中研究如火如荼,动物模型也多种多样,有哪些常用的动物模型,以及它们各自的特点就成了研究人员在选择模型时十分关注的问题。
在缺血性卒中过程中,最终的梗死体积和神经功能预后受到多种因素的影响,例如缺血的持续时间、缺血的严重程度、侧枝循环、系统的血压以及梗死产生的原因和位置。
此外,年龄、性别和相对复杂的药物遗传背景也会对其产生影响。
因为卒中是如此复杂的一个疾病,因而动物模型也往往只能覆盖其中个别方面的特点。
虽然中风是一种复杂的疾病,但其存在一些共同的特点,这使得我们有机会用实验来模拟卒中的发生。
缺血性脑卒中的一个重要特点是进展,这也解释了缺血半暗带的存在。
当血流量降至基线值的15-20%以下时,只要几分钟就会产生不可逆的脑损伤核心,并且迅速相周围发展。
其周围的脑组织血流减少得相对较轻,所以此时神经功能缺失而组织结构却是完整的。
但如果脑血流不能恢复,那么这些所谓的半暗带组织就会被纳入梗死核心区。
最常用的一种模型是啮齿动物的线拴法大脑中动脉闭塞模型(MCA),方法是将普通的血管内缝线或特制的线拴放入大脑中动脉开口处,从而达到阻塞血管造成血流量减少的目的。
这种方法的优点是:不需要开颅的手术,并且通过拔出线拴的方法还可以达到在特定时间再通血管的目的,虽然瞬间的血管开通与人体一般的病理生理过程相去甚远,但与近来应用越来越广泛的机械取栓治疗的病理过程不谋而合。
因此,虽然在模型的制作上存在一些问题,但仍是目前最广受认可的一种脑卒中动物模型。
另一种常用的方法是用各种方式直接地闭塞血管,分为永久地闭塞血管(如凝断)和暂时闭塞血管(如结扎),但大多都需要开颅的手术操作。
使用内皮素-1(一种强血管收缩剂)可以诱导短暂的局灶性脑缺血,其产生的病灶可以分布于脑组织任何位置,常常被用于制作腔隙性梗死的模型制作。
光化学法是在系统给予荧光物质后,用可穿透颅骨的光线,激活特定脑区的荧光剂,从而达到局部梗死的目的。
这种方法可以做到高度的可重复性,并且病灶可以相当局限。
但缺点是这种方法制作的模型缺乏缺血半暗带,因而不能很好地模拟某些病理生理变化。
另外还有血栓栓子模型和栓塞微球模型,这两种方式与实际临床病理生理过程更为相近,但同时也有梗死位置变异性大,并且有不可预知的血管再通等问题。
尽管有如此众多的动物模型,但由于模式动物本身和人有诸多差异,在许多结构和功能上都不能完全模拟。
随着对脑功能研究的进一步深入,这些简单的动物模型将不适用于许多高级神经功能的研究。
诸如卒中后认知功能损伤、神经精神症状、抑郁、睡眠呼吸暂停等常见的卒中后并发症的研究均在不同程度上因为缺少有效的动物模型而受到阻碍。
而这也将是卒中动物模型进一步发展所要解决的问题。
1. Sommer, . Ischemic stroke: experimental models and reality. Acta
Neuropathol133, 245-261 (2017).。
