羟基反应ppt课件
合集下载
【课件】羟基的保护与脱保护ppt

2
应用最广泛的几种保护基
硅醚保护基
三甲基硅醚 (TMS-OR) 叔丁基二甲基硅醚 (TBDMS-OR or TBS-OR) 叔丁基二苯基硅醚 (TBDPS-OR )
苄醚保护基 烷氧基甲基醚或烷氧基取代甲基醚 其他保护基
3
硅醚保护的优点
硅醚是最常见的保护羟基的方法之一。主要优点有:
硅-氮键的结合远比硅-氧键来的弱,硅原子优先与羟基上 的氧原子结合,这正是与其他保护基的不同之处。
4
硅醚保护的稳定性
硅醚对酸和碱都敏感; 但是不同的硅醚对酸,碱有相对的 稳定性。空间效应及电子效应是主要的影响因素 。
在酸中的稳定性为:
TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000);
基醚是应用较多的方法之一。一般来说,在分子中羟基位阻
不大时主要通过TBSCl对羟基进行保护。 但当羟基位阻较大
时则采用较强的硅醚化试剂TBSOTf来实现。生成的叔丁基二
甲基醚在多种有机反应中是相当稳定的,在一定条件下去保
护时一般不会影响其他官能团。它在碱性水解时的稳定性约
为三甲基硅醚的104倍。它对碱稳定。相对来说对酸敏感些。
TBS醚的生成和断裂的难易取决于空间因素,因此常常用于
对多官能团,位阻不同的分子进行选择性保护。在伯、仲醇
中,TBS基相对来说较易于与伯醇反应。TBS醚的断裂除了常
用的四烷基氟化胺外,许多情况下也可用酸来断。当分子内
没有对强酸敏感的官能基存在时,可用 HCl-MeOH, HCl-
Dioxane 体系去除TBS,若有对强酸敏感的官能基存在时,
6
三甲基硅醚(TMSOR)
应用最广泛的几种保护基
硅醚保护基
三甲基硅醚 (TMS-OR) 叔丁基二甲基硅醚 (TBDMS-OR or TBS-OR) 叔丁基二苯基硅醚 (TBDPS-OR )
苄醚保护基 烷氧基甲基醚或烷氧基取代甲基醚 其他保护基
3
硅醚保护的优点
硅醚是最常见的保护羟基的方法之一。主要优点有:
硅-氮键的结合远比硅-氧键来的弱,硅原子优先与羟基上 的氧原子结合,这正是与其他保护基的不同之处。
4
硅醚保护的稳定性
硅醚对酸和碱都敏感; 但是不同的硅醚对酸,碱有相对的 稳定性。空间效应及电子效应是主要的影响因素 。
在酸中的稳定性为:
TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000);
基醚是应用较多的方法之一。一般来说,在分子中羟基位阻
不大时主要通过TBSCl对羟基进行保护。 但当羟基位阻较大
时则采用较强的硅醚化试剂TBSOTf来实现。生成的叔丁基二
甲基醚在多种有机反应中是相当稳定的,在一定条件下去保
护时一般不会影响其他官能团。它在碱性水解时的稳定性约
为三甲基硅醚的104倍。它对碱稳定。相对来说对酸敏感些。
TBS醚的生成和断裂的难易取决于空间因素,因此常常用于
对多官能团,位阻不同的分子进行选择性保护。在伯、仲醇
中,TBS基相对来说较易于与伯醇反应。TBS醚的断裂除了常
用的四烷基氟化胺外,许多情况下也可用酸来断。当分子内
没有对强酸敏感的官能基存在时,可用 HCl-MeOH, HCl-
Dioxane 体系去除TBS,若有对强酸敏感的官能基存在时,
6
三甲基硅醚(TMSOR)
【精品】优化版10羟基化反应PPT课件

优化版10羟基化反应
卤代烃 重氮基
卤代芳烃的水解与分离
卤代芳烃水解产物--酚的分离
1、利用羟基的酸性除去非酸性物质 2、利用挥发酚与水共沸的原理减少水溶解损失 3、利用异构体氢键的差异分离异构体 4、利用熔点差异除去异构体
1、利用羟基的酸性除去非酸性物质
化学方程式
有机溶液溶解度 水溶性
活性炭吸附 挥发性
R
X
溶解 不溶解
吸附 挥发
OH-
R H+
OHO-
不溶解 溶解
不吸附 不挥发
R
OH
溶解 难溶解
吸附 挥发
2、利用挥发酚与水共沸的原理减少水溶解损失
大量酚类物质是挥发性的,即有一定的沸点;大量的酚 类物质又是水溶性的,即有较大的水溶解度;利用酚与水共 沸原理可以将酚从水中蒸净。
从蒸出的酚水中回收酚(酸化后分层或过滤)后,水层 是酚的饱和水溶液,可返回到下一批的水汽蒸馏,这样酚的 损失可减少至最低。
3、利用异构体氢键的差异分离异构体
异构体
氢键结构 氢键形式 挥发性质
OH NO2
H OO
N O
OH NO2
HO O N
O
OH
NO2
HO OON NhomakorabeaO N O OH
N
O
O OH
分子内氢键
分子间氢键
分子间氢键
易挥发
难挥发
难挥发
4、利用熔点差异除去异构体
一般,对称结构物质熔点较高。可通过结晶方式提纯对称 结构物质,去除不对称结构物质。
F
H 2O ,K O HF
H 2O F
F
N O 2
F
N O 2 H C l F
卤代烃 重氮基
卤代芳烃的水解与分离
卤代芳烃水解产物--酚的分离
1、利用羟基的酸性除去非酸性物质 2、利用挥发酚与水共沸的原理减少水溶解损失 3、利用异构体氢键的差异分离异构体 4、利用熔点差异除去异构体
1、利用羟基的酸性除去非酸性物质
化学方程式
有机溶液溶解度 水溶性
活性炭吸附 挥发性
R
X
溶解 不溶解
吸附 挥发
OH-
R H+
OHO-
不溶解 溶解
不吸附 不挥发
R
OH
溶解 难溶解
吸附 挥发
2、利用挥发酚与水共沸的原理减少水溶解损失
大量酚类物质是挥发性的,即有一定的沸点;大量的酚 类物质又是水溶性的,即有较大的水溶解度;利用酚与水共 沸原理可以将酚从水中蒸净。
从蒸出的酚水中回收酚(酸化后分层或过滤)后,水层 是酚的饱和水溶液,可返回到下一批的水汽蒸馏,这样酚的 损失可减少至最低。
3、利用异构体氢键的差异分离异构体
异构体
氢键结构 氢键形式 挥发性质
OH NO2
H OO
N O
OH NO2
HO O N
O
OH
NO2
HO OON NhomakorabeaO N O OH
N
O
O OH
分子内氢键
分子间氢键
分子间氢键
易挥发
难挥发
难挥发
4、利用熔点差异除去异构体
一般,对称结构物质熔点较高。可通过结晶方式提纯对称 结构物质,去除不对称结构物质。
F
H 2O ,K O HF
H 2O F
F
N O 2
F
N O 2 H C l F
羟基的保护(最全版)PTT文档

OH
Bi(OTf)3 (0.5mol%)
Ac2O( 10eq) MeCN, 4h, rt
OAc 94%
OH
CO2Me
Bi(OTf)3 (3mol%)
PivCl(1.5eq) CH2Cl2, 4h, rt
OPiv CO2Me
95%
R - O R '
F e C l3 / A c O H o r R - O A c R '= T H P ,T B S ,T P S
T烷E氧S的基水烷解基稳醚定保性护比基T有MMSO好M,(甲但氧比基TB甲S基差醚。)、MTH M(甲硫基甲CO 基O 醚Bu)t、M过 EM量 M e3Si-Im
COOBut H
如:HOAc-THF-H2O(4:2:1)/45 C O 可以出去TBS和THP,但不能除去MOM、MOEM和O MTM醚。
O T B S OO
O B z
TBDPS醚一般使用TBDPSCl/Imid/DMF体系,DMAP作催化,溶剂也可用DCM,但不能保护叔醇。
B n O
O H
O HO H
T B D P S C l( 1 .2 e q ) im id a z o le ( 1 .2 e q )
D M F , r t
B n O
F e C l3 / A c O H (3 e q )/ C H 2 C l2
8 0 - 9 9 %
2、酯类保护基的除去
一般情况下,酯类保护基的除去均在碱性条件下去除。
KC对N于、乙E酸t3N酯、保或护iP基r2一Ne般t等在。温在和水的和碱醇性的条体件系下中就乙可酸以酯出在去酸,催常化用下的也碱能为发K生2C水O3解、或N酯H3交、换肼除、去胍。、 位阻较大的Piv需要较强的碱性体系,如KOH/MeOH除去。但TBDMS醚是不能承受的, Piv的
精细合成单元反应与工艺第7章羟基化反应

近两年来,我国苯酚生产发展较块。2004年,上海 高桥石油化工公司新建的一套12.4万吨/年装置建成投 产,使我国苯酚总生产能力达到48.3万吨。2005年底, 随着哈尔滨华宇股份有限公司生产装置扩建到7.4万吨/ 年,我国苯酚总生产能力达到54万吨。其中,采用异 丙苯法的生产厂家有4家,总生产能力约为50.9万吨/年, 约占我国苯酚总生产能力的94.26%。
CH2CH2Cl
80~95℃ NaOH
CH2CH2OH
氯化物的水解工艺要点
1.氯化物不溶于水;搅拌和相转移催化剂 2.水解和消除反应的竞争;在发生取代反应时,
水解剂显示亲核性攻击碳原子;在发生消除反 应时,则水解剂取决于碱的性质接近β位氢原 子。因此,在进行取代反应时要求采用亲核性 相对较强的弱碱作水解剂,如Na2CO3;进行消 除反应则要求采用亲核性较弱的强碱,如 NaOH或Ca(OH)2。
NH 2
NaO 3S
H+
酸解
OH
NH 2
J酸
NaO 3S NaO 3S
NH2 SO 3Na
NaO
70 -80%NaOH 180 -270℃
NaO 3S
NH2
HO
H+
SO 3Na
酸解 NaO 3S
NH2 SO 3Na
H酸
OH NH2
HO 3S
γ-酸(6-氨基-4-羟基-萘-2-磺酸)
NH2 HO 3S
NH2
NaO3S
SO3H
23% NaOH 178~182℃ 0.6~0.7MPa,4h
~16% NaOH 228℃
3MPa,10h
OH NH2
NaO3S
SO3H
H酸单钠盐
羟基的保护与脱保护-PPT精选文档

硅-氮键的结合远比硅-氧键来的弱,硅原子优先与羟基上 的氧原子结合,这正是与其他保护基的不同之处。
4
硅醚保护的稳定性
硅醚对酸和碱都敏感; 但是不同的硅醚对酸,碱有相对的 稳定性。空间效应及电子效应是主要的影响因素 。 在酸中的稳定性为:
TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000);
CH3 CN
P y . C H 3C N
J .O r g .C h e m . 1 9 8 7 , 5 2 , 6 2 2
H O TBS 2
C 6H 5 C C Ph Si Ph 1 O OTHP
一般情况下,在TBDMS基团存在时,断裂DEIPS( 二乙基异丙 基硅基) 基团是较容易的,但实际得出的一些结果是相反的。 在这些例子中,分子结构中空间阻碍是产生相反选择性的原因。 电子效应的不同也会影响反应的选择性。对于两种空间结构相 似的醇来说,电子云密度不同造成酸催化去保护速率不同,因 此可以选择性去保护。这一点对酚基和烷基硅醚特别有效:烷 基硅醚在酸中容易去保护,而酚基醚在碱性条件下更容易去保 护。降低硅的碱性还可以用于改变Lewis酸催化反应的结果, 并且有助于选择性去保护。在硅原子上引入吸电子取代基可以 提高碱性条下水解反应的灵敏性,而对酸的敏感性降低。
羟基的保护与去保护
1
羟基的保护(前言)
羟基广泛存在于许多在生理上和合成上有意义的化合物中, 如核苷,碳水化合物、甾族化合物、大环内酯类化合物、聚 醚、某些氨基酸的侧链。另外,羟基也是有机合成中一个很 重要的官能基,其可转变为卤素、氨基、羰基、酸基等多种 官能团。在化合物的氧化、酰基化、用卤代磷或卤化氢的卤 化、脱水的反应或许多官能团的转化过程中,我们常常需要 将羟基保护起来。 在含有多官能团复杂分子的合成中,如何 选择性保护羟基和脱保护往往是许多新化合物开发时的关键 所在,如紫杉醇的全合成。羟基保护主要将其转变为相应的 醚或酯,以醚更为常见。一般用于羟基的保护醚主要有硅醚 、甲基醚、烯丙基醚、苄基醚、烷氧甲基醚、烷巯基甲基醚 、三甲基硅乙基甲基醚等等。羟基的酯保护一般用的不多, 但在糖及核糖化学中较为多见。
4
硅醚保护的稳定性
硅醚对酸和碱都敏感; 但是不同的硅醚对酸,碱有相对的 稳定性。空间效应及电子效应是主要的影响因素 。 在酸中的稳定性为:
TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000);
CH3 CN
P y . C H 3C N
J .O r g .C h e m . 1 9 8 7 , 5 2 , 6 2 2
H O TBS 2
C 6H 5 C C Ph Si Ph 1 O OTHP
一般情况下,在TBDMS基团存在时,断裂DEIPS( 二乙基异丙 基硅基) 基团是较容易的,但实际得出的一些结果是相反的。 在这些例子中,分子结构中空间阻碍是产生相反选择性的原因。 电子效应的不同也会影响反应的选择性。对于两种空间结构相 似的醇来说,电子云密度不同造成酸催化去保护速率不同,因 此可以选择性去保护。这一点对酚基和烷基硅醚特别有效:烷 基硅醚在酸中容易去保护,而酚基醚在碱性条件下更容易去保 护。降低硅的碱性还可以用于改变Lewis酸催化反应的结果, 并且有助于选择性去保护。在硅原子上引入吸电子取代基可以 提高碱性条下水解反应的灵敏性,而对酸的敏感性降低。
羟基的保护与去保护
1
羟基的保护(前言)
羟基广泛存在于许多在生理上和合成上有意义的化合物中, 如核苷,碳水化合物、甾族化合物、大环内酯类化合物、聚 醚、某些氨基酸的侧链。另外,羟基也是有机合成中一个很 重要的官能基,其可转变为卤素、氨基、羰基、酸基等多种 官能团。在化合物的氧化、酰基化、用卤代磷或卤化氢的卤 化、脱水的反应或许多官能团的转化过程中,我们常常需要 将羟基保护起来。 在含有多官能团复杂分子的合成中,如何 选择性保护羟基和脱保护往往是许多新化合物开发时的关键 所在,如紫杉醇的全合成。羟基保护主要将其转变为相应的 醚或酯,以醚更为常见。一般用于羟基的保护醚主要有硅醚 、甲基醚、烯丙基醚、苄基醚、烷氧甲基醚、烷巯基甲基醚 、三甲基硅乙基甲基醚等等。羟基的酯保护一般用的不多, 但在糖及核糖化学中较为多见。
高中化学精品课件:《羟基——重要的官能团》

从以上事实你可以得出什么结论?
拓展视野
四种高吸水性高分子材料
1、婴儿尿布; 2、土壤保湿材料; 3、水果保鲜材料; 4、防止建筑物潮湿、结霜材料
O
思考二、
HO
某有机物A的结构简式为
CH2 C OH
CH2CH2OH
写出该物质分别和Na、NaOH溶液、 NaHCO3溶液反应的产物。
NaO
O CH2 C ONa
A、CH2(OH)CH2(OH) C、CH2BrCH2OH
B、CH2BrCHO D、CH2BrCOOH
有机复习要在熟练掌握典型物质的性质 的基础上熟悉各类反应;以官能团为线索去 归纳整理是一种有效的复习方法。
练习、以CH3CH2OH为主要原料制备
COOCH2 COOCH2
试写出反应流程。如:A
加热
B
…
…
综合练习
1、下列关于羟基和氢氧根的说法错误的是( ) A、两种微粒的电子数不相等 B、羟基主要存在于醇、酚、羧酸和水等物质中 C、两种微粒内都有一对共用电子对 D、两种微粒在水溶液中均能独立存在
2、已知“尿不湿”中含有多种强吸水性的 高分子。下列物质中能作为“尿不湿”材料 的是( )
A、 NaHCO3溶液 B、稀盐酸 C、NaOH溶液
D、CO2
E、Na
4、下列有机物中,不仅能发生消去反应,而 且催化氧化后的产物还能发生银镜反应的是 ()
CH3
A、CH3 C CH2OH
CH3
CH3
B、 CH3 CH CHOH
CH3
C、CH3CH2CH2OH
D、
CH3CH2
CH3 C OH
CH3
羟基——重要的官能团
与羟基有关的会考考点
拓展视野
四种高吸水性高分子材料
1、婴儿尿布; 2、土壤保湿材料; 3、水果保鲜材料; 4、防止建筑物潮湿、结霜材料
O
思考二、
HO
某有机物A的结构简式为
CH2 C OH
CH2CH2OH
写出该物质分别和Na、NaOH溶液、 NaHCO3溶液反应的产物。
NaO
O CH2 C ONa
A、CH2(OH)CH2(OH) C、CH2BrCH2OH
B、CH2BrCHO D、CH2BrCOOH
有机复习要在熟练掌握典型物质的性质 的基础上熟悉各类反应;以官能团为线索去 归纳整理是一种有效的复习方法。
练习、以CH3CH2OH为主要原料制备
COOCH2 COOCH2
试写出反应流程。如:A
加热
B
…
…
综合练习
1、下列关于羟基和氢氧根的说法错误的是( ) A、两种微粒的电子数不相等 B、羟基主要存在于醇、酚、羧酸和水等物质中 C、两种微粒内都有一对共用电子对 D、两种微粒在水溶液中均能独立存在
2、已知“尿不湿”中含有多种强吸水性的 高分子。下列物质中能作为“尿不湿”材料 的是( )
A、 NaHCO3溶液 B、稀盐酸 C、NaOH溶液
D、CO2
E、Na
4、下列有机物中,不仅能发生消去反应,而 且催化氧化后的产物还能发生银镜反应的是 ()
CH3
A、CH3 C CH2OH
CH3
CH3
B、 CH3 CH CHOH
CH3
C、CH3CH2CH2OH
D、
CH3CH2
CH3 C OH
CH3
羟基——重要的官能团
与羟基有关的会考考点
羟基结构及性质

醇的脱水反应
01
02
03
分子内脱水
在加热条件下,醇可以在 分子内发生脱水反应生成 不饱和键。
分子间脱水
在加热条件下,两个醇分 子之间可以发生脱水反应 生成醚。
消除反应
在加热条件下,醇可以发 生消除反应生成烯烃。
04
羟基的应用
醇在工业上的应用
溶剂
醇类化合物是常见的工业 溶剂,可用于溶解和稀释 其他物质。
燃料添加剂
醇可作为燃料添加剂,提 高燃料的辛烷值和燃烧效 率。
化工原料
醇是许多化工产品的原料, 如塑料、合成橡胶、涂料 等。
醇在生物体内的角色
代谢中间体
醇在生物体内是许多代谢反应的中间体,如糖酵 解和三羧酸循环。
生物活性物质
某些醇类化合物具有生物活性,如乙醇(酒精) 和固醇类激素。
溶剂
醇在生物体内作为溶剂,帮助溶解和运输其他物 质。
团取代。
羟基的亲核性与溶剂有关,在 极性溶剂中,羟基的亲核性较 强,而在非极性溶剂中,羟基
的亲核性较弱。
羟基的氧化性
羟基可以被氧化成醛、 酮、酸等化合物。
在常温下,醇可以在 酸性条件下被高锰酸 钾等强氧化剂氧化成 酮或酸。
羟基的氧化性与氧化 剂的种类和浓度、温 度、压力等条件有关。
03
羟基的反应
醇的氧化反应
氧化生成酮
氧化生成羧酸
在催化剂的作用下,醇的α-H可以被 氧化生成酮。
在催化剂的作用下,醇可以被完全氧 化生成羧酸。
氧化生成醛
在催化剂的作用下,醇的α-H可以被 氧化生成醛。
醇的酯化反应
与羧酸反应
01
醇可以与羧酸பைடு நூலகம்应生成酯。
与酸酐反应
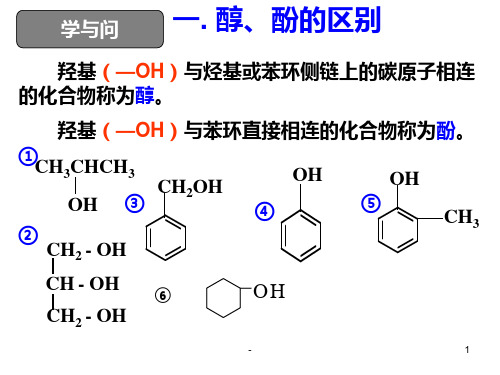
羟基(OH)与烃基或苯环侧链上的碳原子相连的化合物称...PPT课件
下列物质中,能使铜丝变红,且质量仍为m
g的是
BE
A.盐酸
B.酒精
C.稀硝酸
D.浓硫酸 E .CO
延伸:铜丝先放在外焰烧,后放在内焰烧,现象?
-
18
• 3.一元醇
A CH3OH
B
CH3
CH3
C
CH3
OH
C
CH3
CH2OH D C H 3 C
CH2OH
E
CH3
CH3 C
CH2 CH3
F
CH3 CH3 OH
中提取乙醇?如何检验是否还含有水?
3、能用乙醇萃取碘水中的碘吗?为什么?
-
5
醇的化学性质和应用
• 乙醇的化学性质——取代反应
(1)与活泼金属的反应 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 其它活泼金属如钾、钙、镁等也可与乙醇反应
2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑
H2O
结论:①醇分子间脱水得到醚。
②可以是相同的醇,也可以是不相同的醇。
练习:CH4O和C3H8O在浓硫酸加热的条件 下可以得到的产物有多少种?
解析: CH4O只能是CH3OH,而C3H8O有 两种1-丙醇、2-丙醇。然后考虑分子内脱水:
有一种;分子间脱水:有6种。
-
9
2)氧化反应
①燃烧
燃烧时产生淡蓝色的火焰,可作燃料
0.7893g/cm3 ❖溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
❖挥发性:易挥发
-
4
束
小知识:
含乙醇99.5%以上的酒精叫做无水酒精。 制取无水酒精时,通常需要把工业酒精(乙醇体积 含量96%)跟新制的生石灰混合,加热蒸馏才能制得
光催化氧化过程PPT课件

9
– 与无机离子的反应
电子转移
O C H d O H C 2 d O N H iO H N 2 i O T H 3 iO H T 4 i O H C2 3-O O H C-3O O H Br -3 O OH Br 3O
10
– 与无机离子的反应
夺氢反应
O H HC -3 H O 2O C-3O O H- 4 S H O 2 O S- 4 O O H H-3 S O H 2O S-3 O
<500
100± 20 < 3 × 1 0 -5 < 4 × 1 0 -2 (3 ± 1 )× 1 0 -2 (3± 3) × 103
K · OH M -1s -1 7 .8 × 1 0 9 3 .9 × 1 0 9 3 .0 × 1 0 9 7 .5 × 1 0 9 1 .3 × 1 0 8 1 .6 × 1 0 7 1 .4 × 1 0 6 3 .1 × 1 0 8 2 .2 × 1 0 10 3 .2 × 1 0 9 8 .5 × 1 0 7 7 .7 × 1 0 6 3 .1 × 1 0 8 1 .6 × 1 0 10
活泼自由基:·OH, ·OOH, ·O2-
27
0 Vacuum
E (NHE)
-2
SiC SrTiO3
-2
CdS
-4 CdSe
ZnO WO3TiO2
ZnS
BaTiO3
3.0
Fe2O3
SnO2
0
3.2
CdO
1.7 2.5
-6
3.2 3.2 3.2
3.7
3.2 2.2
2.1 2
3.8
-8 4
28
常用的半导体光催化剂:TiO2、CdS、 ZnO、WO3、Fe2O3、SnO2、SrTiO3等 其中催化活性最高: TiO2 、CdS、ZnO CdS、ZnO在光照时不稳定,金属离子溶 出;其优势在能隙较小,可吸收可见光。 TiO2 :不发生光腐蚀;耐酸碱性好,化学 性质稳定;对生物无毒性;来源丰富;能 隙较大(3.2ev,最大入射波长为 387.5nm),有很强的氧化还原能力;
– 与无机离子的反应
电子转移
O C H d O H C 2 d O N H iO H N 2 i O T H 3 iO H T 4 i O H C2 3-O O H C-3O O H Br -3 O OH Br 3O
10
– 与无机离子的反应
夺氢反应
O H HC -3 H O 2O C-3O O H- 4 S H O 2 O S- 4 O O H H-3 S O H 2O S-3 O
<500
100± 20 < 3 × 1 0 -5 < 4 × 1 0 -2 (3 ± 1 )× 1 0 -2 (3± 3) × 103
K · OH M -1s -1 7 .8 × 1 0 9 3 .9 × 1 0 9 3 .0 × 1 0 9 7 .5 × 1 0 9 1 .3 × 1 0 8 1 .6 × 1 0 7 1 .4 × 1 0 6 3 .1 × 1 0 8 2 .2 × 1 0 10 3 .2 × 1 0 9 8 .5 × 1 0 7 7 .7 × 1 0 6 3 .1 × 1 0 8 1 .6 × 1 0 10
活泼自由基:·OH, ·OOH, ·O2-
27
0 Vacuum
E (NHE)
-2
SiC SrTiO3
-2
CdS
-4 CdSe
ZnO WO3TiO2
ZnS
BaTiO3
3.0
Fe2O3
SnO2
0
3.2
CdO
1.7 2.5
-6
3.2 3.2 3.2
3.7
3.2 2.2
2.1 2
3.8
-8 4
28
常用的半导体光催化剂:TiO2、CdS、 ZnO、WO3、Fe2O3、SnO2、SrTiO3等 其中催化活性最高: TiO2 、CdS、ZnO CdS、ZnO在光照时不稳定,金属离子溶 出;其优势在能隙较小,可吸收可见光。 TiO2 :不发生光腐蚀;耐酸碱性好,化学 性质稳定;对生物无毒性;来源丰富;能 隙较大(3.2ev,最大入射波长为 387.5nm),有很强的氧化还原能力;
羟基的保护与去保护.ppt

方法2.2.1:THP
1. THP醚引入形成了一个非对映体,使NMR谱的表达有点困难。 2. 成本低,易于分离,对大多数非质子酸试剂有一定的稳定性,易于除去。 3. 引入THP常用三氟化硼醚化物(BF3.Et2O),对甲苯磺酸(TsOH),吡
啶对甲苯磺酸盐(PPTs)作催化剂。 4. 几乎任何酸性试剂或任何可以在原位产生酸的试剂都可被用来引入THP
(硅原子对氟原子的亲和性远远大于硅-氧之间的亲和性)
4. 硅醚稳定性规律:
在酸中的稳定性: TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000); 在碱中稳定性: TMS (1)<TES (10-100)<TBDMS~TBDPS (20,000)< TIPS (100,000)
方法2.1.3:TBDPS保护
1. 酸性水解条件下,TBDPS 保护基比TBDMS 更加稳定(约100 倍)。 (80%乙酸能够水解TBDMSOR,却无法水解TBDPSOR)
2. TBDPS 保护基对碱的稳定性比TBDMS 要差。(仍然对K2CO3/CH3OH、9M 氨水-60℃-2h、MeONa(cat.)/CH3OH-25℃-24h 稳定。)
(硅-氮键的结合远比硅-氧键来的弱,硅原子优先与羟基上的氧原子结合 结合活性:ROH〉ArOH〉RCOOH〉NH〉CONH〉SH〉CH)
2. 随着硅原子上的取代基的不同(空间效应具有广泛的选择余地
3. 易脱保护: 羟基硅醚都可以通过四烷基氟化胺(如TBAF)脱除
酰化选择性:1. 伯醇 > 仲醇;2. Pv > Bz > Ac
实施:
1. 保护:酰氯 or 酸酐/吡啶回流,有时也用到酰化催化剂DMAP、4-PPY 2. 去保护:碱性水解
羟基化反应 PPT课件

芳伯胺和重氮盐的羟基化1oh置换nh芳伯胺酸性水解法在稀硫酸磷酸和盐酸中进行用亍萘胺及衍生物的水解34碱性水解在碱性熔融条件下将nh转化成oh变色酸35nahso水解即某些芳伯胺在nahso水溶液中常压沸腾回流100104然后再加碱处理即可完成nh被oh的置换反应适用于易互变异构为亚胺式容易和亚硫酸氢钠形成加和物的萘系胺类衍生物362oh置换重氮基一般用重氮硫酸盐进行用重氮化盐酸盐水解须先将重氮盐不氟硼酸作用生成氟硼酸重氮盐然后用冰hac处理得乙酸芳酸再水解即成酚37重氮盐水解
(3)碱熔时间和温度 碱熔的温度主要决定于磺酸的结构。
不活泼磺酸,用熔融碱在300~340℃进行常压碱 熔。一般在熔融碱中加完磺酸盐后数10分钟即到 终点。 温度过高或时间过长,都会增加副反应,但温 度太低会产生凝锅事故。
比较活泼的磺酸,可选用70%~80%的苛性钠溶 解,在180~270℃之间进行碱熔。 更活泼的萘系多磺酸,则可在20%~30%稀碱溶 液中进行加压碱熔,反应时间:10-20h.
(5)苯基二氯甲烷的水解
五.芳环上直接羟基化
1、亲电取代(苯液相直接羟基化) 历程:
2.自由基取代 代表性反应:FeSO4—H2O2水溶液与苯环的作用
第一步是反应速度的控制阶段。与其他自由基反应一 样,·OH自由基的寿命及其进攻芳环的几率是 是发生羟基化反应的决定性因素。
2.金属—氧络合物 历程很复杂尚无定论
④水杨酸脱羧生成苯酚
八.氰基的水解
(1)—CN水解生成羧基(—CN的完全水解)
CH2CN +H2O
70%H2SO4 100℃
CH2COOH
目前方法:一氯共羰基化合法
CH2Cl +H2O + CO
CH2COOH
(3)碱熔时间和温度 碱熔的温度主要决定于磺酸的结构。
不活泼磺酸,用熔融碱在300~340℃进行常压碱 熔。一般在熔融碱中加完磺酸盐后数10分钟即到 终点。 温度过高或时间过长,都会增加副反应,但温 度太低会产生凝锅事故。
比较活泼的磺酸,可选用70%~80%的苛性钠溶 解,在180~270℃之间进行碱熔。 更活泼的萘系多磺酸,则可在20%~30%稀碱溶 液中进行加压碱熔,反应时间:10-20h.
(5)苯基二氯甲烷的水解
五.芳环上直接羟基化
1、亲电取代(苯液相直接羟基化) 历程:
2.自由基取代 代表性反应:FeSO4—H2O2水溶液与苯环的作用
第一步是反应速度的控制阶段。与其他自由基反应一 样,·OH自由基的寿命及其进攻芳环的几率是 是发生羟基化反应的决定性因素。
2.金属—氧络合物 历程很复杂尚无定论
④水杨酸脱羧生成苯酚
八.氰基的水解
(1)—CN水解生成羧基(—CN的完全水解)
CH2CN +H2O
70%H2SO4 100℃
CH2COOH
目前方法:一氯共羰基化合法
CH2Cl +H2O + CO
CH2COOH
羟基结构及性质ppt课件

3.可发生消去反应,如乙醇脱水生成乙烯。
4.可发生置换反应,醇羟基与金属钠反应置 换了羟基中的氢原子,生成了氢气。
5
羟基的还原性
具有还原性,可以被氧化成醛、酮或酸; 一级醇及二级醇与醇羟基相连的碳
原子上有氢, 三级醇与醇羟基相连的碳原子上没
有氢,不易被氧化,
6
羟基的弱酸性
醇羟基——不体现酸性(阿伦尼乌斯酸碱理论中), 酚羟基和羧羟基——体现弱酸性(因而苯酚可与钠反
-C,因为能生成稳定烯烃。该规则称8
羟基的置换反应
9
羟基的消去反应
10
羟基的取代反应
与氢卤酸的反应生成卤代烷
氢卤酸与醇反应生成卤代烷,反应中醇羟基被卤原子取代。
ROH+HX——>RX+H20 醇与卤化磷反应生成卤代烷
醇羟基是一个不好的离去基团,与三溴化 磷作用形成 CH3CH2OPBr2,Br进攻烷基 的碳原子,-OPBr2作为离去基团 离去。OPBr2中还有两个溴原子,可继续与醇发生11 反
羟基的取代反应
12
物质 结构简式
羟基的性质 羟基中
氢原子 的活泼
性
酸性
与金
属Na 反应
与
NaOH
反应
乙醇
CH3CH2OH
苯酚
增
C6H5OH
强
乙酸 CH3COOH
中性 能 不 能
比能H2CO能3还弱能 能
与
Na2CO3
反应
-OH
羟基、羟
不能 基氢均可
被取代
羟基难取 代、羟基
能 氢能电离
-H易电离 羟基可取 代
羟基的结构和性质
高中有机化学
1
“羟”的由来
4.可发生置换反应,醇羟基与金属钠反应置 换了羟基中的氢原子,生成了氢气。
5
羟基的还原性
具有还原性,可以被氧化成醛、酮或酸; 一级醇及二级醇与醇羟基相连的碳
原子上有氢, 三级醇与醇羟基相连的碳原子上没
有氢,不易被氧化,
6
羟基的弱酸性
醇羟基——不体现酸性(阿伦尼乌斯酸碱理论中), 酚羟基和羧羟基——体现弱酸性(因而苯酚可与钠反
-C,因为能生成稳定烯烃。该规则称8
羟基的置换反应
9
羟基的消去反应
10
羟基的取代反应
与氢卤酸的反应生成卤代烷
氢卤酸与醇反应生成卤代烷,反应中醇羟基被卤原子取代。
ROH+HX——>RX+H20 醇与卤化磷反应生成卤代烷
醇羟基是一个不好的离去基团,与三溴化 磷作用形成 CH3CH2OPBr2,Br进攻烷基 的碳原子,-OPBr2作为离去基团 离去。OPBr2中还有两个溴原子,可继续与醇发生11 反
羟基的取代反应
12
物质 结构简式
羟基的性质 羟基中
氢原子 的活泼
性
酸性
与金
属Na 反应
与
NaOH
反应
乙醇
CH3CH2OH
苯酚
增
C6H5OH
强
乙酸 CH3COOH
中性 能 不 能
比能H2CO能3还弱能 能
与
Na2CO3
反应
-OH
羟基、羟
不能 基氢均可
被取代
羟基难取 代、羟基
能 氢能电离
-H易电离 羟基可取 代
羟基的结构和性质
高中有机化学
1
“羟”的由来
醇、酚——羟基化合物PPT 苏教版

明 月 几 时 有 把 酒 ? 问 青 天
各类酒精
工业酒精约含乙醇96%(体积分数), 无水酒精含乙醇99.5%以上 啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%, 白酒含酒精50%—70%
乙醇的分子组成和结构
1.乙醇的分子式:C2H6O
H H - - 2.乙醇的结构式: H-C-C-O-H - - H H
(1)取代反应 A、与活泼金属的反应 2CH3CH2-OH + 2Na 2CH3CH2ONa + H2↑
H H C H H C H O H
断键的位置:
产物乙醇钠在水中强烈水解 CH3CH2-ONa + H2O CH3CH2OH + NaOH
B 、分子间取代: CH3CH2O—H + 断键的位置
浓H2SO4 HO—CH2CH3 140℃
CH3CH2OH
浓硫酸、加热到 170℃ C—O、C—H C=C CH2=CH2、H2O
化学键的断裂
化学键的生成 反应产物
(3)氧化反应
H H C H O H + O2
Cu或Ag
H
△
H C O + 2H2O
2H
C H
2H
C H
断键的位置 思考:若遇强氧化剂,乙醇会发生怎样的变化?
CH3CH2OH
氧化
8、为何教材中使用NaOH溶液进行洗气?要除去什么 杂质气体? 因CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响 乙烯的检验,故必须用NaOH溶液先将其除去。
交流与讨论:
溴乙烷与乙醇都能发生消去反应,它们有什么异同? CH3CH2Br
反应条件 NaOH的乙醇溶 液、加热 C—Br、C—H C=C CH2=CH2、HBr
第十二章羟基化

O H C H 3 C H 3
• 先将2,3-二甲基苯胺和硫酸的混合物冷却至0~ 5℃,逐渐加入亚硝酸钠溶液进行重氮化反应。 然后将重氮盐缓缓加入到已预热至160℃的稀硫 酸中进行水解反应,生成的2,3-二甲基苯酚用水 蒸汽蒸馏,所得的粗品用苯重结晶,即可得到产 品。
第四节 其它羟基化反应
• 一、烃类的氧化-酸解制酚 • ★1.异丙苯氧化-酸解制苯酚
S O 3
O H +
H O S O 3
O
O H
• 芳磺酸盐在高温与熔融的苛性碱溶液作用下,使 磺酸基被羟基所置换的反应称为碱熔。生成的酚 再用无机酸酸化,即转变成游离酚。
• ★2. 影响因素
– (1)磺酸的结构
• 碱熔反应属于亲核置换反应,因此芳环上含有吸 电子基(如磺酸基和羧基)时,对磺酸基的碱熔 起活化作用。
• (3)硝基氯苯的水解
• 当苯环上氯基的邻位或对位含有硝基时,由于硝 基的强吸电子作用的影响,苯环上与氯基相连的 碳原子上的电子云密度显著降低,亲核反应活性 显著增加,使氯基较易水解。因此只需要用稍过 量的氢氧化钠溶液,在较温和的反应条件下进行 水解。例如:
C l a O H + 2N N O 2 C l N O a O H 2 + 2N
N a O S 3
O N a
2 0 0 ~ 2 2 0 ℃ , 1 . 1 M P a
• 三、应用实例 • ★1. 2-萘酚的制备
• 2-萘酚及其磺酸衍生物是合成染料、有机颜料、 农用化学品、医药化学品、香料以及表面活性剂 的重要中间体。
• 2. 2-氨基-5-萘酚-7-磺酸(J酸)的生产
• J酸也是重要的染料中间体,它是由吐氏酸经磺 化、酸性水解和碱熔而制得的。 其化学反应过 程如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
◈ 室温下放置即可得到全乙酰化产物。 ◈ 糖的乙酰化反应没有选择性,但催化剂的
不同对乙酰化产物的端基异构现象有影响。
5、酰化反应的作用: 判断糖分子结构上-OH数目、保护-OH等
(三)缩醛化与缩酮化反应
1、概念:酮或醛在脱水剂存在下可与具有适
当空间位置的多元醇的二个羟基形成环状缩酮
或环状缩醛的过程。
4、酸催化水解反应机理:
O
H
+
阳 碳 离 子
O 2 +H
+ H
O O H 2
+ + -H
O O R
+ H +
O O R
-R O H
O
H O , H
O H
半 椅 式
中 间 体
5、酸水解反应规律:
⑴ 不同苷原子,酸水解顺序为: N > O > S > C (从易到难)
⑵ 呋喃糖苷较吡喃糖苷易水解 ⑶ 酮糖较醛糖易水解 ⑷ 吡喃糖苷中: 五碳糖 > 甲基五碳糖 > 六碳糖 > 七碳糖 》糖醛酸(从易到难)
位和H-内位两种存在方式。
4,6-O-苯甲叉-α-D-半乳吡喃糖甲苷
C6H5 H O O O
O C6H 5 O
H O O M e
O Me
顺式(O-内位)
顺式(H-内位)
H C6 H5
O O
O OMe
反 式的4,6-O-苯 甲 叉- α -D葡萄吡喃糖甲 苷
(四)硼酸的络合反应
1、硼酸络合反应分二步进行: ① 生成1:1的络合物
⑴开链化合物:碳链上 -OH 越多,越易造成
有利位置,越利于与硼酸的络合。
⑵环上的二-OH:
※ 芳环-OH —— 邻位易,间、对位次之;
※ 五元、六元脂环——顺邻二-OH易络合,
反式邻二-OH不作用。
※ α-羟酸(HO-C-COOH)可络合[-COOH水
化成-C(OH)3后再络合];
※ β-羟酸无作用。
⑸ 有氨基取代的糖较-OH糖难水解,-OH糖
又较去氧糖难水解。
2,6-二去氧糖 > 2-去氧糖 >6-去氧糖 > 2-羟
基糖 > 2-氨基糖(从易到难) ⑹ 芳香属苷较脂肪属苷易水解。 酚苷(如蒽醌苷)> 醇苷(如萜、甾苷等) ⑺ 苷元为小基团——横键的苷键比竖键易水 解,即e > a 苷元为大基团——竖键的苷键比横键易水
叉衍生物过程中易转变为呋喃糖结构。
O
O
转 变 成 呋 喃 糖 结 构 O
硫 酸 丙 酮
O
O
O O
D 葡 萄 糖
呋 喃 糖
1 , 2 ; 5 , 6 二 O 异 丙 叉 D 葡 萄 糖
7、糖与苯甲醛生成的六元环状缩醛称为
苯甲叉衍生物。 ① 吡喃糖与与苯甲醛生成的苯甲叉衍生物
有顺式与反式两种构象,其中顺式还有O-内
③ Hakomori法(箱守法)
◈以NaH与CH3I做试剂,二甲基亚砜
(DMSO)做溶剂。
◈ 反应机理为:
O O
Na H
+
CH3
S S CH3 CH2 CH3
R CH3I R-O-CH3 R-O
O-H
◈ 优点:一次反应即可获得全甲醚化产物,
反应速度大大加快。
◈ 该法甲醚化能力最强,后处理相对简单。
2、常用的脱水剂: 矿酸、无水ZnCl2、
无水CuSO4等 常用的多元醇:邻二醇、1,3-二醇等
3、酮类易与顺邻二醇羟基生成五元环状物; 醛类易与1,3-二醇羟基生成六元环状物。 4、缩酮和缩醛衍生物性质: 对碱稳定,对酸不稳定。
5、缩酮和缩醛反应的作用:
◈ 作为某些羟基的保护剂
◈ 推测结构中有无顺邻二醇羟基或
羟基反应
(一) 醚化反应
1、含甲醚化、三甲基硅醚化和三苯甲醚化等. 2、甲醚化常用方法 ① Haworth法 ◈ 以硫酸二甲酯做试剂,在浓NaOH(30%)
中进行。
◈ 本法不常用
② Purdic法
◈ 以碘甲烷做试剂,Ag2O做催化剂。 ◈ 比Haworth法甲醚化能力强。 ◈ 该法只能用于苷,不宜用于还原糖的甲醚 化。 ◈ Kohn法 —改良的Purdic法 所用溶剂为 DMF (二甲基甲酰胺),其 甲醚化能力有所增强。
箱守法是最常用的甲醚化方法。
◈ 缺点: NaH 具有较强的还原能力,可能 会使某些基团发生还原反应。
④ 重氮甲烷法(CH2N2)
※ 样品 + CH2N2 / Et2O + MeOH
→ 部分甲基化
※ 该法适合于含-COOH、-CHO的糖类 化合物的部分甲醚化过程。
3、三苯甲醚化
①使用三苯甲氯在吡啶溶液中与糖及其苷进行 反应,可制得三苯甲醚类化合物。
O H O H
+
H3 B O 3
O O
O H
H
B
O H
+
+ H2O
(两个羟基地位 不适宜产生中性酯)
O O
H B O
+ H2O
I
②二个-OH位置适宜,则继续生成2:1的 螺环状络合物。
H -
O O
O H O H
B I I
+
+O H
O H
O O
O O
B
H
+
I I I
5、硼酸络合反应对二羟基位置的
空间要求
◈ 游离糖在生成异丙叉衍生物过程中, 其氧环的大小可根据需要发生改变。
◆ 当糖具有顺邻-OH时,在生成异丙叉
衍生物过程中吡喃糖结构可保留
O
O
+
H S O 2 4 H O 2
O O O O O
M e M e
α D 半 乳 糖
1 , 2 ; 3 , 4 二 O 异 丙 叉 α D 半 乳 吡 喃 糖
◆当糖结构中无顺邻-OH时,则在生成异丙
1,3-二醇羟基结构
例如:制备3-O-甲基葡萄糖的反应
O O
缩醛对碱稳定 O
NaOH
H
O O
O
MeO O O
缩醛对酸敏感
H
HO O O
(CH3)2SO4
1,2;5,6-二-O-异丙 叉-D-葡萄糖
H2O
HCl
O
MeO
3-O-甲 基葡萄糖
6、丙酮与邻二醇羟基生成的五元环状缩酮
称为异丙叉衍生物,即丙酮加成物。
6、糖及其苷类化合物与硼酸发生络合反应的
难易程度(从易到难)
呋喃糖苷 > 五碳醛糖 > 六碳醛糖> 吡喃糖苷
7、硼酸络合反应的应用
① 酸碱中和滴定;②通过离子交换、电泳、硅
胶等色谱方法进行分离与鉴定。
第四节 苷键的裂解
一、酸催化水解反应 1、苷键性质:苷键属于半缩醛结构,对碱稳定 ,易为稀酸催化水解。 2、酸催化水解常用试剂:水或稀醇 3、酸催化水解常用催化剂:稀盐酸、稀硫酸、 乙酸与甲酸等。
② 本法可用于C6或C5伯羟基的保护,其脱除
保护基也很方便,只要在HBr的醋酸溶液中应:乙酰化与甲苯磺酰化
2、不同羟基反应活性:
C1-OH > C6-OH 》C3最难 3、磺酸酯水解时常引起羟基的构型发生改变 4、乙酰化反应特点: ◈ 反应条件:溶剂为醋酐, 催化剂多为吡啶、氯化锌等。
