初中人教版九年级下册化学盐的化学性质复分解反应课件PPT
合集下载
人教九下化学11.1 生活中常见的盐—— 复分解反应实质 课件(共42张PPT)
NO3-
NO3-
K+
K+
NO3-
K+
NaCl+KNO3 ——
K+ NO3-
Cl-
Na+
Na+ Cl-
K+
NO3-
NO3-
NO3K+
K+
NaCl+KNO3 ——
Cl-
Na+
K+ NO3-
NO3-
Na+
Cl-
NO3K+
K+
NO3-
K+
NaCl+KNO3——
K+ NO3-
ClNa+
NO3-
K+
Na+
Ca2+
HO-
HO-
HO-
Ca2+
HO-
Ca(OH)2+CuCO3 ——
Ca2+
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+ CuC2O+ 32C-O3C2u- 2+CuC2O+ 32-
HO-
Ca2+ HO-
HOHO-
Ca(OH)2+CuCO3 ——
HOCa2+
HO-
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+
⑹HCl + ⑺H2SO4 ⑻CaO +
NaOH == NaCl +CuO==CuSO4 H2O =Ca(OH)2
+ H2O +H2O
⑼BaCl2 + Na2SO4 == BaSO4↓+ 2NaCl
人教版新版化学九年级下册 第十单元+10.3 常见的盐 第2课时 复分解反应 课件

正确的是( D )
选项
除去的杂质离子
选择的试剂
现象预测
A
Ca2+
Na2CO3溶液
产生白色沉淀
B
Mg2+
NaOH溶液
产生白色沉淀
C
S−
BaCl2溶液
产生白色沉淀
D
K+
稀盐酸
产生气泡
易错点:对复分解反应的判断有误
8.下列反应中不属于复分解反应的是( C )
A.H2SO4+Ca(OH)2===CaSO4+2H2O
A.反应物中有酸
B.生成物都有盐
C.反应物都溶于水
D.反应有明显现象
3.(江苏省南菁高级中学月考)下列各组溶液混合,能发生复分解反应,
且既无沉淀又无气体产生的是( C )
A.NaNO3和HCl
B.Na2CO3和HCl
C.NaOH和H2SO4
D.Na2CO3和Ca(OH)2
4.下表是部分物质的溶解性表(20 ℃ ),利用表中提供的信息回答下列问
题。
OH-
H+
NO3−
Cl-
SO2−
4
CO2−
3
溶、挥
溶、挥
溶
溶、挥
Na+
溶
溶
溶
溶
溶
Ca2+
微
溶
溶
微不Biblioteka Ba2+溶溶
溶
不
不
Cu2+
不
溶
溶
溶
—
(1)判断下列反应是否能够发生,说明理由。
①NaOH溶液和Ba(NO3)2溶液:不能发生反应,因为两种物质交换成分后,
没有沉淀、气体或水生成。
② Na2SO4溶液和BaCO3: 不能发生反应,因为两种盐反应时反应物都要
最新人教版九年级下册化学PPT教学课件11.1.2复分解反应和盐的化学性质
、CO32
、SO24
7.(1分)(2020·南阳模拟)用括号内的物质不能区分的一组是( A ) A.NaOH、NaCl、Na2SO4三种溶液(酚酞) B.Na2CO3、AgNO3、BaCl2三种溶液(稀盐酸) C.铁粉、碳粉、氧化铜粉末(稀硫酸) D.NaCl、NaOH、NH4NO3三种固体(水)
A.该溶液是一种碱的溶液
B.该溶液中含有 SO24 离子 C.该溶液中的溶质可能是Na2CO3 D.该溶液能使紫色石蕊溶液变红色
加入的物 酚酞溶 BaCl2
质
液
溶液
稀盐酸
实验现象 变红色
白色沉 淀
产生气 体
6.(3分)(2020·满洲里模拟)如图是生成盐的五种化学反应,请回答下列问题。
(1)若反应②中生成的盐是BaSO4,则所用的酸是___H_2S__O_4 __(写化学式); (2)若反应③用氢氧化钙与硫酸铜溶液反应,则生成的盐名称是___硫__酸__钙____;
(2)向第二支试管的滤液中滴入适量的___B_a_(_O_H_)_2 __溶液,反应方程式为 ___B_a_(_O_H_)_2+_K_2_C_O_3_=_=_=_=_B_a_C_O_3↓__+_2_K_O_H___,再经过滤、蒸干滤液,得到白色固 体氢氧化钾。
3.复分解反应发生的条件: 当两种化合物互相交换成分,生成物中有___沉__淀____、___气__体____或___水____生 成时,复分解反应才可以发生。
二、盐的化学性质 1.与某些金属发生置换反应生成另一种金属和另一种盐: 如铁与硫酸铜溶液反应的化学方程式为 ___F_e_+_C_u_S_O_4_=_=_=_=_C_u_+_F_e_S_O_4 __。 2.与某些酸发生复分解反应生成另一种盐和酸: 如氯化钡与硫酸溶液反应的化学方程式为 ___B_a_C_l_2+_H_2_S_O_4_=_=_=_=_B_a_S_O_4↓__+_2_H_C_l___。
人教版九年级化学下册第11单元复习课件2盐的化学性质与复分解反应(共43张PPT)
A.加入AgNO3溶液和几滴稀硝酸 B.加入紫色的石蕊试液 C.加入BaCl2溶液和几滴稀硝酸 D.先加入紫色的石蕊试液,再另取溶 液加入AgNO3溶液和几滴稀硝酸
A、产生白色AgCl沉淀只能鉴定有Cl-
B、紫色石蕊变红色只能鉴定有H+
C、不反应 D、紫色石蕊变红色鉴定有H+,产生白色 AgCl沉淀鉴定有Cl-
B.在氢氧化钠溶液中:H+、Mg2+、Cl-
C.在氯化钠溶液中:K+、Ca2+、NO3D.在硫酸铵溶液中:Na+、Cu2+、OH-
H+ OH-
NH4+
物质或离子共存题
2、下列各组物质分别加入足量的水中,能得到
无色透明溶液的是( )
D
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2 C.CuSO4、KCl 、HCl D.Na2CO3、NaCl、Na2SO4
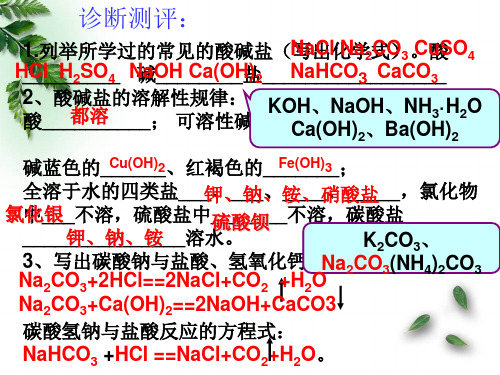
诊断测评:
1.列举所学过的常见的酸碱盐(N写a出Cl化N学a2式CO)3。Cu酸SO4 H_C_l__H_2_S_O_4_ N碱aO__H_C__a_(O__H盐)2___N_a_H__C_O_3__C_a_C__O_3_ 2酸、__酸_都碱__溶盐__的__溶_解;性可规溶律性:碱有K5O种CHa_、(_ON_H_a)_O2_、H_、B__aN,(OH不H3·)溶H22性O
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
AgNO3+HCl=AgCl +HNO3
Ca(OH)2+2HCl=CaCl2+2H2O
复分解反应的产物--沉淀、气体或水
八大沉淀
不共存离子对
A、产生白色AgCl沉淀只能鉴定有Cl-
B、紫色石蕊变红色只能鉴定有H+
C、不反应 D、紫色石蕊变红色鉴定有H+,产生白色 AgCl沉淀鉴定有Cl-
B.在氢氧化钠溶液中:H+、Mg2+、Cl-
C.在氯化钠溶液中:K+、Ca2+、NO3D.在硫酸铵溶液中:Na+、Cu2+、OH-
H+ OH-
NH4+
物质或离子共存题
2、下列各组物质分别加入足量的水中,能得到
无色透明溶液的是( )
D
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2 C.CuSO4、KCl 、HCl D.Na2CO3、NaCl、Na2SO4
诊断测评:
1.列举所学过的常见的酸碱盐(N写a出Cl化N学a2式CO)3。Cu酸SO4 H_C_l__H_2_S_O_4_ N碱aO__H_C__a_(O__H盐)2___N_a_H__C_O_3__C_a_C__O_3_ 2酸、__酸_都碱__溶盐__的__溶_解;性可规溶律性:碱有K5O种CHa_、(_ON_H_a)_O2_、H_、B__aN,(OH不H3·)溶H22性O
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
AgNO3+HCl=AgCl +HNO3
Ca(OH)2+2HCl=CaCl2+2H2O
复分解反应的产物--沉淀、气体或水
八大沉淀
不共存离子对
九年级人教版下学期化学盐的化学性质复分解反应课件

①观察:上述几个反应有什么特点? ②讨论:由此,你又有哪些新发现? ③归纳:复分解反应的概念、一般形式与特点。
讲授新课
二 复分解反应
酸、碱、盐
复分解反应:由两种化合物互相交换成分,生成另 外两种化合物的反应。
+
+
AB + CD → AD + CB
思考:什么条件下复分解反应才能发生呢???
讲授新课
讲授新课
怎样检验这 些物质中含 有碳酸呢?
讲授新课
以检验碎蛋壳为例
实验用品 实验步骤 实验现象 实验结论
试管、导管 1.将碎蛋壳 1 .
。
连单孔塞、
。
铁架台 2 .
。 2.
。
。
讲授新课
小结
碳酸根或碳酸氢根离子检验方法:
某物质 +稀盐酸
(含碳酸根或碳 酸氢根离子)
+澄清石灰水
产生气体
变浑浊
CO2
CaCO3
讲授新课
2.与碱溶液反应
【实验11-2】向盛有少量碳酸钠溶液 的试管中滴入澄清石灰水,观察现象。
现象: 试管里出现白色沉淀。 分析: 碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
澄清石灰水 碳酸钠
这个原理常用作两种碱之间的相互转化
没发生改变
Na+、SO42- K+、NO3- K+、SO42- Na+、NO3-
反应前
反应后
讲授新课
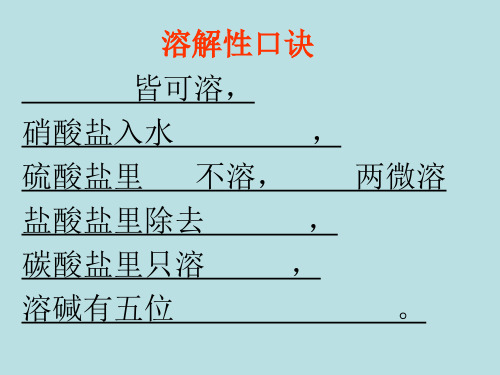
盐在水中的溶解性各不相同
这些你都记 住了吗?
➢ 钾盐、钠盐、铵盐、硝酸盐都可溶; ➢ 盐酸盐只有氯化银不可溶; ➢ 硫酸盐只有硫酸钡不可溶; ➢ 碳酸盐只溶钾、钠、铵,剩下都不溶。
人教版九年级下册 第十一单元 课题1 生活中常见的盐 复分解反应的实质及应用 (共25张PPT)

2、溶液成分的研究
甲化工厂排出的废水中含有少量氢氧化钠 和硫酸钠,与乙化工厂排出的废水混合后, 测得溶液的PH=7,且只含有氯化钠一种溶 质。 请填空:1、乙化工厂的废水中含有的物质 是:_______________ (填化学式) HCl BaCl2 2、写出反应的化学方程式:__________ ______________________________. NaOH+HCl=NaCl+H2O
Na+
结论:
有BaSO4沉淀生成的 复分解反应实质是 Ba2+和SO42-反应
对于复分解反应三个条件我们进行微观总结: 1、有水生成: H+ + OH- → H2O 2、有气体生成:
H+ + CO32- ( H+ + HCO3- ) + NH + OH 4 NH3 3、有沉淀生成:
co2
碱的沉淀 Mg
复分解反应的实质及应用
我们怎么解决这样的问题?
1、某化工厂排出的废水中含有少量氢氧化钠和硫 酸钠,我们如何处理,让废水只含有氯化钠呢? 2、海水晒盐得到的食盐中还含有
硫酸钠,氯化镁,氯化钙
等可溶性杂质,我们如
何处理,才能得到纯净
的氯化钠呢?
板块一:复分解反应的实质
酸、碱、盐、氧化物
由两种化合物互相交换成分 生成另外两种化合物的反应叫 做 复分解反应
板块二:复分解反应实质的应 用
1、溶液中的离子共存问 B 题 例1、下列各组物质,能共同存在于水溶液中的是(
A. H2SO4 Na2CO3 KOH C.AgNO3 BaCl2 K2SO4 B.MgCl2 CuSO4 NaNO3 D.HCl K2CO3 NaNO3
最新中考专项复习盐的性质与复分解反应 (共23张PPT)教育课件

性质
举例
碳酸钙与盐酸:_____________________ _C_a_C_O_3+__2_H_C_l=_=_=_C_a_C_l2_+_H_2_O_+CO2↑ 碳酸钠与盐酸:______________ __N_a_2_C_O_3+__2H__C_l=_=_=2_N_a_C_l+_ H2O+CO2↑ (4)盐+酸→ 碳酸氢钠与盐酸:_______________ 新盐+新酸 ____N_aH__C_O_3+__H_C_l=_=_=_N_aCl+H2O+CO2↑ 硝酸银与盐酸:______________
酸碱性 使紫色石蕊溶液变___蓝___,使酚酞溶液 变_红_____
碳酸氢钠受热分解(产物为碳酸钠、水和
(2)某些盐的 热不稳定性
C__O_2_2)_:N_a__H____C__O____3=___=_△_=__=__=___N__a_2_C_O__3+__H__2O__+__C_O_2_↑ 碳酸钙高温分解:___________________
④___白_色____ 用于玻璃、造 固体、易溶 纸、纺织和洗
于水 涤剂的生产等
碳酸氢钠⑤ ____N_a_H_C_O_3 _
小⑥苏打 _________
白色粉末状 固体、易溶 于水
焙制糕点所用 发酵粉的主要 成分之一,医 疗上用于治疗 ⑦____胃_酸___过 多症
名称、化 学式
俗称(成分)
物理性质
俗称(成分)
物理性质
主要用途
氯化钠① ___N_a_C_l__
食盐的主要 成分
白色固体、 易溶于水, 有咸味
作调味品,配 制医用生理盐 水,农业上用 来选种,工业 上制盐酸和氯 气等,消除公 路积雪
人教九年级化学下册第十一单元课题1 生活中常见的盐 第2课时 复分解反应(共24张PPT)

Cl
SO42- OH- CO32-
K+ Na+ ①钾,钠,铵,硝酸盐 4+ NH 都易溶 Ba2+ Ca2+ 碱溶
NO3Ba2+ Ca2+ Mg2+
. . . . . .
Cl- SO42- CO32- OH不溶
全 溶
不溶
不 溶
不 溶
Ag+
小口决
钾钠氨盐硝酸盐, 均能溶于水中间。 硫酸盐中钡不溶, 氯化盐中银不溶。 碳酸钾钠氨盐溶, 氢氧钾钠钙钡溶。
③盐+碱→ 新盐+新碱 条件:反应物两者均可溶; 生成物有沉淀或气体或水 ④盐+盐→ 新盐+新盐 条件:反应物两者均可溶; 生成物有沉淀或气体或水
OH-
NO3溶、挥
溶 溶 溶
Cl溶、挥
溶 溶 溶
SO42溶
溶 溶 溶
CO32溶、挥
溶 溶 溶
酸 、 碱 、 盐 的 溶 解 性 ( 20℃ )
H+
NH4+ K+ Na+ 溶、挥 溶 溶
分析
向盛有少量BaCl2溶液的试管 滴入硫酸钠溶液,观察现象。
现象 化学方程式
溶液产生白色沉淀
BaCl2 +Na2SO4=BaSO4↓+2NaCl
含有SO42--的溶液与BaCl2反应产生 白色沉淀,且沉淀不溶于硝酸,证明含 有SO42--
分析
Na2CO3 + 2 HCl === 2NaCl + CO2↑+H2O NaHCO3 + HCl === NaCl + CO2↑+H2O
溶液产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应物为多种 特 而生成物只有 征 一种,即“多
变一”
反应物只有一 种而生成物有 多种,即“一 变多”
反应物与生成物 反应物和生成物都 都是两种,且都 为化合物 是单质和化合物
讲授新课
我们已经学过,盐能与金属发生置换反应,如: Fe+CuSO4=Cu+FeSO4
今天学到了,盐能与酸发生复分解反应,如: Na2CO3+2HCl=2NaCl+CO2↑+H2O
讲授新课
怎样检验这 些物质中含 有碳酸呢?
讲授新课
以检验碎蛋壳为例
实验用品 实验步骤 实验现象 实验结论
试管、导管 1.将碎蛋壳 1 .
。
连单孔塞、
。
铁架台 2 .
。 2.
。
。
讲授新课
小结
碳酸根或碳酸氢根离子检验方法:
某物质 +稀盐酸
(含碳酸根或碳 酸氢根离子)
+澄清石灰水
产生气体
变浑浊
CO2
根据所提供的四种溶液,设计实验证明溶液两两之 间是否能发生反应。√表示反应,×表示不反应。
H2SO4 BaCl2 NaOH Na2CO3
H2SO4
√ √ √
BaCl2
√
× √
NaOH
√ ×
×
Na2CO3
√
√ ×
(1)BaCl2+H2SO4= (2)NaOH+H2SO4= (3)Na2CO3+H2SO4=
复分解反应发生的条件 ①生成水;②生成气体;③生成沉淀。(满足一条即可)
讲授新课
复分解反应发生时的离子变化
实质
2HCl+Na2CO3 ——√—— Na2SO4+ CO2↑+ H2O
H+、Cl- Na+、CO3 2 - Na+、SO42-
反应前
反应后
溶液中离子种类 发生改变
Na2SO4 + KNO3 —×— K2SO4 + NaNO3 溶液中离子种类
复分解反应
由两种或
由一种物质
定 两种以上物质 生成两种或两种
义 生成另一种物 以上其它物质的
质的反应
反应
由一种单质
与一种化合物反 应,生成另一种 单质与另一种化 合物的反应
由两种化合物
互相交换成分生成 另外两种化合物的 反应
类 型 A+B→AB
AB→A+B+ …. AB + C→A +BC AB + CD→ AD+ BC
①观察:上述几个反应有什么特点? ②讨论:由此,你又有哪些新发现? ③归纳:复分解反应的概念、一般形式与特点。
讲授新课
二 复分解反应
酸、碱、盐
复分解反应:由两种化合物互相交换成分,生成另 外两种化合物的反应。
+
+
AB + CD → AD + CB
思考:什么条件下复分解反应才能发生呢???
讲授新课
九年级化学(RJ) 教学课件
第十一单元 盐 化肥
课题1 生活中常见的盐 第2课时 盐的化学性质 复分解反应
导入新课
讲授新课
课堂小结
随堂训练
导入新课
【回顾】 请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl === CaCl2 + H2CO3
CO2↑+H2O
【讨论】 根据上述反应,请
问Na2CO3和NaHCO3能 否与稀盐酸反应?如果 能反应,请问它们又会 生成什么物质?
讲授新课
观察与思考
(1)CaCO3 +2HCl==CaCl2 + H2CO3
(2)Na2CO3
+
2HCl==2NaCl
+
H2O+CO2↑ H2COO+C3 O2↑
(3)NaHCO3 + HCl==NaCl + H2COO+C3 O2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
CaCO3
讲授新课
2.与碱溶液反应
【实验11-2】向盛有少量碳酸钠溶液 的试管中滴入澄清石灰水,ቤተ መጻሕፍቲ ባይዱ察现象。
现象: 试管里出现白色沉淀。 分析: 碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
澄清石灰水 碳酸钠
这个原理常用作两种碱之间的相互转化
没发生改变
Na+、SO42- K+、NO3- K+、SO42- Na+、NO3-
反应前
反应后
讲授新课
盐在水中的溶解性各不相同
这些你都记 住了吗?
➢ 钾盐、钠盐、铵盐、硝酸盐都可溶; ➢ 盐酸盐只有氯化银不可溶; ➢ 硫酸盐只有硫酸钡不可溶; ➢ 碳酸盐只溶钾、钠、铵,剩下都不溶。
注意:AgCl、BaSO4既不溶于水,也不溶于稀硝酸。
盐能与碱发生复分解反应,如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
盐还能与盐发生复分解反应,如: Na2SO4+BaCl2=BaSO4↓+2NaCl
讲授新课
小结
盐的化学性质
1.盐溶液的酸碱性不确定。(如NaCl溶液呈中性, Na2CO3溶液呈碱性,NH4Cl溶液呈酸性)
(4)BaCl2+ Na2CO3= (5)BaCl2+ NaOH = (6)Na2CO3 + NaOH =
讲授新课
实验现象及结论: BaCl2+H2SO4= BaSO4 +2HCl 有白色沉淀生成 2NaOH+H2SO4= Na2SO4 + 2H2O 有水生成 Na2CO3+H2SO4= Na2SO4 + H2O + CO2 有气体生成 BaCl2+ Na2CO3= BaCO3 + 2NaCl 有白色沉淀生成 BaCl2+ NaOH =不反应 Na2CO3 + NaOH =不反应
讲授新课
练一练
判断下列复分解反应能否发生: H2SO4 + NaNO3—— 不能 Na2SO4 + BaCl2—— BaSO4↓+ 2NaCl 2HNO3 + K2CO3—— 2KNO3 + CO2↑+H2O KNO3 + NaOH—— 不能
讲授新课 化合反应
化学基本反应类型的比较
分解反应
置换反应
分析
碳酸钠(或碳酸氢钠)与盐酸反应生 成了CO2气体
讲授新课
请同学们写出上述反应的化学方程式:
Na2CO3 + 2HCl = 2NaCl + H2COO+3CO2 ↑ NaHCO3 + HCl = NaCl + H2OCO+3 CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子 (HCO3-)的盐都能与盐酸反应,产生CO2 气体。
盐酸腐蚀含CaCO3的建材
导入新课
学习目标
1.掌握盐的化学性质; 2.知道复分解反应的概念、发生的条件和实质,能 判断复分解反应是否能发生。
讲授新课
一 盐的化学性质
1.与酸反应 【实验11-1】碳酸钠、碳酸氢钠分别与 盐酸反应,是否都能产生CO2 ?
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现象
白色固体溶解,放出使澄清石灰水 变浑浊的无色气体
