盐的化学性质课件
合集下载
九年级化学下册第8章 常见的酸、碱、盐 常用的盐第1课时 几种常见的盐授课课件

Na2CO3、NaHCO3在工业和生活中有哪些用途?
知2-导
归纳
氯化钠用途:①化工原料②调味品③生理盐水④防止食 物腐败
归纳
知2-导
归纳
知2-导
知2-讲
【例2】 [中考·大连]下列关于物质用途的说法,错误的是( C) A. 碳酸钙可用作补钙剂 B. 碳酸钠可用于制洗涤剂 C. 亚硝酸钠可用作调味品 D. 碳酸氢钠可用来治疗胃酸过多症
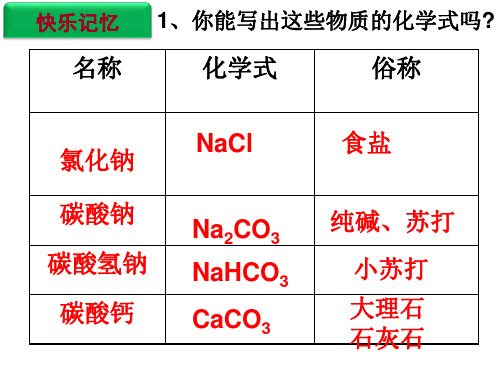
一、氯化钠
①俗名:食盐 ②溶解度随温度变化不大 ③可作调味品、配生理盐水、选种、消去公路积雪等
二、其 他几种 常见的
盐
碳酸钠 ( Na2CO3 )
碳酸氢钠 ( NaHCO3 )
碳酸钙 ( CaCO3 )
①俗名:纯碱、苏打 ②白色粉末、易溶于水、水溶液呈碱性 ③广泛用于玻璃、造纸、洗涤剂的生产等
①俗名:小苏打 ②白色粉末、易溶于水、水溶液呈碱性
知识点 3 CO32-、HCO3-的性质及检验
知3-导
【视频播放】碳酸钠、碳酸氢钠分别与盐酸的反应
知3-导
归纳
1.化学式中含有碳酸根和碳酸氢根的化合物叫碳酸盐。 2.碳酸根和碳酸氢根的检验方法:把它们放入盐酸中,将生成的 气体通入澄清石灰水中,澄清石灰水变浑浊证明该物质中含碳酸 根或碳酸氢根
知3-讲
知2-讲
解析:碳酸钙能与胃酸发生反应(CaCO3+2HCl=== CaCl2+H2O+CO2 ↑),补充钙元素,可用作补钙剂; 碳酸钠溶液显碱性,可用于制洗涤剂;亚硝酸钠与食 盐外观相似,但有毒,不能作调味品;碳酸氢钠能与 胃酸反应,可用来治疗胃酸过多症。
知2-练
1 在以下有关纯碱的描述中,不正确的是( ) A.“纯碱”其实不是碱,属于盐类 B.可用纯碱代替洗涤剂洗涤餐具表面的油污 C.用纯碱可除去面团发酵产生的酸 D.用加水溶解的方法检验纯碱中是否混入了食盐
知2-导
归纳
氯化钠用途:①化工原料②调味品③生理盐水④防止食 物腐败
归纳
知2-导
归纳
知2-导
知2-讲
【例2】 [中考·大连]下列关于物质用途的说法,错误的是( C) A. 碳酸钙可用作补钙剂 B. 碳酸钠可用于制洗涤剂 C. 亚硝酸钠可用作调味品 D. 碳酸氢钠可用来治疗胃酸过多症
一、氯化钠
①俗名:食盐 ②溶解度随温度变化不大 ③可作调味品、配生理盐水、选种、消去公路积雪等
二、其 他几种 常见的
盐
碳酸钠 ( Na2CO3 )
碳酸氢钠 ( NaHCO3 )
碳酸钙 ( CaCO3 )
①俗名:纯碱、苏打 ②白色粉末、易溶于水、水溶液呈碱性 ③广泛用于玻璃、造纸、洗涤剂的生产等
①俗名:小苏打 ②白色粉末、易溶于水、水溶液呈碱性
知识点 3 CO32-、HCO3-的性质及检验
知3-导
【视频播放】碳酸钠、碳酸氢钠分别与盐酸的反应
知3-导
归纳
1.化学式中含有碳酸根和碳酸氢根的化合物叫碳酸盐。 2.碳酸根和碳酸氢根的检验方法:把它们放入盐酸中,将生成的 气体通入澄清石灰水中,澄清石灰水变浑浊证明该物质中含碳酸 根或碳酸氢根
知3-讲
知2-讲
解析:碳酸钙能与胃酸发生反应(CaCO3+2HCl=== CaCl2+H2O+CO2 ↑),补充钙元素,可用作补钙剂; 碳酸钠溶液显碱性,可用于制洗涤剂;亚硝酸钠与食 盐外观相似,但有毒,不能作调味品;碳酸氢钠能与 胃酸反应,可用来治疗胃酸过多症。
知2-练
1 在以下有关纯碱的描述中,不正确的是( ) A.“纯碱”其实不是碱,属于盐类 B.可用纯碱代替洗涤剂洗涤餐具表面的油污 C.用纯碱可除去面团发酵产生的酸 D.用加水溶解的方法检验纯碱中是否混入了食盐
生活中常见的盐—盐的化学性质 课件

盐的化学性质
① 溶于水时产生金属离子和酸根离 子的化合物成为盐。
(盐的结构:金属+酸根)
② 盐可以根据它的金属离子的类 型和酸根离子的类型不同来进行 归类。
盐的分类:
(1)、按金属离子分类:
钾盐
钠
盐
(2)按酸根离子分类:
铵盐 碳酸盐
盐酸盐 硝酸盐
硫酸盐
氯化钾——KCl 硫酸钾——K2SO4 碳酸钾——K2CO3
③ 盐 + 碱 → 新盐 + 新碱
反应条件:反应物都可溶; 生成物有沉淀或气体或水。
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4 FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl CuSO4 + Ba(OH)2 = Cu(OH)2↓ + BaSO4 ↓ Fe2(SO4)3 + 3Ba(OH)2 = 3BaSO4↓ + 2Fe(OH)3↓ Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
②盐 + 酸 → 新盐 + 新酸
反应条件: 生成物中有沉淀或气体或水 。 AgNO3 + HCl = AgCl↓+ HNO3 BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
⑤碳酸钙和硫酸钠 ⑦氯化钡和硫酸铜
⑥氢氧化钠和硫酸铝 ⑧碳酸钾和硝酸钡
⑤× ⑥ 6NaOH+Al2(SO4)3=3Na2SO4+2Al(OH)3↓ ⑦ BaCl2+CuSO4=BaSO4↓+CuCl2 ⑧ K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
① 溶于水时产生金属离子和酸根离 子的化合物成为盐。
(盐的结构:金属+酸根)
② 盐可以根据它的金属离子的类 型和酸根离子的类型不同来进行 归类。
盐的分类:
(1)、按金属离子分类:
钾盐
钠
盐
(2)按酸根离子分类:
铵盐 碳酸盐
盐酸盐 硝酸盐
硫酸盐
氯化钾——KCl 硫酸钾——K2SO4 碳酸钾——K2CO3
③ 盐 + 碱 → 新盐 + 新碱
反应条件:反应物都可溶; 生成物有沉淀或气体或水。
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4 FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl CuSO4 + Ba(OH)2 = Cu(OH)2↓ + BaSO4 ↓ Fe2(SO4)3 + 3Ba(OH)2 = 3BaSO4↓ + 2Fe(OH)3↓ Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
②盐 + 酸 → 新盐 + 新酸
反应条件: 生成物中有沉淀或气体或水 。 AgNO3 + HCl = AgCl↓+ HNO3 BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
⑤碳酸钙和硫酸钠 ⑦氯化钡和硫酸铜
⑥氢氧化钠和硫酸铝 ⑧碳酸钾和硝酸钡
⑤× ⑥ 6NaOH+Al2(SO4)3=3Na2SO4+2Al(OH)3↓ ⑦ BaCl2+CuSO4=BaSO4↓+CuCl2 ⑧ K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
生活中常见的盐 初中九年级化学上册课件

滤失败。(3)蒸发滤液需要使用蒸发皿盛装滤液和蒸发滤液,
蒸发时用玻璃棒不断搅拌,以防液滴迸溅,也可采取间歇加热
来防止液滴飞溅。(4)溶解时食盐没有完全溶解、蒸发时造成
液滴飞溅以及没有把精盐全部转移到称量纸上等,都会使制得
率偏低。
答案:(1)A (2)D (3)蒸发皿 间歇加热
(4)A、B、D
点击进入相应模块
点击进入相应模块
(2)不同氮肥的区别。
点击进入相应模块
【思考感悟】农田施肥时,草木灰不能和铵态氮肥混用,你知 道其中的道理吗? 提示:草木灰的主要成分是碳酸钾,其水溶液呈碱性,铵态氮 肥能与碱性物质反应生成氨气而挥发掉,从而造成氮的流失, 因此不能混用或混放。
点击进入相应模块
粗盐的提纯 【高频考点】实验步骤;操作目的;仪器及各步操作中玻璃棒 的作用;影响产率的因素分析等 1.实验装置
点击进入相应模块
【易错提醒】 1.对照实验流程图,明确各步操作的目的,所需仪器等。 2.产品制得率偏低即实际得到的精盐量比理论值偏少。
点击进入相应模块
【我的收获】(1)操作①是把较大的粗盐颗粒粉碎成较小的粗
盐颗粒,需要研磨,应选用研钵。(2)折叠滤纸应按图中A、B、
C的顺序,不能出现D中滤纸出现裂缝的情况,否则会导致过
OH-
NO3-
CO32-
K+
溶
溶
溶
Ba2+
溶
溶
不
Cu2+
不
溶
不
点击进入相应模块
(1)将甲、乙两车间的废水按适当的比例混合,可以变废为宝, 既能使废水中的Ba2+、Cu2+、OH-、CO32-等离子转化为沉淀除去, 又可以用上层清液来浇灌农田。清液中含有的溶质主要是 ________________(填写物质的化学式)。 (2)已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离 子是_____________。 (3)根据以上溶解性表判断,Cu(NO3)2和Ba(OH)2溶液_____(填 “能”或“不能”)发生复分解反应。若能反应,写出化学方 程式:____________;若不能反应,写出理由:__________。
北京课改版九下化学 1盐的性质 课件

(4)盐+盐 — 新盐+新盐
AgNO3+NaCl = AgCl +NaNO3 BaCl2+CuSO4 = BaSO4 +CuCl2 反应条件:①反应物溶于水;
②符合复分解反应产生条件。
判断下列反应能否产生?
BaCl2 + CaCO3 ----- CaCO3不溶 CuSO4+ CaCO3 ----- CaCO3不溶 BaCl2 + CuSO4=== CuCl2+BaSO4↓ NaCl + AgNO3 == AgCl ↓ +NaNO3
换反应,这种金属是( )
A.Fe
B.Ag
C.Zn
D.Cu
4、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、 CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果: (1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀不溶于稀硝酸。
从实验中判断,该粉末中一定含有
②BaCl2+ Fe ---- Ba不在金属活动性顺序
③CaCO3 +Fe----- CaCO3不溶于水
④CuSO4+ K ---- K Ca Na太活泼
(2) 盐 + 酸 — 新盐 + 新酸 AgNO3 + HCl = AgCl↓+ HNO3 CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O
盐的性质
☞ 教学目标: 1、理解复分解反应的概念 2、掌握盐的化学性质 ☞ 教学重点:盐的化学性质 ☞ 教学难点:判断复分解反应能否产生
根据酸碱中和反应生成盐和水的事实,你 能说出它们可以用哪些酸和碱反应得到吗?
科粤版(科学出版社)九年级下册初中化学课件8.4.2 盐的化学性质和复分解反应发生的条件

一、盐的化学性质 1. 盐+金属=新盐+新金属(前置后,盐溶液) 2. 盐+酸=新盐+新酸 3. 盐+碱=新盐+新碱(两者都要可溶) 盐+盐=新盐+新盐(两者都要可溶) 二、复分解反应发生的条件 生成物中有沉淀、气体或水。
知1-讲
【例1】 〈石家庄28中一模〉 从HCl、NaOH、Na2CO3、
Ca(OH)2几种溶液中取出其中的两种混合。
(1)若混合后溶液总质量小于混合前两种溶液质量 之和,可能的组合是:H__C_l_和________、 Na2CO3和Ca(OH)2(写化N学a2式CO)。3
(2)若混合后溶液总质量等于混合前两种溶液质量
知2-讲
置换出来。复分解反应要发生,产物中要有沉淀、气体 或水,碳酸钠和稀盐酸反应产生水和二氧化碳气体,硫 酸铜和氯化钡反应产生硫酸钡白色沉淀。
知2-练
1 下列各种物质的溶液混合后,能发生反应,且溶 液的总质量不改变的是( ) A.氢氧化钠溶液和稀盐酸 B.碳酸钠溶液和稀盐酸 C.氯化钠溶液和稀硫酸 D.碳酸钠溶液和氯化钙溶液
【投影展示】 1.盐与酸的反应 ①碳酸钙与盐酸的复分解反应 CaCO3+2HCl=CaCl2+H2O+CO2
知1-导
②硝酸银与盐酸的复分解反应 AgNO3+HCl=AgCl +HNO3 可知:盐可能与酸发生复分解反应,生成新盐和新酸
知1-导
归纳
知1-导
盐与酸、碱、其他盐间可能发生复分解反应: 盐+酸 新盐+新酸 盐+碱 新盐+新碱 盐1+盐2 新盐1+新盐2 注:硫酸钡沉淀不溶于稀硝酸,根据这一特征,可用氯化钡 溶液鉴别硫酸和可溶性硫酸盐。
盐的化学性质(2014公开课课件)
CO32-、HCO3-的检验
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl==2NaCl + H2O + CO2↑
NaHCO3 + HCl == NaCl + H2O + CO2↑ 某物质 +HCl 碳酸盐 产生气体 CO2 +Ca(OH)2 变浑浊 CaCO3
一瓶久置的氢氧化钠固体已经发生了变 质。我们一起探究变质原因,作出几种猜想: 1、没有变质 2、可能部分变质 3、全部变质
复分解反应
定义:两种化合物相互交换成分,生 成另外两种化合物的反应。
+CB = AD +CD AB
探究2:市售紫葡萄的表皮常附有一种浅蓝
绿色的斑点,它是为了防治霉菌而喷撒的农药 波尔多液,波尔多液是由硫酸铜溶液和石灰乳 按一定比例混合而制得,配制时不能用铁制容 器是因为 CuSO4+Fe == FeSO4 + Cu (用
知识总结
盐+盐——新盐+新盐
BaCl2 +Cu2SO4=BaSO4↓+2CuCl2
盐的化学性质总结
盐的化学性质总结
盐
金属 酸
碱
盐
新盐+金属
新盐+新酸 新盐+新碱
新盐+新盐
厨房里有两瓶白色固体,一瓶是 食盐,一瓶是纯碱。想想看,我们能 用哪些方法鉴别它们呢?
它们的性质有 什么不同呢?
探究1:如何鉴别氯化钠溶液和碳酸钠溶液?
属于酸: 属于碱
属于盐:
第十一单元
(第二单元)
盐的化学性质
实验探究一
盐的分类以及盐的性质 课件 高一上学期化学人教版(2019)必修第一册

硫酸不溶钡和铅 (微溶)银钙微溶记心间 (Ag2SO4,CaSO4)。
三、盐的物理性质
2.盐溶液的颜色
铜盐溶液一般
呈
铁盐溶液一般
呈
亚铁盐溶液一般 呈
高锰酸钾溶液
呈
其它盐溶液一般为
蓝色 棕黄色 浅绿色 紫红色 无色
三、盐的物理性质
3.常见的沉淀颜色
AgCl 白 BaSO 4白 CaCO3白 BaCO3白 Ag2CO3白 Mg(OH)2白 Al(OH)3白 Zn(OH)2白 Cu(OH)2 蓝 Fe(OH)3 红褐色 PbS/FeS/CuS/Cu2S 黑色 HgS(朱砂)红色
8.注意不同温度下,两者的溶解度比较;学会分析图象,控制变量法 10. 大米(糖类),岩盐(无机盐),烧鸡(蛋白质) 11. 黄铜和食醋都属于混合物(主要成分是Cu和CH3COOH)
14.注意题中条件要求:●溶液质量减小●化学反应 17.物质转化 18.计算(极限法)19.(4)注意审题,写复分解反应 21.实验室制备氧气: 氯酸钾分解、高锰酸钾分解(2KClO3=2KCl+3O2 、 2KMnO4=K2MnO4+MnO2+O2 ) 22.现象表示完整(首先出现Cu红色固体,硫酸铜蓝色溶液变为无色) (二)
交叉分类法特点:同一物质有不同的分类标准。
(eg:妈妈和爸爸可以有不同的身份,可以是姥姥、奶奶的女儿和儿子,也可以是我们的 爸爸和妈妈。)
3.同素异形体:由同一种元素组成的具有不同形态和性质不同的单质。(eg:石墨与金刚 石、O2和O3) 4.氧化物:可以分为金属和非金属氧化物。 在下节课学习分类方法:酸性氧化物、碱性氧化物、不成盐氧化物和两性氧化物。
二、盐的二分、类盐的分类与命名:
NaHCO3和Cu2(OH)2CO3是不是属于盐类?
三、盐的物理性质
2.盐溶液的颜色
铜盐溶液一般
呈
铁盐溶液一般
呈
亚铁盐溶液一般 呈
高锰酸钾溶液
呈
其它盐溶液一般为
蓝色 棕黄色 浅绿色 紫红色 无色
三、盐的物理性质
3.常见的沉淀颜色
AgCl 白 BaSO 4白 CaCO3白 BaCO3白 Ag2CO3白 Mg(OH)2白 Al(OH)3白 Zn(OH)2白 Cu(OH)2 蓝 Fe(OH)3 红褐色 PbS/FeS/CuS/Cu2S 黑色 HgS(朱砂)红色
8.注意不同温度下,两者的溶解度比较;学会分析图象,控制变量法 10. 大米(糖类),岩盐(无机盐),烧鸡(蛋白质) 11. 黄铜和食醋都属于混合物(主要成分是Cu和CH3COOH)
14.注意题中条件要求:●溶液质量减小●化学反应 17.物质转化 18.计算(极限法)19.(4)注意审题,写复分解反应 21.实验室制备氧气: 氯酸钾分解、高锰酸钾分解(2KClO3=2KCl+3O2 、 2KMnO4=K2MnO4+MnO2+O2 ) 22.现象表示完整(首先出现Cu红色固体,硫酸铜蓝色溶液变为无色) (二)
交叉分类法特点:同一物质有不同的分类标准。
(eg:妈妈和爸爸可以有不同的身份,可以是姥姥、奶奶的女儿和儿子,也可以是我们的 爸爸和妈妈。)
3.同素异形体:由同一种元素组成的具有不同形态和性质不同的单质。(eg:石墨与金刚 石、O2和O3) 4.氧化物:可以分为金属和非金属氧化物。 在下节课学习分类方法:酸性氧化物、碱性氧化物、不成盐氧化物和两性氧化物。
二、盐的二分、类盐的分类与命名:
NaHCO3和Cu2(OH)2CO3是不是属于盐类?
常用的盐课件(粤教版化学)

化学性质:
跟某些金属的反应 跟酸的反应 跟碱的反应 跟另一种盐的反应
氯离子Cl-的检验 硫酸根SO42-检验
硝酸银和氯化钠反应 氯化钡和硫酸钠反应
AgNO3 + NaCl = AgCl↓+ NaNO3 BaCl2 + Na2SO4 = BaSO4 + 2NaCl 两种盐起反应,一般生成另外两种盐。
一、几种常见的盐
1、氯化钠
用途很广。日常生活中用于调味和腌制食物, 医疗上用与配制生理盐水,也是重要的化工原料。
通电
2NaCl+H2O=====2NaOH+H2↑+Cl2↑ 工业用盐中因含有_亚__硝__酸__钠__(NaNO2),如果误作食盐, 用于烹饪,会引起中毒事件。
粗盐中因含有___C_a_C_l_2_和___M__g_C_l2_,易潮解。 (试用所学的化学知识,除去这两种杂质)
8.4 常用的盐
酸的通性 1、跟指导剂的反应 2、酸跟金属的反应 3、酸跟某些金属氧 化物反应 4、酸跟碱的反应 5、酸跟盐反应
((2)AgNO3+HCl (3)CaCO3+HCl
碱的通性 1、跟指导剂的反应
2、碱跟某些非金属 氧化物反应 3.碱跟酸反应 4.碱跟盐反应
(1)NaOH+FeCl3 (2)NaOH+CuSO4 (3)Ca(OH)2+Na2CO3
化学性质:
跟某些金属的反应 跟酸的反应 跟碱的反应 跟另一种盐的反应
硫酸铜与氢氧化钠反应 氯化铁与氢氧化钠反应 碳酸钠与氢氧化钙反应
CuSO4+2NaOH = Cu(OH)2↓Na2SO4 FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓ Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH 盐跟碱反应,一般生成另一种盐和另一种碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)定义: 两种化合物互相交换成分生成另外两种化合物的反应。
在水溶液中互相交换离子,元素化合价不变。 (2)特点(实质): 巧记:互交换、价不变 (3)发生的条件: 巧记:碱盐、盐盐要可溶,气体、沉淀、水生成 (4) 复分解反应方程式书写: 巧记:复分解价不变,只把离子来交换
1、判断下列复分解反应能否发生:
有A、B、C、D四种化合物.已知A是硝酸盐,B是酸, C是碱,D是含+3价元素的氯化物.经下列操作,其现 象分别是: ①A与B两溶液混合,产生不溶于稀硝酸的白色沉淀; ②B与C两溶液混合,恰好完全反应,其溶液中溶质是 食盐的主要成分; ③C与D两溶液混合,产生红褐色沉淀,其溶液中溶质 也是食盐的主要成分. (1)用化学式表示各化合物. AgNO3 ,B________ HCl FeCl3 . NaOH ,D________ A________ ,C________ (2)写出有关反应的化学方程式. AgNO3+ HCl=AgCl↓+HNO3 ; ①A和B反应_______________________________ ②C和D反应 _______________________________ . 3NaOH + FeCl3=Fe(OH) 3↓+3NaCl
Na2CO3 + Ca(OH)2 = CaCO3 ↓+ 2NaOH NH4Cl + NaOH = NaCl + NH3↑+ H2O MgCl2 +Ca(OH)2=CaCl2 +Mg(OH)2 ↓ CuSO4 + 2KOH = K2SO4 + Cu(OH)2 ↓
(4)盐+盐——新盐+新盐(复分解反应)
尝试练习
• 练习1:请完成下列方程式: • ⑴铁和硫酸铜溶液 Fe+CuSO4=Cu+FeSO4; • ⑵碳酸钙和盐酸CaCO3+2HCl=CaCl2+H2O+CO ; 2↑ 硝酸银溶液和盐酸 AgNO3+HCl=AgCl↓+HNO ; 3 • ⑶氢氧化钠和硫酸铜溶 液 2NaOH+CuSO4=Na2SO ; 4+Cu(OH)2↓ • ⑷硫酸钠溶液和硝酸钡溶 液 Na2SO4+Ba(NO3)2=2NaNO 。 3+BaSO4↓
1.盐 + 2.盐 + 3.盐 +
金属 = 新盐+新金属 酸 = 碱 = 新盐 + 新酸 新盐 + 新碱
4.盐 +
盐
返
=
回
新盐 + 新盐
(1)盐+金属——新盐+新金属 (置换反应)
反应物中盐要可溶,在金属活动性顺序中前面的金属 规律: 将后面的金属从其盐溶液中置换出来(K、Ca、Na除外) 应用: 判断或验证金属的活性顺序和反应发生的先后顺序
• 规律:
反应物都可溶,生成物中至少有一种不溶于水
• 应用: 检验某些离子或物质 • 举例:
NaCl + AgNO3 = AgCl ↓ + NaNO3(鉴别Cl-) Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3 (鉴别SO42-) Na2CO3+BaCl2 = BaCO3 ↓ +2NaCl
盐的化学性质
总结归纳 三店二中 熊正和
盐 和 复 分 解 反 应
盐的化学性质
复分解反应
当堂检测
自主学习归纳
1.四大基本反应类型 置换 复分解 。 有 化合 分解 、 、 、 2. 在检验氢氧化钠是否已经变质,我们用 稀盐酸 来检验,若已经变质,观察到的现 象是有气泡产生 反应的化学方程式 为Na2CO3+2HCl=2NaCl+H 。 2O+CO2↑ 铜和硝酸 Cu+2AgNO3=2Ag+Cu(NO3)2 银溶液的反应方程式:
H2SO4 + NaNO3—— 不能 Na2SO4 + BaCl2—— BaSO4↓+ 2NaCl 2HNO3 + K2CO3—— 2KNO3 + CO2↑+H2O KNO3 + NaOH—— 不能
当堂检测
1、为检验一瓶氢氧化钠溶液是否变质,同学们展开探究: ⑴甲同学用酚酞试液检验氢氧化钠溶液是否变质,你认为它_______ 不能 (填” 能”或”不能”)成功,理由是 _________————————————— 氢氧化钠和碳酸钠溶液都显碱性 ————————————————————— • ⑵乙同学在三支试管中各放入少量的该瓶溶液,用酸、碱、盐三种物质分 别检验氢氧化钠是否变质,均获得成功,她所用的试剂依次是(写化学 式):酸________ __________ HCl ;碱Ca(OH) CaCl2 。 2 ;盐__________ • 2、判断下列各组物质能否发生反应。能反应写出化学方程式;不能反应, 说出理由。 (1)Fe+ZnSO4 (2)Cu+AgNO3 (3)Al+AgCl (4) Na2CO3+Ca(OH)2 (5)NaCl+H2SO4 (6)KNO3+NaOH (7)K2CO3+HCl (8)CuSO4+Ba(OH)2 • _____ (1) (3) (5) (6) 不能反应,不符合条件 • ---------------------------------------------------------------------------• Cu+2AgNO ———————————— —————————————— 3=2Ag+Cu(NO3)2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH • —————————— ——————————————— K2CO3+2HCl=2KCl+H2O+CO2↑CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓ • —————————— • •
现象 CuSO4 + Fe = FeSO4 + Cu 举例: 2AgNO3 + Cu = Cu(NO3) 2 + 2Ag 现象 3Cu(NO3)2 + 2Al = 2Al(NO3)3 + 3Cu 现象
(2)盐+酸——新盐+新酸(复分解反应)
• 规律
反应物中的酸一般指硫酸、盐酸和硝酸。 盐是碳酸盐时可不溶,若不是碳酸盐,则要求可溶。
• 应用
制取某些盐,制取二氧化碳气体等
• 举例
AgNO3+HCl=AgCl↓+HNO3
BaCl2 + H2SO4——BaSO4↓+ 2HCl CaCO3 + 2HCl——CaCl2 + CO2↑+ H2O
(3)盐+碱——新盐+新碱
• 规律:
(复分解反应)
反应物都可溶,生成物必须满足复分解反应条件
• 应用:制取某些碱 • 举例:
