竞赛题库5年全国化学竞赛初赛模拟试卷(75)
最新-全国化学竞赛初赛模拟试卷(73)

2005年全国化学竞赛初赛模拟试卷(73)(时间:3小时满分:100分)题号 1 2 3 4 5 6 7 8 9 10 11 满分 3 8 6 10 7 8 10 10 14 12 12H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt Ds第一题(3分)1.从化学上看,诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是什么物质?2.工业上冶炼金属一般用热分解法、热还原法和电解法。
不同的金属应选用不同的冶炼方法。
你认为选择的原则主要是依据是什么?第二题(8分)根据右图水被电解的装置图,回答下列问题:1.图中TiO2除做电极外,还有什么作用?2.说明该装置中能量转化形式;3.用1个理科名词描述右图转化过程;4.写出电极反应方程式;5.判断2个槽内pH变化情况;6.标出电阻R上的电流方向。
全国化学竞赛初赛试题

全国化学竞赛初赛试题一、选择题(共30题,每题2分,共60分)1. 下列酸性氧化物中,对健康最无害的是:A. 二氧化硫B. 二氧化氮C. 二氧化碳D. 一氧化碳2. 以下关于元素周期表的说法,正确的是:A. 周期数代表元素的电子层数B. 元素周期表按照元素的质量进行排列C. 元素周期表对应的周期数即为元素的原子序数D. 元素周期表将元素按照化学性质进行分组3. 下列反应中,属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. Fe + S → FeSC. NaCl + H2O → NaOH + HClD. 2H2O → 2H2 + O24. 下列金属中,能与水反应产生氢气的是:A. 铁B. 铜C. 铝D. 银5. 某金属氧化物加热分解,生成该金属和氧气。
根据实验数据,得出氧化物的化学式为:A. MO2B. MOC. M2O3D. M2O……二、填空题(共10题,每题4分,共40分)1. 氧化还原反应中,被氧化的物质称为________,氧化反应中,得到电子的物质称为________。
2. 溶液的pH值为3,该溶液具有________性。
3. 将硝酸铁(III)溶液与硫酸铵混合,会生成______色的沉淀。
4. 氢氧化钠与盐酸反应生成________和________。
5. 在电化学纯度测定方法中,可以通过比较待测金属与________在同样条件下的电极电势差,来确定其纯度。
……三、简答题(共5题,每题10分,共50分)1. 简述溶液中酸和碱的电离过程及其性质。
2. 电极电势有哪些影响因素?请分别说明。
3. 简述燃烧与腐蚀的区别和联系。
4. 请解释化学式中的下标数字代表的含义。
5. 请分析金属的导电性是由什么决定的?并列举一个导电性最好的金属。
……四、计算题(共5题,每题15分,共75分)1. 如图所示,一个不太规则形状的镁块质量为12.4g,完全反应后得到镁离子的质量为19.2g。
请计算镁的氧化态及与氧发生氧化还原反应的相对原子质量比。
2005年全国化学竞赛初赛模拟试卷 (18)

2005年全国化学竞赛初赛模拟试卷(36)(时间:3小时满分:100分)第一题(9分)回答下列问题1.说明岩石裂缝中的水凝固是如何使岩石机械破裂的。
2.说明汞蒸气是否具有光泽和金属性。
3.说明为什么金属钨适合于做电灯丝。
4.用碳把氧化铁还原成生铁,在炼钢过程中要把过量的碳氧化除掉,但最后在钢中还要加入碳。
问为什么第二步是必须的,而不能与第一步或第二步相合并?第二题(11分)完成下列反应方程式1.锂电池新型电极材料LiMnPO4可用两种碳酸盐和NH4H2PO4在N2流中加热得到,写出反应方程式。
2.XeO3和Ba(OH)2液反应得一白色物。
分析知其中含Xe 20.6%。
写出反应方程式。
3.在Pd/C催化下,肼还原对硝基-β-苯乙醇制备对氨基-β-苯乙醇。
4.电解法产生臭氧是利用直流电电解含氧电解质产生臭氧的。
目前,最流行的电化学产生臭氧技术是采用固体聚合物电解质(SPE)膜复合电极电解水产生臭氧。
写出电极反应方程式。
(1)阳极:(副反应)(2)阴极:或第三题(5分)写出出一水氯化一羰基(CO32-)一水四氨合钴(Ⅲ)的同分异构体。
第四题(7分)陶器油灯(图A),可以说是近代发明的煤油灯(图C),煤气炉(图D)的“母型”。
蜡烛(图B)也是秉承了油灯的基本原理。
试回答下列问题A 陶器油灯B 蜡烛C 煤油灯D 煤气炉1.从“点灯照明”的功能分析,油灯的基本构造是油壶和灯芯。
请问:(1)油壶的作用是(只用两个字概括);(2)灯芯至少能起到两个作用:一是通过灯芯和油壶边缘把火焰引到油壶之外而隔热,防止火焰蔓延至油壶内;二是通过灯芯的作用提供燃烧的油;(3)灯芯上燃烧的是(填液或气)态油。
2.蜡烛点燃一段时间后便自然形成了研钵状的“油壶”。
请问此油壶是如何形成的? 3.当煤油灯装上灯罩时,灯会点得更亮一些,其道理是 。
4.根据油灯、蜡烛、煤油灯的点灯燃烧原理分析,假如蜡或食油与煤油的汽化难易相同、燃点也相同,则你认为发明无灯芯的煤气炉至少必须具有的4个基本构造或装置是 、、 、 。
最新-全国化学竞赛初赛模拟试卷(64)

2005年全国化学竞赛初赛模拟试卷(64)(时间:3小时满分:100分)第一题(6分)正烷烃是指没有支链的烷烃。
请仔细研究正烷烃的二氯取代物的同分异构体的个数。
1.请写出正烷烃的碳原子个数n与二氯代物同分异构体个数y之间的关系。
2.请写出正三十八烷、四十七烷二氯代物的同分异构体的个数。
第二题(7分)请回答下列问题:1.根据VSEPR理论推测SF4的空间结构。
2.SF4可以和SbF5反应生成加合物。
该加合物在无水HF中完全电离。
写出电离反应方程式。
3.SCl4和SbCl5反应生成加合物,该加合物熔点很低,且能溶于有机溶剂。
写出该加合物的分子式。
4.上述两个反应为什么得到两种性质不同的产物?第三题(8分)某液体物质A,结构与性质类似CO2,与Na2S反应生成化合物B,B遇酸能产生恶臭有毒的气体C及其物质A。
C可使湿润的醋酸铅试纸变黑。
A与Cl2在MnCl2催化下可得到一种不能燃烧的溶剂物质D;A与一氧化二氯作用则生成极毒的气体E和透明液体F。
1.试确定从A到F个代表什么物质?2.写出生成E和F的化学反应方程式。
现代有机化学的发展为大量新材料的合成提供了技术支持。
DOM和化合物A就是两种新材料。
DOM是一种优良的内增塑剂,可以自聚,也可以和氯乙烯、醋酸乙烯、苯乙烯和丙烯酸酯类共聚,共聚物具有较高的耐冲击性、抗龟裂性和低温柔顺性,广泛用于油漆、涂料、粘合剂等方面。
DOM可用顺丁烯二酸酐与2-乙基己醇反应制得。
已知DOM是一种酯,分子结构对称。
试回答下列问题:1.写出制备DOM方程式;2.给DOM系统命名。
3.1953年合成了透明如玻璃、坚韧如钢的聚碳酸酯,可作防弹玻璃、宇航员头盔上的防护眼睛。
A的合成采用COCl2与HO--OH反应而成。
试写出生成A的化学反应方程式。
第五题(9分)PCl5(固)与NH4Cl(固)在隔绝空气的条件下加热反应,生成HCl(气)和化合物G。
化合物G 的摩尔质量为348g/mol。
2005全国化学竞赛初赛模拟题

2005全国化学竞赛初赛模拟题一.原子核的裂变有多种,例如像U-235吸收中子非自发过程的裂变,但是也有一种自发裂变反应:某元素A不需吸收中子进行自发裂变,释放出142Ba、106Mo和中子,请回答下列问题:1、写出A的元素符号与核外电子排布。
2、写出此和反应的方程式。
二.化合物X是实验室常用的不燃溶剂,工业上或实验室常用它溶解油脂与树脂,且X不与酸碱反应,是一种常用的灭火剂,但其会腐蚀铁铝等金属。
工业上一般用Y与Cl2 在MnCl2、AlCl3催化下合成X,另有一副产物Z。
Y 为直线型分子,是无色有毒且易挥发的液体,Z为金黄色液体。
1.写出X、Y、Z的化学式。
2.写出合成X的化学反应方程式。
三.Ag2HgI4是一种离子晶体,室温时属于四方晶系。
晶胞中2个Ag+占据顶点与底心,而Hg2+无序占据(0,1/2,1/2)(1/2,0,1/2)两个位置,I-作立方最密堆积。
1.画出Ag2HgI4 在室温下的晶胞。
2.分别指出Hg2+ I- 的占有率是多少。
3.当温度升高到50℃时,晶体由黄色变为红色,电导率突然大幅增加,晶体属于立方晶系,请画出升温后Ag2HgI4 的晶胞。
四. 1. 比较下面3个等电子体的熔点:H3C-CH3H3C-F H3N-BH3-181℃-141℃104℃为何H3N-BH3 熔点如此之高?请作出合理的解释与图示。
2. 三氧化钨是钨的一种重要的氧化物,一般用黑钨矿(含有FeWO4和MnWO4)与Na2CO3在空气下反应,用水浸取所得含钨产物过滤后用盐酸酸化,得到钨酸沉淀,再经过加热脱水即得纯WO3。
请写出上述反应的方程式。
Denny制作五.1.某原电池中的一个半电池是由Co浸在1.0mol/LCo2+的溶液中组成,另一半电池则由1.0mol/LCl-的溶液中不断通入Cl2(P Cl2 为101.3KPa)组成,某同学实验测得电动势为1.63V,钴电极电动势为1.63V,钴作负极。
2005年全国化学竞赛初赛模拟试卷

2005年全国化学竞赛初赛模拟训练(一)第一题(3分)多达7~9位,而有的元素的相对原子质量的有效数字位数少至3~4位,为什么?第二题(5分)原子核的壳层模型指出:包含2、8、20、28、50和82个质子或中子以及126个中子At经α或β衰变可得到稳定核。
的核具有特殊的稳定性。
216851.216At经次α和次β衰变可得到稳定核。
852.说明为什么此核为稳定核。
第三题(4分)二硫化钛(TiS2)是一种金属性导体,具有层状结构,而且容易使金属锂夹入,所以TiS2在蓄电池中可作理想的电极材料。
若把TiS2作为一个电极,把金属锂作为另一个电极,用锂盐溶液作为电解质溶液组成原电池,则该蓄电池放电时:负极反应为;正极反应为;总反应方程式为。
第四题(5分)锌钡白(立德粉)是ZnSO4和BaS以相同物质的量混合后反应制成白色颜料。
写出由菱锌矿(ZnCO3)为主要原料制锌钡白的有关反应的化学方程式。
若菱锌矿中含有Fe2+、Ni2+等杂质,在制备过程中如何除去?(已知:φ0Fe2+/Fe=-0.44,φ0Ni2+/Ni=-0.25)第五题(7分)“杯芳烃”(C44H56O4)因其分子形状与希腊圣杯相似而得名。
“杯芳烃”是有A和B 两种化合物经缩合反应而生成的。
A能使FeCl3溶液显紫色,且分子中含有三个化学环境完全相等的甲基。
B能被广泛应用于保存尸体、制作动物标本等科学场合和制造人造象牙。
1.试写出A、B、“杯芳烃”、人造象牙的结构简式。
2.命名:A3.试写出合成“杯芳烃”的化学方程式。
离子晶体X是由三种短周期元素组成,三种短周期元素的简单离子的核外电子排布相同,晶胞参数a=780pm,晶胞中阴离子组成立方最密堆积,阳离子(r=102pm)占据全部八面体和四面体空隙。
1.写出X的化学式和化学名称;2.指出阴离子的空间构型;3.计算晶体X的密度;4.X在化工生产中有什么用途;5.另有一种晶体Y,其阴离子也组成立方最密堆积,且与X的阴离子互为等电子体,而阳离子与X的阳离子相同,但只占据全部四面体空隙,请写出Y的化学式。
2005年全国化学竞赛初赛模拟试卷(01)含答案

化学竞赛模拟试卷(01)(时间:3小时满分:100分)第一题(3分)气态物质的溶解度可用每升水中能溶解的气体的毫升数表示,它的大小与温度和该气体的压强有关。
已知0℃和1.01×105Pa时,氧气的溶解度为49.10 mL,氮气的溶解度是23.20 mL。
试计算该温度下空气(O2:21%,N2:78%)溶解在水中的氧气和氮气的体积比是1︰1.76 。
第二题(6分)光发动机是利用光能作动力直接把光能转变成机械能输出的装置。
其核心装置是化学反应室,室内密封着一种无色的化合物A。
在光照射时,A能接受光能发生化学反应,在无光作用下又发生逆反应,如此循环往复从而带动活塞的往复运动。
1.A是中学教材上的常见物质,它的化学式是N2O4(2分。
写NO2不给分)O42NO2或2NO22NO+O22.写出A在密封室中的全部化学反应方程式;N(2分)3.简单分析密封室活塞被驱动的原因。
光照射时,密封室中的气体分子数增多,引起压强增大,驱动活塞。
(2第三题(7分)卟啉化合物是一类含氮杂环的共轭化合物,其中环上各原子处于一个平面内(结构如图1、图2)。
卟啉环中含有4个吡咯环,每2个吡咯环在2位和5位之间由一个次甲基桥连,在5,10,15,20位上也可键合4个取代苯基,形成四取代苯基卟啉。
图1 卟吩的结构图2 取代四苯基卟啉1.如果卟吩与XCl3形成配合物,写出该配合物的化学式;2.预测卟啉环(卟吩)是否有芳香性,为什么?3.卟啉环能与哪些金属离子配位,列举三种金属离子。
1.C20H12N4XCl(2分)2.卟啉环中有交替的单键和双键,由26个π电子组成共轭体系,具有芳香性。
(2分)3.Mg2+、Fe2+(Fe3+)、Co3+(各1分)第四题(8分)铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出它的立体结构,指出中心原子的氧化态和杂化类型。
要给出推理过程。
铝在化合物中一般显+3价,配体三乙胺[N(C2H5)3]是分子,配合物中还应该有3个H-做配体。
中国化学会2005年全国高中学生化学竞赛(初赛)试题与答案
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na M g Al Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量RfDb Sg Bh Hs Mt第1题(9分)用α粒子撞击铋-209合成了砹-211。
所得样品中砹-211的浓度<10-8mol/L ,砹-211同位素半衰期较长,足以用它来研究砹的化学性质。
1-1 写出合成砹的核反应方程式。
已知室温下用CCl 4萃取I 2的分配系数为c I 2(CCl 4)/c I 2(H 2O)=84,预计用CCl 4萃取AtI 的分配系数c AtI (CCl 4)/c AtI (H 2O) 84(填 >, < 或 =);理由是 。
最新-全国化学竞赛初赛模拟试卷(71)

2005年全国化学竞赛初赛模拟试卷(71)(时间:3小时满分:100分)第一题(4分)1.锝在自然界不存在,是用人工方法制备的第一个元素,锝的希腊文的原意是“人工制造”的意思。
1937年美国加利福尼亚洲立大学的意大利教授B. Segere和C. Perrier,用能量约500万电子伏特的氘核轰击质量数为96的Mo而制得。
请写出核反应方程式。
2.放射性Uub的一个原子经过6次衰变(每次衰变都放出一个相同粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的核素。
请写出核反应方程式。
第二题(6分)把适量Cl2通入Na2S2O3溶液中,总是先出现白色浑浊,继而白色浑浊消失呈无色溶液。
1.写出上述反应方程式;2.如何检验反应中新生成的离子?第三题(8分)某人买了两瓶消毒液,不小心将两种液体混在一起,结果剧烈反应,产生大量有色气体而使人中毒。
收集产生的气体,通入NaOH溶液中,气体仅部分吸收,剩余无色气体。
用pH试纸测量2瓶消毒液:甲瓶中消毒液pH=12,乙瓶中消毒液pH=2,且都能很快使pH试纸变白。
1.写出2瓶消毒液的主要成分;2.写出制备这2种消毒液的化学方程式;3.写出这2种消毒液间反应的化学方程式。
α-硫辛酸(LA)被誉为“万能抗氧剂”,是已知天然抗氧剂中效果最强的一种,其结构简式如右图。
动植物组织中LA通常与蛋白质分子中赖氨酸(C6H14N2O2)结合。
LA含量最高的植物是菠菜;在动物体内肝脏和肾脏组织中LA含量最高。
LA是代谢性抗氧剂,在生物体内可以转化为(DHLA)。
1.画出DHLA的结构简式;2.LA与赖氨酸间是通过什么作用力,以什么形式存在的?3.LA和DHLA除了清除体内自由基和活性氧外,还会有什么重要作用?第五题(7分)揭示原子内部结构的奥秘,有助于理解我们所处的物质世界。
1.某元素原子共有3种能量不同的电子,核外电子占有的轨道总数是4个,该元素有多种同位素,在科学上均有重要的应用,任写出其中2种用途。
全国化学竞赛初赛模拟题及答案

备战全国化学竞赛考前模拟训练题第一题(12分)写出下列各化学反应的方程式定量检测硝基乙烷的含量。
为正四面体构型。
将A的最高价含氧酸冷冻后与B的最高价氧化物混合,升温融化,维持温度40℃,剧烈反应生成气体C,氟化硼可于C以摩尔比1:1反应,生成D,将D溶于硝基甲烷中,通入干燥的氟化氢气体可得到沉淀E,E的阳离子与CO2为等电子体,阴离子为四面体构型。
将E与氟化钠在240℃反应得到产物F,F与固态C中的阴离子为等电子体。
2-1写出A和B生成C的方程式________________________________________2-2推测D,E,F的结构2-3 F可苯剧烈反应,写出反应的方程式第三题(10分)第四周期过渡金属M的氧化物X是重要的无机功能化工材料,研究小组将M 的氯化物加入剧烈搅拌的无水乙二醇中,并通入氨气制得了A,A是金属M的乙二醇盐。
A通过控制水量水解可得到纳米级X,A中M含量为28.5%,所有原子化学环境均相同,且不含氯元素。
X与碳酸钡熔融可以得到一重要压电材料Y,同时有气体生成。
3-1、写出M的元素符号和价电子构型3-2、写出制备A的化学方程式3-3、A的晶体分析结果表明,M的配位数为6,试说明M的配位数是如何满足的3-4、给出Y的化学式第四题(12分)经X射线分析鉴定,某一离子晶体属于立方晶系,其晶胞参数a=403.lpm。
晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
请据此回答或计算:4-1用分数坐标表达各离子在晶胞中的位置。
4-2写出此晶体的化学式。
4-3指出Ti4+的氧配位数和Ba2+的氧配位数。
4-4计算两种正离子的半径值(O2-半径为140 pm)。
4-5钼金属的晶格类型为体心立方晶格,原子半径为136pm,相对原子质量为95.94。
试计算该晶体钼的密度(原子体积占晶体空间的百分率)。
ρ= ;4-6钼能形成六核簇合物,如一种含卤离子[Mo6Cl8]4+,6个Mo原子形成八面体骨架结构,氯原子以三桥基与与Mo原子相连。
全国化学竞赛初赛模拟试卷

全国化学竞赛初赛模拟试卷第一题(4分)1.丁达尔效应的实质及产生条件各是什么?2.胶体系统能在一定程度上稳定存在的2个最主要原因是什么?第二题(5分)1.同一温度和压力条件下液态氖与液态氟化氢样品哪个熵更高些?为什么?2.氯化钠溶于水的反应NaCl(s)+n H2O(l)=Na+(aq)+Cl-(aq)。
25℃的标准焓变为3.81kJ/mol,这暗示该过程可能不自发。
我们知道NaCl事实上易溶于水,否则海水中就不会有那么高的盐分了。
那么反应的驱动力是什么?具体说明。
第三题(7分)人造血液是一种乳白色的完全人工合成的血液代用品。
它可以代替人血中的血红蛋白从肺脏向人体其他部分输送氧气。
目前对人造血液成分的研究主要集中在全氟代有机物上,A是其中有代表性的一种,输氧能力是血红蛋白的20倍,二氧化碳的溶解度也比血液高。
A由3种原子组成,质量分数为2.69%、20.75%、76.57%,其结构中F有3种不同的空间环境。
1.为什么人体血液是红色的,是否所以生物的血液都是红色的,为什么?2.写出A的结构简式;3.与健康人献血相比,人造血液具有3大优点,除输氧(CO2)量大外,还有2个优点是什么?4.人造血的发明,是人类输血史上的一项重大成果,但目前的人造血只是被用来急救,还不能完全替代人血。
其最主要原因是什么?第四题(5分)已知MgS、MnS、CaS、CaO、MgO中阴、阳离子都作立方密堆积,晶胞参数分别为520pm、520pm、567pm、480pm、420pm。
尽可能多的出求这些体系中的离子半径。
第五题(6分)木犀草素属于黄酮类化合物,结构简式如右图,具有止Array咳、怯痰和消炎等多种生理作用,金属配合物可增强原配体的生物活性。
等物质的量的醋酸盐MAc2与木犀草素在非水溶剂中完全反应得到一种配合物X,已知M(Ⅱ)的配位数为4。
1.X中木犀草素是几齿配体,说明理由;2.X是配合物分子还是存在配合物阳离子、阴离子?说明理由;3.画出配合物X的可能结构简式。
最新-全国化学竞赛初赛模拟试卷(65)
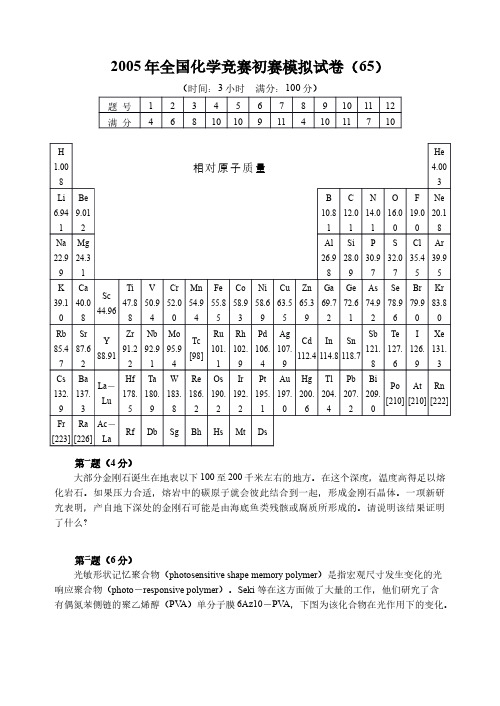
第二题(6 分) 光敏形状记忆聚合物(photosensitive shape memory polymer)是指宏观尺寸发生变化的光 响应聚合物(photo-responsive polymer)。Seki 等在这方面做了大量的工作,他们研究了含 有偶氮苯侧链的聚乙烯醇(PVA)单分子膜 6Az10-PVA,下图为该化合物在光作用下的变化。
第六题(9 分) 高超铁电池电是正在研制中的可充电干电池,如下图所示:负极材料是 Zn, 氧化产物是
Zn(OH)2, 正极材料是 K2FeO4(易溶盐),还原产物是 Fe(OH)3,电解质溶液是 KOH 水溶液, super-iron 为 FeO42-。
1.试写出该电池的电极反应。并提出下图未指出的电极材料和建议。 2.给出电池符号。 3.下图为该电池与某高能碱性电池放电曲线的对比。该图向你提供了哪些信息?简述之?
Sc
39.1 40.0
47.8 50.9 52.0 54.9 55.8 58.9 58.6 63.5 65.3 69.7 72.6 74.9 78.9 79.9 83.8
44.96
08
840453959212600
Rb Sr
Zr Nb Mo
Ru Rh Pd Ag
Sb Te I Xe
Y
Tc
Cd In Sn
85.4 87.6
91.2 92.9 95.9
101. 102. 106. 107.
121. 127. 126. 131.
88.91
[98]
112.4 114.8 118.7
72
214
1949
8693
Cs Ba
Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2005年全国化学竞赛初赛模拟试卷(75)(时间:3小时满分:100分)第一题(6分)英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗仿(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。
已知三氯生的结构简式如右图:1.预测哥罗仿和三氯生在水中的溶解性;2.系统命名法命名三氯生;3.写出由乙醇制取哥罗仿的化学反应方程式第二题(12分)1.用Cu制取硫酸铜的实验有多种方案,写出其中设计能体现“经济、高效、环保”精神2.希尔实验是将分离出的叶绿素加到铁(Ⅲ)盐溶液中,经光照后产生气体。
写出反应4.我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。
汞单质和化合物在工业生产和科学研究上有其广泛用途。
丹砂炼汞的反应包括以下两个反应:①HgS与O2反应;②HgS与CuO反应。
反应①有气体生成;反第三题(7分)联合国世界卫生组织调查,当今缺铁性贫血是世界上最流行的营养性问题,我国缺铁性贫血发生率达到15%至20%,为此2004年10月9日卫生部启动和推广铁强化酱油计划,以预防缺铁性贫血。
所谓铁强化酱油即在普通酱油中加入无铁腥味、极易被人体吸收的添加剂A,A是一种EDTA配合铁的钠盐,经检测A中Fe元素的质量分数是13.26%。
1.写出以2种常见有机物通过取代反应制取EDTA配合剂的反应方程式。
2.通过计算确定A的化学式和Fe的化合价。
第四题(4分)假设冰是六方密集形结构,其中氧一氧原子相连,氢原子占据四面体间隙位置。
估算这种66pm第五题(9分)铬及其化合物是电镀、金属加工、制革等行业必不可少的原料之一,但其生产和应用也产生了大量的含铬(Ⅲ、Ⅵ)废水,严重威胁着周围的环境。
通常认为三价铬毒性很小,危害最大的是六价铬的化合物,常用处理方法是将高价铬还原为低价铬。
23第六题(7分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。
我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):(H+)溶液为强氧化剂,可(1)测定原理:KMnO氧化甲醛和草酸。
(2)测定装置:部分装置如下图所示(a、b为止水夹)(3)实验步骤:①检查装置气密性(气密性良好)。
②准确移取25.00mL 1.00×10-3mol/L的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol/L H2SO4溶液备用。
③将2.00×10—3mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100mL新装修的室内空气。
关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。
再如此重复4次(共5次)。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。
⑥用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
⑦再重复实验2次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)25.00mL):1.写出KMnO4氧化甲醛和草酸的化学反应离子方程式。
2.步骤④如果压送气体时速度过快,可能会产生什么不利后果?【 】步骤⑤如果没有润洗广口瓶,对所测甲醛的含量将产生任何影响?【 】第七题(5分)Ag 2O 晶体属立方晶系,Z =2,O 位于晶胞顶点和体心,Ag 位于晶胞内(构成正四面体) 1.若把Ag 原子放在晶胞原点,请画出新晶胞图;第八题(7分)有机物A 是一种重要的有机化工原料,主要用于合成环氧树脂和聚碳酸树脂塑料。
A 的合成一般是在质子酸催化下,由苯酚和另一常见有机物B 合成。
A 在光照下与Cl 2反应,第九题(6分)2.通常有机物分子的紫外可见光谱是由π电子在不同能级之间的跃迁产生的。
苯胺的紫22-1++第十题(10分)硼砂是重要的硼酸盐之一,其主要成分是Na 2B 4O 7·10H 2O ,溶于水时生成硼酸和硼酸盐。
1.硼砂按其结构应写成Na 2B 4O 5(OH)4·8H 2O ,其酸根中含有两-1022522第十一题(7分)在醋酸铅溶液中加入适量的聚乙二醇,用磁力搅拌器搅拌混合均匀,在激烈搅拌下缓缓滴加没食子酸(结构简式如右图)溶液,生成浅黄色的沉淀。
滴加完后继续搅拌10min ,在室温下静置30min 后过滤,分别用蒸馏水和无水乙醇加超声波震荡洗涤数次。
样品干燥后研磨得土黄色纳米粉体X 。
X 是结构复杂的配合物,经过检测X 中含碳元素14.05%;将X 加热到340℃,分解完全,失重25.42%。
1.计算X 的最简式;2.指出X 的结构特点(不要求画结构);第十二题(5分)乌苯美司(Bestatin )能有效地抑制氨肽酶B 和亮氨酸氨肽酶的活性,对急性白血病、恶性黑色素瘤等有显著疗效。
因此人们对药物的关键中间体E 的研究很感兴趣。
我国研究者设计了如下三步合成路线:-CH 2Br −→−A B −→−CD −→−2H E ()已知第一步反应是取代反应、第二步反应是加成反应、第三步反应是还原反应,其中前2步反应中都用了C 2H 5ONa ,最后一步反应需用催化剂。
1.写出A 、B 、C 、D 的结构简式;第十三题(8分)某常见正盐X ,加强热使其充分分解,未有固体残留;所得气体通入足量BaCl 2溶液中,产生1.336g 白色沉淀,微热溶液得到89.6mL 气体;如果所得气体通入足量Ba(OH)2溶液中,白色沉淀增加到1.771g ,微热溶液足够时间得到313.6mL 气体(气体体积在标准状况下测定)。
1.通过分析确定X 的化学式;第十四题(8分)测定铅锡合金中的Pb 、Sn 含量时,分析步骤如下:①称取试样0.452g ,用HCl 加热溶解后,铅为Pb (Ⅱ)、锡为Sn (Ⅳ),溶液冷却时,出现锡的化合物沉淀和铅的化合物沉淀。
②准确加入50.00mL 浓度为0.1000mol/L EDTA 标准溶液,沉淀溶解得无色透明的溶液。
③将溶液全部转入250.0mL 容量瓶中,用蒸馏水稀至刻度,摇匀。
④取该溶液25.00mL ,加入30%的六次甲基四胺溶液15mL 、60mL 蒸馏水和2滴二甲酚橙溶液,得pH 为5.5的黄色澄清溶液。
⑤用浓度为0.02000mol/L 的Pb 2+标准溶液滴定④溶液由黄色变为红色时为滴定终点,消耗Pb 2+标准溶液9.060mL 。
⑥然后加入足量NH 4F ,加热至40℃左右,溶液重新变回到黄色。
⑦再用上述Pb 2+标准溶液滴定⑥溶液自黄色变为红色时为滴定终点,消耗Pb 2+标准溶液11.84mL 。
1.步骤①中出现的铅化合物的沉淀是什么? 2.解释步骤②于沉淀溶解的原因。
3.在步骤④中加入六次甲基四胺和二甲酚橙、步骤⑥中加入NH 4F 的目的分别是什么?中学综合学科网版权所有,任何网站不得转载参考答案(0575)第一题(6分)1.哥罗仿和三氯生都难溶于水(1分)2.2,4,4’-三氯-2’-羟基二苯醚(1分)3.CH3CH2OH+4Cl2→CCl3CHO+5HCl CCl3CHO+NaOH→HCCl3+HCOONa(各1分)4.136(2分,10+3×6+10×6+16×3)第二题(12分)1.适当温度下,使铜片在持续通入空气的稀硫酸中溶解(1分)2Cu+O2+2H2SO4=2CuSO4+2H2O(2分)2.4Fe3++2H2O4Fe2++4H++O2↑(2分)光合作用产生的氧气来源于水(1分)3.SCl2+SO3=SOCl2+SO2SOCl2+H2O=SO2+2HCl C2H5OH+SOCl2=C2H5Cl+SO2+HCl(各1分)4.①HgS+O2Hg+SO2(1分)②4HgS+4CuO4Hg+3CuS+CaSO4(2分)第三题(6分)1.H2NCH2CH2NH2+4ClCH2COOH→(HOOCCH2)2NCH2CH2N(CH2COOH)2+4HCl(1.5分)2.A的相对分子质量55.85/0.1326=421.2,扣除FeEDTA后余77.1,正好是1个Na+和3个H2O分子。
A的化学式为Na(FeEDTA)·3H2O(3分,C10H12FeN2NaO8·3H2O),Fe +3(0.5分)3.(1分)第四题(4分)因为球体以六方密集型和立方密集型堆积是等效的,则二者的密度也是相等的。
由于便于观察,可求立方密集型晶格的密度。
(1分)2a=4×66,a=187pm(1分)ρ=4M/N A a3=18.3g/cm3(2分)第五题(9分)1.Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O(2分)2.2Cr3++3CO32-+3H2O=2Cr(OH)3+CO2↑(1分)2Cr(OH)3+3S2O82-+10OH-=2CrO42-+6SO42-+8H2O(1分)Pb2++CrO42-=PbCrO4↓Pb2++SO42-=PbSO4↓(1分)3.电解中阳极:Fe-2e-=Fe2+(1分);阴极:2H++2e-=H2↑(1分);生成的Fe2+将Cr2O72-还原:6Fe2++Cr2O72-+14H+=6Fe3++Cr3++7H2O(1分);随着溶液pH的升高,Fe3+、Cr3+沉淀为Fe(OH)、Cr(OH)3(1分),将其过滤加热回收。
3第六题(7分)1.4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(各1分)2.甲醛吸收不充分,影响测定结果结果偏高(各1分)3.27.60(2分,(75c l V1—30c2V2)×103)不能(1分)第七题(5分)1.(3分,Ag位于顶点面心;O位于一对角线1/4,3/4处)2.Ag的配位数为2,配位型式为直线型;O的配位数为4,配位型式为四面体(2分)第八题(7分)1.A:HO--OH(2分)CH3COCH3(2分)2.2-OH+CH3COCH3→+HO--OH+H2O(1分)3.4(1分)4.O--OCO(1分)第九题(6分)1.LiAlH4能与醇发生如下反应:CHOH+LiAlH4→4H2+LiAl(OC2H5)4,因为C2H5OH的酸性比H2强(或H-的碱性比C2H5O-强)(2分)2.苯分子中有离域π键π66,而苯胺分子中有离域π键π87。
π电子的状态不同,因而紫外可见光谱不同。
但在C6H5NH3Cl分子中,N原子采用sp3杂化轨道成键,所形成的离域π键仍为π66,所以其紫外可见光谱和苯相近。
