血清-病毒中和试验的标准操作规程
标准操作规程(SOP)——流感禽流感微量中和抗体检测

标准操作规程(SOP)——一、目的微量中和试验是一种敏感性高、特异性强的血清学方法,用于测定血清中的病毒特异性中和抗体水平。
中国国家流感中心的所有技术人员,必须按照本文件相关的操作规程,进行流感/禽流感微量中和抗体检测实验,以确保实验的准确性。
二、范围适用于中国国家流感中心的所有技术人员进行流感/禽流感微量中和抗体检测。
三、责任进行流感/禽流感微量中和抗体检测的技术人员需严格按照规定进行操作。
四、程序(一)生物安全要求H5,H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的操作需要在生物安全3级(BSL-3)实验室中进行。
其余流感病毒的操作需要在生物安全2级(BSL-2级)实验室中进行。
操作人员必须严格按照相应实验室的要求做好个人防护。
(二)材料1.中和反应实验材料(1)病毒:一般采用接种鸡胚尿囊腔后收获的流感/禽流感病毒液,在-70℃中保存,并且注意避免反复冻融。
进行中和试验之前,需先进行病毒滴度(TCID50)的滴定。
具体步骤如下,1)病毒的稀释:可采取对数或者半对数稀释的方法。
以下介绍半对数稀释法。
取1管冻存病毒尿囊液,用病毒培养液进行1:100稀释。
第一列4个孔每孔加入146μL 1:100稀释过的病毒液,其它各列每孔加入100 μL 病毒培养液。
然后用多道加样器从第一孔吸46μL 至第二孔,做系列半对数稀释,使之成为10-2、10-2.5、10-3、10-3.5……10-7。
每孔含有100μL 病毒液。
2)每孔加入100μL MDCK 细胞悬液(1.5×104细胞/孔),37℃,5%CO 2培养箱孵育18~22h 。
每一滴度作平行4孔。
3)细胞固定、ELISA 操作如下述。
4)OD 值 〉2倍MDCK 细胞对照OD 值判定为阳性5)病毒滴度计算见组织细胞半数感染量滴定SOP 。
(2)血清样品:包括待检血清、阳性及阴性血清对照。
如果待检血清有可能需要多次检测,则需将待检血清进行小量分装,-20℃至-70℃保存均可,避免多次反复冻融。
中和试验方法操作规程

中和试验方法操作规程1.目的:建立中合实验法,统一操作标准,确保产品质量。
2.适用范围:公司生物制品效价测定的中合实验。
3.责任:质检人员有按此程序进行操作的责任,质量管理部经理有检查监督的责任。
4.程序:4.1:实验前准备①、9-10日龄的SPF鸡胚、病毒。
②、样品稀释管、病毒稀释管、打孔器、镊子、5ml吸头、1ml、200ul吸头各一盒、废弃物缸、烧杯,以上物品均需灭菌处理③、照蛋器、电炉、旋涡混合器、5ml微量移液器、1ml微量移液器、200ul微量移液器、记号笔、酒精棉球、碘棉、打火机、蜡、玻璃棒、无菌手套④、实验开始前记得要使房间温度达到30摄氏度左右,房间要紫外照射30min,生物安全柜紫外照射30min准备要用的检测用品同步放在生物安全柜里紫外照射。
4.2:稀释①、将样品用生理盐水2倍系列稀释,使之成1:2;1:4;1:8;1:1;,1:32;1:64;1:128;1:256;1:512;1:1024......。
②、病毒的稀释:将病毒稀释成每单位剂量含200ELD50.。
例如:病毒ELD50=10-8.375/0.1ml,将病毒稀释成每单位剂量含200ELD50的稀释倍数=108.375/200=1.2*106。
即将病毒稀释 1.2*106倍即为200ELD50/0.1ml。
③、准备七根试管(或EP管),编号1-7,在1号管中加入0.2ml 灭菌生理盐水,2-7号管中各加入9ml 灭菌生理盐水.再将ELD50=108.375/0.1ml 的病毒取1ml加入1号管中震荡混匀,再从1号管中取1ml加入2号管中震荡混匀,依次10倍系列稀释至第7管。
(依据最后接种量和接种鸡胚数计算出中和抗体用病毒的量,7号管可以多稀释几支备用。
)4.3:中和:将稀释成每单位剂量含200 ELD50的病毒与等量的2倍系列稀释的待检样品混合,37度中和1小时,准备接种鸡胚。
4.4:在中和的一个小时里准备工作:①、照蛋,弃掉发育不好的和活力不强的鸡胚,②、在血管较少的部位画出气室,③、然后消毒鸡胚(先用碘棉酒毒再用酒精格脱碘),④、随机分组,、编号:一个样品稀释度为一组,每个稀释度3~6枚鸡胚,进行编号。
中和试验

中和试验一.定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10-1、10-2、10-3 ……10-9,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
表2-24LD50的计算(接种剂量为0.03ml)病毒稀释度接种鼠数活鼠数死鼠数积累总计死亡比死亡率(%)10-4 5 0 5 0 15 15/15 10010-5 5 0 5 0 10 10/10 10010-6 5 1 4 1 5 5/6 8310-7 5 4 1 5 1 1/6 1710-8 5 5 0 10 0 0/10 010-9 5 5 0 15 0 0/15 0LD50的计算:按Reed和Muench氏法计算。
高于50%的死亡分数-50%83%-50%距离比例= ────────────────────= ──────= 0.5高于50%的死亡百分数-低于50%的死亡百分数83%-17%LD50的对数=高于50%病毒稀释度的对数+距离比例×稀释系数的对数本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。
血清中和抗体检测流程

血清中和抗体检测流程英文回答:The process of detecting serum neutralizing antibodies involves several steps to ensure accurate and reliable results.First, blood samples are collected from individuals and the serum is separated from the blood cells. The serum is then treated to inactivate any potential infectious agents that may be present in the sample.Next, the serum is diluted to a specific concentration and mixed with a standardized amount of the virus or pathogen that the antibodies are being tested against. This mixture is then incubated for a period of time to allow the antibodies in the serum to neutralize the virus.After the incubation period, the mixture is added to a cell culture or other system that supports viralreplication. If the antibodies in the serum are able to neutralize the virus, there will be a reduction in viral replication compared to a control sample without serum.The final step involves measuring the level of viral replication in the presence of serum and comparing it to the control sample. This can be done using various techniques such as quantitative PCR or plaque assays.The results of the serum neutralizing antibody test can provide valuable information about an individual's immune response to a specific virus or pathogen. This information is important for understanding immunity to infectious diseases and for developing effective vaccines and treatments.中文回答:血清中和抗体检测流程涉及多个步骤,以确保结果准确可靠。
狂犬病病毒中和抗体检测实验流程

狂犬病病毒中和抗体检测实验流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!狂犬病病毒中和抗体检测实验流程详解狂犬病,一种由狂犬病病毒引起的致命性传染病,对人类和动物的健康构成严重威胁。
中和实验方法

RSV特异性中和抗体滴度检测一、实验原理:抗体与相应的病毒粒子特异地结合,使后者失去对易感动物或细胞的致病力。
(该试验方法以测定抗病毒血清的中和价,将待检血清2倍递增稀释,加等量已知毒价的病毒液。
)二、实验分类:1. 固定血清--稀释病毒中和试验2. 固定病毒—稀释血清中和试验3. 简单定性中和试验4. 空斑减少法三、实验步骤:1.提前设定56 ℃水浴锅,将分装好的待测血清于56 ℃灭活(降低补体对实验结果的影响)30min 。
2.将加过双抗的培养基DMEM/F-12(用于Hep-2细胞;Vero细胞常用DMEM培养基)和BI血清进行37℃预热30min,与此同时灭好实验台(该准备3599细胞培养板灭过菌枪头以及15ml和50ml摇菌管)为后续实验做准备。
3.实验台灭菌30min,灭好台子后进行实验,首先取1.5mlEP管,用DMEM/F-12培养基8倍稀释待测血清(每管中加培养基210µl,再加相应的血清30µl),拆开96孔培养板后在盖子进行设计(实验设计参考图1),最后向每孔中加入75µl的培养基,按照实验设计加入相应的稀释血清75µl,用排枪以两倍梯度稀释血清。
(注意:最终到256倍时吸出的多余的75µl血清并弃掉。
)4.实验孔以及阳性对照孔分别每孔加入25 µl(注意:加毒时应从血清低浓度到高浓度)的104 TCID50病毒混匀,4℃孵育2 h。
5.在实验剩余半小时左右进行消化细胞,镜检细胞汇合度为90%左右即可用,弃掉培养液后,用2-3 ml无血清培养吹洗几遍细胞(意图为去除死细胞或活性不好的细胞),加入2 ml 胰酶后开始计时,将细胞培养板置于37℃的CO2无菌培养箱培养消化2-3min,在镜检细胞间有间隙或细胞收缩为单个状态为好,加入等体积的无血清培养基终止,小心吸掉液体,加入有血清的培养基2-3ml轻轻地吹下皿底部的细胞,轻微用枪吹吸几次使其成为均匀的单细胞悬液后转移到新的15ml离心管中等待细胞计数。
中和实验方法

RSV 特异性中和抗体滴度检测一、实验原理:抗体与相应的病毒粒子特异地结合,使后者失去对易感动物或细胞的致病力。
(该试验方法以测定抗病毒血清的中和价,将待检血清2 倍递增稀释,加等量已知毒价的病毒液。
)二、实验分类:1. 固定血清--稀释病毒中和试验2. 固定病毒—稀释血清中和试验3. 简单定性中和试验4. 空斑减少法三、实验步骤:1. 提前设定56 C水浴锅,将分装好的待测血清于56 C灭活(降低补体对实验结果的影响)30min 。
2. 将加过双抗的培养基DMEM/F-12 (用于Hep-2 细胞;Vero 细胞常用DMEM培养基)和BI血清进行37C预热30min,与此同时灭好实验台(该准备3599细胞培养板灭过菌枪头以及15ml和50ml摇菌管)为后续实验做准备。
3•实验台灭菌30min,灭好台子后进行实验,首先取1.5mlEP管,用DMEM/F-12培养基8倍稀释待测血清(每管中加培养基210卩」再加相应的血清30^)1,拆开96孔培养板后在盖子进行设计(实验设计参考图1),最后向每孔中加入75卩的培养基,按照实验设计加入相应的稀释血清75门用排枪以两倍梯度稀释血清。
(注意:最终到256倍时吸出的多余的75卩血清并弃掉。
)4•实验孔以及阳性对照孔分别每孔加入25卩1(注意:加毒时应从血清低浓度到高浓度)的104TCID50病毒混匀,4C孵育2 h。
5. 在实验剩余半小时左右进行消化细胞,镜检细胞汇合度为90%左右即可用,弃掉培养液后,用2-3 ml 无血清培养吹洗几遍细胞(意图为去除死细胞或活性不好的细胞),加入 2 ml 胰酶后开始计时,将细胞培养板置于37C的CO2无菌培养箱培养消化2-3min,在镜检细胞间有间隙或细胞收缩为单个状态为好,加入等体积的无血清培养基终止,小心吸掉液体,加入有血清的培养基2-3ml 轻轻地吹下皿底部的细胞,轻微用枪吹吸几次使其成为均匀的单细胞悬液后转移到新的15ml 离心管中等待细胞计数。
中和试验步骤

中和试验步骤1、测定病毒TCID100µl50/2、制备细胞悬液,使细胞浓度约为1×105个/mL,加到96孔细胞培养板中,每孔100µl。
置37℃CO2培养箱中,直至细胞长至单层。
3、血清灭活:将待检测的血清放到56℃水浴30min(此时血清中的病原菌都已被灭活)。
4、100TCID50/50µl病毒液或者200TCID50/25µl病毒液的制备,这两者是等价的。
100TCID50/50µl病毒液制备方法:计算已测定了TCID50/100µl 的病毒原液稀释至100TCID50/50µl的稀释倍数:lg100TCID50/50µl=-log100-log(100/50)=-2.30103得100TCID50/50µl=10-2.30103,假设病毒TCID50/100µl=10-6.3,则稀释倍数=(100TCID50/50µl)÷(TCID50/100µl)=106.3÷102.30103≈9976倍。
5、取一块新的96孔板,1-10列每孔加50µl待检血清原液,再用8道孔排枪加每孔100TCID50/50µl病毒液50µl,稍微吹打使血清与病毒液混均。
11列先每孔加50µl维持液,再于11列的第一孔加50µl 标准阳性血清,将标准阳性血清往下作1:2、1:22至1:28倍稀释。
12列第1孔加标准阴性血清原液50µl,再加100TCID50/50µl病毒液50µl。
用维持液将100TCID50/50µl的病毒液作4次连续10倍稀释,稀释成10TCID50/50µl、1TCID50/50µl、0.1TCID50/50µl,依次加到第12列的3到6孔,每孔加50µl,再每孔加50µl维持液。
4病毒血清学实验方法

二、方法与步骤
(一)试验材料
病毒
必须是具有感染力的病毒,先进行病毒 滴度的测定。
细胞培养,将病毒10倍稀释接种敏感细 胞,观察CPE,确定滴定终点以CCID50 或LD50表示。
标准病毒试验浓度:100 CCID50/单位 体积或100 LD50/单位体积。
(一)试验材料
抗体
包含病毒抗体阳性和阴性血清。 用细胞培养法测病毒抗体的滴度:将倍比稀释
=(71-50)/(71-29)=0.5
大于50%的CPE阳性率血清稀释度的对数+距离比例×稀释 系数的对数=lg10-3+0.5 ×lg0.1=-3.5,其反对数是10-3.5。
阳性血清组的病毒CCID50为10-3.5/0.1ml。
因抗血清组的CCID50为10-3.5,阴性血清组的病毒 CCID50为10-5.5,所以10-3.5-10-5.5=2,表明分离的病毒 是与中和抗体相对应的病毒。
lgCCID50=大于50%的CPE阳性率血清稀释度的对 数+距离比例×稀释系数的对数=lg10-5+0.5 ×lg0.1=-5.5,其反对数是10-5.5.
阴性血清组的病毒CCID50为10-5.5/0.1ml。
用Reed-Muench计算 表: 阳性组血清病毒CCID50的计算
病毒稀释 CPE孔数
第六章 病毒血清学实验方法
第一节、中和试验
(neutralization test)
概念:体外将病毒与特异抗体混合并 发生反应,再将混合物接种至敏感的 宿主体内,然后测定残存病毒感染力 的方法。
– 中和抗体:凡与病毒抗原结合使病毒失去 感染力的抗体。
–优点
敏感性和特异性高; 中和抗体在体内存在时间长。
BVDV中和抗体检测SOP

1.目的建立血清BVDV中和抗体检验操作规程,以确保抗体水平检测效果。
2.适用范围初制、精制血清的BVDV中和抗体检验操作。
3.职责3.1.质量管理部:负责本规程的起草。
3.2. QC:负责本程序的操作。
4.3. 总经理:负责本规程的审批。
5.定义无6.引用标准《中华人民共和国兽药典》2010版7.材料及设备8. 1 试剂9. 1.1. 标准毒株OregOnC14V9.1.2, 标准阳性血清、标准阴性血清6.1.3. 犊牛原代•肾细胞、睾丸细胞和牛肾细胞系(MBDK)细胞。
6∙2 实验器材9.2.1. 微量细胞培养板(简称微量板)96孔平底板。
6・2.2,加样器:100μ1单通道和多通道的可调加样器。
9.2.3.相应的吸尖6∙2.4. 培养基6.2.5. 稀释液及营养液(DMEM或MEM),pH7.0〜7.2,每毫升加100μg链霉素和IOOIU青霉素,按说明书配制。
6. 2.6. 生长液:营养液加10%犊牛血清。
7. 2.7. 维持液:营养液加2%〜5%犊牛血清。
8. 2.8. 细胞消化液:EDTA-胰酶9. 2.9. 被检血清:常规分离血清,56℃灭活30位11。
10.流程图无11.内容8.1 定量试验8.1.1. 血清稀释8.1.1.1. 用多通道加样器于96孔微量板中每孔加稀释液50μ1o8.1.1.2. 用单通道加样器取50μ1灭活的被检血清加于微量板的第一排孔中,每份样品加4个孔。
8.1.1.3, 用多通道加样器(调至50H1)从第一排孔开始作连续倍比稀释,直至最后一个孔,并从最后孔中弃去50U1稀释物。
8.1.2.加病毒/50μ1的工作液。
8.1.2.1. 用稀释液将标准毒株0regonC24V稀释成含100TCID508.1.2.2. 用多通道加样器从第二排孔开始每孔加病毒工作液50μ1,第一排孔中加50μ1稀释液作为被检血清对照。
8.1.3.将微量板盖严,置于37C 5%二氧化碳培养箱中中和2小时。
病毒中和抗体检测

病毒中和抗体检测1.病毒TCID50检测TCID50 是指组织培养物(细胞)半数致死剂量.它有几个性质我们必须明白:1)它表示的是计量,不是浓度;2)它是一个单位;3)它的值等于1,实际上问它的值等于多少是一个没有意义的问题,就像问km的值等于多少一样,如果非要说出的的值等于多少,那我们只能说它的值在任何情况下都等于1。
理解这三个性质对于理解TCID50非常重要,但是这三个性质经常被误解,所以导致对TCID50的理解出现偏差。
首先我们来看一下这个表示法的意思:病毒滴度为108.2TCID50/ml .它表示的是每ml病毒溶液里含有108。
2个TCID50的病毒,这和氯化钠的浓度为4.5mol/L表示每L溶液中含有4.5个mol 的氯化钠是一样的道理.经常可以听到人说我的病毒的TCID50是10x。
x.这个说法是不科学的,应该说我这个溶液里含有10x。
x个TCID50的病毒或者说我这个溶液的病毒滴度是10xx TCID50/ml。
也可以说病毒的TCID50效价是10-x.x。
TCID50=10^5.64/0.1ml。
即:将病毒悬液作10^5.64稀释后,接种细胞0.1ml,可以使50%的细胞产生CPE.(将病毒悬液作10^5。
64稀释后,0。
1ml中含1个TCID50,作其他一些实验时(如中和试验),一般常用100TCID50/0。
1ml或者100TCID50/0。
05ml)本方法的优缺点:①.优点:出现阳性结果时间较短,且较明显;②.缺点:有时候,在用枪头吸出细胞生长液时,容易出现污染;使用本方法时的注意事项:①.稀释病毒时,每做一个病毒稀释度都需要换枪头,减少浓度误差;②。
96孔板,每孔接种的细胞量:一般在此种测定病毒滴度的方法下,要将细胞密度适当调低,至少要比正常传代时低一些,否则细胞生长速度过快,未到7天则细胞出现死亡,对观察CPE不利.一般情况下,小塑料瓶(8-9ml液体为正常用量),培养长慢单层后,消化细胞,加入6ml培养液,吹匀,吸出其中的2ml,到另外的瓶子,在该瓶中加入14—16ml即可,如果不放心,可以用显微镜看一下,细胞数过多则补加培养液,少则补加剩余4ml的细胞悬液;维持液,即病毒培养液,配方为:①。
血清中和试验步骤

血清中和试验步骤
血清中和试验听起来好像很专业很高深,但其实啊,就像是一场有趣的战斗!咱就来好好聊聊这个血清中和试验到底是咋个搞法。
你得先准备好你的“武器”和“战场”呀。
把血清和病毒准备好,这就像是给战士们配备好刀剑和敌人。
然后呢,把它们放在一起,让它们开始“过招”。
想象一下,血清就像是一群勇敢的卫士,而病毒呢就是那些捣乱的小坏蛋。
卫士们要努力去抓住小坏蛋,不让它们捣乱。
接下来,把血清和病毒混合后,要给它们一点时间去“纠缠”。
这时候可别着急,就像炖一锅好汤需要时间一样。
等它们“纠缠”得差不多了,就把这混合物放到合适的地方去观察。
观察啥呢?看看病毒还能不能继续作恶呀!如果血清厉害,把病毒都给中和掉了,那病毒就没法再去侵害其他细胞啦。
这过程可不简单哦!得特别细心,就像照顾一个小宝宝一样。
每个步骤都不能马虎,不然结果可能就不准确啦。
比如说,血清和病毒的比例得掌握好,多了少了可能都会影响结果呢。
这就好像做菜放盐一样,放多了太咸,放少了没味道。
还有啊,操作的环境也很重要。
要干净、整洁,不能有其他干扰因素跑进来捣乱。
不然血清和病毒的“战斗”可能就会被打乱啦。
做血清中和试验就像是一场冒险,每一步都充满了挑战和未知。
但只要你认真、细心,就一定能顺利完成这场冒险。
而且呀,这个试验可是很有意义的呢!它能帮助我们了解病毒的特性,找到对抗病毒的方法。
就像侦探在寻找线索一样,一点点地揭开病毒的神秘面纱。
所以啊,别害怕血清中和试验,大胆地去尝试吧!让我们一起成为血清中和试验的小勇士,为对抗病毒贡献自己的力量!。
中和试验检测方法

一、实验目的 了解中和试验的基本原理和几种不同的
测定方法,掌握固定病毒—稀释血清法的 操作步骤和计算方法及含义。
二、原理 抗体与相应的病毒粒子特异性地结合,
使后者丧失感染能力。
三、用途
1、疾病诊断 2、病毒分离株的鉴定 3、不同病毒株的抗原关系研究 4、疫苗免疫原性的评价 5、免疫血清的质量评价 6、测定实验动物血清中是否存在抗体
四、材料 1、长满单层的细胞1瓶 2、胰酶、吸球、吸管、生长液 3、96孔细胞培养板 4、加样器、枪头 5、病毒液(PRV) 6、待检血清、阴性对照血清
五、方法
1、固定病毒—稀释血清法 将不同稀释度的血清与固定量的病毒液(一般为
100或200个TCID50、EID50或LD50)混合感作一定 时间以后,接种于敏感细胞、鸡胚或实验动物,测定 被检血清阻止组织培养细胞、鸡胚或实验动物发生病 毒感染的能力及其效价。
即1:20稀释的待检血清可保护50%的组织培 养胞免于出现CPE
2、固定血清——稀释病毒法
在固定量的血清中,加入等量不同稀释度 的病毒,用对照非免疫血清(对照组)和待 检血清同时进行测定,计算每一组的TCID50、 EID50或LD50,然后计算中和指数。
操作步骤:
➢将病毒作连续10倍稀释 ➢将稀释好的病毒接种96孔板,每个稀释度接种一
➢在上述各孔内加入50µl稀释好的病毒液,混匀 后放入37℃ 5%CO2培养箱中作用45min60min。
➢同时设待检血清毒性对照,阴、阳性血清对照, 病毒对照和正常细胞对照,其中病毒对照要作 200个TCID50、20个TCID50、2个TCID50、 0.2个TCID50 4个不同浓度的对照。
纵排共8孔,每孔50μl,做两块板子。在其中一 块板子的每孔加入50μl待检血清(试验组),另 一块板子的每孔加入50μl正常血清(对照组), 混合后置37℃ 5%CO2培养箱作用1h。
血清中和抗体检测流程

血清中和抗体检测流程一、样本采集。
咱们先来说说样本采集这一步。
这就像是从身体这个大宝藏里取出一点小秘密。
一般呢,是从静脉采血。
护士姐姐或者哥哥会拿着一个小小的针管,找到你的静脉,然后轻轻地扎一下。
可能会有点小疼,就像小蚂蚁咬了一口似的。
采集的血量不会太多,但是这一点点血可包含着很多重要的信息哦。
采集完之后,会把血放到专门的采血管里,这个采血管也是有讲究的,它能保证血样的稳定,就像给血样宝宝一个安全的小窝。
二、样本处理。
血样采集好了之后,就到了样本处理这一环节啦。
这就像是给血样来一个小小的变身。
实验室的工作人员会把采血管里的血进行离心处理。
这个离心的机器可神奇了,转呀转的,就把血里面的不同成分分离开来。
就好像是把一群小伙伴按照不同的特点分开一样。
经过离心之后,血清就被分离出来了。
血清可是咱们检测中和抗体的关键部分呢。
这个血清就像是血液中的精华部分,它里面可能藏着中和抗体的小秘密。
三、检测准备。
接下来就是检测准备啦。
这就像是为一场盛大的表演做准备工作。
工作人员要准备好检测用的试剂呢。
这些试剂就像是一把把小钥匙,要去打开血清中和抗体这个神秘大门。
检测的仪器也要提前调试好,就像给乐器调音一样。
这个仪器得处于最佳状态,这样才能准确地检测出中和抗体的情况。
而且实验室的环境也很重要哦,温度、湿度都要合适,就像给这个检测过程创造一个舒适的小天地。
四、进行检测。
然后就到了正儿八经进行检测的时候啦。
把处理好的血清样本和试剂按照一定的比例混合在一起。
这个混合的过程可不能马虎,就像做菜的时候放调料一样,比例得刚刚好。
然后把混合好的样本放到检测仪器里面。
这个仪器就开始工作啦,它就像一个超级侦探,在血清样本里寻找中和抗体的蛛丝马迹。
这个过程可能需要一点时间,咱们就耐心地等待就好啦。
五、结果分析。
检测完了之后,就是结果分析这一步啦。
这就像是解开一个神秘的谜题。
工作人员会根据仪器检测出来的数据进行分析。
如果检测到了中和抗体,那就是一个好消息,就像找到了宝藏一样。
禽流感病毒中和实验

禽流感病毒中和实验及其他方法(一)实验材料1、中和反应实验材料(1)病毒:)的滴定。
一般为鸡胚尿囊病毒液,进行中和实验前,需要进行病毒滴度(TCID50(2)血清样品包括待检血清和阳性以及阴性对照血清。
人血清实验前需要56℃ 30分钟灭活,动物血清需RDE处理。
-20℃储存,避免多次反复冻融。
(3)MDCK细胞和细胞培养试剂1)MDCK细胞(狗肾上皮细胞)2)MDCK细胞培养液:DMEM+5%牛血清+抗生素,过滤除菌500毫升 DMEM(修饰的Eagles培养基)5.5毫升 100×抗生素(100单位/毫升青霉素+100微克/毫升链霉素)5.5毫升 100×L-Glutamine(2毫摩尔)25.5毫升 56℃、30分钟加热灭活的牛血清3)胰酶 / EDTA(4)其它1)平底96孔微量培养板2)病毒稀释液:DMEM+1%牛血清白蛋白+抗生素,即配即用。
429毫升 DMEM66毫升 7.5%牛血清白蛋白(BSA)5毫升 100×抗生素3)TPCK-胰酶(使用浓度为2微克/毫升)4)固定液:80%的丙酮,即配即用,4℃保存400毫升丙酮100毫升 PBS,PH 7.22、ELISA实验材料(1)抗体1:鼠抗流感病毒甲型核蛋白克隆抗体(2)抗体2:辣根过氧化物酶标记的羊抗鼠IgG(3)洗涤液:PBS+0.05%TWEEN-204升 PBS,PH 7.22毫升 TWEEN-20(4)封闭液:PBS+1%牛血清白蛋白+0.05%TWEEN-20867毫升PBS,PH 7.2132毫升牛血清白蛋白1毫升TWEEN-20(5)底物和底物溶液:常用的辣根过氧化物酶(HRP)所用底物为磷苯二胺(OPD)底物溶液为PH5.0磷酸盐-柠檬酸缓冲液(0.05M)底物和底物溶液:10毫克OPD20毫升柠檬酸缓冲液(含0.015%双氧水)即配即用磷酸盐-柠檬酸缓冲液,PH5.058.8克柠檬酸三钠1升蒸馏水用盐酸调节PH为5.0加0.015%双氧水,(临用前加入)* 如果使用磷酸盐-柠檬酸缓冲液胶囊(Sigma)1个胶囊加入100毫升蒸馏水,临用前配制(6)终止反应液:1N硫酸(28毫升浓硫酸+1升蒸馏水)3、其他细胞培养和酶联免役吸附实验的常用设备和仪器(参照英文讲义)备注:A.以上实验材料购自Gibco,,Hyclone,Dynatech,Kirkegaard&Perry和Sigma 公司,材料编号(CAT#)参照英文讲义。
中和抗体测定

病毒分离技术(四) ——中和抗体测定
• 对照的设立 • 血清对照( 1∶4),标准血清和待检血清同时设立 • 细胞对照、稀释液对照 • 100CCID50的抗原对照
❖每 个 对 照 设 两 孔 , 血 清 、 抗 原 的 量 各 为 0.025ml/孔,补加稀释液0.025ml/孔,细胞对 照孔的稀释液应为0.05ml,然后全部加细胞悬 液0.1ml/孔,密封后放34.5℃培养5~7天。
第8页/共18页
病毒分离技术(四)
——中和抗体测定
• 结果判定 当100CCID50的抗原对照出现完全病变时,判定最终结果 当最高稀释度的血清病毒混合液接种的2孔细胞中有1孔不出现CPE,该稀释度 的倒数即为该血清标本的中和抗体滴度。
第9页/共18页
血清对照1∶4 血清稀释1∶4
1∶16 1∶64 1∶256 1∶1024 血清对照1∶4 血清稀释1∶4 1∶16 1∶64 1∶256 1∶1024
题外话
• 感谢大家多年来对免疫预防工作的支持 • 新的问题不断涌现,促使我们不断的向前 • 未来,任重而道远
第16页/共18页
Thank you very much!
第17页/共18页
感谢您的观赏!
第18页/共18页
◎○◎○
◎○◎○
○○○○
○○○○
◎○◎○
◎○◎○
◎○◎○
◎○◎○
血清6
血清7
第3页/共18页
血清4 ○○ ○○ ◎○ ◎○ ◎○ ◎○ ○○ ○○ ◎○ ◎○ ◎○ ◎○
血清8
病毒分离技术(四)
——中和抗体测定
待检血清稀释方法示例:
稀释度
1:4 1:16 1:64 1:256
中和试验

抗HCMV IE单抗的出现促进酶联免疫法在HCMV 中和抗体效价检测中的应用,一些新型快速微量 中和试验相继建立,但结果需通过人工计数,检 测通量不高,本实验使用CCD进行图像采集和克 隆计数软件分析和计算,结果准确客观 本实验参照酶联免疫斑点法(ELISPOT),并使 用生物素-亲和素系统对信号进行放大,灵敏度有 所提高。 反应在96孔板中进行,样品用量仅为25μl,节约 成本。 无需昂贵的荧光显微镜,不受荧光信号容易淬灭 影响。
6.病毒中和试验:Neutralization of a virus is defined as the loss of infectivity through reaction of the virus with specific antibody. • 以测定病毒感染力为基础,以病毒受免疫 血清中和后残存的感染力为依据,来判定 免疫血清中和病毒的能力。 • 常用于检测患者血清中抗体消长情况,抗 原免疫原性评价,也可用来鉴定未知病毒 或对病毒进行半定量等。
步 骤 三
加至已长成单层 的MRC-5细胞
16h,18h,20h 所铺细胞数目要求较高,防止细胞叠层
梯度乙醇固定细胞, 封闭30min
相继用IE1单抗, 生物素标记羊抗鼠IgG, 链霉亲和素-HRP, 以及底物显色
图像采集与数据处理
实验组
病毒对照
细胞对照
步骤一
25μ l血清
25μ l维持液
25μ l维持液
通常滴定终点的判断还需要有经验,不同 操作者之间主观因素影响较大。 CPE只能在细胞水平反映病毒的感染状态 ,对于病毒是否进入细胞(中和抗体主要 作用是在病毒吸附和侵入阶段阻断病毒感 染),感染进程无法体现。
(六)发展趋势
病毒中和试验测定法
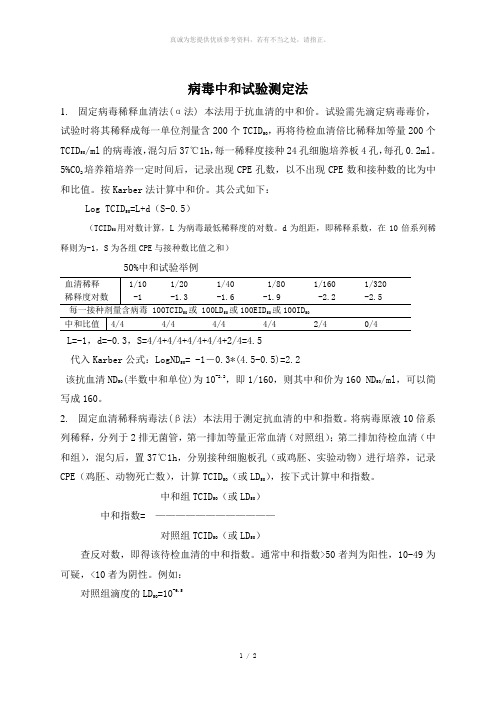
1 / 2病毒中和试验测定法1. 固定病毒稀释血清法(α法) 本法用于抗血清的中和价。
试验需先滴定病毒毒价,试验时将其稀释成每一单位剂量含200个TCID 50,再将待检血清倍比稀释加等量200个TCID 50/ml 的病毒液,混匀后37℃1h ,每一稀释度接种24孔细胞培养板4孔,每孔0.2ml 。
5%C02培养箱培养一定时间后,记录出现CPE 孔数,以不出现CPE 数和接种数的比为中和比值。
按Karber 法计算中和价。
其公式如下:Log TCID 50=L+d (S-0.5)(TCID 50用对数计算,L 为病毒最低稀释度的对数。
d 为组距,即稀释系数,在10倍系列稀释则为-1,S 为各组CPE 与接种数比值之和)50%中和试验举例50505050L=-1,d=-0.3,S=4/4+4/4+4/4+4/4+2/4=4.5代入Karber 公式:LogND 50= -1-0.3*(4.5-0.5)=2.2该抗血清ND 50(半数中和单位)为10-2.2,即1/160,则其中和价为160 ND 50/ml ,可以简写成160。
2. 固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。
将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h ,分别接种细胞板孔(或鸡胚、实验动物)进行培养,记录CPE (鸡胚、动物死亡数),计算TCID 50(或LD 50),按下式计算中和指数。
中和组TCID 50(或LD 50) 中和指数= ———————————— 对照组TCID 50(或LD 50)查反对数,即得该待检血清的中和指数。
通常中和指数>50者判为阳性,10-49为可疑,<10者为阴性。
例如:对照组滴度的LD 50=10-6.5中和组滴度的LD=10-4.550中和指数=10(6.5-4.5)=102.0=100中和指数的对数Log=Log100=2.0一般来说,以10倍稀释进行滴度测定,Log10=1。
交叉保护中和实验

交叉保护中和实验试验目的血清分型标本出血热恢复期病人血清材料1、毒株汉滩病毒标准株76-118,汉城病毒标准株Seoul;2、标准血清兔抗汉滩病毒、汉城病毒血清;3、空斑减少中和试验常用试剂。
步骤1、将待检血清用牛血清Hanks氏液稀释成1:10,56℃灭活30分钟;2、进一步2倍稀释血清成1:20、1:40、1:80……,对照血清1:10稀释;3、稀释两种病毒(在冰浴中进行)至含200pfu/ml;4、各连续稀释度血清分别与200pfu/ml的两种病毒液等量混合(各0.3ml),置37℃中作用1小时(每15分钟振荡一次);5、吸出各细胞培养孔中维持液;6、接种长满单层的Vero-E6细胞(24孔板),每孔接种血清病毒混合液、标准血清对照及两种病毒对照,每稀释度两孔,100ul/孔。
37℃吸附1小时,每隔15分钟摇动一次;7、加第一层琼脂糖覆盖液(需冷置42℃左右),每孔1ml,室温下待凝固,细胞面朝上,置37℃5%CO2孵箱培养7-9天;8、加第二层含中性红琼脂糖覆盖液,1ml/孔,室温下待凝固,细胞面朝上,置37℃5%CO2孵箱培养2-5天,从第二天开始观察空斑数;9、抗体滴度的判定,以比病毒对照的空斑数中和或减少50%的血清最高稀释度倒数判为待检血清中和抗体滴度;10、型别判定:根据同一份血清与两种病毒的反应滴度不同来区分,如果一份血清与汉滩病毒(或汉城病毒)反应的抗体滴度高于与汉城病毒(汉滩病毒)的抗体滴度4倍或以上,即判为汉滩病毒型,反之则为汉城病毒型。
两者滴度相差无几时,则不好分型。
不足4倍时亦不能定型。
配方1、第一层琼脂糖覆盖液2、第二层琼脂糖覆盖液基本上同第一层琼脂糖覆盖液,仅将灭活胎牛血清改为5ml,另加中性红溶液1ml(333.0ug/L中性红钠盐Gibco)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
血清-病毒中和试验的标准操作规程(编号:034)
1、目的及使用范围
该SOP以PRRSV为例,测定血清中的病毒中和抗体滴度。
2、主要仪器及试剂
CO2细胞培养箱、普通光学显微镜、超净工作台(生物安全级别)、电动吸引器、移液器、水浴锅、DMEM培养基、胎牛血清、96孔细胞培养板
3、相关器皿的预处理
玻璃制品要高压灭菌
4、操作步骤
4.1按常规细胞培养方法培养Marc-145细胞
4.2胰酶消化Marc-145细胞,均分与96孔板中,100μL/孔,并保证细胞数为(2~8)×105/孔;CO2细胞培养箱培养16~24h;
4.3抗血清56℃水浴锅灭活30min,与含100 TCID50 PRRSV的DMEM(2%FBS)2倍倍比稀释,混匀后,37℃孵育1h;
4.4弃除96孔板中细胞培养基,加入血清-病毒混合物100μL/孔,置于CO2细胞培养箱中,吸附1h;
4.5弃除上清,用无菌PBS洗2次,吸干各孔中的残留液后,加入含2%FBS的DMEM,置于CO2细胞培养箱培养3~5d;
4.6第4天,于光学显微镜下观察细胞病变CPE,记录病变孔数目;
4.7计算中和抗体滴度,按照运用Reed-Muench法计算。
5、问题向导
5.1细胞病变不明显
根据细胞状态或病毒种类的不同,细胞病变时间会相应发生改变,一般而言,第3天就会出现CPE,第4天就可以计算其中和抗体滴度。
5.2 Reed-Muench法计算中和抗体滴度范例,见表1。
68。
