总甲状腺素(TT4)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
总甲状腺素测定试剂盒(磁微粒化学发光法)产品技术要求总甲状腺素测定试剂盒(磁微粒化学发光法)
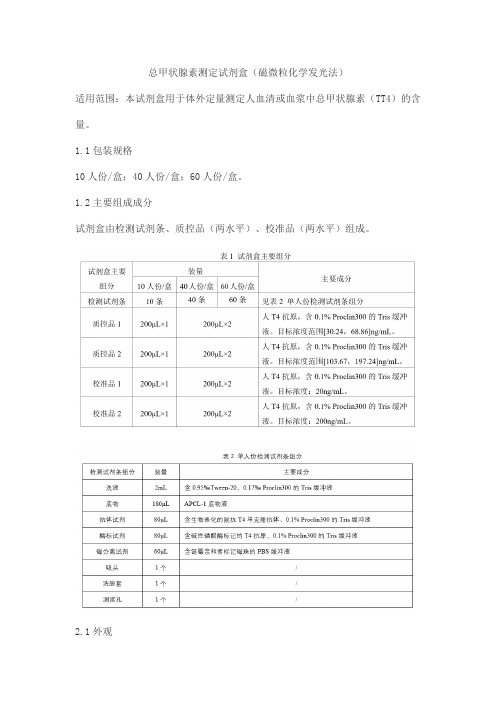
总甲状腺素测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆中总甲状腺素(TT4)的含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至国家标准品150551。
2.3准确性在试剂盒规定的测量范围内检测国家标准品150551,其实测值与理论值之比,应该0.850~1.150之间。
2.4空白限应不高于5ng/mL。
2.5线性在[8, 300] ng/mL的线性范围内,相关系数r的绝对值(|r|)应不低于0.9900。
2.6精密度2.6.1分析内精密度CV≤8%。
2.6.2批间精密度CV≤20%。
2.7质控品测定值测定结果应在本试剂盒规定的范围内。
2.8 特异性浓度不低于500ng/mL的TT,在本试剂盒上的测定结果应不高于315.0ng/mL。
浓度不低于50ng/mL的rT3,在本试剂盒上的测定结果应不高于15.0ng/mL。
2.9校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.10稳定性2.10.1效期末稳定性试剂盒2℃~8℃条件下保存至效期末,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
2.10.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品分析内精密度和质控品测定值,应符合2.6.1和2.7的要求。
2.10.3 校准品开瓶稳定性校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确性、线性,应符合2.3、2.5的要求。
T4 甲状腺素化学发光试剂盒使用说明书

T4甲状腺素化学发光试剂盒使 用 说 明 书济南杏恩生物科技有限公司T4甲状腺素化学发光试剂盒说明书【临床意义】通过化学发光酶免疫法定量分析人血清或血浆中的总T4甲状腺素(Total Thyroxine,tT4)的浓度。
T4增高见于甲抗、T4型甲抗、亚急性甲状腺炎、高TBG血症、甲状腺激素不敏感综合症;减低见于甲减、地方性甲状腺肿、慢性淋巴性甲状腺肿、甲亢治疗期、严重肝病、TBG降低。
【原理】 酶免疫分析测试【试剂存放方式】(所有试剂保存在2-8℃)【试剂盒组成】1. T4 包被板:1板,可拆板,8×12孔。
2. T4 标准品: 6小管,0.3ml/管3. 各个标准品浓度分别为0, 2,5,10,15,25 ug/dl。
4. 浓缩的 T4 标记偶合液(11×):1小管,0.5ml/管。
5. T4 偶合稀释液:1瓶,5ml/瓶。
6. T4低质控对照品:0.3ml/管7. T4高质控对照品:0.3ml/管8. 发光底物 1:5ml/瓶,含有H2O2的缓冲液。
9. 发光底物 2:5ml/瓶,含有发光触酶的缓冲液。
10. 产品说明书一份。
适用机器: 国内外所有板式化学发光仪 .【样本采集】本测试的样品为血清或血浆。
样品可保存在2-8℃下48小时,如需长期保存需冷冻在-20℃。
样品在解冻后需混合均匀后再进行测试简易操作步骤样品化学发光标记偶合液反应时间 15分钟 (室温25+/-2度)洗板Mediators PHL TM 选定程序 机器自动加底液发光底物1反应时间5分钟(室温25+/-2度发光底物2立即测读(1秒钟之内)计算样品浓度。
总甲状腺素(TT4)测定试剂盒(化学发光免疫分析法)产品技术要求kr

总甲状腺素(TT4)测定试剂盒(化学发光免疫分析
法)
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;R1 组分应为棕色含固体微粒的液体,无板结、无絮状物。
R2 和R3 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
其中R1≥5.6mL,R2≥6.0mL,R3≥6.0mL。
2.3准确性
用T4 国家标准品配制成与试剂盒对应校准品定标曲线中相应的5 个浓度点进行分析测定,用双对数或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t 检验);以T4 国家标准曲线为对照,试剂盒定标曲线校准品的实测值与标示值的效价比在0.900~1.100 之间。
2.4最低检出限
最低检出限应不大于0.5 μg/dL。
2.5线性
试剂盒在0.5-24 μg/dL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 15%。
2.8特异性
浓度不低于500ng/mL 的TT3,检测结果应不高于15.0ng/mL。
浓度不低于50ng/mL 的rT3,检测结果应不高于最低检出限。
促甲状腺激素测定试剂盒产品技术要求国赛

促甲状腺激素测定试剂盒产品技术要求国赛摘要:促甲状腺激素(TSH)测定试剂盒是一种通过化学发光免疫分析法来测定人体内促甲状腺激素水平的产品。
本文将从试剂盒的基本原理、技术指标、操作方法、结果判断等方面进行详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
1.试剂盒的基本原理2.技术指标(1)测定范围:0.1-100mIU/L(2)灵敏度:0.1mIU/L(3)精密度:CV≤10%(4)准确度:与国家标准方法比较,差异不超过±10%3.操作方法(1)样品准备:采集血清样本,离心去除红细胞沉淀。
(2)试剂盒开封:将试剂盒从冰箱取出,放置室温下30分钟使其恢复平衡。
(3)标准曲线制备:用不同浓度的标准品配制标准曲线,按照试剂盒使用说明进行操作。
(4)样品测试:取适量血清样本,按照试剂盒使用说明进行操作,加入发光试剂后进行混匀,开始计时。
(5)数据处理:根据标准曲线上的吸光度值,计算出样品中促甲状腺激素的浓度。
4.结果判断(1)阳性结果:样品中促甲状腺激素浓度超过设定的参考范围上限。
(2)阴性结果:样品中促甲状腺激素浓度在参考范围内。
(3)结果异常:样品中促甲状腺激素浓度超过参考范围上下限,需要进一步检测。
5.改进方案(1)优化抗体:选择更具特异性的抗体,提高试剂盒的选择性。
(2)增加质控品:引入质控品,增加结果的稳定性和可靠性。
(3)提高灵敏度:通过改进试剂盒中的光学材料和化学试剂,提高试剂盒的灵敏度。
(4)缩短操作时间:优化操作流程,减少操作时间,提高实验效率。
(5)降低价格:通过技术改进和成本优化,降低试剂盒的价格,提高产品的竞争力。
总结:促甲状腺激素(TSH)测定试剂盒是一种重要的医学检验试剂,可以用于评估甲状腺功能的正常与否。
本文对其技术要求进行了详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
希望上述内容能够为促甲状腺激素(TSH)测定试剂盒的开发和优化提供参考。
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)产品技术要求mairui
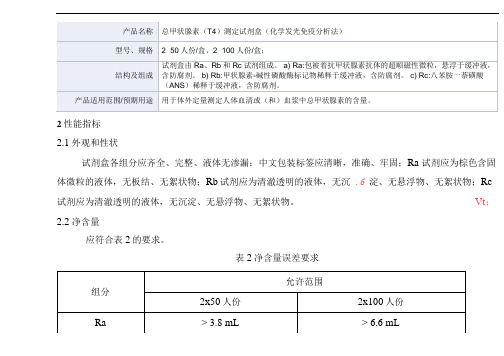
2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;Ra 试剂应为棕色含固体微粒的液体,无板结、无絮状物;Rb试剂应为清澈透明的液体,无沉.6 淀、无悬浮物、无絮状物;Rc 试剂应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
Vt;
2.2净含量
应符合表2的要求。
表2净含量误差要求
2.3准确度
对由国家标准品制备的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
2.4最低检测限
应不大于0.5卩g/dL。
2.5线性
试剂盒在1卩g/dL〜30卩g/dL范围内,其相关系数(r)应不低于0.9900□
2.6重复性
变异系数CV应<10%0
2.7批间差
变异系数CV应<10%o
2.8分析特异性
当样品中甘油三酯浓度与1800 mg/dL,胆红素浓度匕10 mg/dL,血红蛋白浓度%500 mg/dL时,测试结果的干扰偏差在±10%范围内。
样品中反T3浓度为100卩g/dL时,交叉反应率应<10%,当样品中L-三碘甲状腺氨酸浓度为500卩g/dL, —碘酪氨酸浓度为5000卩g/dL,二碘酪氨酸浓度为5000 gg/dL时,交叉反应率应<3%o。
促甲状腺激素测定试剂盒产品技术要求深圳华迈兴微医疗

促甲状腺激素测定试剂盒产品技术要求深圳华迈兴微医疗一、产品介绍促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)是一种用于测定人体血清或血浆中促甲状腺激素(TSH)含量的试剂盒。
该产品采用化学发光免疫分析法,具有高灵敏度、高特异性和高准确性等特点,能够快速、准确地检测血液中的TSH水平,帮助医生进行甲状腺相关疾病的诊断和治疗。
二、技术要求1.试剂盒的组成及规格:-试剂一:免疫固相吸附板(96孔板)。
-试剂二:TSH标准品。
-试剂三:酶标抗体。
-试剂四:酶标底物。
-试剂五:洗涤缓冲液。
-试剂六:稀释缓冲液。
-试剂七:停止液。
-试剂八:试剂盒说明书。
2.试剂盒的性能要求:-灵敏度:试剂盒能够检测到血液中TSH浓度为0.1mIU/L的含量。
-特异性:试剂盒与其他甲状腺相关激素无交叉反应。
-线性范围:试剂盒应能够检测到血液中TSH浓度在0.5-100mIU/L的范围内。
-准确性:试剂盒测定结果与国际标准物质的测定结果相符合。
-稳定性:试剂盒的试剂在储存期限内应稳定,且取用后能够保持一定的稳定性。
3.试剂盒的使用方法:-试剂盒应包含详细的试剂使用说明书,以保证临床使用人员可以正确操作。
-试剂盒应包含标注清晰的试剂混合比例和操作流程。
4.试剂盒的保存要求:-试剂盒应在2-8℃的条件下保存,避免阳光直射和高温。
-试剂盒的有效期应标注在产品包装上,并应在有效期内使用。
5.试剂盒的质量控制:-试剂盒应包含质量控制品,以保证试剂盒的准确性和稳定性。
三、检验方法要求1.血样采集和处理方法:-血样采集应遵循规范化的操作流程,确保血样的准确性和可靠性。
-血样处理方法应包含清除杂质、离心等步骤。
2.检测方法:-试剂盒的检测方法应简单、快捷、准确,并能满足临床诊断的需要。
-试剂盒应配套合适的检测仪器,以保证检测结果的可靠性。
四、质量控制要求1.试剂盒应提供质量控制品,并标注质量控制的方法和范围。
2.试剂盒的试剂和质控品应具有稳定性,以保证在有效期内使用。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求国赛

2.性能指标2.1试剂条性能指标2.1.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
试剂条中第7孔内组分为棕色含固体微粒的液体;其余皆为透明液体。
无悬浮物、无沉淀、无絮状物。
2.1.2装量溶液装量应不少于标示值。
其中试剂条第2孔为酶工作液孔,装量不少于80μL;第3、4、5孔为清洗液孔,装量均不少于380μL;第7孔为磁珠工作液孔,装量不少于45μL;第10孔为样本稀释液孔,装量不少于85μL;第12孔为底物孔,装量不少于130μL。
2.1.3空白限应不大于0.05mIU/L。
2.1.4准确性在试剂盒规定的测量范围内检测国家校准品,其实测值与理论值之比应在0.900-1.100之间。
2.1.5剂量-反应曲线的线性在0.1-100mIU/L区间内,其剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.1.6精密度2.1.6.1分析内精密度变异系数(CV)应不大于8.0%。
2.1.6.2批间精密度变异系数(CV)应不大于15.0%。
2.1.7特异性浓度不低于200IU/L的FSH,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
浓度不低于200IU/L的LH,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
浓度不低于1000IU/L的hCG,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
2.2校准品性能指标2.2.1外观校准品CAL1、CAL2为冻干块。
加入纯水后在10min内溶解,无沉淀或絮状物。
2.2.2校准品准确性校准品CAL2,相对偏差应在±10%以内。
校准品CAL1为零浓度校准品除外。
2.2.3校准品均匀性校准品CAL2均匀性CV应≤10%。
校准品CAL1为零浓度校准品除外。
2.3质控品性能指标2.3.1外观质控品为冻干块。
加入纯水后在10min内溶解,无沉淀或絮状物。
2.3.2质控品准确性质控品测试结果应在靶值范围内。
甲状腺素(T4)测定试剂盒(时间分辨荧光免疫分析法)产品技术要求beifang
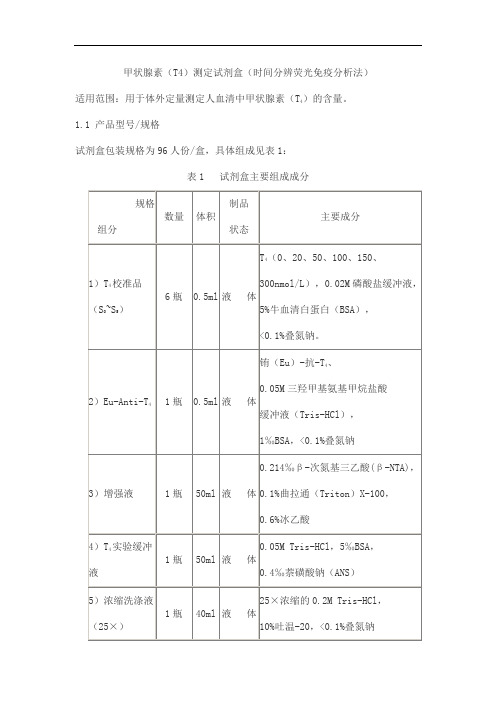
甲状腺素(T4)测定试剂盒(时间分辨荧光免疫分析法))的含量。
适用范围:用于体外定量测定人血清中甲状腺素(T41.1 产品型号/规格试剂盒包装规格为96人份/盒,具体组成见表1:表1 试剂盒主要组成成分2.1外观和物理检查试剂盒组分齐全,内外包装完整,标签清晰,液体组分无渗漏。
各组分装量不少于表1中要求。
2.2准确性试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用百分结合率对数(Log-Logit)数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);国家标准品为对照品,试剂盒内校准品的实测效价与标示值效价的比应在以T40.900~1.100之间。
2.3线性用Log-Logit数学模型拟合,在20~308.9nmol/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4精密度2.4.1分析内精密度(CV%)应不大于15%。
2.4.2批间精密度(CV%)应不大于15%。
2.5最低检出限应不高于10nmol/L。
2.6质控品测定值每次检测结果均应在允许范围之内。
2.7特异性结果不高于15nmol/L;检测浓度为5000ng/ml的T3结果不高于19.31nmol/L。
检测浓度为50ng/ml的rT32.8稳定性2.8.1 效期末稳定性试剂盒在2~8℃储存12个月,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6要求。
2.8.2 热稳定性将试剂盒在37℃条件下放置7天,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6要求。
促甲状腺激素测定试剂盒产品技术要求北京美联泰科

促甲状腺激素测定试剂盒产品技术要求北京美联泰科促甲状腺激素测定试剂盒(磁微粒化学发光法)是一种用来检测人体内促甲状腺激素水平的试剂盒。
在促甲状腺激素测定的过程中,该试剂盒采用磁微粒化学发光法,通过特定的试剂盒,可以快速、准确地检测出人体内促甲状腺激素的浓度。
根据国家相关标准和技术要求,促甲状腺激素测定试剂盒(磁微粒化学发光法)的产品技术要求包括以下几个方面:
1.试剂盒的稳定性要求:试剂盒必须具有较长的保存期限,并且在保存期间,其性能稳定性应能满足测量的需要。
2.试剂盒的灵敏度和特异性要求:试剂盒使用的抗体必须具有较高的灵敏性,能够检测出较低浓度的促甲状腺激素。
此外,试剂盒还应具有较高的特异性,确保只能检测出促甲状腺激素,而不受其他物质的干扰。
3.试剂盒的精确度和准确性要求:试剂盒的使用应具有较高的精确度和准确性,确保能够得到可靠的测量结果。
同时,试剂盒的成本控制也是一个考虑因素。
4.试剂盒的操作简便性要求:试剂盒的操作应简便易行,不需要复杂的专业技能,便于广泛应用于临床实验室。
5.试剂盒的安全性要求:试剂盒必须符合相关的安全标准和规定,确保操作人员的安全。
6.试剂盒的报告范围和结果解释要求:试剂盒显示的测量结果应具有合理的报告范围,且结果能够清楚地解释,并与实际情况相符。
除了上述技术要求外,促甲状腺激素测定试剂盒(磁微粒化学发光法)还需要符合国家食品药品监督管理部门的相关注册要求,包括质量控制要
求和生产工艺要求等。
同时,还需要进行相关的临床验证和评估,以确保
其在实际应用中的可靠性和准确性。
总甲状腺素TT4测定SOP

2.测定方法两步法竞争性结合免疫酶分析法。
3.测定原理两步法竞争性结合免疫酶分析法。
血清中总甲状腺素与试剂中的ALP连结的甲状腺素竞争结合特异的抗甲状腺素抗体的结合位点,形成的抗原-抗体复合物与微粒子上的固相化捕获抗体结合,形成微粒子-鼠抗T4 McAb-(T4或T4-ALP)免疫复合物。
经磁性分离,洗涤除去未结合的物质,加入化学发光底物Lumi-Phos 530发光剂,经碱性磷酸酶的作用产生光子,测量反应产生的光,光子的量与标本中总甲状腺素的浓度成反比,由多点校准曲线求得标本中甲状腺素的浓度。
4.性能参数无须输入操作参数,仪器根据预设的分析项目参数和试剂条码的信息自动进行分析。
标本量30 µL。
4.1 精密度:批内CV<4.5%;总CV<5 %。
4.2 分析范围:5~300μg/dl 。
4.3 灵敏度:5 μg/dl。
4.4 方法的有限性及干扰因素:胆红素10mg/L、TG 18 g/L、肝素、Hb 5 g/L 在检测允许的精密度范围内对结果没有影响。
5.原始样本系统5.1 总则:符合本室《检验标本采集手册》5.2 常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
5.3 检验申请单和血标本试管标上统一且唯一的标识符。
5.4 急诊标本采集后,在检验申请单上填写标本采集时间。
5.5 标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
5.6 标本拒收标准5.6.1 标本量过少。
5.6.2 检验申请单上姓名或条码与标本上姓名或条码不一致。
5.6.3 检验项目与标本类型不符,或抗凝剂不符。
5.6.4 标本送检时已放置时间过久。
5.6.5 输液时在同侧血管抽血。
5.6.6 标本严重容血或脂血。
5.6.7 无标本(空管)5.6.8 条码包含信息不全(如无采样时间等)。
6.标本保存6.1 接收标本后在30min内将标本离心分离出血清, 避免溶血。
tsh试剂盒产品技术要求

tsh试剂盒产品技术要求【原创实用版】目录1.产品概述2.技术要求3.性能指标4.储存与运输要求5.检验方法正文【产品概述】tsh 试剂盒是一种用于检测甲状腺功能的医疗设备,主要用于测量人体中的促甲状腺激素(TSH)水平。
TSH 是由垂体腺分泌的,对甲状腺的功能具有调节作用。
因此,tsh 试剂盒的检测结果对于诊断甲状腺疾病具有重要的临床意义。
【技术要求】tsh 试剂盒的设计和制造需要满足一系列的技术要求,包括但不限于:1.试剂盒的稳定性:在规定的储存条件下,试剂盒中的各种成分不应发生明显的化学反应或物理变化。
2.试剂盒的灵敏度:试剂盒应能够准确地检测到 TSH 水平的微小变化。
3.试剂盒的特异性:试剂盒应只与 TSH 发生反应,不应与其他物质发生交叉反应。
【性能指标】tsh 试剂盒的性能指标主要包括:1.检测范围:试剂盒应能够准确地检测到 TSH 水平的正常范围和异常范围。
2.检测限:试剂盒应能够检测到 TSH 水平的最低限度。
3.精密度:在重复性条件下,试剂盒的检测结果应具有高度的一致性。
4.灵敏度:试剂盒应能够检测到 TSH 水平的微小变化。
【储存与运输要求】tsh 试剂盒应在 2-8°C 的环境中储存,运输过程中也应保持稳定的温度。
在储存和运输过程中,应避免试剂盒受到剧烈的震动或摔落。
【检验方法】tsh 试剂盒的检验方法主要包括:1.试剂盒的稳定性检验:在规定的储存条件下,检查试剂盒中各种成分的变化情况。
2.试剂盒的灵敏度检验:使用已知的 TSH 标准品,检查试剂盒的检测结果是否准确。
总甲状腺素(TT4)测定试剂盒(磁微粒化学发光法)产品技术要求hkt

总甲状腺素(TT4)测定试剂盒(磁微粒化学发光法)组成:适用范围:本试剂盒用于体外定量测定人血清中总甲状腺素(TT4)的含量。
1.1规格100人份/盒、500人份/盒。
1.2主要组成成分注:校准品靶值、质控品质控范围批特异,具体浓度详见标签。
2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的国家标准品(编号:150551)。
2.3 准确度试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用Log-Logit模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.4 线性在线性范围 [20,320]ng/mL内,用Log(x)-Logit (y)模型拟合,线性相关系数的绝对值(|r|)应不低于0.9900。
2.5 重复性分别检测高值和低值两个样本,重复性(CV)应不高于8.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV)应不高于15.0%。
2.7 空白限空白限应不高于10.0ng/mL。
2.8 特异性2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性稳定性可选用以下其中一种方法进行验证:2.10.1 2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 取有效期内的试剂盒在37℃放置7天,分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
总甲状腺素测定试剂盒(化学发光免疫分析法)产品技术要求huadajibiai

总甲状腺素测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人血清中总甲状腺素(T4)的含量。
.1包装规格:96人份/盒
.2主要组成成分
表1 主要组成成分
注:校准品具有批特异性,具体浓度见瓶签。
2.1外观
2.1.1试剂(盒)各组份应齐全、包装完好,液体应为透明溶液,无渗漏,无混
浊,无未溶解物;
2.1.2包装标签应清晰,无磨损。
2.2准确度
试剂盒校准品与相应浓度的国家标准品(标准物质编号:150551)同时进行分析测定,用ln(X)-logit(Y)或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以T4国家标准品为对照品,试剂盒校准品的实测效价与标示效价比的平均值应在0.900~1.100范围内。
2.3空白限
试剂盒的空白限不大于8 ng/mL。
2.4线性
在[20,320]ng/mL线性范围内,试剂盒的相关系数r应不小于0.990。
2.5重复性
批内变异系数(CV)应不大于15.0%。
2.6批间差
批间变异系数(CV)应不大于20.0%。
2.7稳定性
2℃~8℃保存,有效期12个月。
取失效期的试剂盒检测其准确度、空白限、线性和重复性,应符合2.2-2.5的要求。
2.8 校准品溯源性
应根据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定,提供所用企业产品校准品来源、赋值过程以及测量不确定度等内容,企业产品校准品溯源至国家标准品(标准物质编号:150551)。
总甲状腺素(TT4)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂

总甲状腺素(TT4)测定试剂盒(化学发光免疫分析法)性能指标1试剂盒性能指标1.1外观试剂盒各组分应齐全、完整,液体无渗漏,标签应清晰、易识别;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第10孔内组分应为淡绿色液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.2最低检出限应不大于4.0ng/mL。
1.3准确度实测值与理论值之比应在0.850-1.150之间。
1.4线性试剂盒在5.00ng/mL~300.0ng/mL区间内,其线性相关系数(|r|)应不小于0.9900。
1.5精密度1.5.1分析内精密度变异系数(CV)应不大于8.0%。
1.5.2批间精密度变异系数(CV)应不大于15.0%。
1.6特异性1.6.1与三碘甲状腺原氨酸(TT3)浓度不低于500ng/mL的TT3,在本试剂盒上的测定结果应不高于15.0ng/mL。
1.6.2与反三碘甲状腺原氨酸(rT3)浓度不低于50ng/mL的rT3,在本试剂盒上的测定结果应不高于15.0ng/mL。
2校准品性能指标2.1外观校准品CAL1、CAL2应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
2.2装量校准品CAL1、CAL2装量偏差应在±10.0%之内。
2.3准确度总甲状腺素(TT4)校准品,测试结果偏差应在±10.0%之内。
2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10.0%,批内瓶间差CV 应≤10.0%。
3质控品性能指标3.1外观质控品应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
3.2装量质控品装量偏差应在±10.0%之内。
3.3准确度总甲状腺素(TT4)质控品,测试结果应在靶值范围内。
3.4均一性对同一瓶质控品重复10次检测,对同一批次10瓶质控品进行检测,检测瓶内差CV应≤10.0%,批内瓶间差CV应≤10.0%。
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)产品技术要求lianzhongtaike
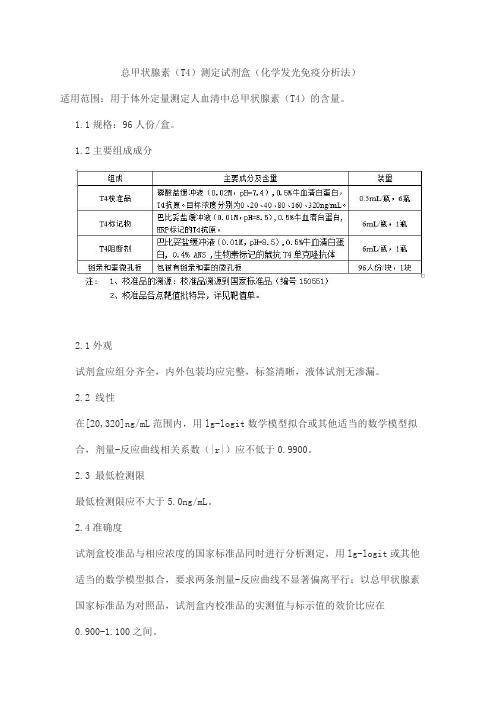
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中总甲状腺素(T4)的含量。
1.1规格:96人份/盒。
1.2主要组成成分2.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
2.2 线性在[20,320]ng/mL范围内,用lg-logit数学模型拟合或其他适当的数学模型拟合,剂量-反应曲线相关系数(|r|)应不低于0.9900。
2.3 最低检测限最低检测限应不大于5.0ng/mL。
2.4准确度试剂盒校准品与相应浓度的国家标准品同时进行分析测定,用lg-logit或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以总甲状腺素国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900-1.100之间。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,检测高、低值样品,各重复检测10次,其变异系数(CV)应不大于8%。
2.5.2 批间精密度用3个批号试剂盒检测高、低值样品,则3个批号试剂盒之间的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与总三碘甲状腺原氨酸(T3)浓度不低于500ng/mL的T3在本试剂盒上的测定结果应不高于15ng/mL。
2.6.2 与反三碘甲状腺原氨酸(rT3)浓度不低于50ng/mL的rT3在本试剂盒上的测定结果应不高于15ng/mL。
2.7溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源到国家标准品(编号150551)。
2.8稳定性效期末稳定性:本产品效期为12个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求;。
总甲状腺素测定试剂盒(化学发光免疫分析法)产品技术要求新产业生物

2.性能指标2.1外观试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰、准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物;磁性微球悬浮液应可均匀分布,无肉眼可观察到的团聚颗粒,无异物,无块状沉淀。
2.2装量100测试/盒和50测试/盒规格各组分应不少于声称的额定装量(见表1)。
表1100测试/盒和50测试/盒两种规格各组分额定装量组分装量×1瓶100测试/盒50测试/盒磁性微球 2.5mL 1.5mL低点校准品 1.0mL 1.0mL高点校准品 1.0mL 1.0mL 置换剂 5.5mL 3.0mL缓冲液9.5mL 5.5mL 发光标记物 6.5mL 4.0mL质控品1 1.0mL 1.0mL质控品2 1.0mL 1.0mL 2.3批内精密度批内变异系数(CV)应≤5%。
2.4批间精密度批间变异系数(CV)应≤10%。
2.5准确性在试剂盒规定的线性范围内,检测甲状腺素免疫测定用国家标准品,每次实测值与理论值之比应在[0.850,1.150]范围内。
2.6线性区间在[0.200,30.000]μg/dL浓度范围内,用lg-logit数学模型拟合,剂量-反应曲线线性相关系数(r)的绝对值应≥0.9900。
2.7空白限空白限应≤0.100μg/dL。
2.8检出限检出限应≤0.150μg/dL。
2.9特异性1)测定浓度为500.000ng/mL的总三碘甲状腺原氨酸(TT3),在本试剂盒上的测定结果应不高于1.500μg/dL。
2)测定浓度为50.000ng/mL的反三碘甲状腺原氨酸(rT3),在本试剂盒上的测定结果应不高于1.500μg/dL。
2.10产品校准品准确度相对偏差应在±10%范围内。
2.11产品校准品均匀性)应≤5%。
产品校准品均匀性(CV瓶间2.12质控品预期结果质控品1每次测定结果应在[4.900,9.100]μg/dL范围内,质控品2每次测定结果应在[9.800,18.200]μg/dL范围内。
总甲状腺素测定试剂盒(化学发光法)产品技术要求深圳市卓润生物科技

总甲状腺素测定试剂盒(化学发光法)
性能指标
1外观
试剂盒各组分应齐全、完整,液体无渗漏;
中文包装标签应清晰,无磨损;
磁珠试剂组分应为含棕色固体微粒的液体,磁珠无板结,液体无絮状物,无异物;
其他液体组分应为清澈均匀的液体,无沉淀,无絮状物。
2最低检出限
不大于6.2ng/mL。
3准确度
准确度应满足下列要求之一:
2.3.1试剂盒工作校准品与相应浓度的国家标准品同时进行分析测定,用lg-logit拟合,要求两条剂量效应-反应曲线不显著偏离平行;以国家标准品为对照品,试剂盒校准品的实测值与理论值的效价比应在0.900~1.100之间。
2.3.2用国家标准品或国家标准品标化的企业准确度参考品进行检测,其实测值与理论值之比应在0.900~1.100之间。
4重复性
用浓度分别为40ng/ml(±20%)和100ng/ml(±20%)的重复性参考品进行检测,各检测10次,其变异系数(CV)应不大于8.0%。
5批间差
使用3个批号试剂分别检测浓度为40ng/ml(±20%)和100ng/ml(±20%)的重复性参考品,3个批号试剂之间的批间变异系数(CV)应不大于15.0%。
6线性
在(6.2~300)ng/ml浓度范围内,试剂盒剂量-反应曲线线性相关系数的绝对值(∣r∣)应不低于0.9900。
7特异性
对总三碘甲状腺原氨酸(TT3)浓度不低于500ng/ml的样本进行检测,检测结果应不高于15.00ng/ml;
对反三碘甲状腺原氨酸(rT3)浓度不低于50ng/ml的样本进行检测,检测结果应不高于15.00ng/ml。
猪总甲状腺素(TT4)酶联免疫分析
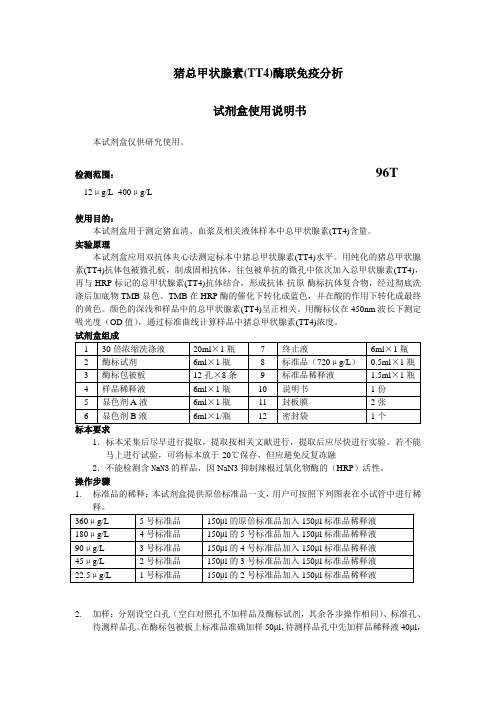
猪总甲状腺素(TT4)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T12μg/L -400μg/L使用目的:本试剂盒用于测定猪血清、血浆及相关液体样本中总甲状腺素(TT4)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中猪总甲状腺素(TT4)水平。
用纯化的猪总甲状腺素(TT4)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入总甲状腺素(TT4),再与HRP标记的总甲状腺素(TT4)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的总甲状腺素(TT4)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中猪总甲状腺素(TT4)浓度。
试剂盒组成标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总甲状腺素(TT4)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中总甲状腺素(TT4)的含量。
1.1产品型号/规格:100人份/盒、200人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(TT4-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.420μg/dL 。
2.3 准确度
用T4国家标准品(150551)进行检测,实测值与理论值之比应在0.850-1.150之间。
2.4 线性
在[1.0,24.86]μg/dL范围内,线性相关系数的绝对值(|r|)应不小于0.9900。
2.5 精密度
2.5.1 分析内精密度
在试剂盒的线性范围内,浓度为(5.0±1.0μg/dL)和(20.0±4.0μg/dL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度
在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0μg/dL)和(20.0±4.0μg/dL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性
2.6.1与三碘甲状腺原氨酸(T3)
测定浓度不低于500ng/mL的T3样品,其测定结果应不高于1.5μg/dL;
2.6.2 与反三碘甲状腺原氨酸(rT3)
测定浓度不低于50ng/mL的rT3样品,其测定结果应不高于1.5μg/dL。
2.7 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至国家标准品(编号150551)。
