标准溶液配制与标定原始记录(氢氧化钠)
氢氧化钠标准溶液的配制和标定实验报告

滴定到达滴定终点后,若仰视滴定管读数,会对计算结果造成什么影响()√
取用()氢氧化钠溶液√
第一次称取邻苯二甲酸氢钾√
第一次实验√
空白实验所用的氢氧化钠√
第一次实验计算的浓度√
第二次实验计算的浓度√
第三次实验计算的浓度√
平均浓度√
数据
详细
操作
内容
左键点击电子天平开关键√
右键聚乙烯烧杯,选择取用√
左键电子天平刷新键√
右键氢氧化钠,选择取用√
右键药匙,选择取氢氧化钠√
右键氢氧化钠,选择放回√
右键聚乙烯烧杯,选择转移到对面实验台√
右键100mL量筒,选择取蒸馏水√
右键100mL量筒,选择倒入聚乙烯烧杯中√
右键玻璃棒,选择搅拌溶解√
右键氢氧化钠溶液试剂瓶,选择取用√
右键聚乙烯烧杯,选择倒入试剂瓶√
右键移液管,选择取液√
右键吸耳球,选择取用√
右键移液管,选择放液至容量瓶√
右键氢氧化钠溶液试剂瓶,选择放回√
右键容量瓶,选择摇匀√
右键容量瓶,选择倒入待标定试剂瓶中√
右键待标定氢氧化钠试剂瓶,选择放回√
右键称量瓶,选择烘干√
右键称量瓶,选择取出放回干燥器√
左键分析天平开关键√
右键称量瓶,选择称量√
左键分析天平Tare键√
右键1号锥形瓶,选择取用√
右键分析天平,选择取出称量瓶倒药√
右键称量瓶,选择称量√
右键分析天平,选择将称量瓶放回干燥器√
右键1号锥形瓶,选择转移到对面实验台√
右键50mL量筒,选择取蒸馏水√
右键50mL量筒,选择倒入1号锥形瓶中√
标准溶液的配制和标定方法

标准溶液的配制和标定方法Prepared on 24 November 2020标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/)C(NaOH)= 1mol/LC(NaOH)= LC(NaOH)= LC(NaOH)= L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 5628(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 808080802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/)C(HCl)= 1mol/LC(HCl)= LC(HCl)= L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL190450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
C灼烧至质量恒定的基准无水碳酸钠,称准至0.0001 g。
溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的盐酸溶液滴定至溶液由绿色变为紫红色,再煮沸2min,冷却后,继续滴定至溶液再呈暗紫色。
实验--氢氧化钠标准溶液的配制与标定

实验 氢氧化钠标准溶液的配制与标定一、实验目的1、掌握氢氧化钠滴定液的配制和标定方法.2、巩固用递减法称量固体物质。
3、熟悉滴定操作并掌握滴定终点的判断。
4、本实验需4学时。
二、仪器与试剂仪器:分析天平、台秤、滴定管(50mL )、玻棒、量筒、试剂瓶(1000mL)、电炉、表面皿、称量瓶、锥形瓶试剂:固体NaOH 、基准邻苯二甲酸氢钾、纯化水、酚酞指示剂三、原理与方法NaOH 易吸收空气中CO 2而生成Na 2CO 3,反应式为:2NaOH + CO 2 = Na 2CO 3 + H 2O由于Na 2CO 3在饱和NaOH 溶液中不溶解,因此将NaOH 制成饱和溶液,其含量约52%(w/w ),相对密度为1.56。
待Na 2CO 3沉待淀后,量取一定量的上清液,稀释至一定体积,即可。
用来配制NaOH 的纯化水,应加热煮沸放冷,除去水中CO 2。
标定NaOH 的基准物质有草酸(H 2C 2O 4·2H 2O )、苯甲酸(C 7H 6O 2)、邻苯二甲酸氢钾(KH C 8H 4O 4)等。
通常用邻苯二甲酸氢钾标定NaOH 滴定液,标定反应如下:计量点时,生成的弱酸强碱盐水解,溶液为碱性,采用酚酞作指示剂。
按下式计算NaOH 滴定液的浓度:310448448⨯=O H KHC NaOH O H KHC NaOH M V m c四、实验内容1、NaOH 溶液的配制(1)NaOH 饱和溶液的配制:用台称称取120g NaOH 固体,倒入装有100mL 纯水的烧杯中,搅拌使之溶解成饱和溶液。
贮于塑料瓶中,静置数日,澄清后备用.(2)NaOH 滴定溶液的配制(0。
1mol/L ):取澄清的饱和NaOH 溶液2。
8mL,置于1000 mL 试剂瓶中,加新煮沸的冷纯化水500 mL ,摇匀密塞,贴上标签,备用.2、NaOH 溶液的标定用递减法精密称取在105~110℃干燥至恒重的基准物邻苯二甲酸氢钾3份,每份约0.5g ,分别置于250 mL锥形瓶中,各加纯化水50 mL,使之完全溶解。
氢氧化钠标准溶液的配置与标定实验报告

氢氧化钠标准溶液的配置与标定实验报告
本文旨在介绍氢氧化钠( NaOH )标准溶液的配置与标定实验报告.
氢氧化钠标准溶液是由于其稳定性,在工业、实验室方面具有较高的应用价值。
它是在实验室里配制和校准溶液的基本液体,并可用于化学传感器的精密测量。
在配置NaOH标准溶液的实验中,应选用无水的NaOH粉末及重熔点高于307℃
的蒸馏水,先将指定的NaOH粉末放入盛有蒸馏水的容器中,再搅拌均匀。
接下来,根据校验计划的要求,溶液的浓度来测试与检验,并依据实验报告的结果进行调整,使之符合规定。
完成配置NaOH标准溶液实验后,对标准溶液进行校准是必不可少的一步。
采
用pH计检测系统,在适当的冷却条件下,将pH电极放入标准溶液中,消除临时反应,充分混合,体系温度应接近20℃,当接触面温度接近饱和状态时,稳定度更好,则在稳定后读取pH值,并记录其结果以供对比。
经过上述实验,NaOH标准溶液的配置与校准实验报告得出。
根据实验的定量
化结果来看,该溶液能够稳定maintains溶液的组分,同时,也可以反映出溶液的pH值及其它测量数据,进而及时、可靠地响应特定的测量任务。
综上所述,NaOH标准溶液的配置与校准实验报告是一项非常重要的工作,被
广泛应用于化学传感器和其它相关设备的精密测量,可以更加准确、高效地进行工作。
氢氧化钠标准溶液的配制与标定

氢氧化钠标准溶液的配制与标定一、实验目的1、掌握用基准邻苯二甲酸氢钾和比较法标定NaOH溶液浓度的方法。
2、掌握以酚酞为指示剂判断滴定终点。
3、掌握不含碳酸钠的NaOH溶液的配制方法。
二、实验原理标定NaOH标准溶液可用的基准试剂有邻苯二甲酸氢钾、苯甲酸、草酸等,最常用的是邻苯二甲酸氢钾。
KHC8H4O4基准物容易获得纯品,不吸湿,不含结晶水,容易干燥且分子量大。
使用时,一般要在105~110℃下干燥,保存在干燥器中。
KHC8H4O4基准物标定反应为KHC8H4O4+NaOH=KNaC8H4O4+H2O该反应是强碱滴定酸式盐,化学计量点时PH为9.26,可选酚酞为指示剂,用标准NaOH 溶液滴定到溶液呈现粉红色且半分钟不褪色即为终点,变色很敏锐。
根据基准邻苯二甲酸氢钾的质量及所用的NaOH溶液的体积,计算NaOH溶液的准确浓度。
三、仪器与药品仪器:分析天平,烘箱,称量瓶。
1000mL烧杯1个,1000mL试剂瓶1个(配橡皮塞),2500mL塑料桶1个,50ml碱式滴定管1支,25mL移液管1支,250mL 锥形瓶3个,5mL量筒1个。
试剂:邻苯二甲酸氢钾(固、基准物),氢氧化钠(固、分析纯),1%酚酞酒精溶液,0.1 mol/LHCl溶液。
四、实验步骤1、0.1%酚酞酒精溶液用托盘天平上称取0.1g酚酞,溶于60mL乙醇中,用水稀释至100mL,摇匀,转移入试剂瓶中,贴标签备用。
2、0.1mol/LNaOH溶液的配制先将氢氧化钠配成饱和溶液,注入塑料桶中密闭静置,使用前用塑料管虹吸上层澄清溶液。
然后量取5mL氢氧化钠饱和溶液,注入盛不含二氧化碳的蒸馏水的烧杯中,稀释至1000mL搅匀,转入试剂瓶中,盖紧橡皮塞,摇匀。
3、0.1mol/LNaOH溶液的标定(1)用基准物邻苯二甲酸氢钾标定准确称取在110~120烘至恒重的基准邻苯二甲酸氢钾0.5~0.6g,放入250mL 锥形瓶中,以50mL不含CO2的蒸馏水溶解,加酚酞指示剂2滴,用0.1mol/LnaOH 溶液滴定至溶液由无色变为粉红30秒钟不褪色为终点。
氢氧化钠标准滴定溶液原始记录

计算公式
A
B
1
2
3
4
1
2
3
C ( NaOH
)
(V1-V2
)(1
m 1000 + V0 /1000) ×204.22
C(NaOH)——氢氧化钠标准溶液的浓度,mol/L; m——邻苯二甲酸氢钾质量,g; 204.22——邻苯二甲酸氢钾的摩尔质量[M(KHC8H4O4)=204.22],g/mol。
标定 mol/L氢氧化钠(NaOH)标准滴定溶液原始记录
标定日期 方法依据
粗溶液配制
氢氧化钠溶液的配制
氢氧化钠 重量ml
无二氧化碳 的水体积ml
配制日期
环境温度
温度体积补正值V0
氢氧化钠滴定溶液的配制
氢氧化钠 体积ml
无二氧化碳 的水体积ml
配制日期
试验次数 (2人比对 每人4平行)
邻苯二甲酸氢钾质量 m(g)
≤0.18%(CrR95(8)×100/C)
CB=
修约值(mol/L)
实测误差 (每人4平行) (Cmax-Cmin)100/Ci
△CA △CB
实测误差 (两人8平行) (Cmax-Cmin)100/C
标定人(A1—4):
对标人(B1—4):
4
CB4
0.15 0.15 0.18
氢氧化钠标准溶液
CA1
CA2
CA3
CA4ol/L)
平均值(mol/L)
CA=
氢氧化钠标准溶液 的浓度(mol/L) C=(CA+CB)/2
允许误差 (每人4平行) (Cmax-Cmin)100/Ci
氢氧化钠标准溶液配制记录

配制人
欲配标准溶液名称
氢氧化钠标准溶液
欲配标准溶液浓度
0.5mol/L
待标定标准溶液配制过程:称取110g氢氧化钠,溶于100ml无二氧化碳水中,摇匀,注入聚乙烯容器中密闭放置至溶液清亮。用塑料虹吸管吸下27ml的上层清液,用无二氧化碳水稀释至1000ml。摇匀。
标定过程:称取3.6g于105℃~110℃烘干至恒重的基准邻苯二甲酸氢钾,精确至0.0001g,溶于80ml无二氧化碳水中,加2滴酚酞指示剂(10g/l),用配好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30s不褪色,同时做空白试验。
标定记录
量取基准物重量(g)
用待标定溶液量(ml)
空白试验
ml
计算结果
mol/L
平均值:C0=标定人:标定:比较记录量取基准物重量
(g)
用待标定溶液量(ml)
计算结果
mol/L
平均值C1=比较人:
(C1-C0)=
标准溶液浓度C=
备注:标准溶液配制温度为:20℃
标准溶液配制记录
氢氧化钠标准溶液的配制与标定

氢氧化钠标准溶液的配制与标定一、实验目的1、掌握用基准邻苯二甲酸氢钾和比较法标定NaOH溶液浓度的方法。
2、掌握以酚酞为指示剂判断滴定终点。
3、掌握不含碳酸钠的NaOH溶液的配制方法。
二、实验原理标定NaOH标准溶液可用的基准试剂有邻苯二甲酸氢钾、苯甲酸、草酸等,最常用的是邻苯二甲酸氢钾。
KHC8H4O4基准物容易获得纯品,不吸湿,不含结晶水,容易干燥且分子量大。
使用时,一般要在105~110℃下干燥,保存在干燥器中。
KHC8H4O4基准物标定反应为KHC8H4O4+NaOH=KNaC8H4O4+H2O该反应是强碱滴定酸式盐,化学计量点时PH为9.26,可选酚酞为指示剂,用标准NaOH 溶液滴定到溶液呈现粉红色且半分钟不褪色即为终点,变色很敏锐。
根据基准邻苯二甲酸氢钾的质量及所用的NaOH溶液的体积,计算NaOH溶液的准确浓度。
三、仪器与药品仪器:分析天平,烘箱,称量瓶。
1000mL烧杯1个,1000mL试剂瓶1个(配橡皮塞),2500mL塑料桶1个,50ml碱式滴定管1支,25mL移液管1支,250mL 锥形瓶3个,5mL量筒1个。
试剂:邻苯二甲酸氢钾(固、基准物),氢氧化钠(固、分析纯),1%酚酞酒精溶液,0.1 mol/LHCl溶液。
四、实验步骤1、0.1%酚酞酒精溶液用托盘天平上称取0.1g酚酞,溶于60mL乙醇中,用水稀释至100mL,摇匀,转移入试剂瓶中,贴标签备用。
2、0.1mol/LNaOH溶液的配制先将氢氧化钠配成饱和溶液,注入塑料桶中密闭静置,使用前用塑料管虹吸上层澄清溶液。
然后量取5mL氢氧化钠饱和溶液,注入盛不含二氧化碳的蒸馏水的烧杯中,稀释至1000mL搅匀,转入试剂瓶中,盖紧橡皮塞,摇匀。
3、0.1mol/LNaOH溶液的标定(1)用基准物邻苯二甲酸氢钾标定准确称取在110~120烘至恒重的基准邻苯二甲酸氢钾0.5~0.6g,放入250mL 锥形瓶中,以50mL不含CO2的蒸馏水溶解,加酚酞指示剂2滴,用0.1mol/LnaOH 溶液滴定至溶液由无色变为粉红30秒钟不褪色为终点。
氢氧化钠标准溶液配制与标定【范本模板】

氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液.浓度氢氧化钠饱和溶液注入不含CO2的水0。
1mol/L量取5ml1000中摇匀0。
2mol/L量取10ml1000中摇匀0。
5mol/L量取26ml1000中摇匀1。
0mol/L量取52ml1000中摇匀二、标定:1、原理:KHC8H4O4+NOH→KNaC8H4O4+H2O酸式酚酞碱式酚酞HIn→In—+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
3、标定过程0.1mol/LNOH标准溶液称取0。
4-0。
6克;0。
2mol/L称1-1.2克;0.5mol/L称取3克于105-110℃烘至恒重的苯二甲酸氢钾,称准至0.0002克,分别溶于50ml;80ml 不含二氧化碳水中,加2滴1%酚酞指示剂,用配好的待标定溶液至溶液呈粉红色与标准色相同。
同时作空白试验。
4、计算:C(NaOH)=m / (V1-V2)*0。
2042C(NaOH)——-氢氧化钠溶液浓度m——苯二甲酸氢钾之质量(克)V1-—氢氧化钠溶液用量(毫升)V2—-空白氢氧化钠溶液用量(毫升)0。
2042——与1。
000mol/LNOH标准溶相当的以克表示的当量苯二甲酸氢钾之质量5、注意事项:1、为使标定的浓度准确,标定后应用相应浓度盐酸对标。
2、液溶有效期2个月.3、氢氧化钠饱和溶液之配制:于1000硬质容器中,加70毫升水,逐渐加入700克氢氧化钠。
随加随搅拌,使溶解完全冷却后移入盛氢氧化钠饱和液之试药瓶中,以胶塞密塞,静置7天以上,使含之碳酸钠沉淀完全。
取澄清之氢氧化钠饱和液少许,加水稀释,加氢氧化钡饱和液1毫升,十分钟内不产生浑浊,表示碳酸钠已沉淀完全。
0。
1 mol/L[0.1N/L]溴酸钾标准溶液GB/T 601—20021.配制称取3克溴酸钾,溶于1000ml水中,摇均。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
氢氧化钠标准溶液的配制和标定

氢氧化钠标准溶液的配制与标定一、实验目的1.学会配制标准溶液和基准物质标定标准溶液浓度的方法。
2.基本掌握滴定操作和滴定终点的判断。
二、实验原理氢氧化钠易吸收CO:和水,不能用直接法配制标准滴定溶液,应先配成近似浓度的溶液,再进行标定。
标定碱溶液用的基准物质很多,如:草酸、苯甲酸、氨基磺酸、邻苯二屮酸氢钾等,目前常用的是邻苯二甲酸氢钾,其滴定反应如下:计量点时山于弱酸盐的水解,溶液呈微碱性,应用酚肽为指示剂。
三、试剂氢氧化钠:A.R.或C. P.;邻苯二中酸氢钾:基准试剂,于105〜110°C干燥至恒重;酚酥指示剂:2g/L四、实验步骤(-)氢氧化钠溶液的配制用表面皿快速称取氢氧化钠2克,用适量水溶解,倒入具有橡皮塞的试剂瓶中,加水稀释至500 mL,摇匀,待标定。
(二)0. lmol/L氢氧化钠溶液的标定精密称取干燥至恒重的基准邻苯二中酸氢钾0.5—0.6“于锥形瓶中,加25ml水,酚駄1滴,用0. lmol/L氢氧化钠溶液滴定至溶液呈淡粉红色保持30s不褪即为终点。
记录所耗用的氢氧化钠溶液的体积,作三次平行测定。
实验流程NaOH 标准溶液酚駄指示液2d滴定至溶液由无色变粉红色五.数据记录与处理编号实验项目倾出前(称量瓶+基准物)质量倾出后(称量瓶+基准物)质量取出基准物的质量NaOH溶液终读数N&OH溶液初读数消耗N&OH溶液体积NaOH溶液的浓度NaOH溶液的平均浓度相对平均偏差六、思考题1.本实验中,氢氧化钠和邻苯二屮酸氢钾两种标准溶液的配制方法有何不同? 为什么?2.本实验中哪些数据需要精确测定?各用什么仪器?参考文献:张龙.潘亚芬《化学分析技术》邢文卫、李炜《分析化学实验》。
氢氧化钠标准溶液的配制与标定

NaOH溶液的配制和标定一、教学要求1、学会NaOH标准溶液的配制与标定方法;2、练习台天平的使用,掌握固体强碱的称量方法;3、了解基准物质邻苯二甲酸氢钾(KHC8H4O4)和草酸(H2C2O4·H2O)的性质及其应用;4、熟悉电子天平的使用,掌握差减法称取基准物质的操作步骤;5、学会用基准物质配制标准溶液的方法;6、学会容量瓶和移液管的正确使用;7、掌握强碱滴定弱酸的滴定过程,突跃范围及指示剂的选择原理。
二、预习内容1、台天平的构造及应用;2、电子天平的称量原理、操作过程及注意事项;3、容量瓶和移液管的规格、使用;4、滴定管的规格、洗涤、涂油、润洗等操作步骤;5、固体NaOH的性质、NaOH溶液的储存注意事项;6、基准物质的性质、常用基准物质的种类及应用。
三、基本操作1、容量瓶的使用(1)定义:容量瓶是一种细颈梨形平底玻璃瓶,主要用于配制准确浓度的溶液或定量的稀释溶液。
(2)使用前检漏:加水至标线附近,盖好瓶塞后,左手用食指按住塞子,其余手指拿住瓶颈标线以上部分,右手指尖托住瓶底,将瓶倒立2分钟,如不漏水,将瓶直立,转动瓶塞180°,再倒立2分钟,如不漏可使用。
(使用中,玻璃塞不应放在桌面上,以免玷污,操作时可用一手的食指和中指夹瓶塞的扁头,当操作结束后随手将瓶盖盖上,也可用橡皮筋或细绳将瓶塞系在瓶颈上)。
(3)洗涤:一般先用自来水洗,最后用蒸馏水水洗3次备用。
(4)定量稀释溶液:用移液管移取一定体积的溶液于容量瓶中,加水至距标线约1cm处,等1~2分钟,使附在瓶颈内壁的溶液流下后,再用滴管滴加水至弯液面下缘与标线相切,然后盖上瓶塞,左手用食指按住塞子,其余手指拿住瓶颈标线以上部分,右手指尖托住瓶底,将容量瓶倒转,使气泡上升到顶,使瓶振荡,正立后再次倒转进行振荡,如此反复15~20次以上,使瓶内溶液混合均匀。
(5)溶液的配制:将准确称量的待溶固体置于小烧杯中,加水溶解,然后将溶液定量转入容量瓶中。
氢氧化钠标准溶液配制与标定

氢氧化钠标准溶液配制与标定一、饱和氢氧化钠溶液的配制准确称取162氢氧化钠溶解在150ml无二氧化碳水中,冷却至室温。
将溶液储存于密闭的聚乙烯容器内,放置一周以上,直至上层溶液清澈。
使用时吸取上清液。
二、0.5mol/L氢氧化钠标准滴定溶液配制量取氢氧化钠饱和溶液上清液26ml,用无二氧化碳水稀释至1L,储存于密闭的聚乙烯容器内,混匀。
三、0.5mol/L氢氧化钠标准溶液的标定1、1%(10g/L)酚酞指示剂称取1.0g(准确至0.001g)酚酞,溶于80ml乙醇(95%),加水稀释至100ml摇匀,转移入试剂瓶中,贴标签备用。
2、将10g基准物令笨二甲酸氢钾(KHC8H4O4),置于110-120℃干燥箱内干燥2个小时,再放于干燥器内冷却至室温。
3、准确称取干燥恒重的基准邻苯二甲酸氢钾 3.0g(准确至0.0001g),放入250ml锥形瓶中,加以80ml不含CO2的蒸馏水溶解,家1%酚酞指示剂2滴,用0.5mol/L氢氧化钠待标定溶液滴定至溶液由无色变为粉色30秒不退色为终点。
平行3次,去平行测定的算术平均值为测定结果。
C(NaOH)=m/0.2042*VC(NaOH)——氢氧化钠标准溶液物质的量浓度,mol//LM——称取令笨二甲酸氢钾质量。
V——滴定用去氢氧化钠溶液实际体积,ml0.2042——与1.00ml氢氧化钠标准滴定溶液{C(NaOH)=1.000mol}相当的以克表示的邻苯二甲酸氢钾的质量。
无配0.01mol/L的NaOH标液,吸取0.5mol/LNaOH标液20ml,加无CO2稀释至1L。
注意事项:1、氢氧化钠标准滴定溶液推荐使用聚乙烯容器储存。
若使用玻璃容器,当怀疑溶液与玻璃发生反应或溶液出现不容物时,必须时常标定溶液。
2、溶液有效期为2个月。
3、为使标定的浓度标准,标定后应用相对应浓度盐酸对标。
硫酸标准溶液配制与标定一、0.5mol/L硫酸标准滴定溶液的配制量取15ml硫酸(AR)慢慢注入500ml烧杯内400ml无CO2的蒸馏水中,混匀。
氢氧化钠标准溶液的配制

验四氢氧化钠标准溶液的配制和标定一、目的1、配制0.1 mol/L 氢氧化钠溶液2、氢氧化钠溶液的标定二、材料仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。
试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。
三、实验原理NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。
反应方程式: 2NaOH + CO2→ Na2CO3 + H2O由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。
除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。
待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。
此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。
标定碱溶液的基准物质很多,常用的有草酸(H2C2O4•2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。
最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。
四、操作步骤1、0.1mol/L NaOH标准溶液的配制用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。
准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中(可以煮沸),摇匀,贴上标签。
2、0.1mol/L NaOH标准溶液的标定将基准邻苯二甲酸氢钾加入干燥的称量瓶内,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。
氢氧化钠标准滴定溶液的配制与标定
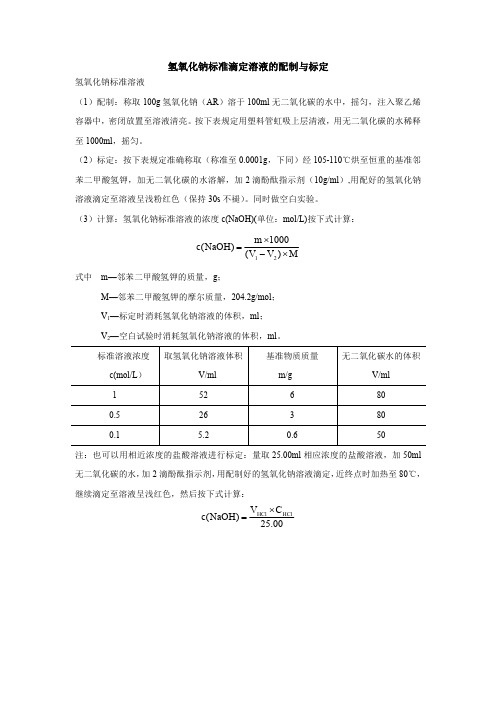
氢氧化钠标准滴定溶液的配制与标定
氢氧化钠标准溶液
(1)配制:称取100g 氢氧化钠(AR )溶于100ml 无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表规定用塑料管虹吸上层清液,用无二氧化碳的水稀释至1000ml ,摇匀。
(2)标定:按下表规定准确称取(称准至0.0001g ,下同)经105-110℃烘至恒重的基准邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示剂(10g/ml ),用配好的氢氧化钠溶液滴定至溶液呈浅粉红色(保持30s 不褪)。
同时做空白实验。
(3)计算:氢氧化钠标准溶液的浓度c(NaOH)(单位:mol/L)按下式计算:
M
)V V (1000
m )NaOH (c 21⨯-⨯=
式中
m—邻苯二甲酸氢钾的质量,g ;
M—邻苯二甲酸氢钾的摩尔质量,204.2g/mol ;V 1—标定时消耗氢氧化钠溶液的体积,ml ;V 2—空白试验时消耗氢氧化钠溶液的体积,ml 。
标准溶液浓度c(mol/L )取氢氧化钠溶液体积
V/ml 基准物质质量m/g 无二氧化碳水的体积
V/ml 1526800.5263800.1
5.2
0.6
50
注:也可以用相近浓度的盐酸溶液进行标定:量取25.00ml 相应浓度的盐酸溶液,加50ml 无二氧化碳的水,加2滴酚酞指示剂,用配制好的氢氧化钠溶液滴定,近终点时加热至80℃,继续滴定至溶液呈浅红色,然后按下式计算:
00
.25C V )NaOH (c HCl
HCl ⨯=。
氢氧化钠标准滴定液的标定

氢氧化钠标准滴定液的标定
考核时间:70分钟
称取于105℃-110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,3.6±0.10g ,加80ml 无二氧化碳的水溶解,加两滴酚酞指示液(10g/L ),用配好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30秒。
同时做空白。
计算: C (NaOH )=M
V V 100021⨯-⨯)(m
式中:
m -邻苯二甲酸氢钾质量,单位为克(g )。
V 1-氢氧化钠溶液的体积的数量,单位是毫升(mL )。
V 2-空白试验氢氧化钠溶液的体积的数值,单位是毫升(mL )。
M -邻苯二甲酸氢钾的摩尔重量的数值,单位为克每摩尔(g/mol )[M (KHC 8H 4O 4)=204.22]。
取五次平行测定结果。
标准溶液浓度标定原始记录
实验用品
评分标准
评委签字:分析者:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
邯郸市丛台区安东食品加工厂
标准溶液配制与标定原始记录
标准溶液的配制
标准溶液名称预配浓度配制方法配制日期
氢氧化钠标准溶液0.1 mol/L GB/T601-2002年月日
标准溶液的标定
基准物名称温度℃湿度%所用仪器及试剂
邻苯二甲酸氢钾(99.9%)
1酚酞指示剂
2无二氧化碳水
3烘箱
标定标定日期:年月日
序号基准物质的质
量m ; (g)
消耗标准溶液的
体积V1 ; (ml)
空白消耗标准溶液
的体积V0 ;(ml)
计算结果
mol/L
平均结果
mol/L
1
2
3
4
复标复标日期:年月日1
2
配制人:标定人:复标人:如有侵权请联系告知删除,感谢你们的配合!。
