暨南大学2017年硕士《基础化学》考试大纲
暨南大学普通化学参考书目

2012年硕士研究生入学统一考试普通化学考试大纲目录Ⅰ. 考察目标Ⅱ. 考试形式和试卷结构Ⅲ. 考察范围Ⅳ. 试题示例Ⅴ. 参考书推荐普通化学课程考试热力学、动力学、溶液及其性质、氧化还原反应、原子结构、分子结构、配位化合物,元素及其性质、化学反应方程式等内容。
要求考生全面系统地掌握普通化学的基本知识、基本理论。
掌握元素、化合物及其性质的变化规律,利用分子结构理论解释化合物的分子结构及其性质,具备较强的分析问题和解决问题的能力。
Ⅱ. 考试形式和试卷结构一、试卷满分及考试时间本试卷满分为150分,答题时间为180分钟二、答题方式答题方式为闭卷、笔试三、试卷内容结构热化学:10~15分化学平衡熵和Gibbs函数:10~15分化学动力学基础:10~15分酸碱平衡:10~15分沉淀溶解平衡10~15分氧化还原反应电化学基础15~20分原子结构15~20分分子结构25~30分配合物结构15~20分元素及化合物30~40分四、试卷题型结构选择答案:20-30分解释回答问题:40-50分填空题:20-30化学反应方程式:10-20计算题:40-50分1. 化学热力学基础掌握理想气体状态方程,分压定律,分体积定律,热力学基本概念及U、H、S、G的物理意义。
熟练运用生成焓、标准熵、生成自由能计算反应的焓变、熵变、自由能变,掌握吉布斯-亥姆霍兹公式,盖斯定律,理解化学反应等温式。
2. 化学平衡常数掌握平衡常数,标准平衡常数Kθ与△r G mθ的关系。
浓度、压力、温度对化学平衡的影响。
3. 化学动力学理解过渡态理论,掌握浓度对化学反应速率的影响及化学反应速率方程,温度对化学反应速率的影响及阿累尼乌斯方程,催化剂对化学反应速率的影响。
4. 稀溶液的依数性了解稀溶液的蒸气压下降、沸点升高、凝固点降低的原因。
熟悉稀溶液的蒸气压下降、沸点升高、凝固点降低概念及计算。
掌握溶液渗透压力的概念及渗透浓度的计算,熟悉渗透压力的医学应用。
暨南大学_831普通化学2012--2017_考研真题/硕士研究生入学考试试题

2012年招收攻读硕士学位研究生入学考试试题******************************************************************************************** 学科、专业名称:应用化学,化学工程(专业学位)研究方向:考试科目名称:普通化学考试科目:普通化学共4页,第1页考试科目:普通化学共4页,第2页考试科目:普通化学共4页,第3页考试科目:普通化学共4页,第4页2013年招收攻读硕士学位研究生入学考试试题******************************************************************************************** 学科、专业名称:应用化学,化学工程(专业学位)研究方向:考试科目名称:普通化学考试科目:普通化学共4页,第1页考试科目:普通化学共4页,第2页考试科目:普通化学共4页,第3页考试科目:普通化学共4页,第4页2014年招收攻读硕士学位研究生入学考试试题******************************************************************************************** 学科、专业名称:应用化学研究方向:考试科目名称:普通化学考试科目:普通化学共4页,第1页考试科目:普通化学共4页,第2页考试科目:普通化学共4页,第3页考试科目:普通化学共4页,第4页2015年招收攻读硕士学位研究生入学考试试题******************************************************************************************** 学科、专业名称:应用化学化学工程研究方向:考试科目名称:普通化学考试科目:普通化学共4页,第1页考试科目:普通化学共4页,第2页考试科目:普通化学共4页,第3页考试科目:普通化学共4页,第4页2016年招收硕士学位研究生入学考试试题******************************************************************************************** 学科、专业名称:应用化学化学工程研究方向:考试科目名称:普通化学考试科目:无机化学共4页,第1页考试科目:无机化学共4页,第2页考试科目:无机化学共4页,第3页考试科目:无机化学共4页,第4页2017年招收硕士学位研究生入学考试试题********************************************************************************************学科、专业名称:应用化学化学工程研究方向:考试科目:普通化学共4页,第3页考试科目:普通化学共4页,第4页。
2017年硕士研究生入学考试初试校自命题科目复习大纲

2017年硕士研究生入学考试初试校自命题科目复习大纲261 日语二外考查要点:1.语汇1.1要求掌握体言、用言的性质和特征。
包括:数词的用法、コソアド体系和指示词、常用的形式体言。
动词的活用形、自动词和他动词、授受关系的动词、形容词、形容动词的活用形。
1.2要求掌握连体词、副词、接续词、感叹词的性质和特征。
包括:状态副词、程度副词、叙述副词。
表示感叹、呼唤、应答的感叹词。
2.文法2.1要求掌握使役、被动、可能、敬语、否定、希望、推量、比况、样态助动词的性质和特征及其用法。
2.2要求掌握格助词、接续助词、副助词、终助词的性质和特征及其用法。
3.读解3.1要求了解以意义和性能进行表现的方式。
包括:理由、逆接、条件、结果、追加、范围、目的、时间、说明、文末、敬语的表现方式。
推荐书目:《标准日本语》(初级上、下册;中级上册), 人民教育出版社, 人民教育出版社、光村图书出版株式会社, 1988年第一版262 德语二外考查要点:1. 词汇和语法1.1 掌握德语基本词汇与短语2000个左右。
1.2 掌握《大学德语》修订版第一、二册中所涉及的名词变格、动词变位、动词时态、语态等基本语法知识并能在阅读和写作中综合运用这些知识。
2 阅读2.1 具备阅读不同体裁(故事、随笔、报道等)和不同题材(经济、历史、文化、新闻、科技等)一般德语资料的能力。
2.2阅读速度为50个词左右/每分钟;阅读文章生词量为3%—10%之间3. 翻译3.1 具备短语和句子的德译汉或汉译德基本能力,或短文的德译汉基本能力。
推荐书目:《大学德语》(第一册、第二册),姜爱红, 高等教育出版社, 2008年8月第三版263 法语二外考查要点:1. 词汇和语法1.1 掌握法语基本词汇与短语2000个左右。
1.2 掌握法语中动词变位、动词时态、语态等语法知识并能综合运用这些知识。
2 阅读2.1 具备阅读不同体裁(故事、随笔、报道等)和不同题材(经济、历史、文化、新闻、科技等)一般法语资料的能力。
暨南大学考研历年真题之基础化学2011--2013年考研真题

)
8. 某溶液由溶剂 A 和溶质 B 组成, 设 A 的物质的量是 0.2 mol, B 的物质的量是 0.3 mol,则溶质 B 的摩尔分数为· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( ) (A) 0.6 (B) 0.4 (C) 0.3 (D) 0.2 9. 与缓冲溶液的缓冲容量大小有关的因素是 · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( (A) 缓冲溶液的 pH 值范围 (B) 缓冲溶液的组分浓度比 (C) 外加的酸量 (D) 外加的碱量 10. 下列各组分子中,每种分子都能形成氢键的一组是 · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( (A) NH3,HNO3,H2S (B) H2O,C2H2,CF2H2 (C) H3BO3,HNO3,HF (D) HCl,H2O,CH4 11. 运算式
2. 某反应的HӨ 和SӨ 均为正值且不随温度变化,下列说法正确的是· · · · · · · ( ) (A) 低温下自发,高温下非自发 (B) 高温下自发,低温下非自发 (C) 任何温度下均非自发 (D) 任何温度下均自发 3. 若某体系所吸收的热量全部用于体系的内能增加,所需要的条件是· · · · · · ( ① 封闭体系 ② 不做体积功和其他功 ③ 恒压 ④ 恒温 (A) ① 和② (B) ① 和③ (C) ① 和④ (D) ② 和④ 4. 真实气体与理想气体的行为较为接近的条件是· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( (A) 高压和较低的温度 (B) 低温和低压 (C) 高温和高压 (D) 低压和较高的温度 5. 影响化学反应平衡常数数值的因素是· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( (A) 催化剂 (B) 温度 (C) 反应物的浓度 (D) 产物的浓度 6. 下列各组量子数中,正确的是 · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · ( (A) n=3,l=1,m=1 (B) n=3,l=2,m=3 (C) n=4,l=4,m=0 (D) n=2,l=1,m=-2 )
暨南大学有机化学考试大纲

2010年Ⅰ. 考察目标有机化学课程考试涵盖有机化合物的结构、有机化合物的性质、有机化合物的制备、有机化合物的反应等内容。
要求考生全面系统地掌握有机化学的基本知识、基本理论。
掌握有机化合物的结构,利用有机化合物的结构推断有机化合物的性质、制备及其应用,具备较强的分析问题和解决问题的能力。
Ⅱ. 考试形式和试卷结构一、试卷满分及考试时间本试卷满分为150分,答题时间为180分钟二、答题方式答题方式为闭卷、笔试三、试卷内容结构有机化合物的结构:20~25分有机化合物的性质:30~40分有机化合物的制备:40~45分有机化合物的反应:40~50分四、试卷题型结构回答问题:30-40分完成反应式:40-50分结构推到:30-40分反应机理:20-30分合成:30-40分Ⅲ. 考察范围1 有机化合物的结构和性质重点难点:有机化合物的结构,同分异构现象;共价键的属性及断裂;布朗斯特酸碱和路易斯酸碱,及两者的异同;有机化合物的分类。
2 烷烃重点:IUPAC命名法和构造异构、甲烷的四面体结构,乙烷的各种构象。
分子间力与化合物沸点、熔点、溶解度的关系。
氯代反应及自由基历程,氯代反应过程中的能量变化。
3 烯烃重点:烯烃的结构, sp2杂化轨道,л-键的结构,顺-反异构;命名主要讨论Z-E命名;加成反应、硼氢化反应、氧化反应,加成反应中亲电加成反应历程,产物的立体化学。
解释Markovnikov规则。
4 炔烃和二烯烃重点:炔烃的命名,亲电加成、亲核加成、氧化反应和酸性;二烯烃的命名,Z-E 命名; 1,3-丁二烯的共轭结构和共轭效应;双烯合成,环戊二烯亚甲基上氢原子的活泼性。
5 脂环烃重点:命名重点螺环和桥环的命名;环的稳定性,角张力,以电子云最大重叠原理说明小环的不稳定性;脂环烃的构象,环已烷的构象、环已烷衍生物的稳定性。
6 芳香族烃类化合物重点:苯的结构和芳香性、大л-键,芳环上的亲电取代反应及亲电取代反应的历程,σ-络合物及其稳定性,亲电取代反应的定位规律及其电子效应的解释。
暨南大学硕士研究生考考试参考书目
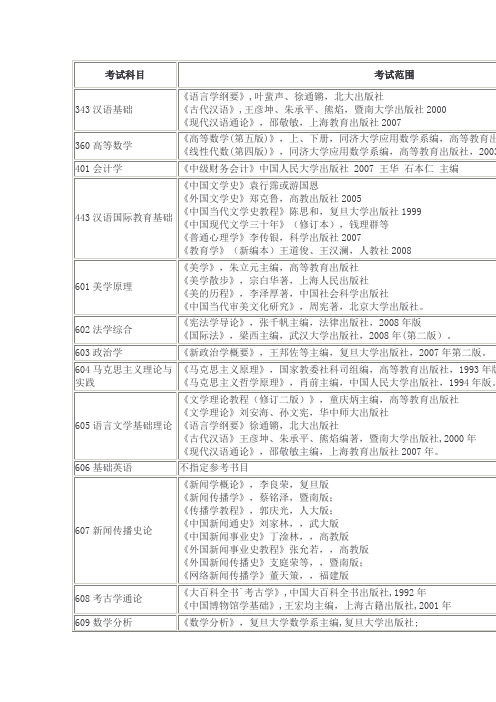
601美学原理
《美学》,朱立元主编,高等教育出版社
《美学散步》,宗白华著,上海人民出版社
《美的历程》,李泽厚著,中国社会科学出版社
《中国当代审美文化研究》,周宪著,北京大学出版社。
602法学综合
《宪法学导论》,张千帆主编,法律出版社,2008年版
《国际法》,梁西主编,武汉大学出版社,2008年(第二版)。
《文学理论》刘安海、孙文宪,华中师大出版社
《语言学纲要》徐通锵,北大出版社
《古代汉语》王彦坤、朱承平、熊焰编著,暨南大学出版社,2000年
《现代汉语通论》,邵敬敏主编,上海教育出版社2007年。
606基础英语
不指定参考书目
607新闻传播史论
《新闻学概论》,李良荣,复旦版
《新闻传播学》,蔡铭泽,暨南版;
401会计学
《中级财务会计》中国人民大学出版社2007王华石本仁主编
443汉语国际教育基础
《中国文学史》袁行霈或游国恩
《外国文学史》郑克鲁,高教出版社2005
《中国当代文学史教程》陈思和,复旦大学出版社1999
《中国现代文学三十年》(修订本),钱理群等
《普通心理学》李传银,科学出版社2007
《教育学》(新编本)王道俊、王汉澜,人教社2008
《新闻公关广告之互动研究》,董天策等,暨南版
810高等代数
《高等代数》,北京大学编著,高等教育出版社
811普通物理
《物理学》,马文蔚编,高等教育出版社,(第四版电磁学、光学和量子物理部分),1999版
812有机化学A
《有机化学》,胡宏纹编,南京大学出版社,第二版
813病理生理学
2017年暨南大学考研真题710无机化学硕士学位研究生入学考试试卷

2017年招收攻读硕士学位研究生入学考试试题********************************************************************************************招生专业与代码:无机化学、分析化学、有机化学、物理化学、高分子化学与物理考试科目名称及代码:710无机化学考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
允许使用非编程型计算器。
一、选择题 (选择一个正确答案,每小题3分,20题共 60分)1. 波函数用于描述(A) 电子的能量 (B) 电子在核外空间的运动(C) 电子的运动速度 (D) 电子在某一空间出现的概率密度2. 下列化合物中,既有离子键又有共价键的是(A) CaO (B) CH 4 (C) BaCl 2 (D) NH 4Cl3. 下列物质中,不适宜作配体的是(A) 223S O - (B) H 2O (C) NH 4+ (D) Cl -4. H 3O +的杂化类型和空间构型为(A) sp 3杂化,正四面体 (B) sp 3杂化,三角锥形(C) sp 3不等性杂化,正四面体 (D) sp 3不等性杂化,三角锥形5. NaF 、NaCl 、NaBr 、NaI 中,熔点最低的是(A) NaF (B) NaCl (C) NaBr (D) NaI6. 与难挥发性非电解质稀溶液的蒸气压降低、沸点升高、凝固点降低有关的因素为(A) 溶液的体积 (B) 溶液的温度(C) 溶质的本性 (D) 单位体积溶液中溶质质点数7. 某金属离子生成的两种八面体配合物的磁矩分别为μ = 4.90 B.M 和μ = 0.00 B.M ,则该金属离子可能是(A) Cr 3+ (B) Mn 2+ (C) Mn 3+ (D) Fe 2+8. 将固体NH 4NO 3溶于水,溶液变冷,则该过程的G ∆、H ∆、S ∆的符号依次是(A) +、-、- (B) +、+、- (C) -、+、- (D) -、+、+9. 下列说法正确的是(A) 两难溶电解质作比较时,K sp 小的,溶解度一定小(B) 欲使溶液中某离子沉淀完全,加入的沉淀剂越多越好(C) 沉淀完全是指用沉淀剂将溶液中某一离子完全消除(D) 欲使Ca 2+沉淀完全,选择Na 2C 2O 4作沉淀剂效果比Na 2CO 3好考试科目: 无机化学 共 4 页,第 1 页。
2017年硕士研究生入学考试自命题科目考试大纲

2017年硕士研究生入学考试自命题科目考试大纲
科目代码:871 科目名称:光电技术
一. 考试要求
主要考查学生对光电技术的理论基础、常用光电器件的原理与应用技术以及光电信号的变换与处理技术等基础知识的理解与掌握,考查学生对典型光电系统的分析能力和对简单光电系统的设计能力。
二、考试内容
1.光辐射源
光辐射源工作的理论基础,包括辐射度学与光度学基础、半导体基础、黑体辐射等知识,热辐射源、黑体辐射器、激光二极管和发光二极管等典型光源结构、特性及应用。
其中,辐射度学和半导体等内容侧重考查基本概念,黑体辐射知识侧重考查基本概念及在光电工程的应用。
2.光电探测器
光电探测器的分类、工作原理,光电导探测器、光伏探测器、光电倍增管、热电偶、测辐射热计、热释电探测器等常见探测器的结构、原理、特性及应用。
光电成像器件的工作原理,MCP像增强器、CCD/CMOS摄像器件和红外焦平面阵列器件的结构、原理、特性及应用。
3.光电信号的变换与处理
光电信号的变换的概念、分类、意义和作用,光学信号调制的概念和方法,直接探测和相干探测原理及应用,检测电路带宽与低噪声设计、相关检测等电学信号处理方法。
4.典型光电系统的分析与设计
光电系统概念,测量检查、控制跟踪、图像测量等功能的典型光电系统的分析方法,简单光电测量系统设计的基本方法。
其中,光电系统限制在参考书目(或相近光电类书目)中的应用实例。
三、考试形式
考试形式为闭卷、笔试,考试时间为3小时,满分150分。
题型包括:选择题、简答题、分析计算题和系统设计题等。
四、参考书目
1.《光电技术》.江文杰,施建华等编著.科学出版社,2014.1, 第二版。
《基础化学》考试大纲

《基础化学》考试大纲一、考试科目基础化学二、适用专业生物技术三、考试内容(一)气体和溶液1、掌握气体状态方程及道尔顿分压定律;2、了解分散系的定义及分类;3、掌握溶液浓度的几种表示方法,并熟练地进行有关浓度的化学计算及相互换算;4、理解稀溶液的依数性(凝固点下降、沸点升高及渗透现象)。
(二)化学热力学和化学动力学基础1、了解热力学常用术语,状态函数特征,理解热力学第一定律、第二定律;2、掌握热化学方程式、反应的摩尔焓变、盖斯定律及有关计算;3、了解摩尔标准熵SØm、摩尔标准生成自由能△f GØm的概念,掌握△r SØm、△r GØm的简单计算,利用自由能变△r GØm判断标准状态下反应自发进行的方向;4、了解化学反应速率的概念、表示方法,活化能的概念,化学反应速率理论;掌握反应级数的概念,质量作用定律、反应速率方程,理解影响反应速率的因素;5、了解化学平衡的概念及标准平衡常数KØ和浓度平衡常数K c 的表示方法,掌握化学平衡的移动规律及平衡计算;6、了解酶催化的一般特征。
(三)物质结构1、了解核外电子运动的特殊性及波函数(原子轨道)、几率密度、电子云等概念;2、掌握四个量子数的物理意义及取值规则;3、掌握核外电子排布三原则,能熟练地书写常见元素的核外电子排布式,并能根据电子层结构特征判断元素在周期表中的位置;了解原子半径、元素电负性的意义及周期性变化规律;4、了解共价键的本质、特点、类型,掌握 sp型杂化轨道理论并能利用其解释简单分子化合物的空间构型;5、掌握分子极性、范德华力、氢键等概念,并能应用它们解释物质的一些物理性质;6、掌握配合物的组成、定义、命名法,了解配位化合物的类型。
(四)定量分析中的误差及分析结果的数据处理1、了解有效数字的含义,掌握正确取舍原则和运算规则;2、掌握定量分析误差的来源、分类和减免措施;3、掌握精密度与准确度的关系;4、了解提高分析结果的准确度的方法,掌握测定结果离群值的取舍方法。
2016暨南大学普通化学考试大纲

填空题:20-30 解释回答问题:30-40 分 计算题:30-50 分
Ⅲ. 考察范围
1. 化学热力学基础 掌握热力学基本概念及重要状态函数, 熟练运用生成焓、 标准熵、 生成能计算反应的焓变、 熵变、自由能变,掌握吉布斯-亥姆霍兹方程,盖斯定律。 2. 化学平衡常数 掌握标准平衡常数 Kθ与△rGmθ的关系。掌握浓度、压力、温度对化学平衡的影响。 3. 化学动力学基础 理解过渡态理论,掌握浓度对化学反应速率的影响及相关计算,温度对化学反应速率的影 响及相关计算,催化剂对化学反应速率的影响。 4. 酸碱平衡及沉淀平衡 理解酸碱的质子理论,掌握一元弱酸(碱)、多元弱酸(碱)氢(氢氧根)离子浓度的计算,理 解酸碱平衡中的同离子效应,掌握缓冲溶液相关理论及计算;理解沉淀溶解平衡中溶度积和溶 解度的关系, 理解沉淀溶解平衡中的同离子效应,掌握溶度积规则并熟练运用于沉淀溶解平衡 中的相关计算。 5. 电化学基础 掌握氧化还原反应的基本概念,氧化还原反应方程式的配平,原电池及其符号书写,标准 电极电势的意义及应用, 熟练运用能斯特方程及元素电势图进行相关计算,熟悉电动势与自由 能、氧化还原反应平衡常数的换算。 6. 配位平衡 掌握与配位平衡相关的计算。 7. 原子结构与元素周期系 了解波函数的空间图象,掌握四个量子数,原子核外电子排布,了解元素基本性质的周期 性变化规律。 8. 分子结构
第五阶段:调整(初试至复试) 调整原因: 经过长时间的复习,经历几乎被耗尽,需要通过这一段时间加以调整。但是,由于现在考 研复试的比重越来越大,平均达到 25%以上。因此,这个阶段还是不能够太过于放松。很多人 没有把握住这个阶段,结果大意失荆州。万望诸君注意。
重点任务: 1.考研复试,往往以时政为核心,来灵活的考察知识点的应用。因此,这个阶段应该多多收集 一些时政热点,并尝试用所学知识去解决。 2.寻找复习的资料。包括老师们最近的讲话、论文等等。 3.准备听力和口语。 以上“五阶段复习法”,步步为营,按部就班,依次行事,一切尽在掌握中,则考研无 忧矣。
暨南大学2017年硕士《生物化学》考试大纲

暨南大学2017年硕士《生物化学》考试大纲I.考察目标II.考试形式和试卷结构III.考查范围IV.试题示例I.考查目标要求考生比较系统地掌握生物化学课程的基本概念、基本原理和基本方法,能够运用所学的基本原理和方法分析、判断和解决有关理论和实际问题。
II.考试形式和试卷结构一、《生物化学》部分分数"药学基础"试卷满分300分(其中<<生物化学>>部分150分),考试时间共180分钟。
二、答题方式答题方式为闭卷、笔试,考生独立完成考试内容。
三、试卷内容结构生物化学基本概念、基本原理、实验技能120分生物化学综合应用30分四、试卷题型结构名词解释20分是非判断题20分选择题30分简答题50分综合题30分Ⅲ.考查范围生物化学【考查目标】1.掌握生物化学课程的基本概念、基本原理和基本方法2.能够运用所学的基本原理和方法分析、判断和解决有关理论和实际问题。
一、蛋白质的结构与功能(一)蛋白质的分子组成(二)蛋白质的分子结构(三)蛋白质结构与功能的关系(四)蛋白质的理化性质及其分离纯化二、核酸的结构与功能(一)核酸的化学组成(二)核酸的一级结构(三)DNA的空同结构与功能(四)RNA的空间结构与功能(五)核酸的理化性质及其应用三、酶(一)酶的分子结构与功能(二)酶促反应的特点与机制(三)酶促反应动力学(四)酶的调节(五)酶的命名与分类四、糖代谢(一)糖类概念及其功能(二)糖的无氧分解(三)糖的有氧氧化(四)磷酸戊糖途径(五)糖原的合成与分解(六)糖异生(七)血糖及其调节五、脂类代谢(一)脂类的消化和吸收(二)甘油三酯代谢(三)磷脂的代谢(四)胆固醇代谢六、生物氧化(一)生成ATP的氧化体系(二)其他氧化体系七、氨基酸代谢(一)蛋白质的营养作用(二)蛋白质的消化、吸收与腐败(三)氨基酸的一般代谢(四)氨的代谢(五)个别氨基酸的代谢八、核苷酸代谢(一)嘌呤核苷酸代谢(二)嘧啶棱苷酸代谢九、物质代谢的联系与调节(一)物质代谢的特点(二)物质代谢的相互联系(三)组织、器官的代谢特点及联系(四)代谢调节十、DNA的生物合成(复制)(一)半保留复制(二)DNA复制的酶学(三)DNA生物台成过程(四)DNA损伤(突变)与修复(五)逆转录现象和逆转录酶十一、RNA的生物合成(转录)(一)模板和酶(二)转录过程(三)真核生物的转录后修饰十二、蛋白质的生物合成(翻译)(一)参与蛋白质生物合成的物质(二)蛋白质的生物合成过程(三)翻译后加工(四)蛋白质生物合成的干扰和抑制十三、基因表达调控(一)基因表达调控基本概念与原理(二)原核基因转录调节(三)真核基因转录调节IV.试题示例一、名词解释(5×4=20分)1.蛋白质构象……5.操纵子二、是非判断题(20×1=20分)1.从热力学上讲蛋白质分子最稳定的构象是自由能最低时的构象。
暨南大学_812有机化学A2017年_考研专业课真题试卷

(B)
H3C H3C
CH3 CH CH CH2 Br
NaOH/EtOH
H3C H3C
CH3 CH C CH2
9、下列3个化合物中,判断具有芳香性和没有芳香性的化合物,并说明理由。
H H (A) (B) (C)
7、
Cl NaOH/EtOH
8、
Me
Cl
OH- / H2 O
9、
Cl OH
CH2COCl (1) AlCl3
H2NNH2, NaOH
10、
(2) H3+O
H3C C CHCl 1. NaCN
11、
CH2Cl
2. H3+O
KOH / EtOH
12、
Br
Ca(OH)2 C6H5CHO (2 equiv.) H+
+
2、
考试科目: 812有机化学B
共 5 页,第 4 页
COOC2H5 EtONa O EtOH
C2H5 OOC
3、
O
O O
四、合成题(共3小题,共30分)
HO H C2H5 OH H C2 H5 。
1、仅通过乙炔及必要无机试剂和催化剂合成
O
O )是重要的有机合成中间体,常用于合成杂环化合物。请通过丙二酸二乙 2、达米酮( 酯和丙酮以及必要的无机试剂合成达米酮。
2017年招收攻读硕士学位研究生入学考试试题 (正题)
********************************************************************************************
2017年暨南大学考研真题831普通化学硕士学位研究生入学考试试卷

)
A. 处于平衡状态
B. 正向进行
C. 逆向进行
D. 没有具体数据,无法判断
16. 反应:mA + nB = pC + qD对A是一级反应,对B是二级反应,某温度时,当[A] = [B] =
2.0 mol·L-1时,反应速度为0.10 mol·L-1 ·S-1,则当[A] = 4.0 mol·L-1,[B] = 2.0 mol·L-1,同温 下,反应速度常数和反应速度的数值分别为…………………………………………………(
2017年招收硕士学位研究生入学考试试题
**********************************************************************************
**********
学科、专业名称: 应用化学 化学工程
研究方向:
考试科目名称:普通化学
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
400
K时 , rGm = -95.33 kJ ·mol-1, 则 该 反 应 的 r H mθ和 r Smθ近 似 各 为 .……………………(
)
A. 187.4 kJ·mol-1; -0.126 kJ·mol-1·K-1
B. -187.4 kJ·mol-1; 0.126 kJ·mol-1·K-1
C. HPO24- 是酸,OH-是它的共轭碱
D. HPO24- 是酸, H2PO-4 是它的共轭碱
考试科目:普通化学
共4页,第1页
10. 298 K时,反应SO2(g) + 2NaOH(aq) ƒ Na2SO3(aq) + H2O(l) 的 r H mθ是…………( )
2017全国硕士研究生招生考试

一、溶液和胶体 考试内容
分散系 溶液浓度的表示方法 稀溶液的通性 胶体溶液 考试要求
1. 了解分散系的分类及特点。 2. 掌握物质的量浓度、物质的量分数和质量摩尔浓度的表示方法及计算。 3. 掌握稀溶液依数性的基本概念、计算及其在生活和生产中的应用。 4. 掌握胶体的特性及胶团结构式的书写。 5. 掌握溶胶的稳定性与聚沉。 二、化学热力学基础
2017 年全国硕士研究生招生考试
佛山科学技术学院自命题考试科目考试大纲 (科目名称:化学(农) 科目代码:710 ) I.考试性质
研究生入学考试化学(农学)是为了佛山科学技术学院招收农学门类相关专业 的硕士研究生而设置的具有选拔性质的科目。其目的是科学、公平、有效地测试 考生是否具备继续攻读农学门类相关专业硕士学位所需要的知识和能力要求,评 价的标准是高等学校农学学科优秀本科毕业生所能达到的及格或及格以上水平, 以利于佛山科学技术学院择优选拔,确保硕士研究生的招生质量。
考试内容 化学反应速率基本概念及速率方程式 反应速率理论 化学平衡及移动
考试要求 1. 理解化学反应速率、基元反应、复杂反应、反应级数、活化分子、有效碰撞及活化能等基 本概念。 2. 掌握质量作用定律及化学反应速率方程式的书写。 3. 掌握浓度、温度及催化剂对化学反应速率的影响。 4. 掌握化学平衡常数的意义及表达式的书写。 5. 掌握△rGmθ与 Kθ的关系及应用。 6. 掌握浓度、压力、温度对化学平衡移动的影响。 7. 掌握化学等温方程式和平衡常数的有关计算。 8. 掌握多重平衡规则。
考试内容 芳香烃的结构、命名和理化性质
考试要求 1. 了解芳香烃的分类和结构,掌握苯和萘及衍生物的命名。 2. 掌握苯的结构、芳香性及 Huckel 规则。 3. 了解芳香烃的物理性质。 4. 掌握苯和苯的衍生物的亲电取代反应(卤代、硝化、磺化、烷基化及碳正离子重排、酰基 化),侧链的氧化反应,侧链的卤代反应;掌握萘的亲电取代反应(卤代、硝化、磺化),氧化 反应,还原反应。 5. 了解芳环亲电取代反应机制,掌握芳环上亲电取代反应的定位规律及电子效应的影响。 五、旋光异构
暨南大学710无机化学2017年考研专业课真题试卷

2017年招收攻读硕士学位研究生入学考试试题********************************************************************************************招生专业与代码:无机化学、分析化学、有机化学、物理化学、高分子化学与物理考试科目名称及代码:710无机化学考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
允许使用非编程型计算器。
一、选择题 (选择一个正确答案,每小题3分,20题共 60分)1. 波函数用于描述(A) 电子的能量(B) 电子在核外空间的运动 (C) 电子的运动速度 (D) 电子在某一空间出现的概率密度2. 下列化合物中,既有离子键又有共价键的是(A) CaO (B) CH 4 (C) BaCl 2(D) NH 4Cl 3. 下列物质中,不适宜作配体的是(A) (B) H 2O (C) NH 4+ (D) 223S O -Cl -4. H 3O +的杂化类型和空间构型为(A) sp 3杂化,正四面体(B) sp 3杂化,三角锥形(C) sp 3不等性杂化,正四面体 (D) sp 3不等性杂化,三角锥形5. NaF 、NaCl 、NaBr 、NaI 中,熔点最低的是(A) NaF (B) NaCl (C) NaBr (D) NaI6. 与难挥发性非电解质稀溶液的蒸气压降低、沸点升高、凝固点降低有关的因素为(A) 溶液的体积 (B) 溶液的温度(C) 溶质的本性 (D) 单位体积溶液中溶质质点数7. 某金属离子生成的两种八面体配合物的磁矩分别为μ = 4.90 B.M 和μ = 0.00 B.M ,则该金属离子可能是(A) Cr 3+ (B) Mn 2+ (C) Mn 3+ (D) Fe 2+8. 将固体NH 4NO 3溶于水,溶液变冷,则该过程的、、的符号依次是G ∆H ∆S ∆(A) +、-、- (B) +、+、- (C) -、+、- (D) -、+、+9. 下列说法正确的是(A) 两难溶电解质作比较时,K sp 小的,溶解度一定小(B) 欲使溶液中某离子沉淀完全,加入的沉淀剂越多越好(C) 沉淀完全是指用沉淀剂将溶液中某一离子完全消除(D) 欲使Ca 2+沉淀完全,选择Na 2C 2O 4作沉淀剂效果比Na 2CO 3好考试科目: 无机化学 共 4 页,第 1 页暨南大学2017年考研专业课真题试卷(原版)。
暨南大学2018年硕士生招生《基础化学》考试大纲_暨南大学考研论坛

I 考察目标
基础化学考试涵盖化学热力学、化学动力学、原子结构、胶体和溶液及滴定分析等几个方面的内容。
要求考生比较系统的掌握基础化学上述方面的概念、基本原理和方法,能够运用所学的基本原理和基本方
法分析、判断和解决有关理论和实际问题。
II 考试形式和试卷结构
渗透压-> 渗透与渗透压的概念;
ПV=nRT,П=cRT。
6.胶体溶液
动力性质->布朗运动的概念与实质;
光学性质-> 丁达尔现象的概念与实质;
电学性质-> 电泳现象的实质,胶团双电层结构
Zeta 电位的定义;
影响溶胶稳定性和导致聚沉的因素;
胶团结构;
高分子溶液与凝胶的特点。
化学热力学基础
1.基本概念
1.试卷满分及考试时间
本试卷满分为 150 分,考试时间为 180 分钟。
2.答题方式
本试卷答题方式为闭卷、笔试。
3.试卷题型结构
概念题
15 分
填空题
20 分
选择题
30 分
简答题
20 分综合题源自65 分III 考察范围
气体与溶液
1.理想气体
分子本身不占体积,分子间没有相互作用力的气体。
2.理想气体方程
A.Q=0,W=0,△U=0,△H=0;
B.Q≠0,W≠0,△U=0,△H=Q;
C.Q=-W,△U=Q+W,△H=0;
D.Q≠W,△U=Q+W,△H=0;
下列物质中,不属于其共轭酸碱的是
A.NH4+,NH3; B.HF,H2F+; C.NH3,NH2-; D.H3O+,OH-
2017年普通高等学校招生全国统一考试大纲(化学)

2017年普通高等学校招生全国统一考试大纲化学Ⅰ考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
一、对化学学习能力的要求1. 接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
(2)通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。
(3)从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
2. 分析和解决化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
(2)将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。
3. 化学实验与探究的能力(1)掌握化学实验的基本方法和技能,并初步实践化学实验的一般过程。
(2)在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究。
二、对知识内容的要求层次高考化学命题对知识内容的要求分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。
能“知其然”,还能“知其所以然”。
综合应用:在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见酸碱指示剂及其变色范围
酸碱标准溶液的配制和标定
5.氧化还原滴定
高锰酸钾法的原理
高锰酸钾标准溶液的配制和标定
碘量法
碘量法标准溶液的配制和标定
碘量法的应用
IV 试题示例
如果体系经过一系列变化,最后又变回初始状态,则体系的
A.Q=0,W=0,△U=0,△H=0;
B.Q≠0,W≠0,△U=0,△H=Q;
氢键的形成
分子内氢键与分子间氢键
氢键的两个特性
配位化合物
1.配位化合物
配位化合物的定义
配位原子(概念)、配位数(概念)
配合物的命名
2.配合物的化学键本质
价键理论->α配键与π配键,内轨与外轨配合物
滴定分析
1.标准溶液的配制
2.滴定分析的计算
3.分析结果的误差
偶然误差
系统误差
偏差
准确度
精密度
4.酸碱滴定
2.热力学第一定律 能量在转化的过程中总值不变(能量守恒定律),△U=Q-W 3.等容反应与等压反应 等容反应->体积保持不变,体系不作体积功,W=0,△U=QV 等压反应->压力保持不变,Qp=H2-H1=△H 4.热化学方程式 定义:表示化学反应与其热效应关系的化学方程式; 热力学标准状态:浓度、压力、温度; 标准焓变 5.盖斯定律 定义:不论化学反应是一步完成还是分步完成,其热效应总是相同的。 6.生成焓 生成焓与标准生成焓的定义与计算; 化学键键能与反应焓变的关系; 7.热力学第二定律 孤立体系的任何自发过程,体系的熵总是增加的。 8.熵与标准摩尔熵 熵->体系混乱度的衡量参数; 热力学第三定律->0K 时,任何纯物质的完整晶体的熵值为零; 标准摩尔熵->标准状态下 1mol 物质的熵值; 熵值大小与聚集态、分子复杂程度、分子量和分子构型的关系。 9.吉布斯自由能 吉布斯自由能也称为自由焓,G=H-TS 吉布斯-赫姆霍兹方程式:对于等温等压过程,△G=△H-T△S 10.标准平衡常数 标准平衡常数的定义; 气体反应、溶液反应和复相反应的标准平衡常数的表达式; 11.化学平衡 用标准平衡常数判断自发反应方向; 化学平衡的移动(浓度、压力和温度对平衡的影响) 化学反应速率 1.反应速率 反应速率的表示方式:; 2.基元反应与非基元反应 反应物分子在碰撞中一步直接转化为生成物分子的反应称为基元反应; 3.质量作用定律 基元反应的反应速率与反应物浓度以方程式中化学计量数的绝对值为乘幂的乘积成正比; 反应速率与反应物浓度的关系-> 4.反应速度与温度的关系 5.反应速度理论 碰撞理论->定义、活化能(概念); 过渡态理论->定义; 6.级数反应及其特点
一级反应 二级反应 解离平衡 1.解离平衡常数 对于一元弱酸-> 对于一元弱碱-> 稀释定律->溶液的解离度与浓度的平方根成反比, 同离子效应与盐效应; 2.多元弱酸的解离平衡 3.水的解离与 pH 标度 水的离子积常数->一定温度下水中氢离子与氢氧根离子浓度乘积为常数 pH=,pH=,pOH=,pH+pOH=14 4.盐类水解 一元强碱弱酸盐的水解-> 一元强酸弱碱盐的水解-> 一元弱酸弱碱盐的水解-> 多元弱酸强碱盐的水解->只考虑一级水解 影响盐类水解的因素 5.缓冲溶液 缓冲溶液的原理 缓冲溶液酸度计算公式-> 6.酸碱理论 酸碱的质子论 酸碱的电子论 共轭酸碱 7.沉淀的生成和溶解 溶度积常数的定义和计算 如何判断沉淀是否生成,Qi 和的关系对沉淀的影响及相关计算 氧化还原反应 1.氧化数 氧化数的定义 2.氧化还原反应方程式的配平 3.原电池 原电池的组成与符号表示法 标准电极电势 标准电极电势的应用 4.能斯特方程 电极电位的能斯特方程表示法 溶液浓度对电极电位的影响(能够进行相关计算) 5.吉布斯自由能与电动势的关系 ,能够进行相关计算 6.电极电动势的应用 电极电动势的计算
A.HgCl2; B.FeCl3; C.FeCl2; D.ZnCl2
下列分子和离子中,键 C.NO; -
下列分子和离子中,具有顺磁性的是
A.NO+; B.[Fe(CN)6]4-; C.B2; D.CO
下列物质中,还原性最强的是
A.HF; B.PH3; C.NH3; D.H2S 同物质的量浓度的下列离子在酸性介质中,氧化性最强的是 A.SO42-; B.ClO-; C.ClO4-; D.H3IO62硫酸亚硝酸根五氨合钴(III)的化学式是_______ (NH4)3[CrCl(SCN)4]的学名是____________; 自然界中硬度最大的单质是_______________;熔点最高的金属元素是____________. (综合题)通过杂化轨道理论说明 SiCl4、PCl3、OF2 的分子几何构型并解释其中键角的变化。 (综合题)将无色硝酸盐 A 加入水中,生成白色沉淀 B 和澄清溶液 C。向 C 中通入 H2S 生成黑色沉淀 D, D 不溶于 NaOH 溶液,但可以溶于盐酸。向 C 中滴加 NaOH 溶液生成白色沉淀 E,E 不溶于过量 NaOH 溶液, 试写出 A、B、C、D、E 的化学式。 (综合题)现代价键理论和分子轨道理论在讨论共价分子成键时,最主要的区别是什么?分析氧气具 有顺磁性时哪种理论更合理? (综合题)CHCl3 在 40 摄氏度的蒸汽压为 49.3kPa,在此温度下 98.6kPa 压力下,4 升空气(综合题) 通过 CHCl3,求(1)空气和 CHCl3 混合气体的体积是多少?(2)被空气带走的 CHCl3 质量是多少? (综合题)在 250ml 容器中装入未知气体 101.3kPa,此气体的质量为 0.164 克,试验温度为 25 摄氏 度,求该气体的相对分子质量。 (综合题)450 克水蒸气在 101.3kPa 和 100 摄氏度下凝结成水,已知水的蒸发热为 2.26kJg-1,计算 此过程的 W、△H 和△U。 (简答题)下列说法是否正确,为什么?(1)放热反应都能自发进行;(2)熵值变大的反应都能自 发进行;(3)的反应都能自发进行;(4)稳定单质规定它的;(5)生成物的分子数比反应物多,该反应 的 (综合题)对于反应 4HBr(g)+O2(g)->2H2O(g)+2Br2(g),(1)在一定温度下测 HBr 起始浓度为 0.0100M, 10s 后 HBr 的浓度为 0.0082M,计算反应在 10s 内的平均速率;(2)如果上述数据是 O2 的浓度,则该反应 的平均速率又是多少? (综合题)301K 时牛奶变酸需要 4h,但是在 278K 的冰箱中则需要 48h,嘉定反应速率与便算时间成 反比,试计算牛奶变酸的活化能。 (综合题)PCl5 加热后,分解反应式为 PCl5(g)=PCl3(g)+Cl2(g),在 10L 密闭容器中装有 2mol PCl5, 某温度时有 1.5mol PCl5 分解,求该温度下的 KΘ。若在该密闭容器中通入 1mol Cl2,PCl5 的分解百分数 为多少? (综合题)酯化反应 C2H5OH(l)+CH3COOH(l)=CH3COOC2H5(l)+H2O(l)可近似看做理想溶液反应。在 298K 时,若将 2mol C2H5OH 与 2mol CH3COOH 混合,平衡时各种物质有 2/3 变为生成物。今将 138 克 C2H5OH 与 120 克 CH3COOH 在 298K 混合,求平衡混合物中有多少 CH3COOC2H5 生成? (简答题)下列说法是否正确,为什么?(1)凡是盐都是强电解质;(2)BaSO4,AgCl 难容于水, 水溶液导电不显著,故为弱电解质;(3)解离作用是先通电,然后解离,溶液就能导电了;(4)氨水稀 释一倍,溶液中的 c(OH-)就减少为原来的一半;(5)HCl 溶液的浓度为 HAc 溶液浓度的一倍,则前者的 c(H+)也是后者的一倍。 (综合题)要配置 250mL,pH 值等于 5 的缓冲溶液,需要在 125mL 1M 的 NaAc 溶液中加多少 6M 的 HAc 和水? (简答题)用质子论判断下列物质那些是酸,哪些是碱,哪些即使酸又是碱? (1)[Al(H2O)6]3+;(2)HS-;(3)CO32-;(4)H2PO4-;(5)NH3;(6)HSO4-;(7)NO3-;(8)HCl;(9)Ac-;(10)OH-;(11) H2O (综合题)0.01M 的 BaCl2 溶液 5mL,稀释到 1000mL,加入 0.01M 的 K2SO4 溶液 0.5mL,有无沉淀析出? (简答题)配平下列化学反应方程式:
利用电极电动势判断氧化还原反应的方向 标准电极电动势和平衡常数 原子结构 1.氢光谱与玻尔理论 氢光谱通式-> 玻尔理论的基本假设 自发跃迁的辐射频率 2.波粒二象性 3.测不准原理 4.薛定谔方程 薛定谔方程的物理意义 波函数的物理意义 5.量子数 主量子数 角量子数 磁量子数 自旋量子数 6.波函数与电子云图形 电子云角度分布图 电子云径向分布图 7.原子核外电子排布 电子排布三规则:保利不相容原理、能量最低原理、洪特规则; 8.原子结构与元素周期律 原子结构与元素性质间的关系 电离能(概念) 电子亲合能(概念) 共价键与分子间力 1.现代价键理论 2.共价键的特性 饱和性、方向性、共价键的类型 3.杂化轨道理论 杂化、杂化轨道的概念; 杂化轨道的特性; 杂化轨道的类型 4.分子轨道理论 分子轨道理论的基本要点; 原子轨道组合成分子轨道的三条原则; 能级图; 分子轨道理论的简单应用 5.分子的极性和分子间作用力 分子间作用力->范德华力(静电力、诱导力、色散力) 范德华力的特点 6.氢键
暨南大学 2017 年硕士《基础化学》考试大纲
基础化学考试涵盖化学热力学、化学动力学、原子结构、胶体和溶液及滴定分析等几个方面的内容。
要求考生比较系统的掌握基础化学上述方面的概念、基本原理和方法,能够运用所学的基本原理和基本方
法分析、判断和解决有关理论和实际问题。
II 考试形式和试卷结构
1.试卷满分及考试时间
