高中化学竞赛配位化合物练习
高中化学竞赛配位化合物

高中化学竞赛专题练习配位化合物1、画出下列配合物可能有的旋光异构体的结构。
(1)[FeCl2(C2O4)en] ;(2) [Co(C2O4)3]3-;(3)[Co(en)2Cl2]+。
2、一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、cis-PtCl2(en)等。
实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。
3、已知下列配合物的磁矩,根据价键理论指出各中心离子的价层电子排布、轨道杂化类型、配离子空间构型,并指出配合物属内轨型还是外轨型。
(1) Mn(CN)63-(μ=2.8 B.M); (2) Co(H2O)62+(μ=3.88 B.M);4、实验测得配离子Co(NH3)63+是反磁性的,问它属于什么几何构型?根据价键理论判断中心离子采取什么杂化状态?5、通过计算说明,在标准状况下金难溶于水,但用氰化钠溶液却可以浸取金矿砂中的金。
已知E°(Au+/Au)=1.69V,E°(O2/OH-)=0.401V,K稳°[Au(CN)2-]=2×10386、已知E°(Fe3+/Fe2+)=0.771V,E°(I2/I-)=0.535V,在标准状况下Fe3+可以将I-氧化为单质I2。
通过计算说明在标准状况下,下列反应能否自发进行?2Fe(CN)63-+2I-=Fe(CN)64-+I2已知K稳°(Fe(CN)63-)=1.0×1042,K稳°(Fe(CN)64-)=1.0×1035。
7、已知E°(Fe3+/Fe2+)=0.771V,E°(Sn4+/Sn2+)=0.14V,K稳°(FeF3)=1.15×1012。
通过计算说明,下列氧化还原反应在标准状态下能否发生。
化学竞赛题库配位化合物答案

ONOOH , ONOOH
NO2 + OH
x=x=1 2 1 3
4x + (+1) ´ 7 + ( -2) ´ 3 = -1 3y + ( -1) ´ 3 + ( +1) ´ 4 = 0
β-PdCl2
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
2.该反应的分步反应方程式为 (1) PdCl2 + 2Cl PdCl42PdCl42- + CH2=CH2 [Pd(C2H4)Cl3] + Cl
-
[Pd(C2H4)Cl3] + H2O [Pd(C2H4)(H2O)Cl2] + Cl ………… 总反应方程式为 PdCl2 + C2H4 + H2O (2) Pd2+采取 dsp2 杂化 (3) C2H4 与 Pd2+之间存在 σ 配键与反馈 π 键 Pd + CH3C
-
O H
+ 2HCl
+ +
2
五、1.∵配合物(C)为单核、电中性分子,其分子量为 含 H 原子个数为:
462.85 ´ 0.0523 = 24 (个) 1.008
M Mn 54.69 = = 462.85 0.1187 0.1187
形成(C)的配体是由 2 分子(A)与 1 分子(B)失去 2 分子水后形成的:
CHO
H2N
H H H B C O (A)
H Na
+
H H
B C
O O
Na+ (B)
CH3 O H3C B B O O B CH3 (C) H3C O B
高中化学 竞赛讲义 配位化合物高中全册化学试题

促敦市安顿阳光实验学校配位化合物1. 熟悉配位化合物的基本概念、组成和命名;2. 熟悉配位化合物的价键理论,会进行一般配离子结构判断和磁性计算;理解晶体场理论的要点,弄清八面体场、四面体场面四边形场中 d轨道的分裂;理解分裂能和晶体场稳化能概念;4. 了解配位化合物顺反异构和旋光异构概念,初步上述两种异构体的判断;5. 熟悉配位实体热力学稳性中的有关概念。
7.1维尔纳学说的要点:●大多数化学元素表现出两种类的化合价,即主价和副价;●元素形成配合物时倾向于主价和副价都能得到满足;●元素的副价指向空间确的方向。
一.配位实体和络合物需要强调配位实体所带的电荷时,也可将其叫作络离子(Complex ion)。
这就是说,“络合物”和“络离子”都是“配位实体”的同义。
二.配位化合物配位化合物(Coordination compound) 指包含配位实体在内的整个化合物。
中心离子或原子:正离子(多)金属元素(多)中性原子(少)非金属元素(少)三.配位体和配位原子与中心原子结合的分子或离子(如例中的NH3分子、CO分子和CN-离子)叫做配位体(Ligand), 配位体中与中心原子直接键合的原子叫配位原子(如配位体NH3中的N原子,配位体CN-和CO中C原子)。
配位体又因含有的配位原子数目不同分为单齿配位体 (Monodentate ligand) 和多齿配位体 (Polydentate ligand) 。
四.配位数与中心离子(或原子)成键的配位原子的总数五.螯合物和金属大环配合物螯合物(Chelate)是多齿配位体以2个或2个以上配位原子配位于金属原子而形成的一种环状络合物 (环中包含了金属原子)。
能用作多齿配体的试剂叫螯合剂(Chelating agent)。
六.化学式的书写和配合物的命名命名原则:按照无机专业会制的规则命名;●含络离子的配合物:阴离子名称在前,阳离子名称在后,阴、阳离子名称之间加“化”字或“酸”字。
高中化学竞赛试题配位化学

⾼中化学竞赛试题配位化学中学化学竞赛试题资源库——配位化学A组1.NO的⾎管舒张作⽤是由于它和⼀种含⾎红素的酶中的铁离⼦配位⽽推动⼀系列变化造成的。
已知配位的NO是CO的等电⼦体,下列物种中可与铁配位的是A NOB NO+C NO-D N2O22.共价键和配位共价键的区别是什么?在NH4+离⼦中分别有多少个共价键和配位共价键?如何对其进⾏区分?3.⼋⾯体共有⼏个⾯?⼏个⾓?具有⼋⾯体配位结构的中⼼离⼦的配位数是多少?4.在⽆限稀的溶液中CoBr3·4NH3·2H2O的摩尔电导率为420cm-1·Ω-1,由此推导此配位化合物的组成。
5.求下列配位化合物的中⼼原⼦的配位数分别是多少?①[Mo(CN)8]4-中的铜;②Cu(en)22-中的铜(en为⼄⼆胺)6.配平⽅程式:AgCl(s)+NH3→7.把下列各物质按摩尔电导率递增的顺序排列:①K[Co(NH3)2(NO)4];②[Cr(NH3)3(NO2)3];③[Cr(NH3)5(NO2)]3[Co(NO2)6]2;④Mg[Co(NH3)(NO)5]8.指出下列各⾦属中⼼离⼦的特征配位数:①CuⅠ;②CuⅡ;③CoⅢ;④AlⅢ;⑤ZnⅡ;⑥FeⅡ;⑦FeⅢ;⑧AgⅠ。
9.指出下列各配位离⼦中⾦属中⼼离⼦的氧化数:①[Cu(NH3)4]2+;②[CuBr4]2-;③[Cu(CN)2]-;④[Cr(NH3)4CO3]+;⑤[PtCl4]2-;⑥[Co(NH3)2(NO2)4]-;⑦Fe(CO)5;⑧[ZnCl4]2-;⑨[Co(en)]3-。
310.标明下列各配位离⼦的电荷数:①[FeⅢ(CN)6];②[PtⅣ(NH3)3(H2O)Cl2];③[CrⅢ(NH3)2(H2O)2Cl2];④[PdⅡ(en)Cl2];⑤[Al(H2O)2(OH)4]。
11.试确定下列化学式中圆括号或⽅括号内配合物离⼦的电荷数?(1)Na2(MnO4) (2)H4[Fe(CN6)] (3)NaCd2(P3O10) (4)Na2(B4O7)(5)Ca3(CoF6)2(6)Mg3(BO3)2(7)(UO2)Cl2(8)(SbO)2SO412.试判断下列化学式中括号内基团的电荷数:(1)Ca(C2O4) (2)Ca(C7H5O3)2·2H2O (3)Mg3(AsO3)2(4)(MoO)Cl3(5)(CrO2)F2(6)(PuO2)Br (7)(PaO)2S3?13.指出下列各配位离⼦中⾦属中⼼离⼦的氧化数:①[Co(NH3)6]3+;②Ni(CO)4;③[CuCl4]2-;④[Ag(CN)2]-;⑤[Co(NH3)4(NO2)2]+。
全国高中生化学竞赛试题3 配位化合物(答案)
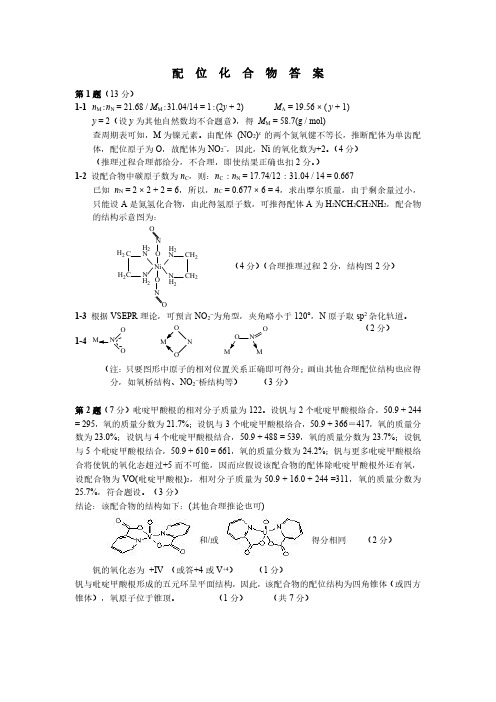
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
高中化学奥林匹克竞赛专题练习:络合物(配位化合物)化学基础
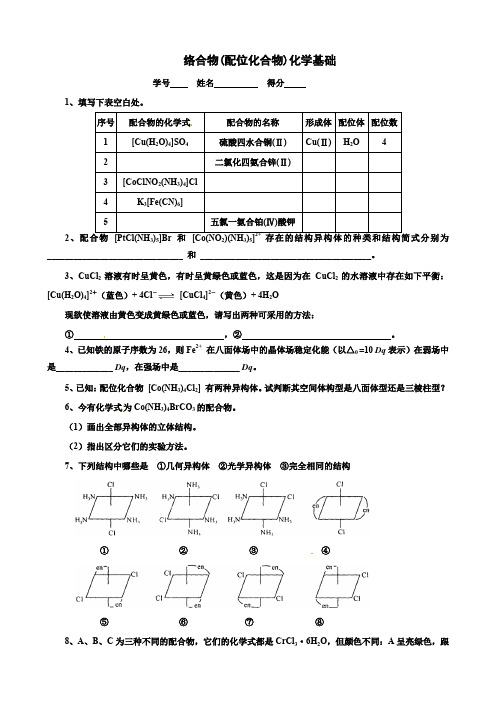
络合物(配位化合物)化学基础学号姓名得分1、填写下表空白处。
235235_______________________________ 和_______________________________________。
3、CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H 2O)4]2+(蓝色)+ 4Cl-[CuCl4]2-(黄色)+ 4H2O现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:①,②。
4、已知铁的原子序数为26,则Fe2+在八面体场中的晶体场稳定化能(以△0 =10 Dq表示)在弱场中是_____________ Dq,在强场中是______________ Dq。
5、已知:配位化合物[Co(NH3)4Cl2] 有两种异构体。
试判断其空间体构型是八面体型还是三棱柱型?6、今有化学式为Co(NH3)4BrCO3的配合物。
(1)画出全部异构体的立体结构。
(2)指出区分它们的实验方法。
7、下列结构中哪些是①几何异构体②光学异构体③完全相同的结构①②③④⑤⑥⑦⑧8、A、B、C为三种不同的配合物,它们的化学式都是CrCl3·6H2O,但颜色不同:A呈亮绿色,跟AgNO3溶液反应,有2/3的氯元素沉淀析出;B呈暗绿色,能沉淀1/3的氯;而C呈紫色,可沉淀出全部氯元素。
则它们的结构简式分别为:A ,B ,C 。
这三种配离子的空间构型为面体,其中某配离子中的2个Cl可能有两种排列方式,称为顺式和反式。
它们的结构图分别为:______ _和。
9、根据下列配离子的磁矩推断中心离子的杂化轨道类型和配离子的空间构型。
[Co(H2O)6]2+[Mn(CN)6]4-[Ni (NH3)6]2+/B.M. 4.3 1.8 3.110、画出[CoCl2(NH3)2(H2O)2]+配离子的几何异构体。
11、把(NH4)2CO3浓溶液逐滴滴AgNO3稀溶液中,开始时出现浑浊,其后逐渐成为无色透明溶液。
全国高中生化学竞赛试题3 配位化合物

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
安徽高中化学竞赛结构化学第六章配位化合物的结构和性质习题

安徽高中化学竞赛结构化学第六章配位化合物的结构和性质习题1、以下配合物最动摇的是( d ):A、[Co〔NH3〕6]3+B、[Co〔H2O〕6]3+C、[Ti〔H2O〕6] +D、[Co〔CN〕6]3-2、红外光谱由分子外部〔 d 〕能量跃迁惹起。
A、转动B、电子-振动C、振动D、振动-转动3、Ni与CO可构成羰基配合物Ni(CO)n,其中n为〔 c 〕:A、6B、3C、4D、54、以下络离子几何构型偏离正八面体最大的是〔 a 〕:A、[Cu(H2O)6]2+B、[Co(H2O)6]2+C、[Fe(CN)6]3-D、[Ni(CN)6]45、以下配合物高自旋的是〔 b 〕:A、[Co(NH3)6]3+B、[Co(NH3)6]2+C、[Co(NO2)6]3-D、[Co(CN)6]4-6、在羰基配合物中,配体CO的C—0键键长比自在CO的键长〔b 〕〔A〕变短了〔B〕变长了〔C〕没变化〔D〕无结论7、以下哪个络合物的磁矩最大?------------------------------ ( d )(A) 六氰合钴(Ⅲ)离子(B) 六氰合铁(Ⅲ)离子(C) 六氨合钴(Ⅲ)离子(D) 六水合锰(Ⅱ)离子8、CO的3σ(HOMO)较大一端在C端。
在金属羰基配合物M(CO)n中,与M配位的是. ( B )A.CO 的O端B.CO 的C端C.CO 的恣意一端二简答题1.导出B4H10能够的styx数, 并写出对应的结构图.答案 1. B4H10能够的styx数(4012), (3103)2.依据式(6-11)求出B5H11, B6H10能够的异构体数目.2. B5H11: (5021), (4112), (3203)B6H10: (4220), (3311), (2402)3.金属团簇M5(M=Li, Na, K)有21种异构体, 试画出它们的拓扑结构.3. 线型, 折线型(5种), W型, V型, T型, Y型,´型, 方形带心, 梯形, 五边形, 四棱锥, 三角形带叉(2种), 菱形带把(2种), 三角双锥, 四面体含心4.计算以下各团簇的价电子数, 并预测它们的几何构型:Sn44-, Sn3Bi2, Sn3Bi3+, Sn5Bi44. Sn44- 20e , Sn3Bi2 22e 三角双锥,Sn3Bi3+ 26e 八面体,Sn5Bi4 40e 带帽四方反棱柱5.关于电子组态位d4的八面体过渡金属离子配合物,试计算:⑴区分处在高、低自旋基态时的能量;⑵当高、低自旋构型具有相反能量时,电子成对能P和晶体场分裂能10Dq的关系。
(完整word版)高中化学竞赛配位化合物练习

配合物选择题:1、(NH4)3[CrCl2(SCN)4]的名称是()A.二氯四硫氰酸根合铬(Ⅲ)酸铵B.四硫氰酸根二氯合铬(Ⅲ)酸铵C.四异硫氰酸根二氯合铬(Ⅲ)酸铵D. 二氯四异硫氰酸根合铬(Ⅲ)酸铵2、Ni(CO)4,Ni(CN)42-,Ni(NH3)62+的空间构型分别为()A.正四面体,正四面体,正八面体B.平面正方形,平面正方形,正八面体C.正四面体,平面正方形,正八面体D.平面正方形,变形八面体,正八面体3、某金属离子在八面体弱场中的磁矩为4.90B.M,而在八面体强场中的磁矩为0,该离子是( )A.Cr3+B. Mn2+C. Fe2+D. Co2+E. Ni2+F. Fe3+4、在配位数为4的Co2+四面体配合物与平面方形配合物(低自旋)中,未成对电子数分别为()A.2与0B.2与1C.3与0D.3与15、根据有效原子序数规则(EAN),下列配合物化学式正确的是()A.Fe(CO)3B. Fe(CO)4C. Fe(CO)5D. Fe(CO)66、在H x Co(CO)4中,x值应为()A.1B.2C.3D.47、已知M为配合物的中心原子,A、B、C为配体,在具有下列化学式的配合物中,哪一个有两种异构体()A.MA5CB.MA6C.MA2B2C2D.MA2BC(平面方形)8.根据十八电子规则,[(CO)3Ni-Co(CO)3]Z中Z值为A +B 3+C 3-D 09、在下列配离子中,存在几何异构体的是()A.[Cr(NH4)5Cl]2+B.[Pt(py)BrClNH3]C.[Cr(en)Cl4]-D.Cr(en)33+10、下列配离子中,属于反磁性的是()A.Co(CN)63—B.Cu(NH3)42+C.Fe(CN)63—D.Mn(CN)64—11、下列配合物中,除存在几何异构体外,还存在旋光异构体的是()A.[Pt(NH3)2Cl2]B.[Co(NH3)4Cl2]ClC.[Co(en)2Cl2]ClD.[PtNH3ClBr(py)]12、按照18电子规则,下列各配合物中应当以双聚体存在的是()A.Mn(CO)4NOB.Fe(CO)5C.Cr(CO)6D.Co(CO)413、两种配合物[PtBr(NH3)3]NO2和[PtNO2(NH3)3] Br互为( )A.键合异构B.配位异构C.电离异构D.聚合异构14.已知[Fe(C2O4)3]3-的磁矩大于5.75B.M;其空间构型及中心离子的杂化轨道类型是()。
高中化学,大学自主配位化学专题训练高中化学竞赛,大学化学自招,配位化学专题训练

配位化学专题训练1.关于配合物[TiCl(H2O)5]Cl2·H2O的下列说法正确的是(C)A.配体是Cl-和H2O,配位数是9B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.作为配体的Cl-与非配体Cl-的数目之比是1∶2D.与AgNO3溶液作用,所有Cl-均易转化为沉淀解:A、配位体是内界的1个Cl-和5个H2O ,配位数是6,故A错误;B、配离子是[TiCl(H2O)5]2+,根据电荷守恒可知中心离子是Ti3+,故B错误;C、根据已知配合物的化学式,[TiCl(H2O)5]2+中(内界)的Cl-数目为1,剩余部分含有的Cl-数目为2,则内界和外界中的Cl-的数目比是1:2,,故C正确;D、作为配体的Cl-难以电离出来与Ag+发生反应,故D错误;综上所述,本题应选C。
2.下列关于配合物的说法中不正确的是(B)A.许多过渡金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多B.配合物中中心离子与配体间、配离子与酸根离子间都是以配位键结合C.配离子中,中心离子提供空轨道,配体提供孤电子对D.中心离子所结合配体的个数称为配位数,不同离子的配位数可能不同【答案】B【解析】【详解】A. 许多过渡元素金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属的配合物多,A项正确;B. 配合物中中心离子与配体间是以配位键结合,配离子与酸根离子间是以离子键结合,B项错误;C. 配合物中中心离子提供空轨道,配体提供孤电子对,C项正确;D. 配位数指形成配离子时配体的个数,不同离子的配位数可能相同也可能不同,D项正确;答案选B。
3.关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是(B)A.配体为水分子,外界为Br-B.中心原子采取sp3杂化C.中心离子的配位数为6D.中心离子的化合价为+2价解:4个H2O分子和2个Br-是配体,配位数为6,1个Br-是外界。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物选择题:1、(NH4)3[CrCl2(SCN)4]的名称是()A.二氯四硫氰酸根合铬(Ⅲ)酸铵B.四硫氰酸根二氯合铬(Ⅲ)酸铵C.四异硫氰酸根二氯合铬(Ⅲ)酸铵D. 二氯四异硫氰酸根合铬(Ⅲ)酸铵2、Ni(CO)4,Ni(CN)42-,Ni(NH3)62+的空间构型分别为()A.正四面体,正四面体,正八面体B.平面正方形,平面正方形,正八面体C.正四面体,平面正方形,正八面体D.平面正方形,变形八面体,正八面体3、某金属离子在八面体弱场中的磁矩为4.90B.M,而在八面体强场中的磁矩为0,该离子是( )A.Cr3+B. Mn2+C. Fe2+D. Co2+E. Ni2+F. Fe3+4、在配位数为4的Co2+四面体配合物与平面方形配合物(低自旋)中,未成对电子数分别为()A.2与0B.2与1C.3与0D.3与15、根据有效原子序数规则(EAN),下列配合物化学式正确的是()A.Fe(CO)3B. Fe(CO)4C. Fe(CO)5D. Fe(CO)66、在H x Co(CO)4中,x值应为()A.1B.2C.3D.47、已知M为配合物的中心原子,A、B、C为配体,在具有下列化学式的配合物中,哪一个有两种异构体()A.MA5CB.MA6C.MA2B2C2D.MA2BC(平面方形)8.根据十八电子规则,[(CO)3Ni-Co(CO)3]Z中Z值为A +B 3+C 3-D 09、在下列配离子中,存在几何异构体的是()A.[Cr(NH4)5Cl]2+B.[Pt(py)BrClNH3]C.[Cr(en)Cl4]-D.Cr(en)33+10、下列配离子中,属于反磁性的是()A.Co(CN)63—B.Cu(NH3)42+C.Fe(CN)63—D.Mn(CN)64—11、下列配合物中,除存在几何异构体外,还存在旋光异构体的是()A.[Pt(NH3)2Cl2]B.[Co(NH3)4Cl2]ClC.[Co(en)2Cl2]ClD.[PtNH3ClBr(py)]12、按照18电子规则,下列各配合物中应当以双聚体存在的是()A.Mn(CO)4NOB.Fe(CO)5C.Cr(CO)6D.Co(CO)413、两种配合物[PtBr(NH3)3]NO2和[PtNO2(NH3)3] Br互为( )A.键合异构B.配位异构C.电离异构D.聚合异构14.已知[Fe(C2O4)3]3-的磁矩大于5.75B.M;其空间构型及中心离子的杂化轨道类型是()。
(A)八面体形,sp 3d2;(B)八面体形,d2sp3;(C)三角形,sp2;(D)三角锥形,sp3。
15.下列配离子的中心离子采用sp杂化呈直线形的是()。
(A)[Cu(en)2]2+;(B)[Ag(CN)2]-;(C)[Zn(NH3)4]2+;(D)[Hg(CN)4]2-。
16.下列配离子的形成体采用sp杂化轨道与配体成键且μ=0B.M.的是.()。
(A)[Cu(en)2]2+;(B)[CuCl2]-;(C)[AuCl4]-;(D)[BeCl4]2-。
17.已知[Co(NH3)6]3+的磁矩μ=0B.M.,则下列关于该配合物的杂化方式及空间构型的叙述中正确的是()。
(A)sp 3d2杂化,正八面体;(B)d2sp3杂化,正八面体;(C)sp3d2,三方棱柱;(D)d2sp2,四方锥。
18.下列配离子中具有平面正方形空间构型的是.()。
(A)[Ni(NH3)4]2+,μ=3.2B.M.; (B)[CuCl4]2-,μ=2.0B.M.;(C)[Zn(NH3)4]2+,μ=0B.M.;(D)[Ni(CN)4]2-,μ=0B.M.。
19.实验测得配离子[MX4]2-的磁矩小于简单离子M2+的磁矩,则下列关于[MX4]2-的中心离子轨道杂化类型和配离子空间构型的叙述中正确的是.()。
(A)sp 3,正四面体形;(B)dsp2,正四面体形;(C)sp3,平面正方形;(D)dsp2,平面正方形。
20.下列各组配离子中,都是外轨型配合物的是()。
(A)[Fe(H2O)6]2+、[Fe(CN)6]4-;(B)[FeF6]3-、[Fe(CN)6]3-;(C)[FeF 6]3-、[CoF 6]3-;(D)[Co(CN)6]3-、[Co(NH 3)6]3+。
21.下列两组离子,每组有两种配离子:(a)组:[Zn(NH 3)4]2+与[Zn(CN)4]2-;(b)组:[Fe(C 2O 4)3]3-与[Al(C 2O 4)3]3-; 它们的稳定性应该是()。
(A)(a)组前小后大,(b)组前大后小; (B)(a)组前大后小,(b)组前小后大; (C)(a)、(b)两组都是前小后大; (D)(a)、(b)两组都是前大后小。
22.某金属离子所形成的八面体配合物,磁矩为μ=4.9B.M.或0B.M.,则该金属最可能是下列中的.( )。
(A)Cr3+;(B)Mn 2+;(C)Fe 2+;(D)Co 2+。
23.测得某金属离子所形成的配合物磁矩,有5.9B.M.,也有1.7B.M.。
则该金属离子最可能是下列中的.( )。
(A)Cr3+;(B)Fe 3+;(C)Fe 2+;(D)Co 2+。
24.已知[CoF 6]3-与Co 3+有相同的磁矩,则配离子的中心离子杂化轨道类型及空间构型为( )。
(A)d 2sp 3,正八面体;(B)sp 3d 2,正八面体; (C)sp 3d 2,正四面体;(D)d 2sp 3,正四面体。
25.配离子[HgCl 4]2-的空间构型和中心离子的杂化轨道类型是.( )。
(A)平面正方形,dsp 2;(B)正四面体,sp 3; (C)正四面体,dsp 2;(D)平面正方形,sp 3。
26.已知[Ni(CN)4]2-的μ=0B.M.,则此配离子的空间构型和中心离子的杂化轨道为( )。
(A)正四面体形,sp 3;(B)正四面体形,dsp 2; (C)平面正方形,sp 3;(D)平面正方形,dsp 2。
27.下列离子中,在形成四配位的配离子时,必定具有四面体空间构型的是.( )。
(A)Ni2+; (B)Zn 2+; (C)Co 2+; (D)Co 3+。
28.[Mn(CN)6]4-是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是.( )。
(A)1,sp 3d 2;(B)0,sp 3d 2;(C)0,d 2sp 3;(D)1,d 2sp 3。
29.已知[Ni(NH 3)4]2+的磁矩为2.8B.M.,则中心离子的杂化轨道类型和配合物空间构型为( )。
(A)d sp 2,平面正方形;(B)dsp 2,正四面体形; (C)sp 3,正四面体形;(D)sp 3,平面正方形。
30.某配离子[M(CN)4]2-的中心离子M 2+以(n -1)d 、ns 、np 轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将.()。
(A)增大,较弱;(B)减小,较弱; (C)增大,较强;(D)减小,较强。
31.[Fe(CN)6]4-是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是.( )。
(A)4,sp 3d 2;(B)4,d 2sp 3;(C)0,sp 3d 2;(D)0,d 2sp 3。
32.[Co(NH 3)6]3+是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是.()。
(A)4,sp 3d 2;(B)0,sp 3d 2;(C)4,d 2sp 3;(D)0,d 2sp 3。
33.[Fe(H 2O)6]2+是外轨型配合物,则中心离子未成对电子数和杂化轨道类型是.()。
(A)4,d 2sp 3;(B)0,d 2sp 3;(C)4,sp 3d 2;(D)0,sp 3d 2。
34.下列物质中不能作为配合物的配体的是()。
(A)NH 3;(B)NH 4+;(C)CH 3NH 2;(D)C 2H 4(NH 2)2。
35.配合物的磁矩主要取决于形成体的()。
(A)原子序数;(B)电荷数;(C)成单电子数;(D)成对电子数。
36.下列关于用价键理论说明配合物结构的叙述中,错误的是.( )。
(A)并非所有形成体都能形成内轨型配合物; (B)以CN -为配体的配合物都是内轨型配合物; (C)中心离子(或原子)用于形成配位键的轨道是杂化轨道; (D)配位原子必须具有孤对电子。
37.价键理论认为,决定配合物空间构型主要是.()。
(A)配体对中心离子的影响与作用;(B)中心离子对配体的影响与作用;(C)中心离子(或原子)的原子轨道杂化;(D)配体中配位原子对中心原子的作用。
38.配位化合物形成时中心离子(或原子)轨道杂化成键,与简单二元化合物形成时中心原子轨道杂化成键的主要不同之处是:配位化合物形成时中心原子的轨道杂化( )。
(A)一定要有d 轨道参与杂化;(B)一定要激发成对电子成单后杂化; (C)一定要有空轨道参与杂化;(D)一定要未成对电子偶合后让出空轨道杂化。
39.下列配体中,与过渡金属离子只能形成高自旋八面体配合物的是.( )。
(A)F -;(B)NH 3;(C)CN -;(D)CO 。
40.下列配体中,与过渡金属离子只能形成低自旋八面体配合物的是.( )。
(A)F -;(B)I -;(C)H 2O ;(D)CN -。
41.具有d 5电子构型的过渡金属离子形成八面体配合物时,在弱场和强场配体作用下,晶体场稳定化能应( )。
(A)都是0D q ;(B)分别为0D q 和-20D q +2P ; (C)均为-20D q ;(D)分别为-20D q 和0D q 。
42.已知在配离子[Cr(H 2O)6]2+中,中心离子d 轨道上有4个成单电子,则下列叙述中正确的是()。
(A)[Cr(H 2O)6]2+是高自旋配合物; (B)中心离子d 轨道的分裂能大于电子成对能;(C)H 2O 是强场配体; (D)4个成单电子都排布在d (t 2g )轨道上。
43.根据晶体场理论,下列叙述中错误的是.()。
(A)强场配体造成的分裂能较小; (B)中心离子的d 轨道在配体场作用下才发生分裂;(C)配离子的颜色与d 电子跃迁吸收一定波长的可见光有关; (D)通常在弱场配体作用下,易形成高自旋配合物。
44.对于八面体配合物,下列叙述中正确的是.( )。
(A)磁矩为零时,其配体都是弱场配体; (B)磁矩为5.9B.M.,其配体都是弱场配体; (C)磁矩越大,晶体场稳定化能越大;(D)磁矩越大,晶体场稳定化能越小。
45.下列配体与相同中心离子形成八面体配合物,其中造成分裂能最小的是()。
(A)F -;(B)Cl -;(C)I -;(D)H 2O 。
非选择题: 1.填写下表空白处。
序号 配合物的化学式 配合物的名称 形成体 配位体 配位数 1 [Cu(H 2O)4]SO 4硫酸四水合铜(Ⅱ) Cu(Ⅱ) H 2O 4 2二氯化四氨合锌(Ⅱ)3[CoClNO 2(NH 3)4]Cl4 K 3[Fe(CN)6]5五氯一氨合铂(Ⅳ)酸钾2.配合物 [PtCl(NH 3)5]Br 和 [Co(NO 2)(NH 3)5]2+ 存在的结构异构体的种类和结构简式分别为_______________________________ 和 _______________________________________。
