吸收(基本概念)
《化工原理吸收》课件

03 常用的模拟方法包括物理模型模拟、数学模型模 拟和实验模拟等。
吸收过程的优化策略
01
吸收过程的优化策略是通过调整操作条件和设备参数
来提高吸收效果的方法。
02
优化策略通常包括选择合适的吸收剂、优化操作条件
、改进设备结构和操作参数等。
增加流速可以提高溶质的 传递速率,但同时会增加 设备的投资和能耗。
04
吸收设备与流程
吸收设备的类型与特点
填料塔
结构简单,易于制造, 适用于气体流量较小、 溶液组成较低的情况。
板式塔
传质效率高,处理能力 大,适用于气体流量较 大、溶液组成较高的情
况。
喷射器
结构简单,操作方便, 适用于气体流量较小、 溶液组成较低的情况。
THANK YOU
感谢各位观看
溶解度与相平衡的关系
物质在气液两相中的溶解度差异是吸收过程得以进行的驱动力。
亨利定律与相平衡
亨利定律:气体在液体中的溶解度与该气体在气液界 面上的分压成正比。
输标02入题
亨利定律的数学表达式:(Henry's Law):(c = kP)
01
03
亨利定律的应用:通过测量气体的溶解度和气液界面 上的分压,可以计算出亨利常数,进而了解物质在特
03
优化策略的目标是提高吸收效果、降低能耗和减少环
境污染等。
06
吸收的实际应用
工业废气的处理
工业废气处理
吸收法可用于处理工业生产过程中产生的废气,如硫氧化物 、氮氧化物等有害气体。通过吸收剂的吸收作用,将有害气 体转化为无害或低害物质,达到净化废气的目的。
消化系统学习顺序

消化系统学习顺序消化和吸收一、消化和吸收的基本概念消化:食物在消化道内被分解成可吸收的小分子物质的过程。
吸收:食物消化后的小分子物质通过消化道粘膜进入血液和淋巴液的过程。
消化的方式:机械消化和化学消化。
机械消化依赖消化道平滑肌的运动,化学消化依赖消化液中所含消化酶的作用。
消化液由各种消化腺分泌,主要成分是水、无机盐和有机物。
无机盐调节消化道的酸碱环境和渗透压、以便一些重要物质的消化和吸收。
有机物中最重要的是消化酶。
其次是粘液,粘液由空腔脏器分泌(所以胆汁和胰液中不含粘液) ,对消化道粘膜具有保护作用。
二、消化道平滑肌的特性1. 消化道平滑肌的一般特性:兴奋性较骨骼肌低、不规则的节律性、紧张性、伸展性、对刺激的特异敏感性即对牵张、温度和化学刺激敏感而对切割、电刺激等不敏感。
2. 消化平滑肌的电生理特性:(1) 静息电位主要由 K+外流的平衡电位形成,但 Na+、 Cl-、Ca2+等离子在安静时也有少量通透性,加之生电钠泵也发挥作用,故静息电位值较低且不稳定。
(2) 慢波电位又称基本电节律 ,是消化道平滑肌特有的电变化,是细胞自发性节律性去极化形成的。
慢波起源于纵行肌,它是局部电位, 不能直接引起平滑肌收缩, 但动作电位只能在慢波的基础上产生,因此慢波是平滑肌的起步电位,控制平滑肌收缩的节律。
消化道平滑肌慢波有如下特点:①慢波是静息电位基础上产生的缓慢的节律性去极化波; ②胃肠道不同部位慢波的频率不同; ③它的产生与细胞膜生电钠泵的周期活动有关; ④不能引起平滑肌收缩;⑤慢波的波幅通常在 10~15mV之间。
(3) 动作电位是慢波去极化到阈电位水平时产生的,动作电位引起平滑肌收缩。
参与平滑肌动作电位形成的离子主要是Ca2+和 K+。
慢波、动作电位和肌肉收缩的关系简要归纳为:平滑肌的收缩是继动作电位之后产生的, 而动作电位是在慢波去极化的基础上发生的。
三、胃肠激素1. 概念:在胃肠道的粘膜内存在有数十种内分泌细胞,它们分泌的激素统称为胃肠激素。
第一节 吸收概述(复习)Microsoft Word 文档(1)

第一节吸收概述(复习)【学习目标】1、理解吸收和解吸的基本概念,工业应用及分类2、了解亨利定律及有关计算3、了解传质的基本方式,理解双膜理论【学习过程】一、吸收概述1、吸收是利用混合物气体中各组分在同一液体中而实现分离的过程。
2、解吸与吸收操作相反,是指的操作。
3、吸收过程中涉及到的物质包含、、、和。
4、吸收过程中分类标准不同,分类也不同,常见的有以下四种分类方法:依据是否发生显著地化学反应可分为、;依据吸收前后温度是否发生变化可分为、;依据气相或液相中吸收质的含量可分为、;依据吸收的组分多少可分为、。
5、吸收在工业生产中的应用主要有:,,,。
二、吸收的相组成表示方法1、吸收的相组成表示方法通常有和。
2、质量比是指,表达式为气相;液相。
3、摩尔比是指,表达式为气相;液相。
4、质量比和摩尔比可以相互换算:已知质量比,则摩尔比的表达式为;已知摩尔比,则质量比的表达式为。
5、气体在溶液中溶解度通常是指,溶解度的表示方法通常质量表示法和体积表示法,质量表示法为,体积表示法为三、气液相平衡关系1、亨利定律是指。
2、亨利定律的表达式有和两种方法。
其中E值随着溶解度的增大而。
随着温度的上升而;H值随着溶解度的增大而,随着温度的上升而。
E和H的关系为。
3、吸收平衡线是指,表达式为,其中m是指,表达式为,m值随着溶解度的增大而,随着温度的升高而,随着总压的升高而。
4、一般溶液,吸收平衡线是,而对于稀溶液吸收平衡线是,其斜率是。
5、相平衡关系在吸收过程中的应用主要有、和。
四、吸收机理1、传质的基本方式含有和。
2、分子扩算是指,扩散速率主要取决于、和。
3、对流扩算是指,扩散速率主要取决于。
4、吸收操作中常用表示物质在介质中的扩散能力,其值随着、、、变化而变化。
5、双膜理论的要点是、、。
【基础练习】1、双膜理论认为传质阻力主要集中在()A、气膜中B、气液相界面上C、液膜中D、气液两个膜层中2、当X﹡>X时()A、发生吸收过程B、发生解吸过程C、吸收推动力为零D、解析推动力为零3、对气体吸收有利的操作条件是()A、低温、高压B、高温、高压C、低温、低压D、高温、低压4、氨水的摩尔分数为20%,而它的摩尔比为()A、15B、20C、25D、305、利用气体混合物各组分在液体中的溶解度的差异而使气体中不同组分分离的操作为()A、蒸馏B、萃取C、吸收D、解吸6、下述说法错误的是()A、溶解度系数H值越大,为易容气体B、亨利系数E值越大,为易容气体C、亨利系数E值越大,为难溶气体D、平衡常数m值越大,为难溶气体7、吸收操作的目的是分离()A、气体混合物B、液体均相混合物C、汽液混合物D、部分互溶的均相混合物8、温度(),将有利于解吸的进行A、降低B、升高C、变化D、不变9、Y为吸收质在气相主体中的浓度,Y﹡为吸收质在气相主体中与液相主体浓度X成平衡的气相浓度。
吸收的基本知识.

吸收过程的基本概念和基本知识
• 基本概念 • 吸收操作:利用气体混合物中各组分在该液体中溶解度的 差异,实现气相各组分的分离。 • 吸收质:气体中能溶于溶剂的组分称为用A表示; • 吸收尾气:吸收塔顶排出的气体,主成分为B以及残余溶 质A • 吸收液:吸收塔底引出的溶液称为吸收液,其成分为溶剂 S和溶质A • 惰性气体:基本上不溶于溶剂的组分统称。惰性气体可以 是一种或多种组分。用B表示
• ——逆流吸收塔操作线方程
在m—n截面与塔顶截面之间作组分A的衡 算
VY LX 2 VY2 LX
L L Y X (Y2 X 2 ) V V
——逆流吸收塔操作线方程
表示:塔内任一截面的气相浓度Y与液相浓度X之间成直线关系,直线的斜率为L/V。
逆流吸收操作线具有如下特点:
(1)稳定态,L、V、Y1、X2恒定,操作线在X~Y坐标上 为一直线,斜率为L/V 。 L/V为吸收操作的液气比; (2)操作线通过塔顶(稀端) A (X2,Y2)及塔底 • (浓端) B (X1, Y1); (3)操作线仅与液气比、浓端及稀端组成有关,与系统的平衡 关系、塔型及操作条件T、p无关。 (4)吸收操作线在平衡线的上方,解吸操作线在平 衡线OE下方。 (5)平衡线与操作线共同决定吸收推动力。操作线 离平衡线愈远吸收的推动力愈大;
吸收塔的物料衡算与操作线方程
物料衡算
• 目的:确定各物流之间的量的关系以及设备中任意位置两物料组成之
间的关系
对单位时间内进出吸收塔的A的物 质量作衡算
VY1 LX 2 VY2 LX 1
V (Y1 Y2 ) L( X1 X 2 )
L L Y1 X 1 Y2 X 2 V V
对于并流操作
第5章吸收-传质与分离过程的基本概念及吸收系数

少倍?
kYa V0.8
气体流量增加20%
8
z HOG NOG
V
HOG KY a
解: (1)回收率变为多少?
NOG
1 1 S
ln1
S Y1
Y2
Y2 Y2
S
原工况下: S m 1.18 0.56 L V 2.1
NOG
1 1 S
ln1
S 1
1
S
1
1 0.56
ln1
0.56
1
1 0.95
11
解:∵
Y1
y1 1 y1
0.05 1 0.05
0.0527
Y2
y2 1 y2
0.0263 1 0.0263
0.00264
X1
61.2 / 58 (1000 61.2)
/ 18
0.02023
X2 0
Y1* 2X1 2 0.02023 0.04046 Y2* 0
∴ ΔY1 Y1 Y1* 0.0527 0.04046 0.01224
解①水的用量:
100/ 32 y1 (11000) / 22.4 0.07
0.07 Y1 1 0.07 0.0753
Y2 Y1(1 ) 0.0753 (1 0.98) 0.00151 X 2 0
5
习题课
X1
0.67
X
* 1
0.67
0.0753 1.15
0.0439
1000
1000
学习目的 与要求
通过本章学习,应掌握吸收的基本概念和吸收过 程的平衡关系与速率关系;掌握低浓度气体吸收的计 算方法;了解传质与分离过程的基本概念及吸收系数 的获取途径、解吸过程的概念。
吸收的基本概念.

双膜模型假设溶质以稳态分子扩散方式通过气膜和液膜, 因此,气相和液相的对流传质速率相等。
以上两式中均用到了相界面处溶质的浓度,很难直接准 确测定,因此一般希望能够直接用气液两相主体浓度来 计算传质速率。
第二节 物理吸收
(三)总传质速率方程
在气液界面上,应用亨利定律:
cAi HpAi
cA Hp*A
YA* mX A 1 (1 m) X A (8.2.8)
当溶液浓度很低时,XA很小,上式可近似写为:
YA* mX A
(8.2.9)
不满足亨利定律的相平衡如何表征?
第二节 物理吸收
(二)相平衡关系在吸收过程中的应用
相平衡是气液两相接触传质的极限状态。
1.判断传质的方向
根据相平衡,计算平衡时溶质在气相或液相中的组成。
KG——气相总传质系数, kmol/(m2 s Pa)
稳态时
(N A)G (N A)L N A
经变换:
1 1 1 KG kG HkL
(8.2.21)
第二节 物理吸收
同理,以液相浓度差为推动力的总传质速率方程:
N A KL (c*A cA )
c*A——与气相主体分压平衡的液体浓度,kmol/m3
液膜传质速率方程改写成:
(NA)L
kL (cAi
cA)
pAi 1
p*A
HkL
(8.2.19)
将(NA)L变化成气体分压的函数。
第二节 物理吸收
以气体分压为推动力的总传质速率方程:
N A KG ( pA p*A )
(8.2.20)
pA*——与液相主体浓度cA平衡的气体分压,Pa
在通常的吸收操作条件下,kG和kL的数值大致相当, 而不同溶质的亨利系数值却相差很大。
第二章消化与吸收

有机物 —— 各种消化酶如:胰淀粉酶、胰脂肪酶、胰 蛋白酶和糜蛋白酶、羧基肽酶等。 (2) 性质:无色碱性液体,pH7.8-8.4; (3) 作用: 碳酸氢盐——中和胃酸,调解pH值
胰淀粉酶——水解淀粉成糊精或麦芽糖等;
胰脂肪酶——消化脂肪; 胰蛋白酶、糜蛋白酶——水解蛋白质; 其他酶类——水解相应的物质
④胆盐可直接刺激肝细胞分泌胆汁—胆盐的利胆作用。
C.小 肠 液
(1)性质:粘稠的碱性液体,pH约为7.6; (2) 成分:水分、无机盐及肠激酶和粘蛋白。
(3) 作用:保护十二指肠粘膜免受胃酸侵蚀;
稀释消化产物,降低肠内容物渗透压,有利 于小肠内水分及营养物质的吸收;肠激酶激
活胰蛋白酶原,从而促进蛋白质消化。
2.胃的运动主要有以下三方面的作用。
贮存食物 胃壁内的平滑肌具有很大的伸展性,伸 长时可达原来长度的2~3倍。因此,胃常可以容纳好 几倍于自己原来容积的食物。 使食物和胃液充分混合 食物进入胃以后,胃体中 部开始产生蠕动。蠕动的主要作用是使胃液和食物充 分混合,形成食糜,便于消化酶发挥作用,并且把食 糜推送到幽门部,然后经过幽门进入十二指肠。 胃的排空 食糜进入十二指肠的过程叫胃的排空。 胃的排空时间,与食物的量、质和胃的运动状况有关。
第二章 食物的消化和吸收
教学主要内容: 1、消化系统概述 2、各种营养素在体内的消化与吸收
本章学习目的 1、掌握消化、吸收等基本概念 2、了解食物在体内的消化与吸收过程 3、重点掌握各种营养素在小肠被吸收和 利用的情况。 学习重点:食物在体内消化与吸收
学习难点:各种营养素如何被消化、吸收
第一节
2.消化的方式:
(1)物理消化(又称机械消化):通过口腔咀嚼及消化道肌 肉收缩活动,将食物磨碎,并使食物与消化液充分混合,将食 物不断地向消化道的下方推送。 (2)化学消化:消化液中含有的各种消化酶分别对蛋白质、 脂肪和糖类等物质进行化学分解,使之成为可被吸收的小分子 物质。
吸收基本理论

吸收--基本概念和基本原理利用各组分溶解度不同而分离气体混合物的单元操作称为吸收。
混合气体中能够溶解的组分称为吸收质或溶质(A);不被吸收的组分称为惰性组分或载体(B); 吸收操作所用的溶剂称为吸收剂(S);吸收所得溶液为吸收液(S+A);吸收塔排出的气体为吸收尾气。
当气相中溶质的的实际分压高于与液相成平衡的溶质分压时,溶质从气相向液相转移,发生吸收过程;反之当气相中溶质的的实际分压低于与画目成平衡的溶质分压时,溶质从液相向气相转移,发生脱吸(解吸)过程。
一、气-夜相平衡-------- 传质方向与传质极限平衡状态下气相中溶质分压称为平衡分压或饱和分压,液相中的溶质浓度称为平衡浓度或饱和浓度----------------- 溶解度。
对于同一种溶质,溶解度随温度的升高而减小,加压和降温对吸收操作有利,升温和减压有利于脱吸操作。
亨利定律:p A -ExE为亨利系数,单位为压强单位,随温度升高而增大,难溶气体(稀溶液)E很大,易溶气体E很小。
H为溶解度系数,单位:kmol/(kN m),—=-EM SH f's随温度升高而减小,难溶气体H很小,易溶气体H很大。
m相平衡常数,无因次,m二旦Pm值愈大,气体溶解度愈小;m随温度升高而增加,随压力增加而减小。
当溶液浓度很低时大多采用该式计算。
X=x/(1-x); Y=y/(1-y); x,y--摩尔分率,X,Y --摩尔比浓度传质理论--传质速率分子扩散一凭借流体分子无规则热运动传递物质的现象。
推动力为浓度差,由菲克定律描述:J^ -D AB dC A J A-扩散通量,kmol/(m2s) D AB -扩散系数d z涡流扩散--凭借流体质点的湍动和旋涡传递物质的现象。
等分子反向扩散传质速率:气相内N A D(P AI_P A2)RT z液相内N A(C AI -C A2)111 1 H 1Z---- —------ 十-------- —+单相扩散传1质速率叭气相内K L N性D k L P(P A1_P A2)RTZ P BmD' C液相内N A(C A1-C A2)z C Bm一般而言,双组分等分子反向扩散体现在精馏单元操作中,而一组分通过另一组分的单相扩散体现在吸收单元操作中。
光和物质相互作用的三个过程

光和物质相互作用的三个过程在日常生活中,光和物质的相互作用无处不在,从阳光照在窗台的温暖感觉,到霓虹灯下的五光十色。
今天,我们就来聊聊光和物质之间的三种主要互动方式:吸收、反射和折射。
听起来有点儿复杂,但别担心,我们慢慢来探讨。
1. 吸收:光的“消失”1.1 吸收的基本概念首先,光的吸收是指光进入物质后,被物质“吞噬”了。
比如说,你站在阳光下,感到暖洋洋的,这就是阳光被你身上的衣物吸收了。
光在这里被转化为热量,物质变得暖和起来。
1.2 吸收的例子想象一下夏天你穿的黑色衣服,太阳照在你身上,黑色衣服吸收了大量的阳光,因此你会觉得特别热。
这就是光的吸收作用。
黑色吸收光的能力强,而白色则反射光,所以你会觉得穿白色衣服要凉快些。
2. 反射:光的“弹跳”2.1 反射的基本概念接下来,我们谈谈反射。
光的反射就是光碰到物体表面时,像弹球一样“弹回”去。
简单来说,就是光“照”在物体上,然后回到你的眼睛里,这样你才能看到物体的样子。
比如你在镜子前面,镜子里的你就是通过光的反射看到的。
2.2 反射的例子举个例子,如果你在湖边看到自己的倒影,那就是光被湖水表面反射了。
镜子也是类似的原理,光在镜子表面弹回,所以你能看到自己。
你也可以想象一下,车灯照在路上,车灯的光线在道路上反射,照亮了前方的路。
3. 折射:光的“弯曲”3.1 折射的基本概念最后,我们来聊聊折射。
光的折射就是光线穿过不同密度的物质时,发生弯曲的现象。
你可以把它想象成光在水里游泳,水的密度改变了光的游泳路线。
比如,当光从空气进入水中时,它会发生弯曲,这就是折射。
3.2 折射的例子举个常见的例子,当你把一根直棍子插进水里,你会发现那根棍子看起来像是弯曲了一样。
这是因为光从空气进入水中,改变了传播方向。
还有,眼镜的原理也是基于折射,通过特殊设计的镜片,改变光线的折射路径,让你看得更清楚。
总结所以,无论是光的吸收、反射还是折射,它们都在悄悄影响着我们的世界。
光和物质的互动就像是一场无声的舞蹈,展示着自然界中那最基本的规则。
环境工程原理2-2复习资料

1、传质过程:去除水、气体和固体中污染物的过程.吸收、萃取、吸附、离子交换、膜分离一个含有两种以上组分的体系,A 组分由浓度高的区域向浓度低的区域转移3、分子扩散:由分子的微观运动引起;涡流扩散:由流体微团的宏观运动引起4、费克定律:由浓度梯度引起的扩散通量与浓度梯度成正比5、单分子扩散:空气与氨的混合气体(静止):相界面上,氨溶解于水;氨的分压 p 减小;气相总压减小;流体自气相主体向相界面流动 ;空气分压增大——反向扩散;氨的扩散量增加;(流动):氨溶解于水;氨分压降低;相界面处的气相总压降低;流体主体与相界面之间形成总压梯度;流体主体向相界面处流动;的扩散量增加6、等分子反向扩散:在一些双组分混合体系的传质过程中,当体系总浓度保持均匀不变时,组分A 在分子扩散的同时必然伴有组分B 向相反方向的分子扩散,且组分B 扩散的量与组分A 相等,这种传质过程称为等分子反向扩散7、质量传递将受到流体性质、流动状态以及流场几何特性等的影响1、吸收的基本概念:依据混合气体各组分在同一种液体溶剂中物理溶解度(或化学反应活性)的不同,而将气体混合物分离的操作过程。
本质:气相到液相的传质过程2、吸收在化工领域中的应用:1)净化原料气及精制气体产品:比如用水(或碳酸钾水溶液)脱除合成氨原料气中的CO2等;2)制取液体产品或半成品:比如水吸收NO2制取硝酸;水吸收HCl 制取盐酸等;3)分离获得混合气体中的有用组分:比如用洗油从焦炉煤气中回收粗苯等4)净化有害气体:湿式烟气脱硫:如用水或碱液吸收烟气中SO2,石灰/石灰石洗涤烟气脱硫。
干法脱硫:喷雾干燥烟气脱硫:SO2被雾化的Ca(OH)2浆液或Na2CO3溶液吸收。
水、酸吸收净化含NOx 废气.5)回收有用物质:如用吸收法净化石油炼制尾气中的硫化氢的同时,还可以回收有用的元素硫6)能够用吸收法净化的气态污染物主要有:SO2,H2S, HF 和NOx 等7)其他应用:曝气充氧3、吸收法净化气态污染物的特点(与化工相比):处理气体量大,成份复杂,同时含有多种气态污染物; 吸收组分浓度低; 吸收效率和吸收速率要求高;多采用化学吸收——如碱液吸收烟气中低浓度的SO2;多数情况吸收过程仅是将污染物由气相转入液相,还需对吸收液进一步处理,以免造成二次污染。
化工单元操作-传质过程(吸收)

• 2.解吸方法 • 解吸方法有汽提解吸、减压解吸、加热解吸、
加热减压解吸。工程上很少采用单一的解吸方 法,往往是先升温再减压至常压,最后采用汽 提法解吸。 • (1)汽提解吸 也称为载气解吸法。 • 向解吸塔中通入不含溶质的惰性气体或溶剂蒸 气等气体,降压液面上溶质气体的分压,使吸 收剂中溶质气体更完全的解吸出来,常以空气 、氮气、二氧化碳、水蒸气、吸收剂蒸气作为 载气。
经济上:X 2L (1.1 ~ 2.0)Lmin
4、塔内返混
吸收塔内气液两相可因种种原因造成少量流体发生
与主流提方向相反的流动,这一现象称为返混。
传质设备发生返混会使传质推动力下降、效率降低
或填料层高度增加。
5、吸收剂是否再循环
吸收剂再循环会降低吸收推动力,使填料层 高度加大,但当喷淋密度不足以保证填料的 充分润湿时,必须采用溶剂再循环。
• 第五节 解吸和吸收流程
一、基本概念——解吸
• 从吸收液中分离岀已被吸收的气体吸收 质的操作称为解吸。显然,解吸与吸收 是相反的过程。生产中解吸的作用有两 个:一个是把吸收剂中吸收的气体重新 释放出来,获得高纯度的吸收质气体; 另一个是使吸收剂释放了被吸收的气体 ,使吸收剂从新具有吸收作用,再返回 吸收塔循环使用,节约操作费用。
1、液气比
操作线斜率L/V称为液气比,是吸收剂与惰性气体摩 尔流量之比,反映了单位气体处理量的吸收剂消 耗量的大小。
当气体处理量一定时,确定吸收剂用量就是确定液 气比,是一个重要参数。
化工原理吸收课后问题详解

化工原理吸收课后问题详解一、吸收的基本概念和原理吸收是化工过程中一种常用的物质分离技术,它通过将气体或液体溶质溶解到溶剂中,从而实现对溶质的分离和回收。
吸收过程中,溶剂与溶质之间发生物质传递和质量转移,达到了分离和纯化的目的。
吸收过程中存在一些重要的基本概念和原理,包括以下几个方面:1. 吸收剂:吸收剂是指用于吸收过程中溶解溶质的溶剂。
吸收剂的选择应根据溶质的性质、吸收过程的要求以及经济因素等综合考虑。
2. 溶质:溶质是指需要被吸收的气体或液体物质。
溶质的选择应根据吸收过程的目的和要求来确定。
3. 吸收塔:吸收塔是吸收过程中的主要设备,它通常由填料或板式结构构成,用于增加吸收剂与溶质之间的接触面积,促进质量传递和物质转移。
4. 质量传递:质量传递是指吸收过程中溶质从气相或液相传递到吸收剂中的过程。
质量传递的速率受到多种因素的影响,包括质量传递系数、液相浓度、气相浓度、温度等。
5. 质量传递系数:质量传递系数是衡量吸收过程中质量传递速率的重要参数,它表示单位时间内单位面积的质量传递量。
质量传递系数受到吸收剂和溶质性质、温度、压力等因素的影响。
6. 质量平衡:质量平衡是吸收过程中的重要原理之一,它描述了吸收剂和溶质之间质量传递的平衡状态。
质量平衡方程可以通过质量传递系数、液相浓度、气相浓度等参数来表示。
二、吸收过程中的影响因素吸收过程中存在许多影响因素,这些因素会对吸收效果和过程性能产生重要影响。
以下是吸收过程中常见的影响因素:1. 吸收剂的选择:吸收剂的选择应根据溶质的性质、吸收过程的要求以及经济因素等综合考虑。
吸收剂的选择应具有良好的溶解性能、较低的蒸汽压、稳定性好等特点。
2. 溶质的性质:溶质的性质对吸收过程有重要影响。
溶质的溶解度、相对挥发性、稳定性等特性会影响吸收过程的效果和稳定性。
3. 温度:温度是影响吸收过程的重要因素之一。
温度的升高可以增加溶质的溶解度和质量传递速率,但同时也会增加能耗和操作难度。
4.1-吸收解吸单元仿真操作
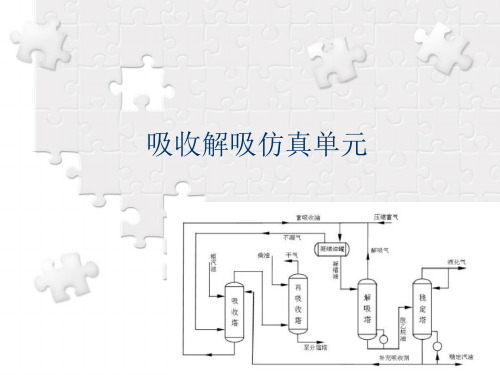
解吸操作的主要工艺设备
1、T102----解吸塔(精馏塔) 2、E103----贫富油换热器 3、E104----解吸塔顶冷凝器 4、E105----T102再沸器 5、D103----C4产品冷凝液罐 6、P102A/B----T102塔回流泵
解吸操作的工艺流程图
事故名称
现象
冷却水中断
加热蒸汽中断
仪表风中断
停电
泵坏
调节阀卡
解吸塔釜加热蒸汽压力异 常
处理方法
吸收解吸仿真单元
一、工作原理简述 二、工艺流程动画演示 三、工艺流程简介 四、主要设备及结构说明
吸收的基本概念
1、吸收----利用气体混合物中各个组分在液体溶剂(吸收剂)中的溶 解度不同,来分离气体混合物。
2、富气----被吸收剂溶解的气体组分称为溶质。含有溶质的混合气 体在工业生产中称为富气。
四、主要设备及结构说明
1.气液传质设备(吸收塔、解吸塔) 2.冷凝器 3.换热器 4.再沸器
)
填料塔的总体结构
填料塔的结构
2.冷凝器
3.换热器
4.再沸器
本单元操作的基本情况
1、混合气体----其中C4:25.13%,CO和 CO2:6.26%,N2:64.58%,H2:3.5%, O2:0.53%。
3、贫气----未被溶解的气体在工业生产中称为贫气或惰性气体。 4、贫液(贫油)----不含溶质的吸收剂(液体溶剂) 5、富液(富油)----富含溶质的吸收剂(液体溶剂) 6、吸收操作----使混合气中的溶质溶解于吸收剂中而得到一种溶液
的生产操作过程。
吸收操作的适宜条件
1、降低温度:温度升高,气体溶解度减小。 工业生产中一般采用常温操作。
Байду номын сангаас
化工基础吸收知识点总结

化工基础吸收知识点总结一、吸收的基本概念吸收是化工过程中常用的一种分离技术,通过将气体、液体或固体混合物中的一种或几种物质吸收到另一种物质中来实现分离和净化。
吸收的基本原理是在可逆或不可逆的化学反应或物理吸附作用下,将气体或液体中的一种或几种物质通过传质作用,吸附到用来吸收的溶剂中。
吸收通常是以溶剂为中介进行的,随着被吸收物质的浓度在溶剂中的增加,溶解度逐渐增大,在达到一定平衡后形成溶液。
吸收在化工生产中广泛应用,例如在石油化工、化学工程、环保等领域都有重要的作用。
二、物理吸收和化学吸收吸收可以分为物理吸收和化学吸收两种类型。
物理吸收是指在物理条件下,溶质分子在溶剂中通过相互作用形成溶液的过程。
物理吸收对于气体在溶液中的溶解有着重要的影响,常用于气体分离和净化的工艺中。
化学吸收是指通过发生化学反应将气体中的一种或几种物质吸收到液体中,常用于气体净化和废气处理的过程。
三、吸收的装置和设备吸收操作通常需要辅助装置和设备来进行,常见的吸收装置包括吸收塔、填料塔、板式吸收塔、直接接触吸收器等。
其中,吸收塔是常见的一种吸收装置,它通常是由塔筒、填料、进口、出口和料液分布器等组成。
在填料塔中,填料可以增加表面积,有利于气液传质和溶液形成,是提高吸收效率的关键。
而板式吸收塔是以板作为介质,通过气体和原液的接触和传质来实现吸收分离的一种装置。
直接接触吸收器则是由于气体和液体直接接触而形成的一种吸收设备,用于一些特殊的气体净化或气体液体传质操作。
四、吸收过程中的影响因素吸收过程受到很多因素的影响,包括气相浓度、液相浓度、温度、压力、塔内气流速度等。
气相浓度和液相浓度是影响吸收速率和效果的主要因素,其浓度大小会直接影响溶质在溶剂中的溶解度。
温度和压力也会对吸收过程产生影响,不同温度下溶质的溶解度会有所不同,由于气相浓度、液相浓度以及温度和压力等因素的相互影响,吸收过程通常是一个复杂的传质过程。
五、吸收设备的选择和设计在化工生产中,选择合适的吸收设备和设计合理的吸收工艺是非常重要的。
环境工程原理 第七章

图7-2 SO2在水中的平衡溶解度
第二节 吸收过程中的相平衡关系
二、亨利定律
1.气液平衡
溶质A溶
解速度 气体
平衡分压, pA* 摩尔分数, yA 摩 ……尔. 比相,际YA动态平衡
液体
溶质挥 发速度
如果温度和总压一定,溶质在液体 中的溶解度只取决于溶质在气相中 的组成。
气-液相平衡关系又称溶解度曲线
1.溶质与吸收剂反应: 如用水吸收氨。
ABM
假设溶质在溶剂中的总浓度为cA, cA AM
化学反应平衡关系可表示为:
K
M AB
cA A AB
进而可得
A
1
cA
K
B
第二节 吸收过程中的相平衡关系
将此浓度代入亨利定律,可得溶质的气液相平衡关系:
pA*
吸收操作的目的: (1)分离和净化原料气: 原料气在加工以前,其中无用的或有害的成分都要预先除去。如从
合成氨所用的原料气中分离出CO2、CO、H2S等杂质。 (2)分离和吸收气体中的有用组分:
如从合成氨厂的放空气中用水回收氨;从焦炉煤气中以洗油回收粗 苯(含甲苯、二甲苯等)蒸气和从某些干燥废气中回收有机溶剂蒸气等。
解度系数为 H 1.56102 kmol/(kPa·m3),一级解离常数
为 K1 1.7 102 kmol/m3。
解:考虑解离情况下 SO2 的吸收情况可以表示为以下两个过 程:
扩散传质过程 SO2 g
SO2 l
解离过程 SO2 +H2O
H+ +HSO3-
由传质平衡可以求得吸收液中 SO2 的浓度
cA HpA 1.56 102 5.05 0.0788 kmol/m3
药理学吸收名词解释

药理学吸收名词解释1.引言1.1 概述概述部分旨在介绍本文的主题——药理学吸收的名词解释,并提供相关背景信息。
药理学吸收是药学领域中的一个重要概念,它涉及到药物在人体内被吸收的过程及其相关机制。
了解药理学吸收的名词解释对于我们理解药物的作用机理以及合理用药具有重要意义。
在正常情况下,当药物被人体内某一部位接触(如口服、注射等),吸收便是其中一个必经环节。
药物在进入人体后,会通过不同的途径被吸收到血液中,从而实现其在体内发挥作用的目的。
然而,药物的吸收过程受到多种因素的影响,包括药物的性质、给药途径、药物的剂型等等。
理解吸收的概念和相关名词对于临床医生、药师和药学研究者来说是至关重要的。
只有通过深入了解药物的吸收过程,我们才能更好地理解药物在人体内的代谢和排泄过程,并且能够合理地设计给药方案。
此外,吸收的过程也会对药物的疗效和安全性产生一定的影响。
因此,本篇长文将对药理学吸收的相关名词进行详细解释和阐述。
通过阅读本文,读者将能够了解吸收过程的基本概念和原理,并深入了解各种因素对药物吸收的影响。
最终,读者将能够将这些知识应用于临床实践和药学研究中,以促进药物治疗的有效性和安全性。
在下一节中,将详细介绍吸收的概念以及相关的原理和机制,以帮助读者更好地理解药物吸收的过程。
1.2 文章结构本文主要分为引言、正文和结论三个部分。
在引言部分,将对药理学吸收进行概述,介绍本文的目的,并简要说明文章的结构。
正文部分将详细探讨吸收和药理学的相关知识。
首先,将对吸收进行详细解释,包括吸收的定义、吸收相关的因素以及体内吸收的过程。
接下来,将重点介绍药理学的概念和研究内容,包括药物的作用机制、药物在体内的分布、药物的代谢和排泄等内容。
通过对吸收和药理学的讨论,可以深入了解药物在体内的吸收过程以及其对机体的影响。
在结论部分,会对本文进行总结和展望。
将总结吸收和药理学的相关知识,强调吸收在药物疗效方面的重要性,并展望今后在药理学吸收方面的研究方向。
吸收

8 气体吸收8.1概述一、基本概念:吸收--利用各组分溶解度不同而分离气体混合物的操作称为吸收。
传质过程——在混合物中因存在着组分浓度的差异,发生自发的物质迁移,该过程称为传质过程(扩散过程)。
溶质--混合气体中,能够溶解的组分称之(或称吸收物质),一般以A表示。
载体--混合气体中,不能被溶解的组分称之(或称惰性组分),一般以B表示。
吸收剂--吸收操作中所用的溶剂称之,一般以S表示。
吸收液--吸收操作中所得到的溶液称之(或称溶液),由S+A组成。
尾气--吸收操作中排出的气体称之,由B+A组成。
吸收是一个传质过程,现以从空气与氨气混合物中除去氨为例,当此混合物与水接触时,因氨易溶于水,则在靠近水面处气相中的氨浓度就低于远离水面处氨的浓度。
氨的转移速率是开始时大,以后逐渐减少,当氨在气相与液相呈平衡状态时,氨的转移速率为零。
可见:1)要实现均相混合物的组分分离,须加入一新的物质,使之与原均相混合物构成不同的相;2)当转移的组分在两相邻的相中的浓度处于不平衡时,传质就会发生;若转移的组分在两相中的浓度距平衡态愈远,组分的转移速率愈大;反之亦然;3)当转移的组分在接触的不同相中的浓度呈平衡态时,该组分的转移成分率为零;4)传质过程是实现均相混合物分离的基本过程。
传质过程的分类:吸收、精馏、干燥、萃取。
须说明的是:精馏(蒸馏)分离过程不同相的生成不是靠外加另一物质,而是靠输入热能,使液体汽化,产生汽、液并存的两相。
二、吸收分离的目的1.回收气体混合物中的有用物质以制取产品。
如用洗油处理焦炉气以回收其中的苯、甲苯、二甲苯等芳烃;用碱液吸收烟道气中的CO2;用水吸收HCl、SO3制成酸。
2.除去工艺气体中的有害成分以净化气体。
如合成氨中原料气中的CO2,或除去工业放空尾气中的有害物以免污染大气。
三、吸收操作的基本流程及设备洗油四、吸收必须解决下列问题1.选择合适的溶剂,以选择性地溶解某些组分2.适当的传质设备,以实现气液两相接触3.溶剂再生可见一个完整的吸收分离过程一般包括吸收和解吸两部分五、溶剂的选择原则吸收操作是气液两相之间的接触传质过程,其成功关键是溶剂的性能,溶剂的选用原则:1.对被分离组分要有较大的溶解度,即在一定的温度与浓度下,溶质的平衡分压要低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸收习题及答案
一、填空题
1、用气相浓度△y为推动力的传质速率方程有两种,以传质分系数表达的速率方程为
_________,以传质总系数表达的速率方程为___________。
N A = k y (y-y i) N A = K y (y-y*) 2、吸收速度取决于__________,因此,要提高气-液两流体相对运动速率,可以_______来增大吸收速率。
双膜的扩散速率减少气膜、液膜厚度
3、由于吸收过程气相中的溶质分压总____ 液相中溶质的平衡分压,所以吸收操作线总是在平衡线的____。
增加吸收剂用量,操作线的斜率_____,则操作线向_____平衡线的方向偏移,吸收过程推动力(y-y*)_____。
大于、上方、增大、远离、增大
4、用清水吸收空气与A的混合气中的溶质A,物系的相平衡常数m=2,入塔气体浓度y = 0.06,要求出塔气体浓度y2 = 0.006,则最小液气比为_________。
1.80
5、在气体流量,气相进出口组成和液相进口组成不变时,若减少吸收剂用量,则传质推动力将_________,操作线将_________平衡线。
减少、靠近
6、某气体用水吸收时,在一定浓度范围内,其气液平衡线和操作线均为直线,其平衡线的斜率可用_____常数表示,而操作线的斜率可用_____表示。
相平衡液气比
7、对一定操作条件下的填料吸收塔,如将塔料层增高一些,则塔的H OG将_________,N OG 将_________ ( 增加,减少,不变)。
不变增加
8、吸收剂用量增加,操作线斜率___,吸收推动力___。
(增大,减小,不变)增大、增大
9、计算吸收塔的填料层高度,必须运用如下三个方面的知识关联计算:_____、_____、_____。
平衡关系物料衡算传质速率。
10、填料的种类很多,主要有_____、______、______、______、______、______。
拉西环鲍尔环矩鞍环阶梯环波纹填料丝网填料
11、填料选择的原则是_________。
表面积大、空隙大、机械强度高价廉,耐磨并耐温。
12、在选择吸收剂时,首先要考虑的是所选用的吸收剂必须有__ ___。
良好的选择性,即对吸收质有较大的溶解度,而对惰性组分不溶解。
13、填料塔内提供气液两相接触的场所的是_________。
填料的表面积及空隙
15、填料应具有较_____的________,以增大塔内传质面积。
大、比表面积
16、吸收塔内填装一定高度的料层,其作用是提供足够的气液两相_____。
传质面积
二、选择题
1、吸收速率主要决定于通过双膜的扩散速度,要提高气液两流体的相对运动,提高吸收效果,则要_________。
B
A. 增加气膜厚度和减少液膜厚度
B. 减少气膜和液膜厚度
C. 增加气膜和液膜厚度
2、当吸收质在液相中的溶解度甚大时,吸收过程主要受_________控制,此时,总吸收系数K y 近似等于_________。
A、 D
A. 气膜
B. k x
C. 气液膜同时
D. k y
E. 液膜
F. K x
3、双膜理论认为吸收过程的阻力集中在_________。
A
A. 两膜层中;
B. 界面上;
C. 液膜之中;
D. 气膜之中;
4、升温会使气体在液体中的溶解度_______,对吸收操作_______。
C、 D
A. 有利;
B. 变大;
C. 变小;
D. 不利;
E. 不变;
F. 无影响;
5、_________,对吸收操作有利。
A
A.温度低,气体分压大时;
B.温度低,气体分压小时;
C.温度高,气体分压大时; C.温度高,气体分压小时;
6、对处理易溶气体的吸收,为较显著地提高吸收速率,应增大_______的流速。
A
A. 气相;
B. 液相;
C. 气液两相;
7、若享利系数E值很大,依据双膜理论,则可判断过程的吸收速率为______控制。
B
A. 气膜;
B. 液膜;
C. 双膜
8、在吸收塔某处,气相主体浓度y = 0.025,液相主体浓度x = 0.01,气相传质分系数k y = 2 kmol.m-2.h-1,气相总传质系数K y = 1.5kmol.m-2.h-1,则该处气液界面上气相浓度y i 应为
_______,平衡关系y = 0.5x。
B
A. 0.02
B. 0.01
C. 0.015
D. 0.005 y e = 0.5×0.01 = 0.005
N A = K y(y-y e)= k y(y-y i) 1.5(0.025-0.005)=2(0.025-y i)∴y i = 0.01
9、通常所讨论的吸收操作中,当吸收剂用量趋于最小用量时,完成一定的分率_____。
D
A. 回收率趋向最高;
B. 吸收推动力趋向最大;
C. 操作最为经济;
D. 填料层高度趋向无穷大。
10、对于逆流操作的吸收塔,其它条件不变,当吸收剂用量趋于最小用量时,则_____。
D
A. 吸收推动力最大;
B. 吸收率最高;
C. 出塔气浓度最低;
D. 吸收液浓度趋于最高。
11、在常压下用水逆流吸空气中的CO2,若将用水量增加则出口气体中的CO2量将_____,气相总传质系数K y 将_____,出塔液体中CO2浓度将_____。
B. A. B.
A. 增加、
B. 减少、
C. 不变
12、选择吸收设备时,综合考虑吸收率大,阻力小,稳定性好结构简单造价小,一般应选__。
A. 填料吸收塔
B. 板式吸收塔
C. 喷淋吸收塔
13、为使脱吸操作易于进行,通常可采用_____或_____。
A、C
A. 升温
B. 加压
C. 减压
D. 降温
14、对于脱吸操作,其溶质在液体中的实际浓度_____与气相平衡的浓度。
B
A. 小于
B. 大于
C. 等于
15、填料吸收塔空塔的速度应_____于液泛速度。
B
A. 大
B. 小
C. 等
16、对吸收操作影响较大的填料特性是_____。
A
A. 比表面积和自由体积;
B. 机械强度;
C. 对气体阻力要小;。
