高中阶段常见酸碱盐溶解性表
重点高中酸碱盐溶解度表格模板全

阴离子
阳离子
溶,挥
溶,挥
溶
溶,挥
溶,挥
溶,挥
微
溶
溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
-
不
不
不
不
微
溶
溶
微
-
不
不
不
不
不
溶
溶
溶
-
微
微
不
不
不
溶
溶
溶
-
-
-
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
―
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
不
不
不
不
溶
溶
溶
不
-
-
-
不
不
溶
微
不
不
不
不
不
不
不
溶
-
溶
不
不
不
-Hale Waihona Puke 不不溶溶
溶
不
酸碱盐溶解性表

溶解性口诀
钾,钠,铵,盐,硝酸盐,
都能溶解水中间.
盐酸盐不容银,亚汞,
硫酸盐不容钡和铅,
碳酸盐照顾溶钾钠铵
溶解性口诀一
钾钠铵盐溶水快,①
硫酸盐除去钡铅钙。
②
氯化物不溶氯化银,
硝酸盐溶液都透明。
③
口诀中未有皆下沉。
④
注:
①钾钠铵盐都溶于水;
②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;
③硝酸盐都溶于水;
④口诀中没有涉及的盐类都不溶于水;
溶解性口诀二
钾、钠、铵盐、硝酸盐;
氯化物除银、亚汞;
硫酸盐除钡和铅;
碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶
溶解性口诀四
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)
只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五
钾钠铵盐硝酸盐
完全溶解不困难
氯化亚汞氯化银
硫酸钡和硫酸铅
生成沉淀记心间
氢硫酸盐和碱类
碳酸磷酸硝酸盐
可溶只有钾钠铵。
酸碱盐溶解性表

NO3-
Cl-
SO42-
CO32-
H+
(H2O)
溶、挥(HNO3)
溶、挥(HCl)
溶(HHale Waihona Puke SO4)溶、挥(H2CO3)
K+
溶(KOH)
溶(KNO3)
溶(KCl)
溶(K2SO4)
溶(K2CO3)
Na+
溶(NaOH)
溶(NaNO3)
溶(NaCl)
溶(Na2SO4)
溶(Na2CO3)
NH4+
溶、挥(NH3·H2O)
不(Ag2CO3)
酸碱性溶解性表(附化学式)
酸碱盐溶解性识记口诀:
钾、钠、铵盐、硝酸盐;(钾盐、钠盐、铵盐、硝酸盐均可溶于水)
氯化物除银、亚汞;(氯化物除氯化银、氯化亚汞外均可溶于水)
硫酸盐除钡和铅;(硫酸盐除硫酸钡、硫酸铅外均可溶于水)
碳酸盐只溶钾、钠、铵。多数酸溶碱少溶、只有钾钠铵钡溶
溶(MgSO4)
微(MgCO3)
Al3+
不Al(OH)3
溶Al(NO3)3
溶(AlCl3)
溶Al2(SO4)3
---
Mn2+
不Mn(OH)2
溶Mn(NO3)2
溶(MnCl2)
溶(MnSO4)
不(MnCO3)
Zn2+
不Zn(OH)2
溶Zn(NO3)2
溶(ZnCl2)
溶(ZnSO4)
不(ZnCO3)
Fe2+
溶(NH4NO3)
溶(NH4Cl)
溶(NH4)2SO4
溶(NH4)2CO3
Ba2+
溶Ba(OH)2
常见酸碱盐溶解表℃

21.5
+溶K
溶112
31.6
溶
11.1
溶
34.7
溶
111.5
+溶Rb
117溶
53
溶
48
溶
91
溶
450
+溶Cs
330溶
23
溶
179
溶
186
溶
﹥500
2+难Be
溶
107
溶
39
溶
﹥500
2+难Mg
0.009溶
70
溶
33
溶
54.2
微
2+微Ca
0.165溶
129
微
0.21
溶
74.5
难
2+微Sr
溶0.8
71
3+In
微
0.04
溶
500﹥
——
——
+Tl
溶
18.6
微
0.05
难
0.0006
3+Tl
——
——
溶
溶
2+Ge
微
0.24
溶
——
——
溶
4+Ge
——
——
——
——
——
——
2+Sn
难
溶
溶
微
0.98
4+Sn
溶
500﹥
——
——
——
——
2+Pb
难
微
0.064
微
0.084
微
0.063
3+As
酸碱盐溶解性口诀

酸碱盐溶解性表钾钠铵盐硝酸银,永远溶解不沉淀!碳酸盐不溶钡、钙、银!硫酸钡氯化银!四大强碱记心间!(特别说明:上述沉淀全部为白色沉淀!)重要化学知识三大强酸:盐酸;HCL硫酸:H2SO4硝酸:HNO3四大强碱:氢氧化钾:KOH氢氧化钠:NaOH氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2常见微溶物:(微溶物指该物质溶解度很低,不能大量存在,当生成的量过多时会有白色沉淀析出)硫酸钙CaSO4、硫酸银Ag2SO4碳酸镁MgCO3氢氧化钙Ca(OH)2中学重要的带有颜色的沉淀:氢氧化亚铁(白色沉淀)Fe(OH)2氢氧化铁(红褐色沉淀)Fe(OH)3氢氧化铜(蓝色沉淀)Cu(OH)2溴化银(浅黄色沉淀)AgBr碘化银(黄色沉淀)AgI常见的有色离子是Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-锰酸根离子(紫色)不能大量共存的离子1、生成难溶物或微溶物:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-(亚硫酸根离子)、S2-(硫离子);Mg2+、Ba2+、Ca2+与CO32-、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)等不能大量共存.2、生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-(碳酸氢根离子)等不能大量共存。
3、生成水:OH-与H+不能大量共存。
碱性溶液中肯定不存在与OH-起反应的离子;酸性溶液中肯定不存在与H+起反应的离子。
酸性溶液、pH=1的溶液、能使pH试纸变红的溶液、使石蕊试液变红等,在分析各选项组的离子时,还需考虑H+的存在;碱性溶液、pH=14的溶液、能使pH试纸变蓝的溶液,使石蕊试液变蓝或使酚酞试液变红的溶液等;在分析各选项组的离子时,还需考虑OH-的存在;练习:1、下列各组离子在溶液中一定能大量共存的是()A.H+、Cl-、OH- B. H+、SO42-、HCO3-C. Ba2+、H+、SO42-D.Cu2+、Cl-、NO3-2、下列各组物质能在同一溶液中大量共存的是()A.NaCl、HCl、MgSO4、Cu(NO3)2B.AgNO3、NaCl、Mg(NO3)2、NaOHC.Ca(OH)2、NaNO3、Na2CO3、NH4ClD.HCl 、K2SO4、NaOH、NaNO33、分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是()A. NaNO3、Ba(OH)2、HNO3B. H2SO4、NaNO3、Na2SO4C. H2SO4、NaNO3、FeSO4D.CaCl2、Na2SO4、BaCl24、化学兴趣小组的同学在分析某种含有三种溶质的无色透明溶液时,得出了以下结论,其中的三种溶质可能正确的是()A. CuCl2、Ba(OH)2、NaClB. Na2SO4、HCl、Ba(NO3)2C. KCl、HCl、Al2(SO4)3D. HCl、NaCO3、Na2SO45、下列各组物质能在PH为1的溶液中大量共存,且溶液为无色透明的是()A. CaCl2、NaNO3、KOH、MgCl2 B. CuSO4、NaCl、H2SO4、KNO3C. Na2CO3、NaCl 、KNO3、NH4ClD. ZnSO4、MgCl2、NaNO3、KCl。
酸碱盐溶解性表

酸碱盐的溶解性表OH(-1 ) NO3(-Cl(-1)SO4(-CO3(-PO4(-1)2)2)3)H(+1)溶、挥溶、挥溶溶、挥溶K(+1)溶溶溶溶溶溶Na(+1)溶溶溶溶溶溶NH4(+ 溶、挥溶溶溶溶溶1)Ba(+2)溶溶溶不不不Ca(+2)微溶溶微不不Mg(+2)不溶溶溶微不Al(+3)不溶溶溶---不Zn(+2)不溶溶溶不不Fe(+2)不溶溶溶不不Fe(+3)不溶溶溶不不Cu(+2)不溶溶溶---不Ag(+1) ---溶不微不不说明:此为 20℃时的状况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“ --- ”表示那种物质不存在或碰到水就分解了背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其余积淀白色呈注: 1. 初顶用够了,红褐铁,代表铁盐积淀为红褐色【f e(oh)2 氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2. 氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色积淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特色2.钾钠铵盐全都溶碳酸除镁是微溶其余全都不可以溶AgCl、 BaSO4酸也不溶磷酸盐,更不溶一、氧气的性质:(1)单质与氧气的反响:(化合反响)1.镁在空气中焚烧: 2Mg + O2 点燃 2MgO2.铁在氧气中焚烧: 3Fe + 2O2 点燃 Fe3O43.铜在空气中受热: 2Cu + O2 加热 2CuO4.铝在空气中焚烧: 4Al + 3O2 点燃 2Al2O35.氢气中空气中焚烧: 2H2 + O2 点燃 2H2O6.红磷在空气中焚烧(研究空气构成的实验): 4P + 5O2 点燃2P2O57.硫粉在空气中焚烧: S + O2 点燃 SO28.碳在氧气中充足焚烧: C + O2 点燃 CO29.碳在氧气中不充足焚烧: 2C + O2 点燃 2CO(2)化合物与氧气的反响:10.一氧化碳在氧气中焚烧: 2CO + O2 点燃 2CO211.甲烷在空气中焚烧: CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中焚烧: C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的根源:13.玻义耳研究空气的成分实验2HgO 加热 Hg+ O2 ↑14.加热高锰酸钾: 2KMnO4加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理 1)15.过氧化氢在二氧化锰作催化剂条件下分解反响:H2O2 MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的构成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水: CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中焚烧: 2Mg + O2 点燃 2MgO20.铁和硫酸铜溶液反响: Fe + CuSO4 === FeSO4 + Cu 21.氢气复原氧化铜: H2 + CuO 加热 Cu + H2O22. 镁复原氧化铜: Mg + CuO 加热 Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23.碳在氧气中充足焚烧: C + O2 点燃 CO224.木炭复原氧化铜: C+ 2CuO高温 2Cu + CO2↑25.焦炭复原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑(2)煤炉中发生的三个反响:(几个化合反响)26.煤炉的基层: C + O2 点燃 CO227.煤炉的中层: CO2 + C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反响(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳固而分解: H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO + CO2↑33.石灰水与二氧化碳反响(鉴识二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳复原氧化铜: CO+ CuO加热 Cu + CO235.一氧化碳的可燃性: 2CO + O2 点燃 2CO2其余反响:36.碳酸钠与稀盐酸反响(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中焚烧: CH4 + 2O2 点燃 CO2 + 2H2O38.酒精在空气中焚烧: C2H5OH + 3O2点燃 2CO2 + 3H2O 39.氢气中空气中焚烧: 2H2 + O2 点燃 2H2O六、金属(1)金属与氧气反响:40.镁在空气中焚烧: 2Mg + O2 点燃 2MgO41.铁在氧气中焚烧: 3Fe + 2O2 点燃 Fe3O442.铜在空气中受热: 2Cu + O2 加热 2CuO43.铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 --------盐+氢气(置换反响)44.锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2↑45.铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑46.镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑47.铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3 H2 ↑48.锌和稀盐酸 Zn + 2HCl == ZnCl2 + H2 ↑49.铁和稀盐酸 Fe + 2HCl == FeCl2 + H2 ↑50.镁和稀盐酸 Mg+ 2HCl == MgCl2 + H2 ↑51.铝和稀盐酸 2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) -------新金属+新盐52.铁和硫酸铜溶液反响: Fe + CuSO4 == FeSO4 + Cu53.锌和硫酸铜溶液反响: Zn + CuSO4 ==ZnSO4 + Cu54.铜和硝酸汞溶液反响: Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 --------盐+氢气(见上)(2)酸 + 金属氧化物 --------盐+水56.氧化铁和稀盐酸反响: Fe2O3 + 6HCl ==2FeCl3 + 3H2O57.氧化铁和稀硫酸反响: Fe2O3+ 3H2SO4== Fe2(SO4)3 + 3H2O58.氧化铜和稀盐酸反响: CuO + 2HCl ==CuCl2 + H2O59.氧化铜和稀硫酸反响: CuO + H2SO4 == CuSO4 + H2O (3)酸 + 碱 --------盐+水(中和反响)60.盐酸和烧碱起反响: HCl + NaOH == NaCl +H2O61.盐酸和氢氧化钙反响: 2HCl + Ca(OH)2 == CaCl2 + 2H2O62.氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反响: H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 --------另一种酸+另一种盐64.大理石与稀盐酸反响: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反响 : Na2CO3+ 2HCl == 2NaCl + H2O+ CO2↑66.碳酸氢钠与稀盐酸反响: NaHCO3+ HCl== NaCl + H2O+ CO2↑67.硫酸和氯化钡溶液反响: H2SO4+ BaCl2 == BaSO4↓+2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 --------盐+水68.苛性钠裸露在空气中变质: 2NaOH + CO2 == Na2CO3 + H2O69.苛性钠汲取二氧化硫气体: 2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠汲取三氧化硫气体: 2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质: Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰汲取二氧化硫: Ca(OH)2 + SO2 == CaSO3 ↓+ H2O (2)碱+酸--------盐+水(中和反响,方程式见上)(3)碱 + 盐 --------另一种碱 + 另一种盐73.氢氧化钙与碳酸钠: Ca(OH)2 + Na2CO3 == CaCO3↓+2NaOH 3、盐的化学性质(1)盐(溶液) + 金属单质 -------另一种金属+另一种盐74. 铁和硫酸铜溶液反响: Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反响 : Na2CO3+ 2HCl == 2NaCl + H2O+ CO2↑碳酸氢钠与稀盐酸反响: NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 --------另一种碱+另一种盐76. 氢氧化钙与碳酸钠: Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 -----两种新盐77.氯化钠溶液和硝酸银溶液: NaCl + AgNO3== AgCl↓ + NaNO3 78.硫酸钠和氯化钡: Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶 BaSO4,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
常见酸碱盐溶解性详表

溶
溶
溶
溶
溶
溶
K╋
溶
溶
溶
溶
微
溶
溶
溶
溶
溶
溶
Rb ╋ 溶
溶
溶
溶
微
溶
溶
微
溶
溶
溶
Cs ╋ 溶
溶
溶
溶
微
溶
溶
微
溶
溶
溶
Be 2╋ 不
溶
溶
溶
不
不
不
不 水解 水解 水解
Mg 2╋ 不
溶
溶
溶
微
微
不
不
溶
溶 水解
Ca 2╋ 微
溶
溶
微
不
不
不
不
溶
溶
微
Sr 2╋ 微
溶
溶
微
微
不
溶
不
溶
溶
不
Ba 2╋ 溶
溶
溶
不
不
不
不
不
溶
溶
溶
Al 3╋ 不
常见酸碱盐溶解性表
OH — NO3— Cl — SO42— CO32— SO32— SiO32— PO43— Br — I — S 2—
H╋
溶、挥 溶、挥 溶 溶、挥 溶、挥 微
溶 溶、挥 溶、挥 溶、挥
NH4╋ 溶、挥 溶
溶
溶
溶
溶 水解 溶
溶
溶
溶
Li ╋ 溶
溶
溶
溶
微
溶
溶
不
溶
溶
溶
Na ╋ 溶
溶
溶
溶
高中阶段常见酸碱盐溶解性表

溶
溶
溶
难
难
难
难
难
Zn2+
难
溶
溶
溶
难
难
难
难
难
Cr3+
难
溶
溶
溶
—
—
—
难
难
Fe2+
难
溶
溶
溶
难
难
难
难
难
Fe3+
难
溶
溶
溶
—
—
—
难
难
Sn2+
难
溶
溶
溶
难
—
—
—
难
Pb2+
难
溶
微
微
难
难
难
难
难
Cu2+
难
溶
溶
溶
难
溶
—
难
难
Hg2+
—
溶
溶
溶
难
难
—
—
难
Ag+
—
溶
难
微
难
难
难
难
难
高中阶段常见酸碱盐溶解性表(25℃,101.3kPa)
OHˉ
NO3ˉ
Clˉ
SO42ˉ
S2ˉ
SO32ˉ
CO32ˉ
SiO32ˉ
PO43ˉ
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
难
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
—
溶
K+
酸碱盐的溶解性表及记忆口诀

酸碱盐的溶解性表
第一条
酸除硅酸全可溶,碱溶钾钠铵钡钙。
钾钠铵盐硝酸盐,全部溶解不困难。
氯化银和硫酸钡,两种沉淀记心间。
碳酸盐除钾钠铵,其余皆不溶于水。
第二条
钾钠铵盐硝酸盐,全都溶于水中间;
溶碱钾钠钡钙铵,碳酸只溶钾钠铵;
硫酸盐中钡不溶,氯化物中银也难;
常见诸酸皆可溶,记住挥酸盐硝碳。
第三条
碱有钾钠铵钡溶,氢氧化钙是微溶。
碳酸铝铁银碱无,钾钠铵硝盐全溶。
硫酸不溶只有钡,硫酸钙银盐微溶。
微溶还有碳酸镁,盐酸只有银不溶。
注:[特殊不溶解:氯化银、硫酸钡不溶于稀硝酸] 第四条
氯盐只有银不溶,碱镁铝锰锌铁铜。
硫酸钡钙银不溶,碳酸钾钠氢氨溶。
氢氧化钙是微溶,钾钠钡铵碱可溶。
红褐铁,蓝絮铜,其它沉淀呈白色。
化学酸碱盐溶解性表以及口诀

阴离子
OH-
NO3-Cl-Βιβλιοθήκη SO42-SO32-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
NH4
溶、挥
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
不
Ca2+
微
溶
溶
微
不
不
Mg2+
不
溶
溶
溶
微
微
Al3+
不
溶
溶
溶
-
-
Mn2+
不
溶
溶
溶
不
不
Zn2+
不
溶
溶
溶
不
不
Fe2+
不
溶
溶
溶
不
不
Fe3+
不
溶
溶
溶
-
-
Cu2+
不
溶
溶
溶
不
不
Ag+
-
溶
不
微
不
不
高中必备知识点
钾钠铵硝皆可溶
盐酸不溶银亚汞
硫酸不溶有钡铅
碳磷酸盐多不溶
溶解只有钾钠铵
多数酸溶碱少溶
只有钾钠铵钡溶
化合价口诀
一价氢氯钾钠银,
二价氧钙钡镁锌.
三铝四硅五氮磷,
二三铁,二四碳,
高中化学盐溶解性表及元素周期表
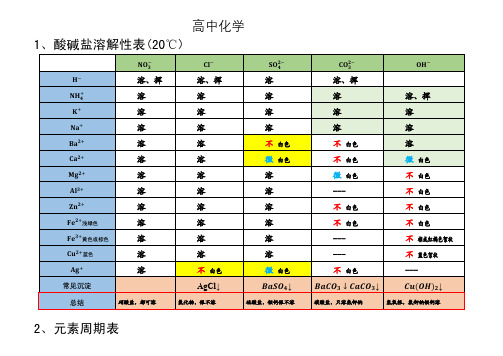
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
部分酸碱盐的溶解性表

Ag2CO3 碳酸银 不
Ag
+
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
O2-
(NH4)2O 硫酸铵 溶 K2O 硫酸钾 溶 Na2O 硫酸钠 溶 BaO 硫酸钡 不 CaO 硫酸钙 微 MgO 硫酸镁 溶 Al2O3 硫酸铝 溶 MnO 硫酸锰 溶 ZnO 硫酸锌 溶 FeO 硫酸亚铁 溶 Fe2O3 硫酸铁 溶 CuO 硫酸铜 溶 Ag2O 硫酸银 微
OHH2O H+ 水 NH3•H2O NH4
+
NO3HNO3 硝酸 溶、挥 NH4NO3 硝酸铵 溶 KNO3 硝酸钾 溶 NaNO3 硝酸钠 溶 Ba(NO3)2 硝酸钡 溶 Ca(NO3)2 硝酸钙 溶 Mg(NO3)2 硝酸镁 溶 Al(NO3)3 硝酸铝 溶 Mn(NO3)2 硝酸锰 溶 Zn(NO3)2 硝酸锌 溶 Fe(NO3)2 硝酸亚铁 溶 Fe(NO3)3 硝酸铁 溶 Cu(NO3)2 硝酸铜 溶 AgNO3 硝酸银 溶
SO42H2SO4 硫酸 溶 (NH4)2SO4 硫酸铵 溶 K2SO4 硫酸钾 溶 Na2SO4 硫酸钠 溶 BaSO4 硫酸钡 不 CaSO4 硫酸钙 微 MgSO4 硫酸镁 溶 Al2(SO4)3 硫酸铝 溶 MnSO4 硫酸锰 溶 ZnSO4 硫酸锌 溶 FeSO4 硫酸亚铁 溶 Fe2(SO4)3 硫酸铁 溶 CuSO4 硫酸铜 溶 Ag2SO4 硫酸银 微
ClHCl 盐酸 溶、挥 NH4Cl 氯化铵 溶 KCl 盐酸 溶 NaCl 氯化钠 溶 BaCl2 氯化钡 溶 CaCl2 氯化钙 溶 MgCl2 氯化镁 溶 AlCl3 氯化铝 溶 MnCl2 氯化锰 溶 ZnCl2 氯化锌 溶 FeCl2 氯化亚铁 溶 FeCl3 氯化铁 溶 CuCl2 氯化铜 溶 AgCl 氯化银 不
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OHˉ
NO3ˉ
Clˉ
SO42ˉ
S2ˉ
SO32ˉ
CO32ˉ
SiO32ˉ
PO43ˉ
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
难
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
—
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶Байду номын сангаас
溶
溶
溶
Ba2+
溶
溶
溶
难
—
微
难
难
难
Ca2+
微
溶
溶
微
—
难
难
难
难
Mg2+
难
溶
溶
溶
—
微
微
难
难
Al3+
难
溶
溶
溶
—
—
—
难
难
Mn2+
难
溶
溶
溶
难
难
难
难
难
Zn2+
难
溶
溶
溶
难
难
难
难
难
Cr3+
难
溶
溶
溶
—
—
—
难
难
Fe2+
难
溶
溶
溶
难
难
难
难
难
Fe3+
难
溶
溶
溶
—
—
—
难
难
Sn2+
难
溶
溶
溶
难
—
—
—
难
Pb2+
难
溶
微
微
难
难
难
难
难
Cu2+
难
溶
溶
溶
难
溶
—
难
难
Hg2+
—
溶
溶
溶
难
难
—
—
难
Ag+
—
溶
难
微
难
难
难
难
难
高中阶段常见酸碱盐溶解性表(25℃,101.3kPa)
