CF系列免疫荧光染料选择方案
细胞免疫荧光染色多色顺序

细胞免疫荧光染色多色顺序
细胞免疫荧光染色的多色顺序通常是根据不同的荧光染料的激发和发射波长来确定的。
一般情况下,荧光染料可以分为三个主要的荧光通道:
1. 绿色通道:通常使用荧光素(FITC)或荧光素类似物(如PE)等绿色荧光染料。
2. 红色通道:通常使用罗丹明B(Texas Red B)或其类似物等红色荧光染料。
3. 蓝色通道:通常使用荧光素(CY3)或荧光素类似物(如CY5)等蓝色荧光染料。
在进行多色荧光染色时,通常先用绿色通道染色,然后用红色通道染色,最后用蓝色通道染色。
这样的顺序可以确保各个通道的染色时间足够长,避免不同通道之间的交叉污染。
同时,这种顺序也可以最大限度地减少不同染料之间的相互干扰,提高染色的准确性和特异性。
当然,具体的多色顺序也可以根据实验的需要进行调整。
例如,如果需要同时检测多个分子的表达,可以使用多个荧光标记的抗体进行染色,然后在不同通道上进行检测。
在这种情况下,多色顺序需要根据具体的实验设计来确定。
免疫荧光实验出现的问题及处理方案

免疫荧光实验出现的问题及处理方案一、引言免疫荧光实验是一种重要的实验方法,广泛应用于生物医学研究中。
然而,在实验过程中,我们时常会遇到一些问题,如背景信号过高、染色效果不理想等。
本文将针对这些常见问题进行分析,并提供相应的处理方案。
二、问题及处理方案2.1背景信号过高在免疫荧光实验中,背景信号过高是常见的问题之一,它会影响到我们对目标物质的检测和分析。
以下是一些可能导致背景信号过高的原因及相应的处理方案:非特异性结合1.:在实验中,可能存在一些非特异性抗体或试剂与样品中的其他成分结合,导致背景信号增大。
解决该问题的方法是使用合适的阴性对照,如对照抗体、缺乏特定抗原的样品等。
未充分洗涤 2.:洗涤步骤不充分可能导致残留的非特异性结合物增多,进而使背景信号过高。
解决该问题的方法是增加洗涤次数,并使用足够的缓冲液来洗涤样品。
荧光染料问题3.:某些荧光染料本身可能存在背景信号较高的情况。
在选择荧光染料时,应注意避免选择背景信号较高的染料。
在实验中,可以尝试不同的荧光染料以减少背景信号。
2.2染色效果不理想除了背景信号过高外,染色效果不理想也是在免疫荧光实验中常见的问题。
以下是一些可能导致染色效果不理想的原因及相应的处理方案:抗体不合适1.:选择不合适的抗体可能导致染色效果不理想。
在实验中,应根据样品的特点选择适当的抗体,并进行充分的优化。
如果抗体来源有问题,应尝试使用其他来源的抗体。
染色条件不合适2.:染色条件的温度、时间等因素对染色效果有重要影响。
如果染色效果不理想,可以尝试调整染色条件,如改变温度、延长或缩短染色时间等。
样品制备问题 3.:样品制备不当可能导致染色效果不理想。
在实验前,应充分准备样品,并采用合适的固定方法和处理步骤,以确保样品的完整性和稳定性。
三、其他问题及处理方案除了背景信号过高和染色效果不理想外,免疫荧光实验还可能存在其他问题,如溶液配制错误、仪器故障等。
以下是一些可能出现的问题及相应的处理方案:溶液配制错误1.:如果实验溶液配制错误,可能会对实验结果产生不利影响。
免疫荧光染色方法介绍

细胞免疫荧光-多重染色1. 原理介绍我们现在来考虑一下多重染色。
使用多个标签进行免疫染色的目的,是在同一细胞或组织切片里,同时对两个或多个抗原进行染色定位。
各个抗原分别使用不同的标签,以便区分。
抗原可以是共定位的,即它们的亚细胞定位一致,或者是分开的。
荧光的作用原理。
荧光分子能吸收特定波长的光,然后发射更长波长的光。
在发出荧光之前,荧光分子跟环境相互作用失去能量,从而达到这一目的,这一现象叫内转换。
电子可以是基态或静止态 S0,也可以是较高能量的激发态 S1 和 S2。
在每一个电子态,荧光染料存在的振动能级可以有多种,包括 0 级、1 级和 2 级。
室温下,能量不足以使电子激发到激发态 S1 和 S2 或基态的较高振动能级。
所以,只有当光存在时,吸收才发生在振动能态最低的分子上。
荧光染料在吸收光后,通常被激发至一个较高的振动能级 S1 或 S2,然后再回到S1的最低振动能级,从而完成内转换过程。
此过程与光子发射过程结合形成荧光。
荧光染料可多次重复这一激发发射循环,直至荧光消失,也就是光漂白。
相较而言,有些荧光素更容易发生光漂白。
例如,FITC 重复激发发射循环约 30000 次后发生光漂白。
而第二代荧光染料,如 Alexa Fluor® 系列的光漂白没有这么快,由于它们有较高的消光系数,比较明亮,更适合用于多标记实验,如本幻灯片图像所示常用到的一种传统染料的组合是:DAPI 蓝色染料、FITC 绿色染料、TRITC 黄色染料和 Cy5® 红色染料。
而相应的第二代染料组合是:DAPI 蓝色染料、Alexa Fluor® 488 绿色染料、Alexa Fluor® 555 黄色染料和 Alexa Fluor® 647 红色染料设计荧光多重标记实验时,可以采取以下几个步骤,以最大限度的减小或消除串色现象。
首先,分析待选荧光素的吸收光谱和发射光谱,结合显微镜滤光片组的特点,评估是否兼容。
免疫荧光通道选择

免疫荧光通道选择免疫荧光通道选择是一项非常重要的实验步骤,可以用来检测样品中的蛋白质或细胞表面分子,并观察它们在细胞内或组织中的定位。
本文将从实验步骤和技巧两方面来详细介绍免疫荧光通道选择的相关知识。
一、实验步骤:1.取样:从细胞或组织中获取需要检测的样品,可以通过培养细胞或组织切片的方式获取。
2.固定样品:用甲醛或乙醛作为固定剂,将样品进行固定。
通常情况下,细胞需要在室温下进行固定10-20分钟,而组织切片需要在4°C下固定1-3小时。
3.脱水:将样品进行脱水处理,这一步骤可以去除样品中多余的水分,便于后续的染色。
4.透明剂处理:将样品进行透明剂处理,这一步骤可以使样品透明,并便于观察。
5.切片:将样品切成薄片,使其能够在显微镜下被观察。
6.离子结合剂:用离子结合剂,如牛血清蛋白、BSA等,来阻止抗体在非特异性结合上的作用,提高特异性。
7.荧光探针:将荧光探针与样品进行染色,这一步骤可以使细胞中的蛋白质或细胞表面分子轻易地被检测到。
二、技巧:1.检测波长选择:在进行染色前,需要根据荧光物质的激发波长和发射波长来选择检测波长。
2.荧光物质选择:根据需要检测的分子类型,选择适合的荧光探针。
3.品牌和抗体选择:尽量使用经过验证的品牌和抗体,以及进行合适的负对照和正对照,确保实验数据的准确性。
4.控制异种抗体的交叉反应:异种抗体在进行荧光染色时可能会产生交叉反应,例如小鼠产生的抗体可能会与人的样品产生交叉反应。
此时可以使用与样品同种类的标记物或选择与样品没有交叉反应的抗体。
5.互补性质:在进行荧光染色时,需要考虑到抗原表位和抗体的互补性质。
如果抗原表位和抗体不互补,则染色效果不佳,影响观察结果。
免疫荧光通道选择在生命科学领域中得到了广泛应用,可以用于检测疾病的诊断、药物研发等多个领域,因此正确地掌握实验步骤和技巧非常重要。
希望本文介绍的内容能够对大家在科学研究中有所帮助。
免疫荧光一抗二抗的选择及其技巧

免疫荧光一抗二抗的选择及其技巧据一抗种属及类型-如何选择二抗?如何选择二抗——根据一抗种属及类型选择合适的二抗二抗广义上是指专门和一抗进行特异性反应和结合的抗体,在免疫学反应中,经常需要针对试验选择不同的二抗,艾美捷能为您的科研工作提供最适合和最全面的二抗产品。
检测任何目的靶蛋白都有不止一种抗体可供选择,同时在后继试验中也会有不同的检测方案,因此在选择二抗的时候要综合考虑一抗的类型及后继检测方案的要求,一般来说,选择合适的二抗需要从下面几个方面考虑:【一抗的种属来源】二抗应选用与使用的一抗相同的物种来源,例如:如果你的一抗是小鼠源的单克隆抗体,二抗则选抗小鼠的二抗(山羊抗小鼠或者兔抗小鼠等均可);如果一抗是从兔血清里制备的兔源多克隆抗体,则相应的二抗需要选择抗兔的二抗。
即根据一抗的物种来源选择相应的抗该物种的二抗。
艾美捷能为您提供最全的抗不同种属的原装进口二抗,包括抗小鼠、大鼠、兔、山羊、绵羊、人、豚鼠、猪、马、牛、鸡、鸭等二抗。
【一抗的类别亚型】二抗需与一抗的类别或亚类相匹配。
这通常是针对单克隆抗体而言。
多克隆抗体主要是IgG类免疫球蛋白,因此相应的二抗就是抗IgG抗体。
其中单克隆抗体的类别及亚类通常会在产品说明书中都会有描述,如果你的一抗是小鼠IgM,那么相应的二抗就应当是抗小鼠IgM。
如果单克隆一抗是小鼠IgG的某一亚类(IgG1,IgG2a,IgG2b,IgG3),那么几乎所有的抗小鼠IgG都可以与之结合,或者你也可以选择专门针对这一亚类的二抗,例如,如果你的一抗是小鼠IgG1,那么你可以选择抗IgG1的二抗,此种抗体在双标记实验中尤其适合。
在不清楚一抗为何种类/亚类的情况下,可以选用抗相应物种IgG。
艾美捷能为您提供通用的IgG(H+L)二抗,或者特异性只结合IgM的Anti IgM (mu) Antibody、IgA的Anti IgA (alpha-Antibody、IgE的Anti IgE (epsilon) Antibody等。
免疫荧光(IF)细胞化学染色方法

免疫荧光(IF)细胞化学染⾊⽅法免疫荧光(IF)细胞化学染⾊⽅法⼀、标本制作 可制作涂⽚、印⽚、细胞单层培养物、组织切⽚,经适当固定或不固定,作免疫荧光染⾊⽤。
⼆、荧光抗体染⾊⽅法 (⼀)直接法 1.染⾊切⽚经固定后,滴加经稀释⾄染⾊效价如1:8或1:16的荧光抗体(如兔抗⼈γ-球蛋⽩荧光抗体或兔抗⼈IgG或IgA荧光抗体等),在室温或37℃染⾊30min,切⽚置⼊能保持潮湿的染⾊盒内,防⽌⼲燥。
2.洗⽚ 倾去存留的荧光抗体,将切⽚浸⼊pH7.4或pH7.2PBS中洗两次,搅拌,每次5min,再⽤蒸馏⽔洗1min,除去盐结晶。
3.⽤50%缓冲(0.5mol/L碳酸盐缓冲液pH9.0~9.5)⽢油封固、镜检 4.对照染⾊ ①正常免荧光⾎清染⾊,如上法处理切⽚,结果应为阴性。
②染⾊抑制试验(⼀步法):将荧光抗体和未标记的抗体球蛋⽩或⾎清(相同)等量混合,如上法处理切⽚。
结果应为阴性。
为证明此种染⾊抑制不是由于荧光抗体被稀释所致,可⽤盐⽔代替未标记抗⾎清,染⾊结果应为阳性。
此法结果较⼆步法稳定。
③类属抗原染⾊试验,前⾯已作叙述。
直接法⽐较简单,适合做细菌、螺旋体、原⾍、真菌及浓度较⾼的蛋⽩质抗原如肾、⽪肤的检查和研究。
此法每种荧光抗体只能检查⼀种相应的抗原,特异性⾼⽽敏感性较低。
(⼆)间接法 (1)切⽚固定后⽤⽑细滴管吸取经适当稀释的免疫⾎清滴加在其上,置于染⾊盒中保持⼀定的湿度,37℃作⽤30min。
然后⽤0.01mol/l pH7.2PBS洗两次,10min,⽤吸⽔吸去或吹⼲余留的液体。
(2)再滴加间接荧光抗体(如兔抗⼈γ-球蛋⽩荧光抗体等),同上步骤,染⾊30min,37℃,缓冲盐⽔洗两次10min,搅拌,缓冲⽢油封固,镜检。
对照染⾊:①抗体对照:⽤正常兔⾎清或⼈⾎清代替免疫⾎清,再⽤上法进⾏染⾊,结果应为阴性。
②抗原对照:即类属抗原染⾊,亦应为阴性。
③阳性对照。
间接法中上述⽅法称双层法(Double Layer Method)。
想做多重免疫荧光收好指南教你一张片子染出七种颜色

想做多重免疫荧光?收好指南,教你一张片子染出七种颜色想做多重免疫荧光?需要先思考这几个问题:问题1:你认得全动物园里的动物们吗,比如大鼠,小鼠,兔,山羊,绵羊,鸡,荷兰猪(豚鼠)?不同种属的抗体需闹清楚。
问题2:你确定能分得清字母表并做得了十以内得加减法吗?有不同亚型鉴定的过的一抗,比如:IgG1,IgG2a,IgG2b,IgG2c,IgM,IgE 不知道怎能行?问题3:你确定能将动物和数字字母们对号入座,并找对门牌吗?有对应种属特异反应性的Fab 二抗,比如:F(ab')2 Fragment (避免Fc 反应性出现的非特异染色),Cross adsorbed(抗体纯化过程交叉吸附,避免物种交叉反应带来的背景)。
问题4:你确定能将重峦叠嶂移出两山排闼吗?选择合适的荧光素,明辨激发光和发射光,且不会导致荧光背景增强,比如:FITC、PE、Cy、Alexa Fluor、DyLight。
就算上面的问题你都能搞定,订购来了各种试剂,准备来了片子,你就一定能染出来多重颜色?你只是迈开了万里长征的第一步而已。
因为要得到理想的荧光实验结果,每一个步骤都需深(w ā) 度(kēng) 优(mái) 化(tǔ),固定通透方法、浓度配比、抗体共孵育、抗体稀释液、封闭条件等等。
此时,有人在你发际线还没有升高,头发还乌黑浓密的时候,在你的耳边悄悄跟你说:做多重荧光简单,有种快捷省时的方法。
先让你们随意感受一下这种方法染出来的图片:接下来我们将仔细介绍该方法实验原理和实验步骤。
多重荧光免疫组化(mIHC)实验原理上述方法采用TSA 技术(Tyramide Signal Amplification?,酪胺信号放大技术):简单来说,用该方法做多重免疫荧光是利用二抗上带有的HRP(而不是直接偶联荧光素),来催化后续添加入体系的非活性荧光素。
荧光素在HRP 和过氧化氢的作用下被活化,跟临近蛋白的酪氨酸残基共价偶联,使得蛋白样品与荧光素稳定结合。
免疫荧光染色一抗二抗的稀释方法

免疫荧光染色一抗二抗的稀释方法《免疫荧光染色一抗二抗的稀释方法:独家秘籍大放送!》嘿,宝子们!今天我要跟你们唠唠免疫荧光染色中一抗二抗的稀释方法,这可是我在实验室摸爬滚打这么久总结出来的小秘籍,就像厨师做菜的独特配方一样,可珍贵着呢!首先呢,咱们来说说一抗。
在开始稀释之前,你得先搞清楚一抗的来源、特异性和推荐的工作浓度范围。
这就好比你要去约会,得先了解对方的喜好、性格啥的,不能盲目行动。
比如说我之前有次没仔细看一抗的来源,结果拿错了相关的试剂,就像你去约会结果找错了人一样,那可就尴尬了,实验结果也是一塌糊涂。
一、一抗的稀释1. 选择合适的稀释液一般来说,我们会用专门的抗体稀释液,这就像是一抗的“专属饮料”,可以让它在合适的环境下发挥作用。
不过有时候,也可以根据实际情况用PBS(磷酸缓冲盐溶液)之类的。
但千万别拿错成其他奇奇怪怪的溶液哦,不然一抗会像鱼儿进了开水里,直接“歇菜”了。
2. 确定稀释比例这可是个关键步骤。
通常,抗体的说明书上会给一个推荐的工作浓度范围,就像菜谱上给的食材用量范围一样。
但这个范围只是个参考,实际操作中可能需要根据你的样本类型、抗原表达水平等进行调整。
如果你的抗原像个爱出风头的大明星,表达量很高,那你就可以把一抗稀释得浓一点,就像给明星的聚光灯不用开那么亮一样;要是抗原比较低调,表达量少,那你就得把一抗稀释得淡一点,就像要努力去发现隐藏在角落里的小宝藏,需要更敏锐的“探测工具”。
我一般的做法是,先从推荐范围的中间值开始尝试。
比如推荐是1:100 - 1:1000,我就先选1:500来试试。
然后做个小的预实验,就像先试吃一小口菜,看看味道对不对。
在载玻片或者孔板里用这个稀释比例的一抗去处理你的样本,然后进行后续的免疫荧光染色步骤。
如果染色效果太浅,就像妆容太淡看不太出来一样,那就说明一抗浓度可能低了,下次可以提高浓度;如果染色背景太深,就像粉底打得太厚,不自然,那可能一抗浓度高了,下次就降低浓度。
免疫荧光三色染色步骤

免疫荧光三色染色步骤免疫荧光三色染色是一种常用的免疫组化技术,用于检测和定位细胞或组织中的特定抗原。
通过使用三种不同的荧光染料,可以同时检测三种不同的抗原,从而在同一样本中获得更多的信息。
下面是免疫荧光三色染色的步骤:1. 样本处理:首先需要准备好待检测的细胞或组织样本。
可以通过固定、切片和脱脂等步骤来处理样本,以便于荧光染料的渗透和抗原的暴露。
2. 抗原修复:某些细胞或组织中的抗原可能会经历一定程度的损伤或变性,需要进行抗原修复以恢复其免疫反应性。
常用的抗原修复方法包括热处理、酶解和化学修复等。
3. 阻断非特异性结合:为了避免荧光染料的非特异性结合,需要使用适当的阻断剂来防止非特异性结合。
常用的阻断剂包括牛血清蛋白、小鼠或兔子血清等。
4. 一抗染色:选择合适的一抗,加入到样本中与目标抗原结合。
一抗可以是单克隆抗体或多克隆抗体,根据实验的需要选择合适的一抗。
5. 二抗染色:二抗是与一抗结合的抗体,通常是兔抗小鼠或小鼠抗兔的抗体。
二抗上标记有荧光染料,常见的有荧光素、荧光素同工酶和荧光素同工酶等。
6. 染色显色:将标记有荧光染料的二抗加入到样本中,与一抗所结合的抗原发生特异性反应,形成荧光染色的复合物。
7. 洗涤:染色完成后,需要进行多次洗涤以去除未结合的抗体和荧光染料,减少背景信号的干扰。
8. 封片:将处理好的样本用适当的封片剂封装在载玻片上,然后使用适当的封片胶或胶带固定样本。
通过以上步骤,可以实现免疫荧光三色染色的目的。
这种技术可以在细胞或组织中同时检测和定位多种抗原,为科研工作者提供更多的信息和数据。
需要注意的是,在进行免疫荧光三色染色时,要选择合适的一抗和二抗,以及荧光染料的激发和发射波长。
此外,还需要进行严格的实验控制,包括阴性对照和阳性对照,以确保实验结果的准确性和可靠性。
免疫荧光三色染色技术在生命科学研究中具有广泛的应用,可以用于研究细胞分子机制、疾病诊断和治疗等方面。
随着技术的不断发展和改进,相信免疫荧光三色染色技术将在未来的研究中发挥更大的作用。
荧光二抗染料选择方案
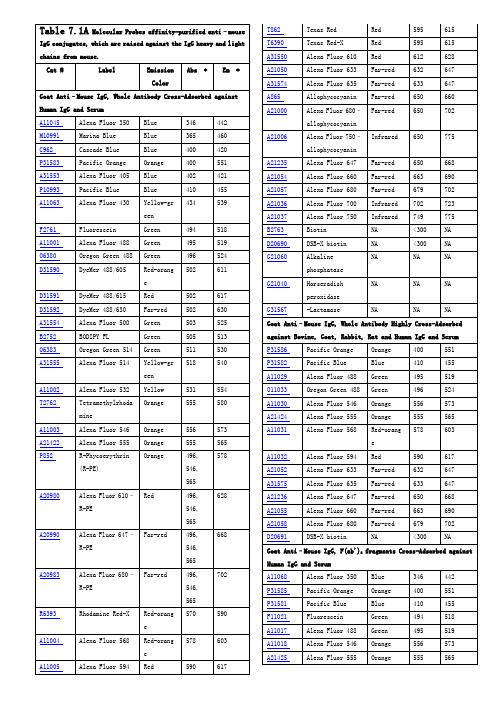
Red Red Red Far-red Far-red Far-red Far-red
595 595 612 632 633 650 650
615 615 628 647 647 660 702
IgG conjugates, which are raised against the IgG heavy and light chains from mouse. Cat # Label Emission Color Goat Anti–Mouse IgG, Whole Antibody Cross-Adsorbed against Human IgG and Serum A11045 M10991 C962 P31583 A31553 P10993 A11063 Alexa Fluor 350 Marina Blue Cascade Blue Pacific Orange Alexa Fluor 405 Pacific Blue Alexa Fluor 430 Blue Blue Blue Orange Blue Blue Yellow-gr een F2761 A11001 O6380 D31590 Fluorescein Alexa Fluor 488 Oregon Green 488 DyeMer 488/605 Green Green Green Red-orang e D31591 D31592 A31554 B2752 O6383 A31555 DyeMer 488/615 DyeMer 488/630 Alexa Fluor 500 BODIPY FL Oregon Green 514 Alexa Fluor 514 Red Far-red Green Green Green Yellow-gr een A11002 T2762 Alexa Fluor 532 Tetramethylrhoda mine A11003 A21422 P852 Alexa Fluor 546 Alexa Fluor 555 R-Phycoerythrin (R-PE) Orange Orange Orange 556 555 496, 546, 565 A20980 Alexa Fluor 610– R-PE Red 496, 546, 565 A20990 Alexa Fluor 647– R-PE Far-red 496, 546, 565 A20983 Alexa Fluor 680– R-PE Far-red 496, 546, 565 R6393 Rhodamine Red-X Red-orang e A11004 Alexa Fluor 568 Red-orang e A11005 Alexa Fluor 594 Red 590 617 578 603 570 590 702 668 628 573 565 578 Yellow Orange 531 555 554 580 502 502 503 505 511 518 617 630 525 513 530 540 494 495 496 502 518 519 524 611 346 365 400 400 402 410 434 442 460 420 551 421 455 539 Abs * Em *
免疫荧光染色方法

免疫荧光染色方法免疫荧光染色方法是一种广泛应用于生物学研究领域的技术,可以用于检测和定位特定抗原分子在细胞或组织中的分布和表达情况。
该方法利用抗体与特定抗原结合,并利用荧光染料标记抗体,通过显微镜观察荧光信号来确定抗原的位置和表达量。
免疫荧光染色方法具有高灵敏度、高分辨率和广泛的应用范围,因此在细胞生物学、分子生物学、免疫学等领域得到了广泛应用。
首先,需要固定样品以保持细胞或组织的形态和结构。
常用的固定剂包括乙醛、甲醛和氯酸等,可以在细胞或组织中形成交联结构,固定抗原。
固定剂的选择应根据具体实验目的和样品类型来确定。
接下来,渗透化步骤是为了提高抗体与抗原的结合效率,并使抗体能够穿透细胞或组织进行染色。
常用的渗透剂包括甲醇、乙醇、Triton X-100等。
渗透化的时间和条件需根据样品的特性和实验要求来确定。
最后,通过荧光检测来观察和分析抗原在样品中的分布和表达情况。
荧光检测通常利用荧光显微镜来观察光信号。
在荧光染色中,主要有两种常用荧光染料,一种是荧光素和异硫氰酸荧光素(FITC),另一种是罗丹明(Rhodamine)。
这些染料在特定波长下能产生荧光,并且可以选择性地与抗体结合,形成荧光复合物。
通过荧光显微镜观察这些标记的复合物,可以确定抗原在样品中的位置和表达量。
除了基本的免疫荧光染色方法,还有一些其他的变种方法可供选择,例如间接免疫荧光染色、多重免疫荧光染色、双标记荧光染色等。
这些方法可以进一步提高检测的敏感性和分辨率,并提供更多的信息。
总的来说,免疫荧光染色方法是一种重要的生物学研究工具,可以用于检测和分析抗原的表达和定位。
随着技术的不断发展,免疫荧光染色方法在细胞和分子生物学研究中的应用前景将更加广阔。
CF染料抗体快速标记试剂盒问答

Mix-n-Stain常见问题:问:标记的原理是化学性质的还是物理性质的?答:标记的原理是化学性质的,也就是说染料是通过共价化学键的方式与抗体之间进行结合。
化学共价键的结合方式能够确保在多重染色的情况下,多种被不同CF染料标记试剂盒标记的抗体之间不会发生染料重分布和迁移。
问:与Invitrogen的Zeon抗体标记试剂盒相比,Mix-n-Stain具有什么优势?答:优点主要有四个:1)CF染料是通过化学共价键的方式与抗体结合,在多重染色的情况下,能够消除各种染料在不同抗体间的迁移。
2)Mix-n-Stain标记的抗体在储存缓冲体系中可以保存几个月的时间,而Zeon只能保持30分钟。
3)Mix-n-Stain中的CF染料使标记的抗体偶合物化学构象改变更少,因为CF染料通过化学键直接与抗体偶联,不像Zenon是通过其他抗体片段与目标抗体偶联。
4)无需计算染料/蛋白样品比例,只需简单混合和标记即可。
问:什么是CF染料,相比于Alexa Fluor染料有何优势?答:CF染料是高度溶于水,由Biotium科学家研发的标记蛋白质和核酸的有机染料。
是一系列颜色超过20种,大部分的CF染料比的Alexa Fluor染料的荧光强度更高。
特别是我们远红光和近红外CF染料,亮度和耐光性远远超越Alexa Fluor染料。
如需更详细的比较说明,详见CF染料产品的传单。
问:没有纯化操作步骤,如何去除无染料标记的游离抗体?答:这个问题也涉及到我们研发的核心点,我们独特的染料和缓冲液的配方以及荧光抗体耦联策略的已完全消除这种传统荧光抗体制备过程中的疑虑。
应用Mix-n-Stain标记试剂盒,你完全不必担心该问题,我们关于该问题解决原理的专属信息。
问:CF染料是共价连接到抗体的赖氨酸或半胱氨酸侧链吗?答:染料共价结合的氨基酸侧链区域远离抗原抗体特异结合位点,以保证不影响抗体的亲和力。
然而,确切结合位点和化学偶联性质也有专属信息。
细胞免疫荧光染色多色顺序

细胞免疫荧光染色多色顺序细胞免疫荧光染色是一种用于研究细胞免疫应答的重要技术。
通过使用特定的抗体和荧光染料,可以将不同种类的细胞和细胞亚群在显微镜下进行区分和观察。
本文将介绍一种常用的多色顺序染色方法,以帮助读者更好地理解这一技术。
我们需要准备样本。
可以选择合适的细胞系或组织,然后将其固定和包埋。
固定可以使用一些常见的化学品,如甲醛或乙醛,固定后的样本可以长期保存,并且不会对抗原结构进行破坏。
接下来,我们需要选择合适的抗体和荧光染料。
抗体可以选择特异性识别我们感兴趣的细胞表面分子或细胞内标志物的抗体。
荧光染料可以根据需要选择,常用的有荧光素、荧光蛋白等。
在进行染色之前,我们需要对样本进行适当的处理。
可以使用一些特定的缓冲液,如PBS(磷酸盐缓冲液)或TBS(三氯甲烷缓冲液),来洗涤样本,去除不必要的物质,并增强抗体的结合。
然后,我们可以开始染色了。
首先,需要将适当稀释的抗体加入到样本中,使其与目标分子结合。
一般情况下,孵育时间在30分钟至1小时之间,温度为室温或4°C。
然后,需要用缓冲液洗涤样本,以去除未结合的抗体。
接下来,我们可以加入第二个抗体和荧光染料。
这个抗体通常是针对第一个抗体的种属特异性的抗体,比如将兔抗小鼠二抗用于结合第一抗体。
荧光染料可以选择与第一抗体不同的颜色,以便在显微镜下区分两种标记。
同样,需要进行适当的洗涤步骤来去除未结合的抗体和荧光染料。
然后,可以选择继续进行下一轮染色,以标记更多的细胞亚群或标志物。
这里需要注意的是,每一轮染色之间的洗涤步骤非常重要,以避免不同染色之间的交叉污染。
我们可以在荧光显微镜下观察和记录染色结果。
通过观察不同颜色的荧光信号,我们可以确定细胞的类型和状态,并进一步研究其功能和相互作用。
细胞免疫荧光染色多色顺序方法可以帮助我们更全面地理解细胞免疫应答。
通过选择合适的抗体和荧光染料,并进行适当的染色和洗涤步骤,我们可以将不同种类的细胞和细胞亚群清晰地区分开来。
CF系列免疫荧光染料选择方案

常用抗体标记荧光染料的选择随着免疫荧光技术的不断发展,荧光染料及其标记的抗体偶联物也被广泛的应用于生物学实验中。
目前,市场上抗体及蛋白标记的荧光染料主要有CF TM系列(BIOTIUM, USA); Alexa Fluor®系列(Life technology, USA); DyLight系列; Cy系列; IR Dye系列等等。
使用最多的为Alexa Fluor®系列和CF TM系列。
CF TM系列染料的核心对比Alexa Fluor®系列具有以下几点优势:1.新型罗丹明核心罗丹明染料以优异的耐光性和良好的荧光量子产量著称。
因此很多Alexa Fluor®染料具有罗丹明核心结构,但是,传统罗丹明的化学结构很难从长波长的荧光染料延伸至远红外区域甚至是更具挑战性的近红外区域,而且生物偶联后其水溶性并不理想。
Biotium 科学家发现从绿色到近红外多色荧光的罗丹明染料的新型化学方法。
该方法被有效的应用于CF染料的产品中,尤其是远红外CF染料,而且通过这种方法制备的染料不仅水溶性极佳而且耐光性极好。
如:(下图)图3. CF系列染料的稳定性,图示为CF633在5min中仍然具有稳定的荧光强度;而AF647 Dy e在1min左右已经淬灭。
2.特异性高的近红外染料近红外染料最大的特点是比可见光范围要大很多,大滴的染料常会导致染料水溶性低、染料聚合体多、荧光量子产量差等问题。
为了解决这些问题,许多商用的近红外染料比如Alexa Fluor®、 DyLight®dyes 和 IRDyes®近红外染料,在制备时吸附了大量的带负电荷的磺化基团,其磺化作用可以在一定程度上会提高染料的溶解性和荧光性,但这样也带来了另一些更加严重的问题,经这种染料标记的生物耦联物的非特异性结合。
例如:与大量负电荷结合后可以显著的改变抗体的等电点,进而影响抗原抗体的特异性结合反应。
免疫分析中常用的荧光染料与标记染色

(一)免疫荧光标记最常用的荧光染料最常用的染料有FITC和藻红蛋白类(PE)及罗丹明等。
FITC(异硫氰酸荧光素):绿色530nm PE(藻红蛋白):橙黄色575nm PerCP (多甲藻黄素叶绿素蛋白):深红色675nm PI(碘化丙啶):橙红色620nm 488nm波长的氩离子激光激发APC(别藻青蛋白):红色660nm 630nm波长的氦氖激光或红色二极管激光激发(二)免疫荧光标记常用的标记染色为直接免疫荧光染色和间接免疫荧光染色。
在进行双参数或多参数分析时,常常需要进行荧光抗体的组合标记,目前已经有双色、三色以及四色标记。
(三)细胞自发荧光自发荧光信号为噪声信号,在多数情况下会干扰对特异荧光信号的分辨和测量。
在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。
一般说来,细胞成分中能够产生自发荧光的分子(例如核黄素、细胞色素等)的含量越高,自发荧光越强;培养细胞中死细胞/活细胞比例越高,自发荧光越强;细胞样品中所含亮细胞的比例越高,自发荧光越强。
免疫荧光染色方法

免疫荧光染色方法(一)制片选无自发性荧光的石英玻片或普通优质玻片,洗净后浸泡于无水乙醇和乙醚等量混合液中。
用时取出用绸布擦净。
将待检样品如组织块剪成适当大小印压于玻片上。
也可采用冰冻切片或石蜡切片样品。
(二)固定除研究细胞表面抗原或不稳定抗原可不固定外,一般均应固定。
固定的作用有三:①防止标本从玻片上脱落;②除去防碍抗原—抗体结合的类脂,使抗原抗体结合物易于获得良好的染色结果;③固定的标本易于保存,如组织切片固定后在-20℃下可保存一年而不改变其染色特性。
标本的固定原则是:①不能损伤细胞内的抗原;②不能凝集蛋白质;③不能损伤细胞形态;④固定后应保持细胞膜的通透性,以允许抗体进入与抗原结合。
(三)水洗固定后以冷的0.01Mol/L pH7.4PBS液浸泡冲洗,最后以蒸馏水冲洗,防止自发性荧光。
(四)染色染色分直接染色法与间接染色法。
1.材料与试剂(1)荧光抗体,稀释至应用浓度。
(2)0.01Mol/L pH7.4PBS液(3)9份优质甘油加1份pH7.4PBS液即为甘油缓冲液。
甘油有减少非特异性荧光的作用。
(4)带盖方盘2.直接染色法(1)将固定好的玻片置于湿盘中,滴加荧光抗体染色液,以覆盖为度,加盖,37℃感做30 min~45min。
(2)PBS冲洗3次,每次冲洗3min,即3×3ˊ冲洗。
(3)蒸馏水冲洗。
(4)滴甘油缓冲液一滴,封片,荧光显微镜检查。
2.间接染色法(1)检查抗原:①取固定标本,加已知的免疫血清,37℃孵育30min;②以PBS液3×3ˊ冲洗;③再加荧光标记的抗抗体,37℃孵育30min;④PBS 3×3ˊ冲洗;⑤H2O冲洗,凉干;⑥加甘油缓冲液,封片、镜检。
(2)检查抗体:①以免疫后动物的淋巴组织涂片,自然干燥,甲醇固定;②滴加相应抗原液(按1﹕100~1﹕500稀释),37℃孵育30min;③PBS液3×3ˊ冲洗;④加荧光抗体,37℃孵育30min;⑤PBS液3×3ˊ冲洗;⑥水洗,凉干;⑦加甘油缓冲液,封片、镜检。
免疫荧光染色术的原理和方法

免疫荧光染色术的原理和方法免疫荧光染色术,这名字一听就让人觉得很高深对吧?它就像是一种“闪亮亮”的探测器,能帮我们“看见”体内那些微小到几乎看不见的物质。
你想啊,细胞、蛋白质这些小家伙,肉眼是完全无法察觉的。
科学家就像侦探一样,拿着这项技术,能精准找到隐藏在细胞里的“罪犯”——那些可能会导致疾病的病原体,或者是那些变异的蛋白质。
你以为这只是个小工具?不,它是生物医学领域里,尤其在癌症、免疫学研究中,一项“重头戏”呢!简单来说,免疫荧光染色术是通过抗体和荧光染料来标记目标分子,然后在荧光显微镜下通过观察发出的光信号,来“追踪”它们。
听起来是不是有点像科幻电影里的设备?不过,这个技术是真的能够让我们看到细胞内部那些看似“不可能”存在的微小细节。
就拿抗体来说,它就像是一把钥匙,能精确找到并锁住某些分子或蛋白质。
然后,我们再通过荧光染料给它们上色。
这些染料可是有趣的东西哦,涂抹上去后,它们会在紫外光下发出明亮的荧光。
就好像是夜空中最亮的星星,照亮了细胞内部的每个角落。
但你知道吗,免疫荧光染色可不是一蹴而就的事儿。
整个过程就像在做一个大工程,步骤繁琐但是也充满了成就感。
我们需要“固定”细胞。
这一步很关键,如果不做固定,细胞可能会因处理过程中受到干扰而变形,搞不好连基本的结构都看不清。
之后,我们用一种溶液把细胞膜的脂质“溶解”,让抗体可以顺利进入细胞“内部”。
才是最酷的部分:我们会用特异性的抗体去标记我们感兴趣的目标分子。
这就像是用显微镜去找“隐形人”,如果这隐形人(也就是目标分子)跟我们的抗体“亲密接触”,它就会被染色,亮起荧光。
这时候,我们的显微镜就变成了真正的侦探工具,可以让我们看到那些细胞内部复杂而细腻的结构。
再说说为什么这项技术在医学研究中那么重要。
假设你是一名医生,面对一个疑难杂症的病人,光凭经验和常规检查,根本无法确定病因。
可是如果你能用免疫荧光染色术来“标记”病人的细胞,找出其中的病理变化,你就能找到问题的根源。
免疫荧光染色方法

免疫荧光染色方法(一)制片 选无自发性荧光的石英玻片或普通优质玻片,洗净后浸泡于无水乙醇和乙醚等量混合液中。
用时取出用绸布擦净。
将待检样品如组织块剪成适当大小印压于玻片上。
也可采用冰冻切片或石蜡切片样品。
(二)固定除研究细胞表面抗原或不稳定抗原可不固定外,一般均应固定。
固定的作用有三:①防止标本从玻片上脱落;②除去防碍抗原—抗体结合的类脂,使抗原抗体结合物易于获得良好的染色结果;③固定的标本易于保存,如组织切片固定后在-20℃下可保存一年而不改变其染色特性。
标本的固定原则是:①不能损伤细胞内的抗原;②不能凝集蛋白质;③不能损伤细胞形态;④固定后应保持细胞膜的通透性,以允许抗体进入与抗原结合。
(三)水洗固定后以冷的0.01Mol/L pH7.4PBS液浸泡冲洗,最后以蒸馏水冲洗,防止自发性荧光。
(四)染色染色分直接染色法与间接染色法。
1.材料与试剂(1)荧光抗体,稀释至应用浓度。
(2)0.01Mol/L pH7.4PBS液(3)9份优质甘油加1份pH7.4PBS液即为甘油缓冲液。
甘油有减少非特异性荧光的作用。
(4)带盖方盘2.直接染色法(1)将固定好的玻片置于湿盘中,滴加荧光抗体染色液,以覆盖为度,加盖,37℃感做30 min~45min。
(2)PBS冲洗3次,每次冲洗3min,即3×3ˊ冲洗。
(3)蒸馏水冲洗。
(4)滴甘油缓冲液一滴,封片,荧光显微镜检查。
2.间接染色法(1)检查抗原:①取固定标本,加已知的免疫血清,37℃孵育30min;②以PBS液3×3ˊ冲洗;③再加荧光标记的抗抗体,37℃孵育30min;④PBS 3×3ˊ冲洗;⑤H2O冲洗,凉干;⑥加甘油缓冲液,封片、镜检。
(2)检查抗体:①以免疫后动物的淋巴组织涂片,自然干燥,甲醇固定;②滴加相应抗原液(按1﹕100~1﹕500稀释),37℃孵育30min;③PBS液3×3ˊ冲洗;④加荧光抗体,37℃孵育30min;⑤PBS液3×3ˊ冲洗;⑥水洗,凉干;⑦加甘油缓冲液,封片、镜检。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用抗体标记荧光染料的选择随着免疫荧光技术的不断发展,荧光染料及其标记的抗体偶联物也被广泛的应用于生物学实验中。
目前,市场上抗体及蛋白标记的荧光染料主要有CF TM系列(BIOTIUM, USA); Alexa Fluor®系列(Life technology, USA); DyLight系列; Cy系列; IR Dye系列等等。
使用最多的为Alexa Fluor®系列和CF TM系列。
CF TM系列染料的核心对比Alexa Fluor®系列具有以下几点优势:1.新型罗丹明核心罗丹明染料以优异的耐光性和良好的荧光量子产量著称。
因此很多Alexa Fluor®染料具有罗丹明核心结构,但是,传统罗丹明的化学结构很难从长波长的荧光染料延伸至远红外区域甚至是更具挑战性的近红外区域,而且生物偶联后其水溶性并不理想。
Biotium 科学家发现从绿色到近红外多色荧光的罗丹明染料的新型化学方法。
该方法被有效的应用于CF染料的产品中,尤其是远红外CF染料,而且通过这种方法制备的染料不仅水溶性极佳而且耐光性极好。
如:(下图)图3. CF系列染料的稳定性,图示为CF633在5min中仍然具有稳定的荧光强度;而AF647 Dy e在1min左右已经淬灭。
2.特异性高的近红外染料近红外染料最大的特点是比可见光范围要大很多,大滴的染料常会导致染料水溶性低、染料聚合体多、荧光量子产量差等问题。
为了解决这些问题,许多商用的近红外染料比如Alexa Fluor®、 DyLight®dyes 和 IRDyes®近红外染料,在制备时吸附了大量的带负电荷的磺化基团,其磺化作用可以在一定程度上会提高染料的溶解性和荧光性,但这样也带来了另一些更加严重的问题,经这种染料标记的生物耦联物的非特异性结合。
例如:与大量负电荷结合后可以显著的改变抗体的等电点,进而影响抗原抗体的特异性结合反应。
综合以上内容,Biotium 的科学家用革命性的方法设计出近红外染料C F,在避免引入大量负电荷的情况下,极大的保证了染料优异的理化特性。
Biotium 近红外的CF 染料以花青或罗丹明染料为核心结构,该核心结构的特殊化学修饰限制了染料的分子内位移,从而获得染料的高量子产率和更好的水溶性。
因此,近红外CF染料比其他近红外染料荧光强度更高,光稳定性好。
最重要的是,在免疫印迹实验上应用近红外CF染料标记蛋白质样品相对于其他商业用近红外染料制备的抗体偶联物,最大限度的提高了信噪比。
(见下图)图2. AF 染料(左图)结构中含有大量的磺化基团SO3-来增加染料的水溶性,但大量磺化基团的引入会使染料带大量负电荷,在标记蛋白和抗体时,容易非特异性吸附带正电荷的蛋白和抗体基团。
而CF系列染料(右图)是经过新型改造过的染料,不会存在上述情况,而且染料的水溶性极好。
图4. CF染料的超强特异性;由于AF染料制备过程中含有大量带负电的磺化基团,容易非特异性结合正电基团,请看AF790 Dy e与CF790的条带特异性对比。
3.优异的标记效率生物偶联后的活性染料一般很容易水解,会在运输,操作及储存中带来诸多不便,最终致染料结合效率低下。
像Alexa Fluor® dyes,DyLight™dyes and IRDyes®等严重的磺化作用有较强的吸湿性,恶化水解作用等问题。
例如:AlexaFluor® 488 在应用时琥珀酰亚胺脂酯SE 活性部分远低于50%(AlexaFluor488微量标记试剂盒产品信息,Invitrogen)。
相反,所有Biotium 的CF染料具有相对稳定的胺活性的SE基团型,这比大部分AlexaFluor 染料的SE更耐水解。
总体来说,CF染料SE产品一贯的给出更高的标记效率,提供给用户更好的使用价值。
选择方案:蓝色(350-450nm处激发)CF 350 、Alexa Fluor 350、AMCA等----亮蓝和紫外光激发CF350是类似于Alexa Fluor 350和传统荧光染料AMCA的蓝色荧光染料,CF350的荧光强度高于Alexa Fluor 350、AMCA , 吸附在蛋白上的荧光超过50%, 水溶性更好, 耐光性非常优秀亮, 更容易与现有的绿色荧光基团区分。
CF 405S/ CF 405 M、Alexa Fluor 405 ----近乎完美的匹配蓝色二极管激光器CF 405S/ CF 405 M 、Alexa Fluor 405与近来使用的荧光显微镜和流式细胞仪405nm; 谱线的蓝色二极管激光器完美的匹配。
在流式细胞仪上的分析结果显示CF 405S/ CF 405 M 荧光信号强度高于Alexa Fluor 405染料1.7倍。
绿色(488nm处激发)CF 488A、Alexa Fluor 488、FITC、FAM、DyLight 488、Cy2等----针对488nm 氩离子激光器的绿色荧光染料;以上染料其标记的抗体蛋白适用于所有配备488nm氩离子激光器的流式细胞仪;流式细胞仪的FL1通道检测;或者可用于荧光显微镜技术;CF 488A最低限度的带电量降低了与抗体耦联物的非特异性结合;在红色通道溢出少于Alexa Fluor 488;耐光性好;水溶性好和pH 不敏感;良好的稳定性和活性染料的标记率。
Alexa Fluor 488在较宽的PH值范围内保持稳定(PH4~10);FITC激发波长488nm,最大发射波长525nm;缺点荧光强度易受PH值影响,PH值降低时其荧光强度减弱。
橙红色(543-555nm处激发)CF 543、Alexa Fluor 546、ATTO550, Cy 3, DyLight 549, Rhodamine (TRITC) 匹配543nm 的橙色荧光染料;CF ™543 荧光条带明亮,耐光,水溶性好,确保了CF 543 染料与抗体的耦联物保持优异的水溶性,为该波段最亮的橙色荧光染料。
例如:同等的标记程度下,CF 543 标记的羊抗鼠IgG抗体的亮度高于用Alexa Fluor 546 标记的2~10倍。
CF 555、Alexa Fluor 555、Tetramethylrhodamine (TAMRA) 等匹配Cy3滤光片的橙色荧光染料;红色(568-594nm处激发)CF 568、Alexa Fluor® 568, ATTO 565, Rhodamine Red等568nm处红色荧光染料;CF 568染料耐光性最好;高效水溶性;比Alexa Fluor 568 标记的抗体亮度更亮;CF 594、Alexa Fluor® 594, ATTO™ 594,DyLight™ 594, Texas Red等最亮红色荧光染料;CF 594由于其高量子产量和优异的水溶性而比AlexaFluor 594 明亮2~4倍。
同时CF594 对光极其稳定,使它能被理想地应用于诸如共聚焦显微镜和单分子显像条件苛刻的应用中去。
远红外(620-660nm处激发)CF 620R、LightCycler Red 640等620nm处;CF ™ 620R 是以红色荧光染料罗若丹(rhodamine)为基础的远红外的荧光染料,该染料有高荧光亮度和极度的耐光性。
它的吸收和发射光谱为617 和639nm,该染料能被用于荧光能量共振转移中高能量的接收者,或者在激发和发射窗口能和该染料的光谱特性匹配的条件下,被应用于多色检测中的最高荧光量采集。
染料的卓越的水溶性有利于生物耦合在水介质中,更好的保持耦联物的生物特异性结合。
CF 633、Alexa Fluor 633, Alexa Fluor 647, Cy 5, DyLight 633, DyLight 649等633/635nm 激光线的最佳染料荧光染料;CF 633染料的优点:当被633 nm 氦氖激光或635 nm 红色二极管激光激发时,产生最亮的抗体耦联物;光稳定性远高于Alexa Fluor 647;高效的水溶性 CF 640、Alexa Fluor 647, ATTO 647N, Cy5, DyLight649等远红外荧光染料;CF 640R 的优点:以红色染料罗丹明(rhodamine)为基础,吸收和发射峰类似Cy 5、Alexa Fluor 647;但以罗丹明(rhodamine)为基础的红色染料CF 640R它最大的优点就是对光稳定性,Cy 5 和 Alexa Fluor 647 以花青素为基础,因此有着和花青素一样的特点即耐光性较差。
极好的亮度和耐光性使CF ™ 640R 被理想的用于共聚焦显微镜和单分子成像等条件苛刻的检测中。
CF 647、Alexa Fluor 647, ATTO 647N, DyLight649等远红外荧光染料;以花青素为基础的远红外荧光染料CF 647 比Cy 5、Alexa Fluor 647 明亮。
CF 660、Alexa Fluor® 660, Allophycocyanin (APC)等介于远红外近红外之间的荧光染料;近红外(680-790nm处激发)CF 680R/ 680、Alexa Fluor 680, Cy 5.5, IR Dye 680等近红外荧光染料;CF 680 是高水溶性的以花青素为基础的染料,分子量大约为3000。
该染料标记抗体极佳,发出最亮的荧光和在免疫染色光谱相似的染料中产生最高的信噪比。
CF 680R 分子量约为900,更适合标记核酸或者相对小的生物分子。
CF 680R 是新型的以罗丹明(rhodamine)为基础的高荧光亮度, 极度耐光性染料,这使它可被理想地用于共聚焦显微镜,单分子成像等条件要求苛刻的应用中。
CF 750、CF™770 and CF™790等近红外荧光染料;CF 750、CF 770、CF 790 是领域内真正具有突破性的长波长的新型染料代表。
其他近红外染由于受到染料聚集和稳定性差等因素的影响而导致荧光亮度有限。
基于Biotium 科学家研制的新型分子工程技术,近红外CF 染料克服了这些问题。
即使在633 nm 被激发,CF 750 也会比APC-AlexaFluor 750 拥有足够的亮度来在流式细胞仪检测中带来更好的信噪比,而且不存在串联染料的低稳定性等问题。
另外,近红外CF 染料高度水溶性,没有会增加抗体耦联物非特异性结合的过剩的负电荷,也代表了该产品的优秀性能。
