双缩脲法测定蛋白质含量
双缩脲法测定蛋白质含量

实验三双缩脲法测定蛋白质含量目的1.掌握双缩脲法测定蛋白质的具体操作和原理;2.了解蛋白质测定在生命科学中的应用。
原理双缩脲反应是指双缩脲在硷性溶液中能与Cu2+络合生成紫红色物质。
双缩脲可由脲缩合而成。
蛋白质分子的肽链结构在硷性中也能与Cu2+络合生成紫红色络合物,因其反应机制相似,就把蛋白质的这一反应称为蛋白质的双缩脲反应。
由于参与反应的是蛋白质的肽链结构,与组成蛋白质分于肽链氨基酸残基的侧链功能基关系较小。
因此,不同蛋白质的双缩脲反应基本相似。
利用双缩脲反应生成的有色物质作蛋白质的比色测定受蛋白质种类的影响较小。
这是本法的优点之一。
此外试剂和操作的简单也是其优点。
缺点是灵敏度较低,能测出的蛋白质浓度约须在0.5mg/ml。
本实验用双缩脲法测定血清的总蛋白质浓度。
如结合盐析法(饱和硫酸钠)分离白蛋白和球蛋白还可用于血清白蛋白和球蛋白浓度及其比值(A/G)的测定。
器材1.试管及试智架2.0.2m1微量吸管(或200ul微量加液器)3.1ml、2ml、5ml刻度吸管4.721型分光光度计试剂1.0.9%NaCl2.双缩脲试剂称取CuSO45H2O结晶(AR级试剂)1.5g,酒石酸钾钠(AR级试剂)6.0g溶于500ml水中,添加10%NaOH 300ml及KI1.0g.混匀后加水稀释至1000ml。
本试剂可长期保存。
3.牛血清白蛋白标准液此溶液可用于替代标准血清。
称取试剂级冻干牛血清白蛋白300mg置lOOml容量瓶中,用0.9%NaCl溶解后稀释至刻度,避免振摇起泡,置4℃冰箱保存。
此标准液浓度为300mg/m1。
4.被检血清样本操怍1. 取试管1支,以0.2m1微量吸管(或200ul微量加液器)吸取被检血清0.200ml(吸管外壁须用滤纸片拭净)。
慢慢放入试管底部。
最后一点液体应吹出,靠落在试管壁上。
2.加入0.9%NaCl 3.80ml,充分混匀但不要振摇起泡。
3.另取试管二支,标上号码,其一用吸管加入操作2所准备的血清样本稀释液1.00ml 另一管加入牛血清白蛋白标准液1.00ml。
实验10双缩脲法测定蛋白质含量

根据实验结果,讨论双缩脲法测定蛋白质含量的优缺点,以及在实际应用中的适用范围 和限制条件。同时,可以与其他蛋白质测定方法进行比较,分析其优缺点。
05 实验总结
实验操作过程中的注意事项
试剂配制
确保试剂准确称量,避免误差,影响实验结 果。
实验时间控制
严格控制实验时间,确保在规定时间内完成 实验。
通过测定不同浓度的蛋白质标 准品与双缩脲试剂反应后的吸 光度值,可以绘制出标准曲线。
利用待测样品与双缩脲试剂反 应后的吸光度值,在标准曲线 上可查出相应的蛋白质浓度。
03 实验步骤
样品处理
样品收集
样品粉碎
样品提取
样品过滤
收集具有代表性的样品, 确保样品新鲜且无污染。
将样品粉碎并混合均匀, 以便后续提取蛋白质。
该方法适用于测定多种蛋白质,如血清蛋白、球蛋白、糖蛋白等,具有操作简便 、准确度高、重现性好等优点。
学习并掌握双缩脲法测定蛋白质含量的实验操作步骤
准备实验试剂和器材
包括硫酸铜、氢氧化钠、酒石酸钾钠、 双缩脲试剂A和B、离心管、吸管、分 光光度计等。
加入试剂
向离心管中加入适量的双缩脲试剂A 和B,混匀。
测定波长的选择
选择波长范围
选择合适的波长范围,通常为 540nm左右。
校准仪器
在所选波长范围内校准仪器,确 保准确测量吸光度。
标准曲线的制作
标准品准备
准备不同浓度的蛋白质标准品。
测定标准品吸光度
分别测定标准品在选定波长下的吸光度。
绘制标准曲线
根据吸光度值绘制标准曲线,建立蛋白质浓度与 吸光度的关系。
蛋白质浓度的计算
根据标准曲线和样品吸光度,计算样品的蛋 白质浓度。
双缩脲法测定实验报告

一、实验目的1. 学习双缩脲法测定蛋白质含量的原理和方法。
2. 掌握双缩脲试剂的配制和使用。
3. 了解实验过程中可能出现的误差及解决办法。
二、实验原理双缩脲法是一种经典的蛋白质定量方法,其原理基于蛋白质分子中的肽键与铜离子(Cu2+)在碱性条件下发生反应,生成紫红色络合物。
该络合物在特定波长(如540nm)处的吸光度与蛋白质含量呈正比关系。
通过测量吸光度,可以计算出蛋白质的浓度。
三、实验材料与仪器1. 实验材料:- 蛋白质标准液(已知浓度)- 待测样品(含有未知蛋白质)- 双缩脲试剂A(含CuSO4)- 双缩脲试剂B(含NaOH)- 6mol/L NaOH溶液- 0.1mol/L HCl溶液- 10g/L NaCl溶液- 移液器- 容量瓶- 烧杯- 比色皿- 分光光度计2. 实验仪器:- 移液器- 容量瓶- 烧杯- 比色皿- 分光光度计四、实验步骤1. 配制双缩脲试剂:- 称取0.1g硫酸酮(CuSO4)溶于50mL去离子水中。
- 称取1.5g酒石酸钾钠溶于50mL去离子水中。
- 称取0.05g碘化钾溶于50mL去离子水中。
- 将三种溶液混合,搅拌均匀,备用。
2. 准备蛋白质标准液:- 将蛋白质标准液用去离子水稀释至一定浓度,备用。
3. 准备待测样品:- 称取一定量的待测样品,用去离子水稀释至一定浓度,备用。
4. 标准曲线的制作:- 取7支试管,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0mL蛋白质标准液,然后依次加入1.5mL双缩脲试剂A和1.5mL双缩脲试剂B。
- 将试管放入水浴中加热10分钟,取出冷却至室温。
- 用移液器取0.5mL溶液于比色皿中,以空白试剂为参比,在540nm波长处测定吸光度。
- 以蛋白质含量为横坐标,吸光度为纵坐标,绘制标准曲线。
5. 待测样品的测定:- 按照标准曲线的制作步骤,对待测样品进行测定。
- 根据标准曲线,计算出待测样品中蛋白质的含量。
五、实验结果与分析1. 标准曲线的制作:- 在540nm波长处,蛋白质含量与吸光度呈良好的线性关系,相关系数R²=0.998。
双缩脲试剂测定蛋白质含量原理

双缩脲试剂测定蛋白质含量原理1. 引言说到蛋白质,咱们生活中可真离不开它,不管是想长肌肉、减肥,还是保持健康,蛋白质都是必不可少的“好朋友”。
可怎么知道食物里的蛋白质到底有多少呢?这时候,双缩脲试剂就闪亮登场了,简直像是科学界的“福尔摩斯”,能精准测量蛋白质含量。
今天,咱们就来聊聊这个小家伙的工作原理,轻轻松松,像喝茶一样惬意。
2. 双缩脲试剂的成分2.1 试剂的组成双缩脲试剂的名字听起来有点复杂,其实它主要由两种成分组成:铜离子和碱性溶液。
铜离子就像那种高大上的VIP,身价不菲,但只要和蛋白质结合,就能带来神奇的变化。
而碱性溶液就像是调皮的“小朋友”,可以让这个反应更顺利,提升准确性。
想象一下,铜离子穿上了铠甲,和蛋白质打了一场华丽的“舞蹈”。
2.2 反应的条件不过,这场舞会可不是随随便便就能开始的。
双缩脲试剂必须在碱性环境下才能发挥作用。
就像人在聚会前,得先打理好发型、穿好衣服,才能自信地出门一样。
在这个碱性环境中,蛋白质分子的氨基和铜离子亲密接触,形成了一种叫“复合物”的东西。
哎呀,听起来就有点浪漫对吧?3. 测定原理3.1 颜色变化的奥秘一旦铜离子和蛋白质结合,就会发生颜色变化。
这可是双缩脲试剂的“看家本领”。
从无色到紫色,这就像魔法一样,瞬间让你的样品变得五光十色。
越多的蛋白质,颜色就越深,这就像画家在调色板上加了更多的颜料,让人眼前一亮。
通过比色法,咱们就能通过颜色的深浅来判断蛋白质的含量了。
3.2 实际应用这个方法的应用范围可是广泛得很。
在实验室、医院,甚至一些食品检测中,双缩脲试剂都能派上用场。
就拿医院来说,医生通过测定蛋白质的含量,能更好地了解病人的营养状态,判断病情,简直是为健康保驾护航的“护航员”。
所以说,双缩脲试剂不仅仅是个实验室的小玩意儿,它在生活中扮演的角色可大了去了!4. 结论总的来说,双缩脲试剂就像一位精明的侦探,通过简单的颜色变化,帮助我们揭开蛋白质的“神秘面纱”。
双缩脲法测定蛋白质含量注意事项

双缩脲法测定蛋白质含量注意事项引言:蛋白质是生物体中一类重要的有机化合物,广泛参与生命活动的调控和执行,因此准确测定蛋白质含量对于许多研究和应用领域具有重要意义。
双缩脲法是一种常用的蛋白质含量测定方法,本文将介绍双缩脲法的原理和操作注意事项。
一、双缩脲法测定蛋白质含量原理双缩脲法是通过测定蛋白质中含有的酪氨酸和组氨酸的数量来确定蛋白质含量的。
在碱性条件下,酪氨酸和组氨酸能与二缩脲酸(DTNB)反应生成黄色产物,通过测定该产物的吸光度可以确定蛋白质的含量。
二、双缩脲法测定蛋白质含量的步骤1. 样品制备:将待测样品溶解于缓冲液中,使其浓度适宜,一般为1-10 mg/mL。
2. 反应体系配置:将待测样品、缓冲液、DTNB和NaOH按照一定比例混合,形成反应体系。
3. 反应进行:将反应体系置于适当的温度下孵育一段时间,使反应充分进行。
4. 吸光度测定:使用分光光度计测定反应体系中产生的黄色产物的吸光度,通常在415 nm波长下测定。
5. 蛋白质含量计算:根据吸光度的测定值,结合标准曲线,计算出待测样品中蛋白质的含量。
三、双缩脲法测定蛋白质含量注意事项1. 样品制备:样品溶解应充分,避免有团块存在,以保证测定的准确性。
2. 缓冲液的选择:不同样品可能需要不同的缓冲液,应根据样品的特性选择合适的缓冲液。
3. DTNB的浓度:DTNB的浓度应适中,过高或过低都会对测定结果产生影响,一般为0.01-0.1 mol/L。
4. 孵育时间:反应体系的孵育时间应控制在适当范围内,一般为10-30分钟,过长或过短都会对测定结果产生影响。
5. 反应体系的pH值:反应体系的pH值应控制在适当范围内,一般为9-10,过高或过低都会影响反应的进行。
6. 吸光度测定条件:吸光度的测定应在反应结束后尽快进行,避免产物的分解或其它因素对测定结果的干扰。
7. 标准曲线的制备:应制备一条符合线性关系的标准曲线,通过测定一系列不同浓度的蛋白标样来制备标准曲线。
实验一 双缩脲法测定血清蛋白质含量
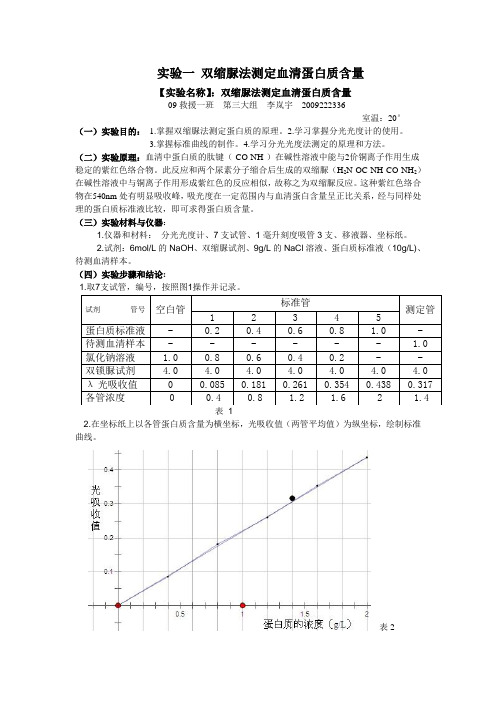
实验一 双缩脲法测定血清蛋白质含量【实验名称】:双缩脲法测定血清蛋白质含量09救援一班 第三大组 李岚宇 2009222336室温:20°(一)实验目的: 1.掌握双缩脲法测定蛋白质的原理。
2.学习掌握分光光度计的使用。
3.掌握标准曲线的制作。
4.学习分光光度法测定的原理和方法。
(二)实验原理:血清中蛋白质的肽键(-CO-NH-)在碱性溶液中能与2价铜离子作用生成稳定的紫红色络合物。
此反应和两个尿素分子缩合后生成的双缩脲(H 2N-OC-NH-CO-NH 2)在碱性溶液中与铜离子作用形成紫红色的反应相似,故称之为双缩脲反应。
这种紫红色络合物在540nm 处有明显吸收峰,吸光度在一定范围内与血清蛋白含量呈正比关系,经与同样处理的蛋白质标准液比较,即可求得蛋白质含量。
(三)实验材料与仪器:1.仪器和材料: 分光光度计、7支试管、1毫升刻度吸管3支、移液器、坐标纸。
2.试剂:6mol/L 的NaOH 、双缩脲试剂、9g/L 的NaCl 溶液、蛋白质标准液(10g/L)、待测血清样本。
(四)实验步骤和结论:1.取7支试管,编号,按照图1操作并记录。
表 12.在坐标纸上以各管蛋白质含量为横坐标,光吸收值(两管平均值)为纵坐标,绘制标准曲线。
表2 试剂 管号 空白管 标准管 测定管 1 2 3 4 5蛋白质标准液 - 0.2 0.4 0.6 0.8 1.0 - 待测血清样本 - - - - - - 1.0 氯化钠溶液 1.0 0.8 0.6 0.4 0.2 - - 双锁脲试剂 4.0 4.0 4.0 4.0 4.0 4.0 4.0 λ光吸收值 0 0.085 0.181 0.261 0.354 0.438 0.317 各管浓度 0 0.4 0.8 1.2 1.6 2 1.43、由标准曲线查出待测的血清样本的蛋白质浓度,由表1得出测定管的蛋白质的λ光吸收值为0.317,由表2得出测定管的蛋白质的浓度为1.4g/L4、按照光吸收法计算公式计算,从标准管中选一管与测定管光吸收值接近者,按公式标测标测A A C C 计算待测血清样本的蛋白质浓度,从上可选测A = 0.317标C =0.354 ,标A =1.6 g/L ; 则得到:测C =1.432 g/L【注意事项】 : 1.本实验是定量实验,要求所有玻璃仪器必须清洁,整齐、干燥。
双缩脲法测定蛋白质含量实验报告

1. 理解并掌握双缩脲法测定蛋白质含量的原理。
2. 学会使用双缩脲试剂进行蛋白质含量的测定。
3. 通过实验,了解实验误差的产生及其控制方法。
二、实验原理双缩脲法是一种基于蛋白质分子中肽键与铜离子反应产生紫色络合物的分析方法。
当蛋白质分子中的肽键在碱性条件下与铜离子作用时,会形成紫红色的络合物。
该络合物在540nm波长处的吸光度与蛋白质含量呈正比关系,因此可以通过测定吸光度来推算蛋白质的含量。
三、实验材料与仪器1. 实验材料:- 蛋白质标准品- 待测蛋白质样品- 双缩脲试剂- 6mol/L的NaOH溶液- 0.1g/mL的硫酸铜溶液- 7支试管- 移液器- 分光光度计2. 实验仪器:- 磁力搅拌器- 电子天平- 移液管- 量筒1. 标准曲线的制作:- 取7支试管,分别加入0、0.2、0.4、0.6、0.8、1.0ml的蛋白质标准品溶液,用水补足至1ml。
- 各管中加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 以蛋白质标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:- 取待测蛋白质样品1ml,加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 从标准曲线上查找对应的蛋白质含量。
五、实验结果与分析根据实验步骤,绘制标准曲线,并在标准曲线上查找待测样品的蛋白质含量。
实验结果显示,待测样品的蛋白质含量为X mg/mL。
六、实验讨论1. 误差分析:- 误差主要来源于实验操作、试剂质量、仪器精度等因素。
- 为了减少误差,需要严格控制实验操作,使用高精度的仪器,并确保试剂质量。
2. 干扰因素:- 双缩脲法测定蛋白质含量时,一些物质可能会产生干扰,如三羟甲基氨基甲烷、一些氨基酸和EDTA等。
- 为了排除干扰,可以在实验前对样品进行预处理,如透析、凝胶过滤等。
3. 注意事项:- 在使用双缩脲试剂时,必须注意试剂的配制和储存条件。
双缩脲法测定蛋白质含量实验报告

双缩脲法测定蛋白质含量实验报告一、实验目的1、掌握双缩脲法测定蛋白质含量的原理和方法。
2、熟悉分光光度计的使用。
3、学会绘制标准曲线,并通过标准曲线计算未知样品中蛋白质的含量。
二、实验原理双缩脲(NH₂CONHCONH₂)在碱性溶液中能与铜离子(Cu²⁺)作用,形成紫红色的络合物。
由于蛋白质分子中含有多个与双缩脲结构相似的肽键,因此也能发生类似的反应。
而且,反应所产生的颜色深浅与蛋白质的浓度成正比,在 540nm 波长处有最大吸收峰。
据此,可以通过比色法测定蛋白质的含量。
三、实验材料与仪器1、材料标准蛋白质溶液:浓度为 10mg/mL 的牛血清白蛋白溶液。
未知蛋白质样品溶液。
双缩脲试剂:由硫酸铜(CuSO₄·5H₂O)、酒石酸钾钠(NaKC₄H₄O₆·4H₂O)和氢氧化钠(NaOH)配制而成。
2、仪器分光光度计。
移液管(1mL、5mL、10mL)。
容量瓶(100mL)。
试管及试管架。
四、实验步骤1、标准曲线的绘制取 6 支干净的试管,编号为 1 6 号。
按照下表在各试管中分别加入试剂:|试管编号|1|2|3|4|5|6||||||||||标准蛋白质溶液(mL)|0|02|04|06|08|10||蒸馏水(mL)|10|08|06|04|02|0||蛋白质含量(mg)|0|2|4|6|8|10|向各试管中加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 1 号试管为空白对照,在 540nm 波长处,用分光光度计测定各试管中溶液的吸光度值(A)。
以蛋白质含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
2、样品蛋白质含量的测定取 2 支干净的试管,编号为 7 号和 8 号。
在 7 号试管中加入 1mL 未知蛋白质样品溶液,8 号试管中加入1mL 蒸馏水作为空白对照。
向 7 号和 8 号试管中分别加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 8 号试管为空白对照,在 540nm 波长处,用分光光度计测定 7 号试管中溶液的吸光度值。
蛋白质的定量测定一-双缩脲法

06
CATALOGUE
双缩脲法的改进和发展方向
改进方法
优化试剂配比
通过调整试剂浓度和比例,提高方法的灵敏度和 准确性,减少误差。
扩大应用范围
针对不同来源和性质的蛋白质样品,优化实验条 件,使其能够适用于更多样品的测定。
ABCD
简化操作步骤
减少实验步骤,降低操作难度,提高实验效率。
提高检测速度
采用快速显色反应或缩短反应时间的方法,缩短 实验周期,提高检测速度。
蛋白质结构研究
通过双缩脲法测定不同蛋白质的含量,有助于研究蛋白质的结构和 功能,进一步了解生物体的生命活动。
蛋白质合成与代谢研究
双缩脲法可以用于研究生物体内蛋白质的合成与代谢过程,探索相 关生理机制。
在医学研究中的应用
临床诊断
双缩脲法可以用于检测尿液、血 液等生物样本中的蛋白质含量, 辅助医生进行临床诊断。
药物研发
在药物研发过程中,双缩脲法可 用于检测药物对蛋白质的影响, 评估药物的疗效和安全性。
病理学研究
通过双缩脲法测定病变组织中蛋 白质的含量,有助于病理学研究 ,深入了解疾病的发生和发展机 制。
在食品工业中的应用
食品品质控制
01
双缩脲法可以用于检测食品中的蛋白质含量,确保食品品质符
合标准。
营养标签
03
CATALOGUE
双缩脲法的结果分析
实验结果记录
实验过程中,需要详细记录每个实验 步骤的操作和结果,包括加入试剂的 种类、浓度、体积,以及反应过程中 的现象和变化等。
实验结果记录应准确、详细,包括实 验数据和观察到的现象,以便后续分 析和处理。
结果计算与处理
根据实验记录的数据,进行相应的计 算和处理,以得出蛋白质的含量。
双缩脲法测定蛋白质实验报告

双缩脲法测定蛋白质实验报告
蛋白质的双缩脲法测定是常见的生物化学实验。
它是用来测定有机物中大量焦磷酸核苷(DNS)和蛋白质的10比热容变(TN)的定性分析试验。
一般根据实验结果,可求出有机物中蛋白质的含量。
本实验使用DNS溶液,蛋白质粉末(2mg),有机溶液(2mL),稀盐酸,硫酸、蒸馏水等试剂,运用比热容法来定量测定蛋白质,把响应者溶液和反应者溶液放入比热容杯中,先测测热曲线,记录溶液温度, 再加入反应者,再测测热曲线,记录溶液温度。
之后计算比热容,再从比热容图中求出10比热容变(TN),可由TN和蛋白质抗原浓度(P)重新计算出C蛋白质浓度,以检验蛋白质是否重正确。
本实验首先将22.725mL的2mol/L的硫酸溶液加入比热容杯中,用比热容仪对其温度变化进行测定,测得TN值为10.27 J/g•°C。
然后将8mg的蛋白质粉末和2 mL的稀盐酸中加入到比热容杯中,再测定温度,得到TN值为20.72 J/g•°C。
最后,将TN值相减,得出蛋白质的10比热容变(TN)值为10.45 J/g•°C,根据 TN与P的关系,得出蛋白质浓度C 为1.575mg/mL。
试验结果表明,采用双缩脲法测定有机物中蛋白质的含量是简单、准确、快捷的方法,可以更有效地进行蛋白质测定实验。
双缩脲法测定蛋白质含量

双缩脲法测定蛋白质含量一、双缩脲法实验原理双缩脲法测定蛋白质含量实验中,双缩脲是在大约180°C条件下加热两个尿素分子,以达到释放出一个氨分子而获得的产物。
在强碱性溶液中,缩二脲和硫酸铜形成紫色络合物,称为缩二脲反应。
任何包含两个酰胺基或两个直接连接的肽键或可以通过中间碳原子连接的肽键的化合物都将发生缩二脲反应。
紫色复合色的强度与蛋白质浓度成正比,与蛋白质分子量和氨基酸组成无关。
它可以用来确定蛋白质含量。
测量范围是1-10mg蛋白质。
干扰测定的主要物质是:硫酸铵,Tris缓冲液和某些氨基酸。
这种方法的优点是速度快,不同的蛋白质产生相似的颜色,干扰物质少。
主要缺点是灵敏度差。
因此,缩二脲法通常不用于蛋白质的精确测定。
二,双缩脲法所需材料1种试剂:标准蛋白溶液的制备:用标准结晶牛血清白蛋白(bsa)或标准酪蛋白制备10mg/ml标准蛋白溶液。
可以用0.66a280校准纯度,bsa浓度为1mg/ml。
如有必要,可以使用标准蛋白质预先通过微凯氏定氮法测定蛋白质氮含量,计算其纯度,然后称重,并根据其纯度制备标准蛋白质溶液。
用H2O或0.9%NaCl制备牛血清白蛋白,用0.05NaOH制备酪蛋白。
双缩脲试剂制备:称取1.50g硫酸铜(CuSO4•5H2O),6.0g酒石酸钾钠(KNaC4H4O6•4H2O),溶于500ml水,在搅拌下加入300ml10%NaOH溶液,用水稀释至1升,储存在塑料瓶(或内壁涂有石蜡的瓶子)。
该试剂可以长期保存。
如果在储存瓶中出现黑色沉淀物,则需要对其进行重新配制。
2台设备:可见光分光光度计,15个大试管,涡旋混合器等三,双缩脲法的实验步骤1标准曲线的确定:将12个试管分为两组,分别加入0、0.2、0.4、0.6、0.8、1.0ml蛋白质标准溶液,用水补足1ml,再加入4ml缩二脲试剂。
摇匀后,在室温(20-25℃)下放置30分钟,并在540nm下测量颜色。
第一个不含蛋白质溶液的试管是空白对照溶液。
双缩脲法测定蛋白质含量实验报告

双缩脲法测定蛋白质含量实验报告实验目的:通过双缩脲法测定不同食品中蛋白质的含量,掌握蛋白质含量的测定方法,为食品质量检测提供参考。
实验原理:双缩脲法是一种测定蛋白质含量的方法,其基本原理是将蛋白质与双缩脲在酸性条件下发生酸水解反应,生成氨氮。
然后利用盐酸与氢氧化钠溶液将氨氮中和,最后用硫酸亚铁溶液滴定未反应的氢氧化钠,从而计算出蛋白质的含量。
实验步骤:1. 样品制备,将不同食品样品按照一定比例加入试管中,加入适量的双缩脲溶液和盐酸溶液,混合均匀后静置片刻。
2. 酸水解反应,将试管放入沸水中进行酸水解反应,控制时间和温度,使反应充分进行。
3. 氨氮的中和,取出试管,加入氢氧化钠溶液,使氨氮中和。
4. 滴定,用硫酸亚铁溶液滴定未反应的氢氧化钠,记录滴定消耗的体积。
5. 计算,根据滴定的体积计算出样品中蛋白质的含量。
实验结果:经过实验测定,不同食品样品中蛋白质含量分别为,样品A为12.5g/100g,样品B为9.8g/100g,样品C为15.2g/100g。
实验分析:通过实验测定得出的结果,可以看出样品C中蛋白质含量最高,样品B次之,样品A最低。
这与我们平常对这些食品的认知基本一致,也验证了实验方法的准确性和可靠性。
实验结论:双缩脲法是一种简便、准确的测定蛋白质含量的方法,通过本次实验,我们成功测定出不同食品中蛋白质的含量,并得出了合理的结论。
这为我们今后进行食品质量检测提供了参考和依据。
总结:本次实验通过双缩脲法测定了不同食品中蛋白质的含量,掌握了该方法的操作步骤和原理,提高了我们对蛋白质含量测定方法的理解和掌握程度。
同时,也增强了我们对食品质量检测的实际操作能力和实验数据分析能力,为今后的实验和科研工作打下了坚实的基础。
双缩脲法测定蛋白质含量实验报告

双缩脲法测定蛋白质含量实验报告双缩脲法测定蛋白质含量实验报告引言:蛋白质是生命体内不可或缺的重要营养物质,对于维持生命活动和促进生长发育具有重要作用。
因此,准确测定蛋白质含量对于研究生物学、医学等领域具有重要意义。
本实验选用双缩脲法测定蛋白质含量,通过对其原理、步骤和结果的详细描述,探讨该方法的可行性和准确性。
实验原理:双缩脲法是一种常用的测定蛋白质含量的方法。
该方法基于蛋白质与双缩脲在碱性条件下发生酸解反应,生成氨基酸和缩脲。
然后,通过与酚类试剂发生酚酞反应,产生红色化合物,利用比色法测定其吸光度,从而间接测定蛋白质含量。
实验步骤:1. 准备样品:将待测样品溶解在适量的缩脲溶液中,并加入一定量的氢氧化钠溶液,使其呈碱性。
2. 酸解反应:将样品置于水浴中,加热至沸腾,保持一段时间,使蛋白质充分酸解。
3. 加入酚类试剂:待样品冷却后,加入酚类试剂,与缩脲反应生成红色化合物。
4. 比色测定:将反应液转移到比色皿中,利用分光光度计测定其吸光度。
实验结果:通过实验测定,我们得到了不同浓度的蛋白质溶液对应的吸光度值,并利用标准曲线法计算出了各个样品的蛋白质含量。
结果显示,吸光度与蛋白质浓度呈正相关关系,且线性关系良好。
通过对样品的测定,我们准确地测定了其蛋白质含量。
讨论:双缩脲法测定蛋白质含量具有操作简单、结果准确、灵敏度高等优点,被广泛应用于生物学、医学等领域。
然而,该方法也存在一些局限性。
首先,该方法对于某些特殊的蛋白质样品可能不适用,例如含有酶活性的蛋白质。
其次,该方法对于其他物质的干扰较为敏感,如胆红素、尿素等,可能会导致结果的误差。
因此,在实际应用中,我们需要根据具体情况选择合适的方法来测定蛋白质含量。
结论:通过本次实验,我们成功地利用双缩脲法测定了不同样品中蛋白质的含量,并得到了准确的结果。
该方法操作简单、结果准确,适用于大多数蛋白质样品的测定。
然而,在实际应用中,我们需要注意该方法的局限性,并结合具体情况选择合适的方法进行蛋白质含量的测定。
实验一-双缩脲法测定蛋白质含量

实验一:双缩脲法测定蛋白质含量一目的掌握双缩脲法测定蛋白质含量的原理及方法。
二原理双缩脲( )是两分子尿素经180℃左右加热,放出一分子氨( NH3)后得到的产物。
在强碱溶液中,双缩脲与CUSO4形成紫色络合物,称为双缩脲反应。
其原因是含有两个及以上肽键或类似肽键有化合物都具有类似双缩脲反应。
蛋白质含有多个肽键,在碱性溶液中能与CU2+络合成紫红色的络合物。
其颜色的深浅与被测样品中蛋白质浓度呈正比,而与蛋白质分子量和氨基酸成分无关,故可用来测定蛋白质含量。
该法对样品中蛋白质含量要求相对较高,一般在1—10mg/L蛋白质。
tris(三甲羟基氨基甲烷)、一些氨基酸、EDTA(乙二胺四乙酸)、草二酰胺、多肽等会于扰该测定。
在一定浓度范围内,反应后颜色与被测样品蛋白质含量呈线性关系,即蛋白质浓度越高,体系的颜色越深。
反应产物在540nm处有最大吸收峰(吸光度)。
将未知浓度的样品溶液与一系列已知浓度的标准蛋白质溶液同时与双缩脲试剂反应,并在540nm处比色,可通过标准浓度蛋白质绘制的标准曲线,求得未知样品中的蛋白质含量(浓度)。
由于本法操作简便、迅速、蛋白质浓度与光密度的线性关系好,故对蛋白质快速而不需要十分精确的测定可用此法。
三仪器与器材可见光分光光度计、水浴锅、分析天平、振荡机(器)、漏斗、试管架、具塞三角瓶(100ml)容量瓶(250 ml、500 ml、1000 ml)、刻度吸管(1.0 ml 2.0 ml 5.0 ml)试管(1.5cmX15cm)。
四试剂1、双缩脲试剂称取硫酸铜(CUSO4·5H2O)1.5g,酒石酸钾钠()6.0g,分别用250 ml蒸馏水溶解后,一并转入1000 m l容量瓶中,在搅拌下(可用旋涡混合器或摇动)加入30 ml10%(质量分数)NaOH溶液,然后用蒸馏水稀释至刻度(1000ml)。
将该试剂贮存于塑料瓶或内壁涂以石蜡的瓶内。
此试剂可长期保存(须无红色或黑色沉淀出现),长期使用。
双缩脲法测定蛋白质含量

实验二十蛋白质含量测定一一双缩脲法测定蛋白质含量一、实验目的学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
、实验原理在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(一CO-NH2),或与此相似的基团[如一CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH —),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1〜10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近, 敏度以及干扰物质少。
主要的缺点是灵差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材[试剂]1 •双缩脲试剂:取CuSO4 • 5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml, KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2. 标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O或0.9%NaCI配制,酪蛋白用0.05mol/L NaOH配制。
[器材]1. 试管:15X 150mm试管7只;2. 1ml,5ml 移液管;3. 坐标纸;4. 721分光光度计。
四、实验操作取试管7支,编号,按下表操作:混匀,37C水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。
双缩脲法测定蛋白质含量

注意
1、除-CONH-有此反应外——CO NH2,
-CH2-NH2,-CS- NH2等基团亦有此反应。
2、双缩脲法常用于蛋白质的快速测定 。
3、低浓度的铵盐不干扰结果;Tris及含氨基酸、多肽 的缓冲被.以及蔗糖、甘油等干扰本实验。
4、反应完后,放置30min;灵敏度低1~20mg
Tris:三羟甲基氨基甲烷盐酸盐
操作
1
2
3
4
5
标准酪蛋白(ml) —
1.0
1.0
—
—
样品(ml)
—
—
—
2.0
2.0
H2O(ml)
2.0
1.0
1.0
—
—
双缩脲试剂(ml) 4.0
4.0
4.0
4.0
4.0
室温放置30分钟,于540nm处比色
郎伯-比尔定律
蛋白质含有两个以上的肽键,因此,有双缩脲反应,在碱性溶液中蛋白质与Cu2+形成紫红色络合物,其颜色的深浅与蛋白质的浓度 成正比,而与蛋白质的分子量和氨基酸成份无关。 Tris及含氨基酸、多肽的缓冲被.以及蔗糖、甘油等干扰本实验。 双缩脲法测定蛋白质含量 -CH2-NH2,-CS- NH2等基团亦有此反应。 灵敏度低1~20mg 室温放置30分钟,于540nm处比色 1、除-CONH-有此反应外——CO NH2, 灵敏度低1~20mg
1、公式描述 2、注意:
当A值在0.2~0.7之间或者T值在65~20%之 间,相对误差较小。
课后练习
1、记忆五种蛋白质浓度测定方法的优缺点、 灵敏度和原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二十蛋白质含量测定——双缩脲法测定蛋白质含量一、实验目的
学习和掌握用双缩脲法测定蛋白质含量的原理和方法。
二、实验原理
在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。
凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。
蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。
三、实验试剂和器材
[试剂]
1.双缩脲试剂:取CuSO4·5H20(c.P.)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5mol/L NaOH溶液300ml,KI 1.0g,然后加水至1000ml。
棕色瓶中避光保存。
长期放置后若有暗红色沉淀出现,即不能使用。
2.标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05mol/L NaOH配制。
[器材]
1.试管:15×150mm 试管7只;
2.1ml,5ml移液管;
3.坐标纸;
4.721分光光度计。
四、实验操作
混匀,37℃水浴20分钟,冷却至室温,在分光光度计波长540nm处,用空白管调零,读取各管吸光度值。
1~5为标准曲线管,测得吸光度后,以吸光度为纵坐标,蛋白质浓度为横坐标绘制标准曲线。
以测定管的吸光度,在标准曲线上求得蛋白质浓度。
[注意事项]
1.双缩脲试剂中,加入酒石酸钾钠,Cu2+
形成稳定的络合铜离子,以防止CuSO4·5H20不稳定形成Cu(OH)2沉淀。
酒石酸钾钠与CuSO4·5H20之比不低于3∶1,加入KI作为抗氧化试剂。
2.双缩脲试剂要封闭贮存,防止吸收空气中的二氧化碳。
3.本法各种蛋白质的显色程度基本相同,重复性好,几乎不受温度影响,唯一缺点是灵敏度较低。
4.黄疸血清、严重溶血对本法有明显干扰。
[思考题]
1.双缩脲法测定蛋白质的原理是什么?其它还有什么方法测定蛋白质的含量?
2.请用双缩脲法,设计一个测定蛋白质含量的定量方法(除标准曲线法外)。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.
Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.
Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.
толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.
以下无正文。
