第8章_配位化合物
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
第八章 配位化合物

A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
第八章络合物(配位化合物)化学基础

第八章络合物(配位化合物)化学基础【竞赛要求】场理论。
Ti(H2O)36的颜色。
路易斯酸碱的概念。
【知识梳理】一、配合物基本知识1、配合物的定义由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
[Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
[Co(NH3)6]、[Cr(CN)6]也是配位化合物。
判断的关键在于是否含有配位单元。
思考:下列化合物中哪个是配合物①CuSO4·5H2O②K2PtCl6③KCl·CuCl2④Cu(NH2CH2COO)2⑤KCl·MgCl2·6H2O⑥Cu(CH3COO)2注意:①配合物和配离子的区别②配合物和复盐的区别2、配合物的组成中心离子内界单齿配体配位体多齿配体配合物螯合配体外界(1)配合物的内界和外界以[Cu(NH3)4]SO4为例:[Cu(NH3)4]2+SO24内界外界内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是-1-K可以无外界,如Ni(CO)4但不能没有内界,内外界之间是完全电离的。
(2)中心离子和配位体中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。
如Fe3+、Fe、Co、Ni、Cu、Co等,只要能提供接纳孤对电子的空轨道即可。
配位体:含有孤对电子的阴离子或分子。
如NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。
(3)配位原子和配位数配体中给出孤对电子与中心离子直接形成配位键的原子,叫配位原子。
配位单元中,中心离子周围与中心离子直接成键的配位原子的个数,叫配位数。
配位化合物[Cu(NH3)4]SO4的内界为[Cu(NH3)4]2+,中心Cu2+的周围有4个配体NH3,每个NH3中有1个N原子与Cu2+配位。
无机化学第8章 配位化合物

HBNU-Liujy
2. 四面体场(Td, Tetrahedron Field)中d轨道的分裂
Z
Z
Y
dz2
Z
X Y
Z
X
dX2-Y2
Z
X
X
X
Y
dXY
Y
dXZ
Y
dYZ
18
第08章 配位化合物
HBNU-Liujy
Td
Splitting分裂能Δt =Et2-Ee
d
d
自由离子 free ion
球形场 sphere
Py
Px
Px
S
S
Py
pz
Py
Py
Px
Px
Pz
pz
Py
Py dx2-y2
pz
dz2
杂化轨 直 道的空 线 间构型 形
平面 正四 平面 三角 三角形 面体 正方形 双锥
形
四方 锥形
正八 面体 形
正八 面体 形
10
第08章 配位化合物
HBNU-Liujy
3. Inner-Orbital and Outer-Orbital Complex
16
第08章 配位化合物
HBNU-Liujy
Oh
Splitting分裂能Δo =Eeg-Et2g
d
d
自由离子 free ion
球形场 sphere
eg(dz2,dx2-y2)
Δo=10Dq
160Δo 140Δo
t2g(dxy,dxz,dyz)
四面体场 tetrahedron
17
第08章 配位化合物
22
第08章 配位化合物
HBNU-Liujy
第八章配位化合物解析

P t Cl 3 ( NH3 )
( 2 )
( 3) K 3 Fe(CN)6
赤血盐 ,
( 2) K 4 Fe(CN)6
黄血盐
(0) ( 3) Co Cl 3 (NH3 ) 3 , Fe(CO)5
配合物磁性的测定是判断配合物结构的一个重要手段。 磁矩: µ = [n(n+2)]1/2 (B.M.)玻尔磁子.
[Fe(H2O)6]3+ 磁矩 5.9B.M. 5个未成对电子 外轨型 [Fe(CN)6]3磁矩 2.0B.M. 1个未成对电子 内轨型
价键理论能很好地解释了配合物的空间构型、
磁性、稳定性,直观明了,使用方便,但它无
的多面体结构的化合物。
金属冠状配合物:过渡金属离子相互连接成 与冠醚结构类似的环状结构的化合物。 有机金属配合物:含有金属-碳键的配合物。
8.2.2 配位化合物的命名
配酸:×××酸。例: H2[PtCl6]
配碱:氢氧化×××。 例:[Ag(NH3)2]OH
配盐:先阴离子后阳离子,简单酸根加“化”字,
8.2.1 配合物的类型 简单配合物:一个中心离子,每个配体均为单齿配体. 如 Fe(CN)4 Co(NH ) (H O)3
6 3 5 2
螯合物:一个中心离子与多齿配体成键形成环状结构 的配合物. 如[Cu(en)2]2+, CaY2-
其它分类: 多核配合物:一个配位原子同时与两个中心 离子结合形成的配合物。 原子簇化合物:簇原子以金属-金属键组成
2
4 3 1 4 2 2 2 6 3 2 6 1 6 6
P tCl3 (NH3 ) 2 CoCl2 (en)2 3 Al(C2O 4 )3 2 Ca(EDT A)
《无机化学》第8章.配位化合物PPT课件

配位化合物的发展趋势与展望
新材料与新能源
随着人类对新材料和新能源需求的不断增加,配位化合物有望在太 阳能电池、燃料电池等领域发挥重要作用。
生物医药领域
配位化合物在药物设计和治疗方面的应用前景广阔,有望为人类疾 病的治疗提供新的解决方案。
环境科学领域
配位化合物在处理环境污染和保护生态环境方面具有潜在的应用价值, 未来有望为环境保护做出贡献。
螯合物
由两个或更多的配位体与同一 中心原子结合而成的配合物,
形成环状结构,如: Fe(SCN)3。
命名
一般命名法
根据配位体和中心原子的名称,加上 “合”字和数字表示配位数的顺序来 命名,如:Co(NH3)5Cl。
系统命名法
采用系统命名法,将配位体名称按照 一定的顺序列出,加上“合”字和数 字表示配位数的顺序,最后加上中心 原子名称,如: (NH4)2[Co(CO3)2(NH3)4]·2H2O。
配位化合物的种类繁多,其组成和结 构取决于中心原子或离子和配位体的 性质。
配位化合物的形成条件
01
存在可用的空轨道 和孤对电子
中心原子或离子必须有可用的空 轨道,而配位体则需提供孤对电 子来形成配位键。
02
能量匹配
中心原子或离子和配位体的能量 状态需要匹配,以便形成稳定的 配位化合物。
03
空间和电子构型适 应性
中心原子或离子和配位体的空间 和电子构型需相互适应,以形成 合适的几何构型和电子排布。
02
配位化合物的组成与结构
组成
配位体
提供孤电子对与中心原子形成配位键的分子或离子。常见的配位 体有:氨、羧酸、酰胺、酸酐、醛、酮、醇、醚等。
中心原子
接受配位体提供的孤电子对形成配位键的原子。常见的中心原子有: 过渡金属元素的离子。
8配位化合物

单齿配体 Cu(NH 3 ) 4 多齿配体 4 3 1 4 2 2 2 6 3 2 6 1 6 6
12
PtCl 3 (NH 3 ) CoCl 2 (en) 2 2 Al(C 2 O 4 ) 3 3 Ca(EDTA) 2
影响中心原子配位数的主要因素有:
Fe(CO) 5
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾
六氯合铂(Ⅳ)酸
氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾
硝酸羟基•三水合锌(Ⅱ)
(三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁
三硝基•三氨合钴(Ⅲ)
乙二胺四乙酸根合钙(Ⅱ)
18
Question
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3
(一)晶体场理论的基本要点
二、配合物的晶体场理论
(1)在配位个体中,中心原子与配体靠静电作
用结合,这是配位个体稳定的主要因素。 (2)配体所形成的负电场对中心原子的电子, 特别是价电子层的 d 电子产生排斥作用,使中心 原子原来 5 个简并 d 轨道的能级发生分裂。 (3)由于 d 轨道的能级发生分裂,中心原子 价电子层的 d 电子重新分布,使配合物的能量降 低,在中心原子和配体之间产生附加成键效应。
1价金属离子 2价金属离子 3价金属离子
Cu+ 2,4 Ag+ 2 Au+ 2,4
Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
Al3+ Cr3+ Fe3+ Co3+ Au3+
4,6 6 6 6 4
第八章_配位化合物

0.10 21 1.0 10 2 y (0.10)
y 1.0 10
20
即Ag+的平衡浓度为1.0×10-20 mol/L。
2、判断配位反应进行的方向
[Ag(NH3)2] ++ 2CN反应向哪个方向进行?
2 [ Ag ( CN ) ][ NH ] 2 3 K [ Ag ( NH 3 ) 2 ][CN ]2
[Cu( NH 3 ) ] 1 2 [Cu ][NH 3 ]
2
2
[Cu( NH 3 ) 2 ] [Cu 2 ][NH 3 ]2
2
3
[Cu( NH 3 ) 3 ] [Cu 2 ][NH 3 ]3
2
2
4
[Cu( NH 3 )4 ] K稳 2 4 [Cu ][ NH 3 ]
[Zn(NH3)4]2+ [Zn(CN)4]2+ 5×108 1.0×1016
中心离子不同,配体相同,配位数相同。
[Zn(NH3)4]2+ [Cu(NH3)4]2+ 5×108 4.8×1012
不同类型配合物稳定性要通过计算 求出溶液中的离子浓度。
CuY2[Cu(en)2]2+ 6.3×1018 4.9×1019
配位离子 [Cu(NH3)4]2+ 配位单元 配合物 配位分子 Fe(SCN)3 配离子与带有异电荷的离子 组成的中性化合物。 [Cu(NH3)4]SO4
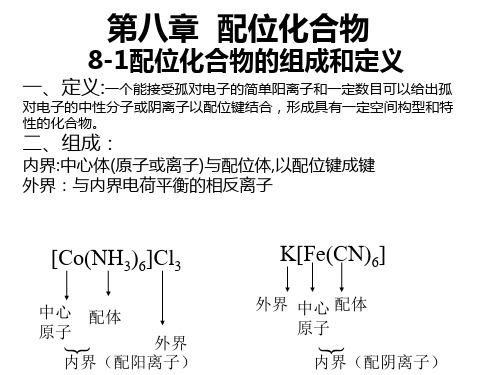
Hale Waihona Puke 1.2 配合物的组成中心离子和配位体之 间以配位键结合。
NH3 H3N Cu NH3 NH3
2+ 2 SO4 2
配合物的组成分为内 界和外界两部分。
第8章 配位化合物

[Cu(NH3)4]SO4
配阳离子 [Cu(NH3)4]2+
K2[HgI4]
配阴离子 [HgI4]2-
2、配位化合物 配离子与相反电荷离子所构成的电中性化合物
含有配离子的配合物 [Cu(NH3)4]SO4
K2[HgI4]
电中性配合物
[CoCl3(NH3)3]
[Fe(CO)5]
8.1.2 配合物的组成
(out spher)
①内外界之间为离子键,配合物可解离。
配位单元内部,形成体和配体之间是配位键,相对稳定。
②外界离子具有简单离子的性质。
③有的配位单元是电中性的,如:[Ni(CO)4]、[Fe(CO)5]。
配位原子
[Fe(CO)5]
中心 配 配 原子 体 位 (形成体) 数
1. 含有配离子的配合物
阴离子 F- Cl- Br- I- OH- CN- NO2配体 氟 氯 溴 碘 羟基 氰 硝基 O C N 配位原子 F Cl Br I
ONOSCNNCS阴离子 配体 亚硝酸根 硫氰酸根 异硫氰酸根 O S N 配位原子
常见多齿配体 分子式 名称
O C
-
缩写符号 (OX)
O C
O
O
-
草酸根
乙二胺
一、配合物化学式的书写原则 (1)在配合物中,阳离子在前,阴离子在后 (2)在配离子中,按如下顺序: [形成体∙∙∙阴离子配体∙∙∙中性配体∙∙∙阳离子配体]
例如: [CoCl2(NH3)3(H2O)]Cl
[Co(ONO)(NH3)5]SO4
二、配合物的命名
1、按无机化合物的命名原则:
从后向前读,即先阴离子后阳离子
[Cu(NH3)4]SO4
中 心 离 子 配 体 配 位 数
第八章 配位化合物

NH3 Cu(NH )
2 3 3
K f,3 10
0
3.04
2 Cu ( NH3 ) 3 NH3 Cu(NH3 ) 2 4 K 0 K0 K0 K0f,3 K0f,4 1013.32 f f,1 f,2
外界: 普通阴、阳离子(Cl-,K+,SO42-等),有的配合物无外界
例如:[Ag(NH3)2]Cl
、 K[PtCl5(NH3)]、
[Ni(CO)4](无外界)
几个基本概念:
1、配合物:内界+外界(有的 无外界)
2、配离子: [Ag(NH3)2]+ 、[PtCl5(NH3)]配分子: [Ni(CO)4 ]
1
Ag(NH3 ) 2 0 0.010 0.010 x
0.030 0.030 0.020 0.010 2 x
0 x
1
0.010 x K f 1.67 107 x (0.010 2 x ) 2 0.010 x 0.010 0.010 2 x 0.010 0.010 1.67 107 x 6.0 106 x 0.0102 c ( Ag ) 6.0 106 mol L1 c ( NH3 ) c (Ag(NH3 ) 0.010mol L1 2
Cu(en)2
H 2C H 2C
2
的结构:
H2
H2
N Cu N
H2
N N
CH 2 CH 2
2+
H2
8、配离子与形成体的电荷数
Ag(S2 O3 ) 2
() ( 2 ) 3
第八章配位平衡和配位滴定法ppt课件

K f
1
(
K
a
)6
Kf越小,即生成的配合物稳定性越小;Ka越小, 即生成 的酸越弱,K就越大。
Fe3+ + 6F3OH-
[FeF6]3+
Fe(OH)3↓
既要考虑配位体的酸效应,又要考虑金属离子的水解效应。
2. 沉淀反应对配位平衡的影响
[Cu(NH3) 4]2+
Cu2+ + 4NH3 +
S2-
CuS↓
y 2.2310-7
二、配位平衡的移动
Mn+ + x L-
水解 氧化还原 沉淀
酸效应
MLx(n-x)
1. 酸度的影响 2.沉淀影响 3.氧化还原的影响
1. 酸度的影响
Fe3+ + 6F+ 6H+
[FeF6]36HF
总反应为:[FeF6]3- +6H+
Fe3+ + 6HF
K
c(Fe3 ) c6 (HF) c(Fe3 ) c6 (HF) • c6 (F- ) c([FeF6 ]3 ) c6 (H ) c([FeF6 ]3 ) c6 (H ) c6 (F- )
2. 配位体和配位原子 有孤电子对
Na[BF4]中[BF4]-是配位体, F为配位原子. a 单基配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 、 NCS-
含氧配位体 H2O 、 OH-
含卤素配位体 F- 、 CI- 、 Br- 、 I- 含碳配位体 CN- 、 CO
含硫配位体 SCN-
代入稳定常数表达式得:
Kf
c(Ag(NH3 )2 ) c(Ag )c2 (NH3 )
第八章_配位化合物

NH3 H3N H3N Co NH3 NH3 NH3
中心离子最高配位数: 第一周期 2 , 第二周期 4 第三,四周期 6 ,第五周期 8 影响配位数的因素: 中心离子 半径 电荷 半径 电荷 配位数 配位数
(AlF63-, BF4-)
配位原子 半径 电荷 半径 电荷 配位数 配位数
(AlF63-, AlCl4-)
配位数: 与中心原子成键的配位原子总数.
配位数 配位原子
[Fe(CO)5]若配位单元为中性分子,只有内界,没有外界
1、中心离子(或原子)
一般为带正电的过渡金属离子
[Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 非金属元素原子:SiF62- , PF6-
二者形成配位键ML. (2)中心原子采用杂化轨道成键. (3)中心原子杂化方式与配合物空间构型有关.
配位键形成条件: 成键原子一方有孤对电子; 另一方有空轨道.
配位键的形成: 配位键是由中心原子空的杂化轨道与配 位原子充满孤对电子的原子轨道相互重叠而 形成的。
二、σ配键和π配键
1、σ配键
[Co(NH3)6]3+ Co3+: 3s23p6 3d6
8.4 配合物的化学键本性
目前有三种理论讨论配合物中的化学键。 这
里介绍价键理论(实际上只是把杂化轨道扩大到 d
轨道)、晶体场理论和分子轨道理论。在此介绍价
键理论。
8.4 配位化合物的化学键本性
一、配合物价键理论要点 (1)中心原子(M):价电子层有空轨道,是电子对接
受体;
配体(L):提供孤对电子,是电子对给予体;
8.3 配合物的异构现象
第八章 配位化合物

三氯化三(乙二胺)合铁(Ⅲ)
氢氧化二氨合银(Ⅰ)
硫酸亚硝酸根•五氨合钴(Ⅲ) 四硝基•二氨合钴(Ⅲ)酸钾
NH4[Cr(NCS)4 (NH3)2] K2[Pb(SNC)2Cl4]
[Ni(CO)4 ] H2[PtCl6 ]
四(异硫氰酸根)•二氨合铬(Ⅲ)酸铵
四氯•二(硫氰酸根)合铅(Ⅳ)酸钾 四羰基合镍(0) 六氯合铂(Ⅳ)酸 氨基•硝基•二氨合铂(Ⅱ)
3.
配合物的空间构型,取决于中心
原子所提供杂化轨道的数目和类型。
杂化轨道要点 1. 在成键过程中,由于原子间的相 互影响,同一原子中参加成键的几个能 量相近的原子轨道可以进行混合,重新 分配能量和空间方向,组成几个数目相 等的杂化轨道
2. 杂化轨道成键时,要满足原子轨 道最大重叠
3. 杂化轨道成键时,要满足空间取 得最大键角 4. 杂化轨道又分为等性杂化和不等 性杂化两种 5. 杂化轨道的成键能力 sp3 > sp2 > sp > p > s
配体数(汉)+配体+―合”+中心原子+氧化数(罗马)
+ 不同配体用 • 分开 先无机、后有机 先负离子、后中性分子
若同为分子或离子则按配位原子的元素符号
的英文字母顺序
K [ Pt (NH3)Cl3]
三氯•氨合铂()酸钾
[Fe(en)3]Cl3 [Ag(NH3)2]OH [Co(ONO)(NH3)5]SO4 K[Co(NO2)4 (NH3)2]
磁 性:物质在磁场中表现出来的性质. 顺磁性:被磁场吸引 n > 0 , µ > 0,如O2, NO, NO2 反磁性:被磁场排斥 n =0 , µ = 0 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 磁 矩: µ =[n(n+2)]1/2 玻尔磁子 ( B ) B = 9.27 10-24 A· m2
无机化学(人卫版)第八章__配位化合物

配合物的命名:配位盐类
盐的名称
硫酸钾
配合物
K4[Fe(CN)6] [Cu(NH3)4]SO4
配合物的名称
六氰合铁(II)酸钾 硫酸四氨合铜(II)
配离子的名称
六氰合铁(II)配离子 四氨合铜(II)配离子
(K2SO4)
硫代硫酸钠
K4[FeCl2(C2O4) (en)]
二氯· 草酸根· 乙二 胺合铁(III)酸钾
特点:必须含有孤对电子。
常见配位原子:一般为周期表中电负性较大 的非金属原子。
F–,Cl– ,Br–,I– OH–,OH2, NO2–(硝基),NCS–,NH3,NO–(亚硝酸根)
CO,CN–
SCN–
中心离子(或原子)
又称配合物形成体,位于配离子中心。 绝大多数为金属离子或金属原子,一般为过渡金属 离子或原子,如:Fe、Co、Cr、Ni、Cu、Ag、Hg等。
常见金属离子的配位数
1价金属离子 Cu+
Ag+ Au+
2价金属离子 Ca2+
Fe2+ Co2+ Ni2+ Cu2+
3价金属离子 Al3+
Sc3+ Cr3+ Fe3+ Co3+
2,4
2 2,4
6
6 4,6 4,6 4,6
4,6
6 6 6 6
Zn2+
4,6
Au3+
4
影响配合物配位数的因素
1. 中心原子及配体的种类
关计算。
第一节 配合物的基本概念
最早配合物:亚铁氰化铁(Fe4[Fe(CN)6]3)(普鲁士蓝)。 铜氨配合物: 硫酸铜溶液滴加氨水,开始时有大量天蓝色
第八章 配位化合物,,

出现多种配体:
先离子后分子,例如:
K[PtCl3NH3]:三氯•氨合铂(Ⅱ)酸钾; 同是离子或同是分子,按配位原子元素符
号的英文字母顺序排列,例如:
[Co(NH3)5H2O]Cl3:氯化五氨•水合钴(Ⅲ); 配位原子相同,少原子在先;配位原子相
同,且配体中含原子数目又相同,按非配位原
子的元素符号英文字母顺序排列,例如:
(M1L1) (M2L2) 与(M2L1) (M1L2)
•
§8.4 配合物的化学键理论
8.4.1 价键理论 * 8.4.2 晶体场理论
8.4.1 配合物的价键理论
1.价键理论的要点: (1) 中心离子(M):有空轨道
配位体(L):有孤对电子 中心离子与配体通过配位键相结合,由配 体提供孤对电子填入中心离子的空轨道, 二者形成配位键M L
• (2)配离子中成键轨道的杂化和空间构型
• 在形成配离子时,中心原子所提供的空轨 道必须进行杂化,形成一组等价的杂化轨 道,以接受配体的孤电子对。
• 杂化类型有:SP、SP2、SP3、dSP2、 SP3d2 (d2SP3)
• (3)内轨和外轨型配合物
配位数为 2 的配合物 [Ag(NH3)2]+的空间构型为直线形,μ=0。
(2)结构异构现象 • 解离异构
当配合物在溶液中电离时,由于内界和外 界配位体发生交换生成不同的配离子的异构现 象叫解离异构。 [CoBr(NH3)5]SO4 紫色 [Co(SO4)(NH3)5]Br红色
水合异构:[Cr(H2O)6]Cl3 紫色; [Cr(H2O)5Cl]Cl2·H2O蓝绿色 [Cr(H2O)4Cl2]Cl·2H2O绿色
配离子 计算磁矩 实测磁矩 杂化类型
Fe(CN)63- 1.73 2.3 内轨型(低自旋) Fe(H2O)63+ 5.92 5.88 外轨型(高自旋) 这类配合物的磁矩可按下式计算:
无机化学第八章 配位化合物(天大)

类型
配位 酸
主要内容 化学式
H[BF4]
命名
四氟合硼(Ⅲ)酸
H3[AlF6]
六氟合铝(Ⅲ)酸
配位1[Z. n镧(N系H3、)4](锕OH系)2元素氢氧通化性四氨合锌(II)
碱 2[C.r(我OH国)(H稀2O)土5](O元H)2素氢氧资化源一羟和基提五水取合铬(Ⅲ)
配 K[Al(OH)4]
四羟基合铝 (Ⅲ)酸钾
位 3[C.o核(NH反3)5应(H2类O)]型Cl3 三氯化五氨一水合钴(III)
盐 [Pt(NH3)6][PtCl4] 四氯合铂(II)酸六氨合铂(II)
中性 [Ni(CO)4]
四羰基合镍
分子 [PtCl2(NH3)2]
二氯二氨合铂(II)
主要内容 注意 带倍数词头的无机含氧酸根阴离子配
体,命名时需用括号括起来
阴离3.子核反O应NO类- 型 SCN-
NCS-
配体 亚硝酸根 硫氰酸根 异硫氰酸根
配位原子 O
S
N
常见多齿配体
分子主式 要内容名称
O
O
CC
草酸根
-O
O-
缩写符号 (OX)
1. 镧系、锕系元乙素二通胺性 (en)
2. 我N 国N稀土元素邻资菲源罗和啉 提(o取-phen)
3. 核N 反N应类型
配体 配位原子
命名
2. 我O国NO稀- 土元素O资源和亚提硝取酸根
3. 核SN反CON应-2- 类型
N S
硝基 硫氢酸根
NCS-
N 异硫氢酸根
主要内容 注意 某些分子或基团,作配体后读法上
有所改变
1. 镧系、锕系元素通性
2.如我国稀CO土元素羰资基源和提取
第八章 配位化合物

硬碱: 给出电子对的原子的电负性大,不易变形。 如 : F-、Cl-、H2O、OH-、O2-、SO42–、NO3-、NH3 软碱: 给出电子对的原子的电负性小,易变形。 如: I-、S2-、CN-、SCN-、CO、S2O32-、C6H6 交界碱: 其变形性介于硬碱和软碱之间。 如: Br-、SO32-、N2、NO2-
离子浓度计算: 1 各逐级稳定常数都很大(K稳很大) 2 配体大大过量 配位平衡与酸碱解离平衡 配位平衡和沉淀-溶解平衡:Ksp、K稳 配位平衡和氧化还原平衡:电对电极电势的变化 配位平衡与配合物的取代反应:配合物的稳定顺序
(2) K稳的应用
比较同类型配合物的稳定性 计算配合物中相关离子的浓度 计算沉淀的可溶性 判断配体取代反应的可能性 计算配离子形成对电极电势的影响
利用配合物的磁性判断其属于内轨型还是 外轨型配合物;
μ n(n 2)B.M.
几种特殊配合物中的d-pπ配键
中心离子的轨道杂化方式与配合物的空间构型
sp(直线) sp2(平面三角) sp3(正四面体) dsp2(平面正方) dsp3(三角双锥) d2sp2(d4s,四方锥) d2sp3(sp3d2,八面体)
配体影响(光谱化学序列):配位原子的电负性小, 给电子能力强,配位能力强,分裂能大。 按配位原子来说,∆大小为:卤素<氧<氮<碳 I-< Br-< SCN-< Cl-< F-< OH-<-ONO-<C2O4 2 -< < H O < NCS- < NH < en < NO - < CN-≈ CO 2 3 2
三、配位-解离平衡 1. 溶液稳定性 (1) 软硬酸碱原则 分类
第八章 配位化合物与配位滴定

26
4.配离子的转化
在配位反应中,一种配离子可以转化成更稳定 的配离子。
如[HgCl4]2-与I-反应生成[HgI4]2-,[Fe(NCS)6]3-
与F-反应生[FeF6]3-,其反应式如下:
[HgCl4]2- +4I-
[HgI4]2- +4Cl-
[Fe(NCS)6]3-+6F- [FeF6]3-+6SCN- 血
红色
无色
原因:Kf([HgI4]2-)> Kf (HgCl42-); Kf ([FeF6]3-)> Kf {[ Fe(NCS)63-]}
*
第八章 配位化合物与配位滴定
27
例8-3 计算反应
[Ag(NH3)2]+ + 2CN-
[Ag(CN)2]- + 2NH3
的平衡常数,并判断配位反应进行的方向。
Fe3+ + I-
Fe2+ + 1/2I2
向该系统中加入F-,Fe3+立即与F-形成了[FeF6]3-, 降低了Fe3+浓度,因而减弱了Fe3+的氧化能力,使上述 氧化还原平衡向左移动。I2又被还原成I-。
总反应: Fe3+ + 1/2I2 + 6F-
[FeF6]3-+ I-
*
第八章 配位化合物与配位滴定
32
配位性质
EDTA 有 6 个配位基
2个氨氮配位原子 4个羧氧配位原子
溶解度
型体
溶解度 (22 ºC)
H4Y
0.2 g / L
Na2H2Y 111 g / L, 0.3 mol /L
*
第八章 配位化合物与配位滴定
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1704年,普鲁士人在染料作坊中发现第一个配合物 1789年,B. M. Tassert发现分子加合物[Co(NH3)6]Cl3 1893年,Werner提出“络合理论” 1930年,Pauling 提出配位键理论
1929 年,H. Bethe 提出晶体场理论
X-射线晶体衍射技术的产生,促进配位化学的发展
•• ••
4s 3d
•• ••
4p
dsp2杂化
Ni(CN)42 –的空间构型为平面四边形
③ML6配合物:
[FeF6]3– Fe3+ (3d5):
3d
F–的配位作用较弱,利用4s、4p、4d轨道杂化
•• •• •• •• •• ••
3d
4s
4p sp3d2杂化
4d
[FeF6]3–的空间构型为八面体
[Fe(CN)6]4Fe2+ (3d6):
例如:
[NiCl4]2-
[Ni(CN)4]2-
sp3杂化
外轨型 正四面体
dsp2杂化 内轨型 平面正方形
3. 价键理论的应用
⑴判断配合物的空间构型
判断中心离子杂化类型及配合物空间构型的方法
1. 根据配位数=杂化轨道数,初步判断中心离子
也有中性原子,如[Ni(CO)4]、[Co(CO)4]中的Ni、Co等。
②配位体:
含有孤对电子的分子或离子
配体中提供孤对电子与 中心离子以配位键相结 合的原子称配位原子, 如NH3分子中的N原子, H2O分子中的O原子。
常见配体和配位原子
配体
NH3,RNH2,NCS-
配位原子
N
H2O,OH-,RCOO-,
②中心离子提供的空轨道是经过杂化的。 杂化类型由中心原子M的价电子构型和配 体L的种类、数目决定。 ③配合物(配离子)的空间构型取决于中 心离子的杂化方式。
2. 杂化类型、配位数与空间构型
2 4 4 6
sp
sp3
dsp2
d2sp3 or sp3d2
直线形
正四面体形
平面正方形
八面体形
配位数与杂化类型及空间构型关系
2.系统命名法 配合物中有不同配体,命名顺序为: [阴离子配体中性分子配体—合—中心原子 (用罗马数字标明可变的中心原子的氧化 数)]。 配体个数用倍数词头二、三、四等表示。 较复杂的配体名称,配体要加括号以免 混淆。
举例: ①配阴离子配合物:命名同含氧酸盐 K2[SiF6] 六氟合硅酸价 K[PtCl5(NH3)] 五氯· 氨合铂(Ⅳ)酸钾 Na[Co(CO)4] 四羰基和钴(-I)酸钠 K[PtCl3NH3] 三氯· 氨合铂(II)酸钾 [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化硝 基· 氨· 羟氨· 吡啶合铂(II)
抗癌药
(紫色)
(绿色)
图:[Cr(NH3)4Cl2]+的几何异构
2.旋光异构
旋光 异构是指 两个异构 体的对称 关系类似 人的左、 右手,他 们是互成 镜像的对 应关系。
图:三(乙二胺)合钴(III)的旋光异构体
8.3.2 结构异构
结构异构是指配合物的实验式相同, 但成键原子的连接方式不同而形成的异构 体。 常见的种类有:解离异构、水和异 构、配体异构、键合异构、配位异构等。
如:
[Co(NH3)5Br]SO4 紫色 [Co(NH3 )5SO4]Br 红色
[Co(NH3)5 Br]2+ + SO42[Co(NH3)SO4 ]+ + Br-
8.4 配位化合物的化学键本性
价键理论
1
2
晶体场理论
8.4.1 价键理论
1. 价键理论要点 ①中心离子(或原子)与配体以配位键结合形 成σ键和π配键(常存在于复杂配合物中)。 中心离子:提供空轨道;电子受体(acceptor) 配体 :提供孤对电子;电子给体(donor)
CN-,CO H2S,SCNF-,Cl-,Br-,I-
O
C S X
两可配体
SCN配合物实例 配位原子 配体名称 [Ag(SCN)2]- *SCN-
硫氰酸根
[Fe(NCS)6]3* NCS-
异硫氰酸根
NO2配合物实例 配位原子 配体名称 [Co(NH3)5(NO2)]2+ *NO2- 硝基 [Co(NH3)5(ONO)]2+ ONO*- 亚硝酸根
例题:命名下列配合物,指出它们的
配位体、配位原子及配位数 [Co(NH3)6]3+ 六氨合钴(Ⅲ)配离子 配体: NH3 ,配位原子: N
配位数:
6
K4[Fe(CN)6]
CN 配体:
六氰合铁(Ⅱ)酸钾
,配位原子: C
配位数: H2[PtCl6]
6
六氯合铂(Ⅳ)酸
,配位原子: Cl
Cl 配体:
配位数:
2+ H2 N H2 N
[Co(en)3]3+
[Ca(edta)]2-
Cu
N H2
N H2
3.特殊配合物
(1)金属羰基配合物:金属原子与一氧化碳 结合的产物。Ni(CO)4,Fe2(CO)9等。 (2)簇状配合物(簇合物):含有至少两个 金属,并含有金属-金属键的配合物。如: Co4(C5H5)4H4,(W6Cl12)Cl6。
为外轨型配合物。
内轨型配合物与外轨型配合物的区别:
内轨型:配位键共价性较强 外轨型:配位键离子性较强 配位键的键能:内轨型 > 外轨型
配合物的稳定性:内轨型 > 外轨型
内外轨型取决于:
配位体
中心原子
同一中心离子由于配体的影响可能分 别生成内、外轨型配合物
CN –、 CO、 NO2 –等易形成内轨型(d电子重排) ——强场配体 X – 、OH –等易形成外轨型(d电子不重排) ——弱场配体
6
8.3 配位化合物的异构现象
几何异构
立体异构
配合物的异构
结构异构
旋光异构
8.3.1 立体异构
配合物的立体异构是指配合物的中心 离子(或原子)相同、配体相同、内外界 相同,只是配体在中心体周围空间排列方 式不同的一些配合物。
几何异构 立体异构 旋光异构
1.几何异构
几何异构主要发生在配位数为4的平面 正方形配合物和配位数为6 的正八面体配合 物中。
M
草酸根:
-O–C–C–O-
= =
O O
四齿配体:
氨基三乙酸根:
CH2COON–CH2COOCH2COO-
六齿配体
乙二胺四乙酸根(EDTA)
③配位数 与中心原子直接以配位键结合的配位原 子的总数称为该中心原子的配位数。
中心原子的配位数与配体的齿数有关。
a) 若配体是单齿的,配位数=配体的数目,如 [Cu(NH3)4]2+中,配位数是NH3分子的数目4; b) 若配体是多齿的,配位数=配体的数目×齿数, 如 乙二胺是双齿配体,在[Pt(en)2]2+中,Pt2+的配 位数为 2×2=4。
简单配合物
配合物
螯合物
特殊配合物
1.简单配合物
• 由单齿配体和中心原子所形成的配合为简 单配合物。[Ag(NH3)2]Cl, K3[Fe(CN)6]等。
Zn(OH )( H 2O)3 NO3
K PtCl5 ( NH 3 )
2.螯合物
一个中心离子与多齿配体成键,形成环状结构。
[Cu(en)2]2+
铁钼硫簇合物
(3)大环配合物 一类在配合物的环的骨架 上含有O,N,S,P或As等多个配位原子的多齿 配体所生成的环状配合物。
8.2.2 配合物的命名
1.习惯命名法 少数配合物用习惯命名,如: K4[Fe(CN)6]:黄血盐或亚铁氰化钾 K3[Fe(CN)6]:赤血盐或铁氰化钾 [Ag(NH3)2]+:银氨络离子
内外轨型的决定因素
① 中心离子的价电子
a) 若中心离子为d9~d10型,只能形成外轨型配合
物,如Zn2+、Cd2+、Hg2+等离子;
b) 若中心离子为d1~d3型,易形成内轨型配合物,
如Cr3+等离子; c) 若中心离子为d4~d8型,二种类型的配合物均有 可能形成,具体采用何种方式与配位原子的性 质有关,如Fe2+、Fe3+、Co3+、Ni2+等离子。
根据一个配体中所含配位原子数目的不同, 可将配体分为单齿(或称单基)配体和多齿(或 称多基)配体。
单齿配体:一个配体中只有一个配位原子。
如:NH3、OH-、X-、H2O、 (吡啶) 等。
N N
多齿配体:一个配体中有两个或两个以上的配位原子。
如:乙二胺(简写为en)
H 2N M
NH2
双齿配体:
乙二胺(en): H2N–CH2–CH2–NH2
2
配位化合物的组成
配位原子
[ Cu ( NH3 )
中心离子 配位体 内 界
4
] SO4
外界离子 外 界
配位数
离子键
配 合 物
内界 (inner sphere):配位单元 外界 (outer sphere):与内界电荷平衡的相反离子 中性配合物(配合分子)没有外界,如:Fe(CO)5
①中心离子: 具有能接受孤对电子的价层空轨道。 一般多为带正电荷的阳离子,其中以过渡元 素金属离子居多,如Cu2+、Fe2+、Fe3+、Ag+ 等; 少数高氧化态的非金属元素也可以作中心离 子,如[BF4]-、[SiF6]2-,其中的B3+、Si4+
在CN-作用下,d电子重排后,空轨道进行杂化
•• ••
••
••
••
