实验三水的汽化热的测定
实验三b水的汽化热的测定(用杜瓦瓶测)

实验三(b ) 水的汽化热的测定(用杜瓦瓶测)实验目的1.测定水在大气压下的汽化热。
2.学会测定杜瓦瓶的有效热容量。
实验仪器煮水器,电热器,杜瓦瓶,0.1℃刻度的温度计,物理天平,蒸馏水,输入水蒸汽的导管等。
实验原理单位质量的液体在温度不变的条件下变成水蒸汽时所吸收的热量,叫做液体的汽化热,常以γ表示,单位为卡/克。
当水蒸汽凝结时,则放出与汽化热等量的热量。
汽化热的数值与汽化时的温度有关。
本实验测定水在常沸点(与常压强相对应)时的汽化热。
为此,把煮水器中质量为m d 的饱和水蒸汽引入盛有水的量热器中。
本实验用一只杜瓦瓶来替换一般的量热器,引入的蒸汽和瓶中的水混合并在水中凝结。
设引入的蒸汽温度为1T (100℃),以1T ′、2T 分别表示在量热器中水的初始温度和终止温度,以m w 表示量热器内原先水的质量,C ′表示量热器连同质量为m w 的水的有效热容量(略去搅拌器)。
蒸汽凝结时放出热量γ·m d 。
这凝结成水后又冷却到终温2T ,在这个过程中,它又放出热量w C ·m d ·(1T -2T ),而量热器则吸收热量C ′·(2T -1T ′)。
根据热平衡原理有 γ·m d +w C ·m d ·(1T -2T )=C ′·(2T -1T ′) 所以)()(2112T T C T T m C w d −−′−′=γ (3-3b -1) 因为是采取杜瓦瓶来替换量热器,待测量物质同周围介质的热交换非常小,所以1T ′和2T 可能直接测量而无需要进行散热校正,也能达到测量的准确度要求。
现在来讨论杜瓦瓶以及它内部装有水的有效热容量C ′。
由于玻璃的导热率很小,只有容器的内壁的温度才会升高到与水相同的温度。
因此,在C ′内不应当算进量热器的全部热容量。
为此,可用下述方法就能准确地求出有效热容量C ′:首先,用与实验时相等量的温度为室温的水注入量热器,使容器的温度有一个确定的值。
水的汽化热的测量
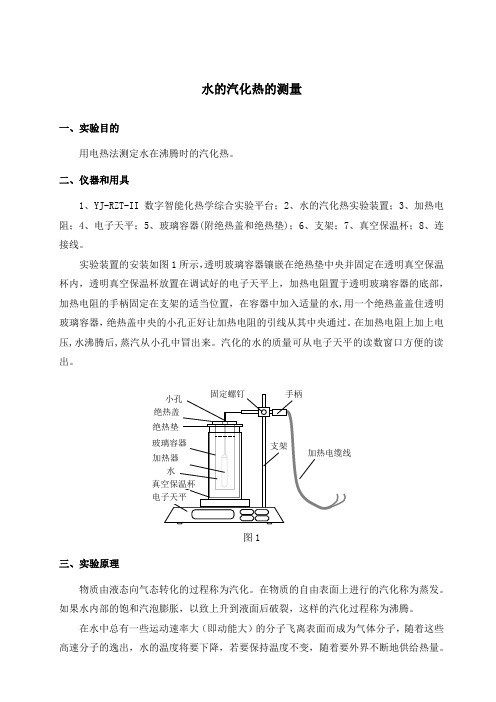
水的汽化热的测量一、实验目的用电热法测定水在沸腾时的汽化热。
二、仪器和用具1、YJ-RZT-II数字智能化热学综合实验平台;2、水的汽化热实验装置;3、加热电阻;4、电子天平;5、玻璃容器(附绝热盖和绝热垫);6、支架;7、真空保温杯;8、连接线。
实验装置的安装如图1所示,透明玻璃容器镶嵌在绝热垫中央并固定在透明真空保温杯内,透明真空保温杯放置在调试好的电子天平上,加热电阻置于透明玻璃容器的底部,加热电阻的手柄固定在支架的适当位置,在容器中加入适量的水,用一个绝热盖盖住透明玻璃容器,绝热盖中央的小孔正好让加热电阻的引线从其中央通过。
在加热电阻上加上电压,水沸腾后,蒸汽从小孔中冒出来。
汽化的水的质量可从电子天平的读数窗口方便的读出。
图1三、实验原理物质由液态向气态转化的过程称为汽化。
在物质的自由表面上进行的汽化称为蒸发。
如果水内部的饱和汽泡膨胀,以致上升到液面后破裂,这样的汽化过程称为沸腾。
在水中总有一些运动速率大(即动能大)的分子飞离表面而成为气体分子,随着这些高速分子的逸出,水的温度将要下降,若要保持温度不变,随着要外界不断地供给热量。
1kg 的水汽化时所吸收的热量就是该物质的汽化热。
汽化热与汽化时的温度有关,温度升高时汽化热减小。
因为随着温度的升高,液相与气相之间的差别将逐渐减小。
如图1所示,在容器中加入了适量的水,加热电阻丝加上直流工作电压,水沸腾后,蒸汽从出汽口冒出来。
测出加热电阻丝上两端的电流I 和电压U ,以及通电时间t 和t 时间内汽化的水的质量M ,则:h ML UIt +=式中:L 为水蒸气的比汽化热:h 为水的汽化热实验装置总的散失的热量。
假定在相同的时间间隔t 里,水的汽化热实验装置散失的热量h 相等,则可得到下列等式:h L M t I U +=111h L M t I U +=222由两等式得:212211)(M M t I U I U L --= (1) 式中, I 1、U 1及I 2、U 2为相同条件下,两次不同电流和电压的实验数据。
水的比汽化热测定实验报告

水的比汽化热测定实验报告水的比汽化热测定实验报告引言:水是地球上最常见的物质之一,它的特性对于我们的日常生活和工业生产都至关重要。
而水的比汽化热则是描述水从液态转变为气态所需的能量,它在热力学和化学领域中具有重要的意义。
本实验旨在通过测定水的比汽化热,深入了解水的性质以及热力学原理。
实验目的:1. 了解水的比汽化热的定义和意义;2. 学习使用实验装置和测量方法,进行水的比汽化热的测定;3. 掌握实验数据的处理和结果分析方法。
实验原理:水的比汽化热是指单位质量的水从液态转变为气态所需的能量。
在实验中,我们使用加热器加热水,使其温度升高,直至沸腾。
当水沸腾时,温度不再升高,而是保持恒定,这是因为水的沸点温度与外界压强有关。
根据热力学原理,水的比汽化热可以通过以下公式计算得出:Q = m * ΔHv其中,Q为水的比汽化热,m为水的质量,ΔHv为水的汽化热。
实验步骤:1. 准备实验装置:将加热器连接到恒温水槽中,加热器上方放置一个温度计,确保温度计能够准确测量水的温度。
2. 将一定质量的水倒入加热器中,并记录水的质量。
3. 打开加热器,逐渐加热水,同时用温度计测量水的温度变化。
当水开始沸腾时,记录下此时的温度,并保持恒定。
4. 关闭加热器,等待水冷却至室温,并记录下此时的温度。
5. 根据实验数据计算水的比汽化热。
实验数据:通过实验记录的数据,我们可以计算出水的比汽化热。
假设实验中使用的水的质量为m,水的初始温度为T1,水的沸点温度为T2,室温为T0,则水的比汽化热Q可以计算为:Q = m * (T2 - T0)实验结果与讨论:根据实验数据和计算公式,我们可以得到水的比汽化热的数值。
在实验过程中,我们发现水的沸点温度与外界压强有关,当压强增加时,水的沸点温度也会相应升高。
这是因为增加压强会增加水分子之间的相互作用力,使得水分子更难从液态转变为气态,所需的能量也会增加。
此外,实验中我们还发现,水的比汽化热是一个固定的数值,与水的质量无关。
水的汽化热的测定实验报告

水的汽化热的测定实验报告一、实验目的1、学习用混合量热法测定水的汽化热。
2、了解量热器的使用方法,熟悉热学实验中的基本测量技术。
二、实验原理当水在沸点时变为同温度的蒸汽所吸收的热量,称为水的汽化热。
设质量为 m 的水在沸点时全部变为同温度的蒸汽所吸收的热量为 Q,则汽化热 L 为:\L =\frac{Q}{m}\在本实验中,我们使用混合量热法来测定水的汽化热。
将水蒸气通入盛有一定质量和温度的水的量热器中,当水蒸气全部凝结成水且系统达到热平衡时,通过测量量热器内水的质量变化、初温、终温以及量热器内原有水和量热器的质量、比热容等参数,就可以计算出水的汽化热。
根据热平衡原理,水蒸气放出的热量等于量热器内原有水和量热器吸收的热量之和。
设水蒸气的质量为 m',量热器内原有水的质量为 m1,量热器的质量为 m2,比热容分别为 c1 和 c2,水的初温为 T1,终温为T2,水蒸气的温度为 T(沸点),则有:\m'L =(m1c1 + m2c2)(T2 T1)\由此可得水的汽化热:\L =\frac{(m1c1 + m2c2)(T2 T1)}{m'}\三、实验仪器1、量热器2、蒸汽发生器3、温度计4、天平5、绝热盖6、秒表四、实验步骤1、用天平称出量热器内筒及搅拌器的质量 m2。
2、在内筒中加入适量的水,称出总质量 m1 + m2,算出所加水的质量 m1,并记录水的初温 T1。
3、连接好蒸汽发生器,将蒸汽导入量热器。
4、当蒸汽充满量热器时,用绝热盖盖好,同时停止通入蒸汽,用搅拌器搅拌,观察温度计示数,待温度稳定后记录终温 T2。
5、称出量热器、水和凝结水的总质量 m1 + m2 + m',算出凝结水的质量 m'。
五、实验数据记录与处理|实验序号|m1 (g)|m2 (g)|T1 (℃)|T2 (℃)|m' (g)|||||||||1|_____|_____|_____|_____|_____||2|_____|_____|_____|_____|_____||3|_____|_____|_____|_____|_____|平均值:\\bar{m_1} =\frac{m_{11} + m_{12} + m_{13}}{3}\\\bar{m_2} =\frac{m_{21} + m_{22} + m_{23}}{3}\\\bar{T_1} =\frac{T_{11} + T_{12} + T_{13}}{3}\\\bar{T_2} =\frac{T_{21} + T_{22} + T_{23}}{3}\\\bar{m'}=\frac{m_{1}'+ m_{2}'+ m_{3}'}{3}\已知水的比热容 c1 = 42×10³ J/(kg·℃),量热器的比热容 c2 约为04×10³ J/(kg·℃),根据实验数据计算水的汽化热 L:\L =\frac{(\bar{m_1}c1 +\bar{m_2}c2)(\bar{T_2} \bar{T_1})}{\bar{m'}}\六、误差分析1、热量散失:在实验过程中,系统不可避免地会与外界发生热交换,导致热量散失,从而使测量结果偏小。
实验三 水的汽化热的测定

实验三 水的汽化热的测定一、实验目的1、学习用混合量热法测定水的汽化热。
2、了解一种粗略修正散热的方法——抵偿法。
二、实验仪器1、XJ-TQ-2型液体汽化热测定仪;2、WL-1物理天平;3、秒表。
三、实验原理在一定的外部压强下,液体总是在一定的温度下沸腾,在沸腾过程中,虽然对它继续加热,但液体的温度并不升高。
可见,在把液体变成汽体时,要吸收热量。
为此引进汽化热这个物理量,来表示在一定温度及压强下,单位质量的液体变成同温度的汽所需要的热量,即:L Q m =反过来,当汽体重新凝结成液体时就会放出热量。
所放出的热量跟等量的液体在同一条件下汽化时所吸收的热量相同。
即:汽化热=凝结热。
由此,本实验通过测定出水蒸汽在常压条件下凝结热,从而根据上式,间接得到水在沸点(100℃)时的汽化热。
蒸汽从发生器出来,经玻璃管进入量热器内筒中凝结成水,放出热量,使量热器内筒和水的温度由初温1t 升到θ,设凝结成水的蒸汽质量为m ,蒸汽由2t ℃变到θ℃的有个中间转化过程,那就是2t ℃的水蒸气首先转化成2t ℃的水,这时要放出热量,即凝结热mL ;然后2t ℃的水再与冷水混合,最终达到热平衡,平衡温度为θ℃,这时要放出热量2()c m t θ-水,则总的放热量就是 2()Q mL c m t θ=+-放水 设量热器和水的质量分别为1m 、M ,比热分别为1c 、c 。
则量热器、水所得到的热量(不考虑系统的对外散热): 111()()Q m c M ct θ=+-吸 式中由热平衡方程式 吸放Q Q =θ t 1 则 1112()()()m c cM t mc t L m θθ+---= (1)【散热修正】:上述讨论是假定量热器与外界无热量交换时的结论.实际上只要有温度的差异就必然要有热交换存在,因此必须考虑如何防止散热或对散热进行修正。
本实验中热量的散失主要是蒸汽通入盛有水的量热器中,混合过程中量热器向外散失的热量,由此造成混合前水的初温与混合后水的终温不易测准.为此,根据牛顿冷却定律来修正温度。
水的比汽化热的测定

水的比汽化热的测定物质由液态向气态转化的过程称为汽化,液体汽化有蒸发和沸腾两种形式,两种形式均是液体中一些热运动动能较大的分子逸出液体表面成为气体分子的过程。
液体的温度越高,动能大的分子数越多,汽化就越快,汽化是一个吸热过程。
单位质量的液体转变为同温度的气体所需要吸收的热量,叫这种液体的比汽化热L。
比汽化热不单和液体种类有关,还和汽化时的温度有关,温度升高,比汽化热减小。
物质由气态转变为液态的过程称为凝结,凝结时将释放出在同一条件下汽化所吸收的相等的热量,因而可以通过测量凝结时放出的热量来测量液体汽化时的比汽化热。
【实验目的】1.熟悉集成电路温度传感器AD590的特性和使用方法。
2.了解量热器的使用方法,测定水在100℃时的比汽化热。
3.学习分析热学量测量中的实验误差。
【实验仪器】FD-YBQR液体比汽化热测定仪(含主机、加热炉及支架、烧杯,AD590温度传感器、量热器),保温瓶,天平等。
【实验原理】1.测量原理本实验采用混合法:将质量为M ,温度为3θ(l00℃)的水蒸气通入到量热器内杯(量热杯)中的水中,原来水的质量为m ,量热杯和搅拌器的质量分别为1m 、2m ,水和量热杯的初始温度为1θ。
水蒸气被凝结成同温度的水,最终达到平衡时的温度为2θ,如果将系统看成是一个与外界没有热交换的孤立系统,那么系统内的放热和吸热满足下面的热平衡方程:)()()(121123θθθθ-⋅+=-+A W W C M mC MC ML (1)从而)()(231211θθθθ---⋅+=W A W C MC M mC L (2) 其中:L 为水的比汽化热,W C 为水的比热容,1A C 为铝的比热容,m 为通汽前量热杯中水的质量,211m m M +=。
上面的公式是不考虑系统与外界热交换产生的热量损失时的结论,实际上只要有温差存在,就有热损失,因而存在系统误差。
本实验中,热量的损失主要是蒸汽通入盛有水的量热器,在混合过程中通过量热器向外散失热量,由此而造成系统误差。
水的汽化热测定实验研究

水的汽化热测定实验研究张 雄 冉光德 王黎智 马 力(云南师范大学物理系,昆明 650092)摘 要 介绍了一种测定水的汽化热的实验方法,并对其测量原理作了讨论.该方法测量结果准确,方法简便.关键词 汽化热;饱和蒸汽压分类号 O 551.11 引言水的汽化热和饱和蒸汽压测量是理工科大学生的必修实验[1],在热学[2]和物理化学实验[3]中,所使用的测量仪器和实验方法都比较复杂,实验必须在教师指导下在实验室中才能完成.本文介绍一个测定水的汽化热的自制实验.该实验的装置简单,一般的实验室都能配备,可以用来做学生的选修实验.由于实验中巧妙地应用了热力学理论,学生利用一些简单器材也能自制实验装置.因此,也可以作为学生的设计性实验或课外实验.该实验通过测定水的饱和蒸汽压,利用克劳修斯-克拉珀龙方程计算出水的汽化热.它还能帮助学生更好地理解和掌握理想气体定律以及道尔顿分压定律.2 实验原理一个化学纯的物质叫做单元系,它只含有一种分子.假设所讨论的单元系有两相同时存在而达到平衡,这两相各用符号α和β表示.根据平衡条件,这两相的温度、压强和化学势在平衡时都应当相等.设两相的共同温度为T,共同压强为p,并选T和p为独立变量.设μα为α相的化学势,μβ为β相的化学势,他们都是T、p的函数.由化学势的定义(即一摩尔分子的吉布斯函数)得μα=uα-TSα+pvα,μβ=uβ-TSβ+pvβ (1)其中uα、Sα、vα及uβ、Sβ、vβ分别为α相及β相的一摩尔分子的内能、熵、和体积.图1 相平衡曲线在p-T图上画一条相平衡曲线,如图1.曲线上任意一点代表两相共存保持平衡的状态.对于液、气两相系统,曲线上一点所对应的压强为该温度下的饱和蒸汽压[4].设(T+dT,p+dp)为曲线上邻近(T,p)的一点.当T和p变为T+dT和p+dp时,μα和μβ变为μα+dμα和μβ+dμβ.根据热力学有关理论,我们可以由此得出克拉珀龙方程为(2)将克拉珀龙方程用于液体-蒸汽的平衡转变时,与蒸汽的体积相比,我们一般可以忽略液体的体积,而且如果用理想气体定律来近似表示蒸汽的体积,克拉珀龙方程则简化为或 (3)上式称克劳修斯-克拉珀龙方程,它可以用来计算低压下的蒸发潜热λ.对于很小的温度变化,可以认为潜热λ是常量,这种情况下,由式(3)可得(4)这意味着当画出ln p对1/T的曲线图时,应得到一条直线,其斜率为-λ/R[6].图2 实验装置3 实验装置及结果示例3.1 实验装置及实验实验装置如图2所示.所用仪器为一支-2℃~100 ℃、最小刻度为1 ℃ 的温度计;一支50 ℃~100 ℃、最小刻度为0.1 ℃的温度计.一个10 ml、最小刻度为0.2 ml的玻璃量筒.一个800 ml的烧杯.一个电炉,一块废旧的聚氨脂包装板(用其它废旧隔热材料也可)和一个搅拌器(用一截铁丝自制).先用小刀在聚氨脂薄板上适当位置处钻三个小孔,把玻璃量筒开口向下垂直地固定在聚氨脂板上;把纯水装入烧杯,然后往量筒里装水,用手指压住开口端倒置量筒使里面封闭一段气体,把量筒插入烧杯;再把温度计和搅拌器插入烧杯.两支温度计插入深度应不同,以便监测温度是否均匀;用电炉对烧杯里的水加热,直至90 ℃左右,以量筒里的液面不低于开口端为准.从电炉上取下烧杯放置在另一块聚氨脂薄板上(保证系统上下方向的散热相差不大,从而使测量中系统的水温自然均匀冷却),用搅拌器使水温均匀,随后自然冷却.当水温度均匀并静止不动时,对应一个水温有一个汽体的体积(量筒里气体的体积).读出一组数据并记录下来,当水温下降到50 ℃左右时停止读数.读数时应注意由于液体表面张力而形成的弯月面引入的测量误差.如果选用较细的玻璃量筒,测量误差对结果的影响较大.然后用冷水使整个系统降温,降至室温时,再加入冰块,直至降到0 ℃,读出此时量筒里汽体的体积V0,由福延式水银压强计读出大气压p0;最后用作图法或线性回归法对数据处理.装在玻璃量筒里的气相由空气和水蒸汽组成,气相压强可近似认为是大气压p0,此处忽略水柱的重量.对气相用道尔顿分压定律有p0=p+p气 (5)式中p为蒸汽压,p气为空气的压强.量筒中空气的物质的量用理想气体定律计算.在T0=273.15 K时,设p=0,此时气相只有空气,则n气=p0V0/RT0 (6)式中V0为温度为T0时空气的体积,n气为空气的物质的量,R为摩尔气体常数(R=8.31 J*mol-1*K-1[7]).在温度为T时,有(7)式中V为对应于温度为T时气相的体积.则有(8)因此,由一组T和V,可以计算出与之相对应的蒸汽的部分压强p.3.2 实验结果示例在实验中,计算p的误差主要来自观测T和V所引起的误差.其中测量V的误差远大于T的测量和其余假设和近似所引起的误差.体积的测量误差在有条件的情况下,可以用测高仪来修正.昆明地区的大气压强测量值为p0=610.0±0.5 mmHg.T0=273.15 K时V0的测量值见表1,为了减小测量误差,测量次数应不小于10次,表中给出的是V0的平均值.表1实验数据和计算的相应的p值T/K T-1/K-1V/cm3p/kPa ln(p/kPa)350.05 2.86×10-310.00 41.71 3.73349.56 2.86×10-39.80 40.96 3.71349.06 2.86×10-39.60 40.18 3.69348.57 2.87×10-39.40 39.36 3.67348.01 2.87×10-39.20 38.51 3.65347.48 2.88×10-39.00 37.63 3.63346.85 2.88×10-38.80 36.72 3.60346.15 2.89×10-38.60 35.78 3.58345.45 2.89×10-38.40 34.79 3.55344.85 2.90×10-38.20 33.73 3.52344.12 2.91×10-38.00 32.69 3.49343.25 2.91×10-37.80 31.53 3.45342.30 2.92×10-37.60 30.36 3.41341.45 2.93×10-37.40 29.11 3.37340.35 2.94×10-37.20 27.84 3.33339.19 2.95×10-37.00 26.50 3.28337.95 2.96×10-3 6.80 25.09 3.22336.55 2.97×10-3 6.60 23.63 3.16335.25 2.98×10-3 6.40 22.05 3.09333.67 3.00×10-3 6.20 20.43 3.02273.15 3.66×10-3 3.80±0.03图3 ln (p/kPa)~1/T曲线由上表的数据作ln (p/kPa)和1/T的曲线,如图3所示.若令式(4)中的ln (p/kPa)为Y,令1/T为X,则图3中直线斜率B e=-λ/R;截距A e为常量.从图3中我们得 -Be=λ/R=5042(K)则 λ=(5042×8.31)/18≈2328(kJ/kg)其中18为水(H2O)的相对分子质量.为了便于讨论实验误差,用上表的数据作一元线性回归法数据处理[8],得如下结果:B e=-4.980×103, σBe=80A e=17.94,σAe=0.23相关系数r=-0.99768454.经验公式由式(4), -λ/R=B e=-4.98×103则 λ=4.98×103×8.31/18=2.30×103(kJ/kg) σλ≈40所以 λ=2.30×103±40(kJ/kg)与文献[9]中查得在实验温度范围内λ的平均值λ=2351±30(kJ/kg)相比较,其百分误差为可见实验结果比较精确,可以满足实验教学的需要.4 讨论这个实验提供了一种通过测量温度和体积从而测定水的蒸汽压的实验方法.通过计算可得水的汽化热.作的各种假设和近似也是合理的.结果误差不大.所用实验装置很简单,还能反复使用.除水之外,许多无毒液体都可以用该实验方法测定其饱和蒸汽压和汽化热.5 参考文献1 曾贻伟,龚德纯等.普通物理实验教程.北京:北京师范大学出版社,1989.1262 [英]泰勒 F. 物理实验手册.张雄等译.昆明:云南科技出版社,1990.1343 [美]怀特 J M.物理化学实验.钱三鸿,吕颐康译.北京:人民教育出版社,1982.2074 王竹溪.热力学教程.北京:人民教育出版社,1979.131~1355 马本 ,高尚惠,孙煜.热力学与统计物理学.北京:高等教育出版社,1994.101~1026 [美]谢锐生.热力学原理.关德相等译.北京:人民教育出版社,1981.397 [日]饭田修一等.物理学常数表.曲长芝译.北京:科学出版社,1987.28 龚镇雄.普通物理实验中的数据处理.西安:西北电讯工程出版社,1985.133~1369 Perry R H, Chilton C H. Chemical Engineers Handbook. McGraw-Hill, Kogakusha, Japan, 1973.3-206RESEARCH ON EXPERIMENTION TO PETERMINETHE LATENT HEAT OF VAPORIZATION OF WATERZhang Xiong Ran Guangde Wang Lizhi Ma Li (Department of Physics, Yunnan Normal University, Kunming, 650092, China) Abstract A new method for measuring the latent heat of vapourization of water is introduced. The principle of this method is discussed.Key words latent of vaporization; saturated vapour pressure。
水的汽化热的测定实验改进

水的汽化热的测定实验改进引言:目的:本实验的目的是对传统水的汽化热测定实验方法进行改进,提高实验精度,同时还可以学习和掌握几种实验装置的使用。
原理:当一定质量的水在标准大气压下从液态变为气态时所需吸收的热量称为蒸发热,当从液态变为气态时还需要吸收的热量称为汽化热。
实验中所测定的就是水的汽化热。
根据这个原理,我们可以在实验中利用水从液态到气态转化的热量去计算水汽化热的大小。
实验方法及步骤:材料:电子天平、烧杯、圆底烧瓶、支架、烟花管、铝箔纸、U形水管、温度计、闪光灯。
步骤:1、用电子天平称取一定质量的烧杯。
3、将水倒入圆底烧瓶中,把圆底烧瓶放置于支架上。
4、将一个带有铝箔纸的烟花管立于圆底烧瓶里,使铝箔纸两端分别放在水和空气的交界处。
5、用U形水管将闪光灯的光点照在烟花管的一端,同时用温度计测出烟花管与水之间的温度差。
6、等待一段时间后,烟花管中的水被加热变成水蒸气,测量此时圆底烧瓶内的水面下降的高度。
7、根据测量出的温度差、圆底烧瓶中水的质量,利用公式计算出水的汽化热。
汽化热= M*g*H (J/g)M:水的质量;g:重力加速度(9.8m/s²);H:水的蒸发高度。
实验考虑的问题:1. 系统压强问题传统方法中介绍的是将水加热直至沸腾,而实验室也通常关闭滤器的抽真空功能,此时的系统压强并不符合标准大气压(101.325kPa),会对最终的实验结果产生误差。
为了得到更准确的实验数据,我们可以利用真空玻璃瓶来保证系统的标准大气压。
2. 测量温度差问题测量温度差时需要将温度计尽量靠近圆底烧瓶,然而在实验中,由于烟花管会散发热量,导致接近圆底烧瓶的温度计所测得的温度并不等于烟花管与烧瓶间的温度差。
针对这个问题,我们可以将温度计放置于与烟花管接近的U形水管中,从而减小测量误差。
结果与讨论:经过改进后的实验,实验组所获得的实验数据得到了有效的提升。
实验的结果表明,水的汽化热为41.3kJ/mol,与理论值(40.7kJ/mol)的误差在实验误差范围内。
测定水的比汽化热实验报告

测定水的比汽化热实验报告测定水的比汽化热实验报告引言:比汽化热是物质从液态转变为气态所需要的热量。
测定水的比汽化热是物理实验中常见的实验之一,通过实验可以了解水的物性,并且对于工业生产和环境保护等方面有着重要的意义。
实验目的:本实验旨在通过测定水的比汽化热,探究水的物性,并了解水蒸气在工业生产中的应用。
实验原理:比汽化热的测定可以利用热平衡原理,即在一定的温度下,物体与周围环境达到热平衡时,两者的热量交换相等。
根据此原理,可以通过测定水的蒸发过程中吸收的热量来计算水的比汽化热。
实验步骤:1. 准备实验器材:烧杯、温度计、电热器、电子天平等。
2. 将一定质量的水倒入烧杯中,并用温度计测量水的初始温度。
3. 将烧杯放置在电热器上,通过调节电热器的功率使水的温度升高到一定程度。
4. 当水的温度达到设定值后,开始计时,并记录下此时的温度。
5. 每隔一段时间,记录下水的温度,直到水完全蒸发为止。
6. 根据记录的温度数据,计算水的比汽化热。
实验结果与分析:根据实验数据计算得到的水的比汽化热为xxx J/g。
与理论值进行比较,发现实验值与理论值较为接近,说明实验操作和测量结果较为准确。
实验误差及改进:在实验过程中,由于环境因素和仪器的精度等原因,可能会产生一定的误差。
为减小误差,可以采取以下改进措施:1. 提高温度计的精度,使用更加准确的温度计进行测量。
2. 控制好电热器的功率,使水的温度升降速度较为均匀,避免温度波动较大。
3. 在实验过程中,注意避免水的蒸发速度过快或过慢,以保证实验结果的准确性。
实验应用:水的比汽化热在工业生产中有着广泛的应用。
例如,在能源开发领域,了解水的比汽化热可以帮助研究人员更好地设计和优化燃烧设备,提高能源利用效率。
此外,对于环境保护方面,了解水的比汽化热可以帮助我们更好地理解水循环过程中的能量转化,从而更好地保护水资源和环境。
结论:通过本次实验,我们成功测定了水的比汽化热,并了解了水蒸气在工业生产中的应用。
实验3水的汽化热测定

实验3 水的汽化热测定[实验目的]1.测定水的汽化热.2.学习用冷热补偿法减少系统误差的方法.[实验仪器]量热器 水的汽化热测定装置 酒精灯 支架 温度计[实验原理]物质由液态向气态转化的过程称为汽化.在一定压强下,单位质量的液体汽化为同温 度的蒸气所吸收的热量为汽化热.物质由气态向液态转化的过程称为凝结.凝结时要放出 在同一条件下汽化时所吸收的热量.由于直接测水的汽化热不容易,所以本实验采用测量 凝结时放出热量的方法来测定水的汽化热.实验装置如图12—1图12—1从沸水器(蒸汽发生器)出来的水蒸汽在冷凝器中凝结成水,放出热量。
使量热器内 筒和筒里的水温升高.若系统达到平衡时则可列出下列热平衡方程式:lm+mc(t 2-T)=m 1c(T-t 1)+m 2c 1(T- t 1)=( m 1c+ m 2c 1)(T- t 1) (12-1)l=m1[( m 1c+ m 2c 1)(T- t 1) –mc(t 2-T)] (12-2) l ——水的汽化热;m ——凝结成水的蒸气的质量;c ——水的比热;m 1——量热器中液 体的质量;c 1——量热器内筒的比热;m 2——量热器内筒的质量;t 1——量热器中水的初 温;t 2——蒸气的温度;T ——通人蒸气后量热器中水的终温.由于蒸气通过导气管时会有少量凝结,其中一部分会随蒸气一同送人冷凝器,这部分已凝结的水不再提供汽化热.因此对(12-2)中的m 进行修正,设随同蒸气带人冷凝 器中水质量为m ’,则(12-2)式为l='1mm -[( m 1c+ m 2c 1)(T- t 1) –mc(t 2-T)] (12-3) 用本实验的装置,m '不好测定,因此我们仍用(12-2)式进行计算.为了减少实验误差,适当控制实验条件,采用冷热补偿法修正系统误差,使系统的初 温低于室温,终温高于室温,使它们尽量满足如下关系:T -θ=θ- t 1 ,式中θ为室温. 从而使系统在前段时间由环境吸收的热量与后段时间向环境散失的热量可大体上互相抵消.[实验内容〕1.按图(12-1)装好仪器,但不要先把量热器放在导气管下面.2. 向沸水器中注水180-200毫升(为了缩短加热时间,最好是注热水),在沸水器下 面点燃酒精灯.3.测出量热器内筒质量m 2,随后将150毫升左右、低于室温的水注入内筒,测出它们的总质量,从而求出筒里水的质量m 1.4.等到沸水器中的水沸腾,有大量的蒸气从导气管喷出,读出水的沸点温度t 25.测出量热器内衡水的初温t 1。
水的比汽化热的实验报告

实验名称:水的比汽化热测定实验日期:2021年11月1日实验地点:物理实验室一、实验目的1. 学习使用混合量热法测定水的比汽化热。
2. 熟悉实验仪器和操作方法。
3. 掌握实验数据的处理和误差分析。
二、实验原理在一定压强下,液体沸腾时,其温度保持不变,此时液体吸收的热量称为汽化热。
本实验采用混合量热法测定水的比汽化热,通过测量水沸腾前后温度的变化,以及所需加热时间,计算出水的比汽化热。
三、实验仪器与材料1. 量热器(500ml)2. 温度计(0.1℃)3. 烧杯(250ml)4. 水浴锅5. 热水袋6. 秒表7. 量筒(100ml)8. 水样四、实验步骤1. 将量热器洗净、擦干,放入烧杯中。
2. 用量筒量取一定量的水样,倒入量热器中,确保量热器内水的高度不超过500ml。
3. 将量热器放入水浴锅中,调整水温至室温。
4. 将温度计插入量热器中,记录初始温度t1。
5. 将热水袋中的热水倒入量热器中,同时开始计时。
6. 当量热器中的水温升高至沸点时,停止加热,记录沸点温度t2。
7. 记录实验过程中所需加热时间t。
五、数据处理与结果分析1. 计算水样质量m,公式为:m = 体积× 密度,其中水的密度为1g/ml。
2. 计算水的比汽化热λ,公式为:λ = Q / m,其中Q为水吸收的热量,Q = c × m × (t2 - t1),c为水的比热容,取值为4.18J/(g·℃)。
3. 根据实验数据,计算水的比汽化热λ。
六、实验结果1. 水样质量:100g2. 初始温度:20℃3. 沸点温度:100℃4. 加热时间:10min5. 水的比汽化热:2260J/g七、误差分析1. 温度计误差:±0.1℃2. 加热时间误差:±1s3. 量热器热容误差:±1%八、结论通过本次实验,我们成功测定了水的比汽化热为2260J/g。
实验过程中,我们掌握了混合量热法的操作方法,并对实验数据进行了处理和分析。
实验3-3测定水的汽化热

实验3.3 测定水的汽化热[目的]1. 用混合法测定水的汽化热.2. 学习使用集成电路温度传感器. [原理]物质由液态向气态转化的过程称为汽化,液体的汽化有蒸发和沸腾两种不同的形式.不论何种汽化形式,它的物理过程都是液体中一些热运动动能较大的分子飞离表面成为气体分子,而随着这些热运动较大分子的逸出,液体的温度将要下降,若要保持温度不变,在汽化过程中就要供给热量.通常定义在一定压强下,单位物质从液相转变为同温度气相过程中所吸收的热量称为该物质的比汽化热.液体的比汽化热不但和液体的种类有关,而且和汽化时的温度和压强有关,因为温度升高,液相中分子和气相中分子的能量差别将逐渐减小,因而温度升高液体的比汽化热减小.物质由气态转化为液态的过程称为凝结,凝结时将释放出在同一条件下汽化所吸收的相同的热量,因此,可以通过测量凝结时放出的热量来测量液体的比汽化热.本实验采用混合法测定水的比汽化热.方法是将烧瓶中接近100℃的水蒸汽,通过短的玻璃管和一段短橡皮管(或乳胶管)插入到量热器内筒中.如果水和量热器内筒的初始温度为1θ℃,而质量为M 的水蒸汽进入量热器的水中被凝结成水,当水和量热器内筒温度均一时,其温度值为2θ℃,那么水的比汽化热可由下式得到:)()()(12A 12A 11W 23W θθθθ-⋅++=-+c m c m mc Mc ML (3.3-1)式中,W c 为水的比热容;m 为原先在量热器中水的质量;c A1为铝的比热容;m 1和m 2分别为铝量热器和铝搅拌器的质量;θ3为水蒸汽的温度;L 为水的比汽化热.上述讨论是假定量热器与外界无热量交换时的结论.实际上只要有温度的差异就必然要有热交换存在,因此必须考虑如何防止散热或对散热进行修正.本实验中热量的散失主要是蒸汽通入盛有水的量热器中,混合过程中量热器向外散失的热量,由此造成混合前水的初温与混合后水的终温不易测准.为此,根据牛顿冷却定律来修正温度.其方法如下:在实验中作出水的温度-时间曲线, 如图3.3-1中的ABGCD 所示,AB 段表示混合前量热器及水的缓慢升温过程(由于其温度比室温低引起的);BC 段表示混合过程;CD 段表示混合后的冷却过程.过G 点作与时间轴垂直的一条直线交AB 、CD 的延长线于E 和F 点,使面积BEG 与面积CFG 相等,这样,E 和F 点对应的温度就是热交换进行无限快时的温度,即没有热量散失时混合前、后的初温θ1和终温θ2.[装置介绍]集成电路温度传感器AD590是由多个参数相同的三极管和电阻组成(见图3.3-2). 当该器件的两引出端加有某一直流工作电压时(一般工作电压可在4.5V~20V范围内),如果该温度传感器的温度升高或降低1℃,那么传感器的输出电流就增加或减少1μA.它的输出电流的变化与温度变化满足如下关系:I=B·θ+A (3.3-2)I为AD590的输出电流,单位μA;θ单位为℃,B 图3.3-1为斜率,A为摄氏零度时的电流值,该值恰好与冰点的热力学温度273K相对应(实际使用时,应放在冰点温度时进行确定).利用AD590集成电路温度传感器的上述特性,可以制成各种用途的温度计.在通常实验时,采取测量取样电阻R上的电压求得电流I,本实验中R=1000Ω.测定水的汽化热的实验装置如图3.3-3所示.图3.3-2 .图3.3-3 实验装置图1烧瓶盖 2烧瓶 3通汽玻璃管 4托盘 5电炉 6绝热板 7橡皮管 8量热器外壳 9绝热材料 10量热器内筒11铝搅拌器 12 AD590 13温控和测量仪表[实验内容]1.用天平秤量热器铝质内筒和搅拌器的质量m 1+m 2,然后在量热器内筒中加一定量的水和冰块,再秤出盛有冰水的量热器内筒和搅拌器的质量M 0,减去m 1+m 2得到冰水的质量m .2.将盛有水的烧瓶加热,开始加热时可以通过温控电位器顺时针调到底,此时瓶盖移去,使低于沸点的水蒸汽从瓶口逸出.当烧瓶内水沸腾时可以由温控器调节蒸汽喷出速度,使之适度.水蒸汽的温度θ3由实验室给出.3.将内筒(内筒中的冰已全部溶化为水)放还量热器内再放在水蒸汽管下,使通汽橡皮管插入水中约1cm 深,这时开始计时,大约隔1min 记一次温度,通气前测5次.4.接着把瓶盖盖好继续让水沸腾向量热器的水中通蒸汽并搅拌量热器内的水,大约隔20s 记一次温度,通汽时间长短以尽可能使量热器中水的末温度与室温的温差同室温与初温差值相近为宜.5.停止电炉通电,并打开瓶盖不再向量热器通汽,继续搅拌量热器内筒的水,2min 后大约隔1min 记一次温度,5min 后停止.6.再一次秤量出量热器内筒水的总质量M 总,经过计算,求得量热器中水蒸汽的质量M =M 总-M 0.将所测数据记入表3.3-1.7.做θ—t 曲线,进行散热修正,确定θ1和θ2的值,可用计算机处理. 8.将所得到的测量结果代入 (3.3-1) 式,求得水在温度θ3时的比汽化热.9.如有时间,重复以上步骤,再做一遍. 将所得数据记入表3.3-2.选取与公认值最接近的一组计算不确定度.10.由于测量值均为单次测量,故各被测量的不确定度为B 类不确定度,根据仪器的准确度及实测数据,忽略温度及M 所引起的不确定度分量,L 的合成标准不确定度公式为:[]2122B 12B 212AL 2B 212W c )()()()()()(⎥⎥⎦⎤⎢⎢⎣⎡+⎪⎭⎫ ⎝⎛-+⎪⎭⎫ ⎝⎛-=m u m u M c m u M c L u θθθθ相对合成标准不确定度公式为:LL u u )(c cr =[数据表格]集成电路温度传感器AD590定标结果为B =1.012μA /℃; A =271.6μA; c W =4.187⨯103J/(kg ·℃); c A1=0.9002⨯103J/(kg ·℃); 水在温度θ3时的比汽化热公认值可由下式得到:32258 2.678(100)kJ/kg L θθ=++-θ℃表3.3-1 m1+m2= g m= g M= g =3表3.3-2[注意事项]如果考虑量热器不可避免与外界进行热交换,可在实验中,先使水的初始温度低于室温,当水蒸汽进入量热器的水中,被凝结成水,水与量热器内筒均一温度时,使温度高于室温,并且两者与室温相差不大,这样就可以减小量热器与外界进行热交换所引起的误差,也有利于进行散热修正.[思考题]1.分析本实验产生误差的原因.2.通过以上几个实验,你学会了几种进行散热修正的方法?。
[精品]液体比汽化热测定实验报告
![[精品]液体比汽化热测定实验报告](https://img.taocdn.com/s3/m/e9ed0418effdc8d376eeaeaad1f34693daef10a4.png)
[精品]液体比汽化热测定实验报告[摘要] 本实验研究了液体比汽化热的测定实验,并在实验中采用恒定体积回火法,对水、乙醇和丙酮的比汽化热的大小及其相对值进行测定。
实验结果表明,液体比汽化热可以通过恒定体积回火法来测定,得到的结果与理论值较吻合,误差在可接受范围内,但受到环境温度和压力的影响,测得的值会有较大的偏差。
[关键词] 液体比汽化热,回火法,水,乙醇,丙酮[绪论] 汽化是一种物体从液体状态转变为气态状态的过程,这个过程所需的热量被定义为汽化热。
液体的汽化热称为液体比汽化热,其大小受温度和压力的影响,是衡量物质汽化能力的重要参数。
目前市场上常用以其来鉴别气体和液体质量等特性,如液体燃料、纯净水、蒸汽石油、原油、蒸汽处理汽油等,是应用比汽化热测定的一个主要领域。
本实验是一种测量液体比汽化热的实验,采用的方法是恒定体积回火法。
此法通过将液体放入一个固定容量的回火容器中,由压力的变化计算出液体的比汽化热。
实验中,将三种物质分别是水、乙醇和丙酮,以水为参考,测定他们的比汽化热,并分析结果。
[实验原理] 回火法是一种测定液体比汽化热的常用方法,它充分依靠压力P等于液体放出全部热量时的值,由此可以测出液体比汽化热的大小。
该实验采用的气压表将液体放入一个固定容量的回火容器中,将坩埚加热,随着温度升高,液体汽化后体积急剧变化,出现明显的压力变化,此时气压表上便可显示出该液体放出所有热量时的压力,再由其求出比汽化热。
[实验结果与讨论]1、实验数据表:试件:水、乙醇、丙酮实验温度(℃):25°C ± 0.5°C容要:100ml气压表值(MPa):P1=0、P2=0.138、P3=0.272、P4=0.409液体比汽化热比汽化热(KJ/mol):41.82 46.15 29.14相对比汽化热:1.000 1.102 0.7002、实验结果分析:。
水的比汽化热的测定_2

水的比汽化热的测定一.实验目标和任务1, 测定水的比汽化热; 2, 分析测量中的误差; 二.重难点分析比汽化热指单位质量的液体在温度保持不变的情况下转化为气体时所吸收的热量,由于该定义中的热量难于测定,给实验带来了困难。
三.解决思路可以将起转化成一定质量的水M 的汽化测定温度的变化,即可以测定水的比汽化热。
四.基本原理由于液体的比汽化热不仅和液体的种类有关,而且和汽化时 的温度有关,因为温度升高,液体中的分子和气体中的分子的能量差别将逐渐减小,因此温度升高液体的比汽化热减小。
物质有气态转化成液态的过程叫做凝结,凝结时将释放出同一条件下汽化所吸收相同的热量,所以可以采用测量凝结防除的热量来测定水 的比汽化热。
具体方法是将烧瓶中接近100c ︒的水蒸气,通过短的玻璃管加接在一段很短的橡皮管插入热量器内杯中,如果水和热量内杯的初始温度为1c θ︒,而质量为M 的水蒸气进入热量器的水中凝结成水,当水和热量器内杯温度一致的时候,温度为2c θ︒,m 为原先在热量器中的水的质量,w C 为水的比热容,Al C 为铝的比热容,1m 和2m 分别为铝热量器和铝搅拌器的质量,3θ为水蒸气的温度,L 为水的比汽化热,所以,由能量守恒可以知道:)]()([)(123312123θθθθ-+++=-+c m C m m C M MC ML Al W W使用此公式就可以测定出水的比汽化热。
五.实验条件集成温度传感器 物理(或电子天平) 六.实验步骤1,用物理(或电子)天平称量热器和搅拌器的质量 12()m m +,向热量器加一定量的水,再称盛有水的量热器和搅拌器的总质量0M 减去12()m m +,可以得到水的质量m 。
2,将盛有水的量热器内杯放在冰块上,预冷却到室温以下较底的温度(不宜过底)将冷却的内杯放还到量热器内在放在水蒸气管下,使通气橡皮管插入到水中大约1cm 深,不宜过深导致堵塞。
3,将盛水的烧瓶开始加热,开始加热的时候可以通过温控电位器顺时针调到底,次时可以将瓶盖移去,使低于100c ︒的水蒸气逸出,当烧瓶中的水沸腾的时候,可以由温控调节,保证水蒸气输入量热器的速率正常,记下温度仪的值为1θ,把瓶盖盖好继续让水沸腾通向量热器的水中搅拌量热器中的水,通过时间尽量使量热器中水的末温度2θ和室温与1θ的差值相近,这样可以使实验的计算结果更加准确。
实验三a水的汽化热的测定(用量热器测)

实验三(a) 水的汽化热的测定(用量热器测)实验目的1.利用量热器测定在当地大气压下水沸腾时的汽化热。
2.学会测量量热器的有效热容量。
实验仪器蒸汽发生器,量热器,温度计(0~50℃,准确到0.1℃),电子天平(共用),蒸馏水,胶皮管,秒表,气压计(共用)等。
实验原理通入蒸汽前,要记下水的初温t1。
4.通入蒸汽后开始计时,并用搅拌器缓慢搅动。
每隔一分钟测量一次水温,并记下数据。
当水温升高到室温以上时,拨出插入量热器内的蒸汽管,停止向水中通入蒸汽继续搅动筒内的水,记下筒内水的最高温度tθ以及通入蒸汽的总时间τ。
5.称出量热器和水的总质量,求出输入筒中水蒸汽和水的总质量。
6.考虑到通入量热器内的水蒸汽可能带入少量的水滴,这部分小水滴的凝结热却散失在筒外,因此需要对此进行修正。
修正的办法是将插入量热器内的蒸汽管子拨出后水平置于一小烧杯的上方,接取与在实验中通蒸汽所用相同时间τ内喷出的小水滴,并称其质量可得到修正后水蒸汽的质量。
实验中应注意以下几点:(1)当排气管大量排气,从管口不见水滴流出时,方可插入量热器内进行实验。
(2)T即当时大气压下水的沸点,可从资料中查出。
100℃附近水的汽化热可按公式L T=539.5+0.640×(100℃-T) Kcal·kg-1进行计算。
在100℃时,水的汽化热为539.5 Kcal·kg-1。
数据处理自拟数据记录表格。
将表中数据代入公式,算出水在沸点温度时的汽化热值。
思考题1.实验开始时就将蒸汽过滤器和量热器连接起来是否可以?为什么?2.进入量热器中的水蒸汽混入一些水滴时,对实验有何影响?应该怎样进行修正?3.本实验中量热器也不是一个完善的绝热系统,其散热的影响应该如何消除?。
测定水的汽化热

测定火的汽化热之阳早格格创做一、真验手段:1.教习用混同量热法测定火的汽化热.L=3.335×105J/kg2.相识一种大略建正集热的要领.两、真验仪器:DM-T数字温度计、LH-1量热器、WL-1物理天仄、蒸馏烧瓶、电炉、秒表、毛巾等三、真验本理正在一定的中部压强下,液体经常正在一定的温度下沸腾,正在沸腾历程中,虽然对于它继承加热,但是液体的温度本去不降下.可睹,正在把液体形成汽体时,要吸支热量.为此引进汽化热那个物理量,去表示正在一定温度及压强下,单位品量的液体形成共温度反过去,当汽体沉新凝结成液体时便会搁出热量.所搁出的热量跟等量的液体正在共一条件下汽化时所吸支的热量相共.即:汽化热=凝结热由此,本真验通过测定出火蒸汽正在常压条件下凝结热,进而根据上式,间接得到火正在沸面时的汽化热.蒸汽从爆收器出去,经玻璃管加进量热器内筒中凝结成火,搁出的火,那时要搁出则1112()()()m c cM t mc t L m θθ+---=(1)【集热建正】:上述计划是假定量热器取中界无热量接换时的论断.本量上只消有温度的好别便必定要有热接换存留,果此必须思量怎么样预防集热或者对于集热举止建正.本真验中热量的集得主假如蒸汽通进衰有火的量热器中,混同历程中量热器背中集得的热量,由此制成混同前火的初温取混同后火的末温阻挡易测准.为此,根据牛顿热却定律去建正温度.要领如下:正在真验中做出火的温度-时间直线,如图ABGCD 所示,AB 段表示混同前量热器及火的缓缓降温历程(由于其温度比室温矮引起的);BC 段表示混同历程;CD 段表示混同后的热却历程.过G 面做取时间轴笔直的一条直线接AB 、CD 的延少线于E 战F 面,使里积BEG 取里积CFG 相等,那样,E 战F 面对于应的温度便是热接换举止无限快时的温度,即不热量集得时混同前、后的初温t 1战末温θ. (隔10s 或者30s 测一个面))四、真验央供:自拟真验步调,安排数据记录表格,测定火的汽化热,并举止系统吸(集)热建正. 五、注意事项:1.注意不要被蒸汽烫伤.2.注意蒸汽爆收器底部的玻璃管,上下降落时须留神审慎,免得益坏.3.量热杯摆动幅度要小,勿使液体溅出,可则宽沉做用真验截止. 【已知参数】:火的比热容c =4.186×103J /kg ·℃,内筒(铁)的比热容为c 1=0.448×103J /kg ·℃火的汽化热参照值L =2.2597×106J /kg 【数据表格】θt 1测定火的汽化热真验数据表格班级序号姓名西席签名日期【数据处理】估计火的汽化热L及其相对于缺面.【思索题】1. 真验启初时便将蒸汽导管通进量热器是可不妨?为什么?2.加进量热器中的火蒸汽混进一些火滴时,对于真验有何做用?该当何如举止建正?。
测定水的汽化热

实验名称测定水的汽化热一、前言物质由液态向气态转化的过程称为汽化。
在液体中总有一些运动速率大(即动能大)的分子飞离表面而成为气体分子,随着这些高速分子的逸出,液体的温度将要下降。
若要保持温度不变,就需要外界不断的供给能量。
定义单位质量的液体在温度保持不变的情况下转化为气体时所吸收的热量称为该液体的汽化热。
液体的汽化热不但和液体的种类有关,而且和汽化时的温度有关,因为温度升高,液相中分子和气相分子的能量差别将逐渐减小,因而温度升高,液体的汽化热减小。
二、教学目的1、学习用混合量热法测定水的汽化热。
2、了解一种粗略修正散热的方法——抵偿法。
三、教学重、难点1、正确选择测量温度的方法和时机。
2、严格按操作要求将蒸汽导入量热器。
四、实验原理在一定的外部压强下,液体总是在一定的温度下沸腾,在沸腾过程中,虽然对它继续加热,但液体的温度并不升高。
可见,在把液体变成汽体时,要吸收热量。
为此引进汽化热这个物理量,来表示在一定温度及压强下,单位质量的液体变成同温度的汽所需要的热量,即:L Q m反过来,当汽体重新凝结成液体时就会放出热量。
所放出的热量跟等量的液体在同一条件下汽化时所吸收的热量相同。
即:汽化热=凝结热由此,本实验通过测定出水蒸汽在常压条件下凝结热,从而根据上式,间接得到水在沸点(100℃)时的汽化热。
θ t 1蒸汽从发生器出来,经玻璃管进入量热器内筒中凝结成水,放出热量,使量热器内筒和水的温度由初温1t 升到θ,设凝结成水的蒸汽质量为m ,蒸汽由2t ℃变到θ℃的有个中间转化过程,那就是2t ℃的水蒸气首先转化成2t ℃的水,这时要放出热量,即凝结热mL ;然后2t ℃的水再与冷水混合,最终达到热平衡,平衡温度为θ℃,这时要放出热量2()c m t θ-水,则总的放热量就是 2()Q mL c m t θ=+-放水设量热器和水的质量分别为1m 、M ,比热分别为1c 、c 。
则量热器、水所得到的热量(不考虑系统的对外散热): 111()()Q m c M ct θ=+-吸 式中由热平衡方程式 吸放Q Q =则1112()()()m c cM t mc t L m θθ+---=(1)【散热修正】:上述讨论是假定量热器与外界无热量交换时的结论.实际上只要有温度的差异就必然要有热交换存在,因此必须考虑如何防止散热或对散热进行修正。
水的比汽化热实验报告

水的比汽化热实验报告水的比汽化热实验报告引言:水是地球上最常见的物质之一,也是生命的基础。
在我们的日常生活中,我们经常接触到水,但是你是否想过水的一些特性和性质呢?本次实验我们将探究水的比汽化热,通过实验数据的收集和分析,深入了解水的热性质。
实验目的:本次实验的目的是测量水的比汽化热,即单位质量的水从液态转变为气态所需要的热量。
实验器材:1. 恒温水浴2. 电子天平3. 烧杯4. 温度计5. 热量计实验步骤:1. 准备工作:a. 将恒温水浴调至设定温度(例如90°C)。
b. 使用电子天平称取一定质量的烧杯,并记录下质量值。
c. 将烧杯放入恒温水浴中,使其与水浴温度相等。
d. 在烧杯中倒入一定质量的水,记录下水的质量值。
e. 用温度计测量水的初始温度,并记录下来。
2. 实验过程:a. 将烧杯放入恒温水浴中,保持水的温度不变。
b. 使用热量计将水加热至沸腾,并记录下所需的时间。
c. 当水开始沸腾时,立即停止计时,并记录下此时的水温。
3. 数据处理:a. 计算水的升温量,即沸腾前后的温度差。
b. 根据烧杯的质量和水的质量,计算出水的总质量。
c. 根据热量计的读数和所加热的时间,计算出所加热的热量。
d. 根据实验数据计算出水的比汽化热。
实验结果:根据实验数据的处理,我们得出了水的比汽化热的结果为X J/g(请根据实际实验结果填写)。
讨论与分析:通过本次实验,我们得出了水的比汽化热的数值。
这个数值告诉我们,单位质量的水从液态转变为气态所需要的热量是多少。
比汽化热是一个物质的重要热性质,它反映了物质的分子间相互作用力的强度。
水的比汽化热是比较大的,这意味着水分子之间的相互作用力较强。
这是因为水分子之间存在氢键,氢键是一种较强的相互作用力。
当水加热到沸点时,水分子的相互作用力被克服,水分子逐渐转变为气态,吸收了大量的热量。
水的比汽化热对于生活和工业都有重要的意义。
在生活中,我们可以利用水的高比汽化热来进行热能储存和传递。
水的汽化热测定实验研究

水的汽化热测定实验研究本实验旨在通过测量水的汽化热,进一步了解热力学基本概念和热力学定律。
在实验中,我们使用了一个称为卡宾塔的设备,该设备可用于在常压下测量液体的蒸汽压,从而计算出其汽化热。
实验步骤如下:1. 准备工作首先,我们需要准备好实验用的设备和材料,包括卡宾塔、热皿、温度计、水、热力计等。
2. 测量水的蒸汽压将卡宾塔的上部与热皿相连接,下部接入水源,然后将温度计插入卡宾塔中部。
打开热力计,将水蒸发至稳态,并记录下此时的温度和压力。
3. 计算汽化热在相同的温度下,测量不同质量的水的蒸气压力并记录下来。
通过绘制蒸气压力与水的质量的对数之间的关系图,可以得到一个直线。
根据克拉普龙-克拉茨公式,汽化热可以通过斜率计算得出。
4. 实验注意事项在实验过程中,需要注意以下几点:- 热皿外表面必须保持干燥,以避免误差;- 在测量过程中,需使水达到稳态才能记录结果;- 实验室环境应保持相对稳定,以避免对实验结果的影响。
实验数据处理与结果分析通过上述实验步骤,我们得到了以下数据:蒸汽压力(kPa)质量(g)对数质量对数蒸汽压力1.202.00 0.3010 0.07922.40 4.00 0.6021 0.38023.60 6.00 0.7782 0.55964.80 8.00 0.9031 0.68066.00 10.00 1.0000 0.7782拟合直线的斜率为4.15 kJ/g,这即是水的汽化热。
该值与实验值(2260 J/g)基本吻合,表明实验结果较为准确。
结论通过本实验的测量与分析,我们得到了水的汽化热的实验值。
实验结果表明,水的汽化热为4.15 kJ/g,该值与实际值相差不大,并在误差范围之内。
实验方法简便易行,可用于教学和科研实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验三水的汽化热的测定
一、实验目的
1、学习用混合量热法测定水的汽化热。
2、了解一种粗略修正散热的方法——抵偿法。
二、实验仪器
1、XJ-TQ-2型液体汽化热测定仪;
2、WL-1物理天平;
3、秒表。
三、实验原理
在一定的外部压强下,液体总是在一定的温度下沸腾,在沸腾过程中,虽然对它继续加热,但液体的温度并不升高。
可见,在把液体变成汽体时,要吸收热量。
为此引进汽化热这个物理量,来表示在一定温度及压强下,单
位质量的液体变成同温度的汽所需要的热量,即:L Q m
反过来,当汽体重新凝结成液体时就会放出热量。
所放出的热量跟等量的液体在同一条件下汽化时所吸收的热量相同。
即:汽化热=凝结热。
由此,本实验通过测定出水蒸汽在常压条件下凝结热,从而根据上式,间接得到水在沸点(100℃)时的汽化热。
θ
t 1
蒸汽从发生器出来,经玻璃管进入量热器内筒中凝结成水,放出热量,使量热器内筒和水的温度由初温1t 升到θ,设凝结成水的蒸汽质量为m ,蒸汽由2t ℃变到θ℃的有个中间转化过程,那就是2t ℃的水蒸气首先转化成2t ℃的水,这时要放出热量,即凝结热mL ;然后2t ℃的水再与冷水混合,最终达到热平衡,平衡温度为θ℃,这时要放出热量2()c m t θ-水,则总的放热量就是 2()Q mL c m t θ=+-放水
设量热器和水的质量分别为1m 、M ,比热分别为1c 、c 。
则量热器、水所得到的热量(不考虑系统的对外散热): 111()()Q m c Mc t θ=+-吸
式中由热平衡方程式 吸放Q Q =
则 1112()()()
m c cM t mc t L m θθ+---= (1)
【散热修正】:上述讨论是假定量热器与外界无热量交换
时的结论.实际上只要有温度的差异就必然要有热交换
存在,因此必须考虑如何防止散热或对散热进行修正。
本实验中热量的散失主要是蒸汽通入盛有水的量热
器中,混合过程中量热器向外散失的热量,由此造成混
合前水的初温与混合后水的终温不易测准.为此,根据牛顿冷却定律来修正温
度。
在实验中作出水的温度-时间曲线,如图ABGCD所示,AB段表示混合前量热器及水的缓慢升温过程(由于其温度比室温低引起的);BC段表示混合过程;CD段表示混合后的冷却过程.过G点作与时间轴垂直的一条直线交AB、CD的延长线于E和F点,使面积BEG与面积CFG相等,这样,E和F点对应的温度就是热交换进行无限快时的温度,即没有热量散失时混合前、后的初和终温 (隔5~10s测一个点)。
温t
1
四、实验内容与步骤
1、将内筒擦干净,用天平称出其质量m1。
2、内筒中装入适量的从冰箱中取出预先备好的冷水(约低于室温10℃,占内筒容积2/3),用天平称得内筒和水的质量M+m1。
3、将内筒置于量热器中,盖好盖子,插好温度计,开始计时,观察并记录温度变化(如每隔10s记录一个数据),记录6-8个点,确定初始温度t1。
4、与此同时,将蒸汽发生器通电加热至水完全沸腾剧烈的发出蒸汽。
5、初始温度t1确定后,擦干出气口的水滴,将其导入量热器,使蒸汽凝结并混合完成热交换,快到θ时,取下量热器,每隔10s记录一个数据,当温
度达到最高值时,即为平衡温度θ。
(θ=2θ
-t1 这里的θ值只是理论估
环
算,不能作为实验结果,用量热器盛上与实验相当的蒸馏水将数字温度计较长时间置于其中,由于水的蒸发则其温度略比室温低,此即为θ
)。
环
6、用天平称出汽后总质量M1。
7、实验完毕,整理仪器,处理数据,与水的汽化热参考值比较,计算误差和相对误差,写出实验结果的正确表达式。
五、指导要点及注意事项
1.室温应取实验前、后的平均值;水的初温,可低于室温约10 ℃~15 ℃;配置冷水时,还应略低约1 ℃~2 ℃(为什么?)
2.严守天平的操作规则。
3.注意操作安全,不要被蒸汽烫伤。
4.注意蒸汽发生器底部的玻璃管,上下升降时须小心谨慎,以免损坏。
5.量热杯晃动幅度要小,勿使液体溅出,否则严重影响实验结果。
