1-2-1 阿马格分体积定律
混合物的组成

气体的温度、体积下的压力.
这是由于理想气体分子之间没有相互作用, 分子本身又没
有组体分积存在, 混没合有气关中系每. 一组分的性质(包括分压••1J1J8po8o4hB4h4)n4)n与)DDEEa有nalntlgtog没loinlsinsh(有h(1m1m77a其6a6n6n6-它--道尔顿分压定律: 理想气体混合物的总压力11等88110于0年年各提提出组出分分分压压单定定独律律存 在于混合气体的温度、体积下产生压力的总和.
00-7-22
3
阿马加定律
理想气体组分的分体积VB* : 理想气体物中的组分B 的分体积 是所含nB的B单独存在于混合气体的温度和总压条件下占有 的体积. 阿马格分体积定律: 理想气体混合物的总体积等于各组分的分 体积之和.
阿马格定律是理想气体pVT性质的必然结果:
( ) ∑ ∑ ∑ V = nRT / p = B nB RT / p = B nB RT / p = BVB*
的摩尔分数yB与总压力p 的乘积定义为该组分的分压力:
ppBB==yyBBpp
( ) ∑ ∑ B pB = B yB p = p
对于理想气体混合物(及低压真实气体混合物)
( ) ∑ ∑ pB = yB p =
nB B nB
B nB RT /V = nBRT /V
表明理想气体组分的分压力 等于该 组分单独存在于混合
混合物的组成
摩尔分数:
∑ xB (或yB ) def nB / B nB
∑B xB(或yB ) = 1
质量分数:
∑ wB def mB / B mB
∑B wB = 1
体积分数:
∑ ϕB def xBVm*,B / A xAVm*,B
第一章 物质的聚集状态

vap H m
为液体的摩尔蒸发热(摩尔汽化焓)
只要知道p1、p2、T1、T2和 vap H m 五个量 中任意4个,就能求出另外一个物理量。
1.2.3 液体的沸点 液体在蒸发过程中,随着外加温度的升高, 蒸气压也在逐渐增大,当外加温度增加到液体 的饱和蒸气压等于外界(环境)压力时,在整 个液体中的分子都能发生气化作用,液体开始 沸腾,此时的温度就是该液体在该压力下的沸 点(boiling point)。 液体的沸点随外压而变化,压力越大, 沸点也越高。当外压为标准情况的压力(即 101.325kPa)时的沸点,为正常沸点。一般我 们所说的沸点都是正常沸点。
理想气体分子之间没有相互吸引和排斥, 分子本身的体积相对于气体所占有体积完全可 以忽略。
pV = nRT
R---- 摩尔气体常量
在STP下,p =101.325kPa, T=273.15K
n=1.0 mol时, Vm=22.414L=22.414×10-3m3
pV R nT 3 3 101325Pa 22.414 10 m 1.0mol 273.15K 8.314 J mol 1 K 1
定量的气体,当压力一定时,气体的体积 V与热力学温度T成正比。 数学式可表示为 或 或 V = V0T/T0 V∞T V1/V2 = T1/T2
查理-盖· 吕萨克定律也可以用图形来表示, 称为等压线—— 直线。如图1.2 所示。
3. 阿伏加德罗定律 在相同的温度和压力下,相同体积的不同 气体均含有相同数目的分子。 1.1.2 理想气体的状态方程 人们将符合理想气体状态方程式的气体, 称为理想气体。
R=8.314 kPaLK-1mol-1=8.314Pa· 3 · -1mol-1 m K
第一章 物质的聚集状态

3. 物质B的物质的量浓度(cB)
溶质B的物质的量除以溶液的体积
cB = nB / V 4. 物质B的质量摩尔浓度 (bB) 溶质B的质量摩尔浓度定义为溶质B的物质的量 除以溶剂的质量 bB = nB / mA 《大学化学》- “物质的聚集状态”
College of Chemistry & Materials Science
College of Chemistry & Materials Science
VB nB B V n
B 称为B的体积分数
pB VB xB B p V pB B p
《大学化学》- “物质的聚集状态”
College of Chemistry & Materials Science
《大学化学》- “物质的聚集状态”
College of Chemistry & Materials Science
分压定律的应用:实验室排水取气法。
《大学化学》- “物质的聚集状态”
College of Chemistry & Materials Science
2. 阿马格分体积定律 分体积:
混合气体中某一组分B的分体积VB是该组 份单独存在并具有与混合气体相同温度和压 力时所占有的体积。
College of Chemistry & Materials Science
pB
分压定律:
nB RT V
混合气体的总压等于混合气体中各组分气 体分压之和。
p = p1 + p2 +
或 p = pB
《大学化学》- “物质的聚集状态”
College of Chemistry & Materials Science
《物理化学》(天大第五版)考点精讲教程(第1讲 气体的pVT关系)

第1讲气体的pVT 性质《物理化学》考点精讲教程(天津大学第五版)主讲人:张彩丽网学天地《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程四、物理化学课程的内容《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、气体常数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程(1)指定状态下计算系统中各宏观性质。
《物理化学》(天大第五版)考点精讲教程(2)状态变化时,计算系统各宏观性质。
《物理化学》(天大第五版)考点精讲教程例:某空气《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 质量分数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程5. 理想气体方程对理想气体混合物的应用《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 道尔顿分压定律《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程三、阿马格分体积定律《物理化学》(天大第五版)考点精讲教程物理意义:《物理化学》(天大第五版)考点精讲教程四、两者关系《物理化学》(天大第五版)考点精讲教程1. 指定状态下的计算《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 状态变化时的计算《物理化学》(天大第五版)考点精讲教程A,0200kPap=《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 性质《物理化学》(天大第五版)考点精讲教程二、临界参数c《物理化学》(天大第五版)考点精讲教程三、真实气体的《物理化学》(天大第五版)考点精讲教程1. T< T c,反映出液体的不《物理化学》(天大第五版)考点精讲教程2. T = T c《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 波义尔温度《物理化学》(天大第五版)考点精讲教程二、范德华方程《物理化学》(天大第五版)考点精讲教程2. 体积修正《物理化学》(天大第五版)考点精讲教程三、维里方程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、压缩因子图任何Tr ,pr→0,Z→1(理想气体);T r较小时,p r↑,Z先↓,后↑,反映出气体低压易压缩,高压难压缩;T r 较大时,Z ≈1。
1-3热力学定律复习

•化学热力学的理论基础是热力学第一定律和热力学第二定律.
•在气液固三种聚集状态中, 气体最容易用分子模型进行研究. 一,气体的pVT关系
理想气体 理想气体状态方程: pV = nRT 真实气体 范德华方程 二,热力学第一定律 • 热力学第一定律本质是能量守恒. U = Q + W • 基本概念和术语
数据包括标准热容、标准相变焓、标准生成焓和标准燃烧焓 等.
8
二 热力学第一定律--系统与环境,过程与途径
系统
所研究的 物质对象
敞开系统 封闭系统 隔离系统
物质进出 能量得失
√
√
√
系统的宏观性质: • 广延性质 n, V, U, H, S, G, A, …, 有空间上的加和性.
• 强度性质 T, p, Vm , Um , , …, 无空间上的加和性.
理想气体:在任何温度/ 压力下均服从理想气体状态方程的气体. 两个特征: (1)分子本身必定不占有体积; (2)分子间无相互作用.
3
一 气体的 p V T 关系—理想气体
分压力pB: 无论是理想气体还是真实气体, 混合气中任一组分B的 摩尔分数yB与总压力p 的乘积定义为该组分的分压力:
pB = yB p
功的符号: 系统得功, W > 0 ;系统作功, W <0 .
体积功的一般计算式:
W
V2 V1
pambdV
热(Q): 因系统与环境间未达到热平衡而传递的能量. 热的符号: 系统吸热, Q > 0 ;系统放热, Q < 0. 热的类型: 物质变温过程的热; 相变热; 化学反应热等.
• 故功和热不是系统性质, 不是状态函数!
物质的聚集状态

PV = nRT的其它形式
PV= m RT M
P=
m RT V M=
ρRT M
理想气体状态图
理想气体状态方程的应用 ➢ 计算气体的存在状态和条件;
p,V,T,n四个物理量之一
应用范围:温度不太低,压力不太高的真实气 体。
➢ 通过实验测定分子量和原子量;
例:304ml的某气体在25℃和压力为9.93×104Pa时重 0.780克。求:该气体的分子量。
3. 阿伏加德罗定律 在相同的温度和压力下,相同体积的 不同气体均含有相同数目的分子。
•标准状况:101.325kPa和273.15K(即0℃)
1mol气体: 粒子数NA=6.02×1023mol-1 体积 Vm=22.4141L
理想气体(Ideal Gas)
• 在任何温度、压力下都符合气体三定律的气体。 • 特点:
1. 理想气体分子是不占体积的质点; 2. 分子间无作用力; 3. 理想气体的分子几乎是弹性的,与器壁相撞, 单位面积所承受的压力相等。
【低压(< 1atm),高温(>0℃ )的气体】
1.1.2 理想气体状态方程
状态1
p1V1T1
任意变化
状态2
p2V2T2
( )T
p1V1= p2V2’
p2V2’T1
2RT M
根均方速率:
ur
N1u12 N2u22 N1 N2
3RT M
up ua ur v 1 v v
2
速率分布曲线示意图
算术平均速率:
up:ua:ur=1:1.128:1.22
不同温度下的速率分布曲 线
能量分布
f (E)
2
(
1
第二章 物质的聚集状态

2.1 2.2 2.3 2.4 气体 固体 液体 液晶态
2.5
等离子体
2.1
气体
2.1.1
理想气体定律 实际气体的状态方程
2.1.2
2.1.3
临界现象和超临界流体
2.1.1
理想气体定律
1
2
理想气体 状态方程式
理想气体的 分压定律和 分体积定律
1. 理想气体状态方程式
(1) 为什么引入理想气体的概念
超临界状态容易达到,设备投资不高;
聚苯乙烯泡沫塑料绿色生产技术
聚苯乙烯+发泡剂→聚苯乙烯泡沫塑料 →快餐饭盒、包装、减震、保温材料。 Dow化学公司开发出一种用液态二氧化碳 完全替代有机发泡剂生产聚苯乙烯泡沫 塑料的新技术,可生产厚度小于1.27cm 的泡沫塑料食品包装板,每年可减少 1500吨以上的二氟二氯甲烷或二氟一氯 甲烷的排放。
(5~30) ×10-3
(1~9) ×10-5
(30~70) ×10-3
(0.2~0.3) ×10-3
(70~250) ×10-3
超临界二氧化碳作为溶剂
当二氧化碳温度超过31℃,压力超过7.38 M Pa时就称 为超临界二氧化碳, 超临界二氧化碳作为溶剂: 从来源上看,是生产合成氨和天然气的副产物。对它加 以利用只会减少二氧化碳的排放,故不会加剧温室效应。 不燃烧,不形成光化学烟雾,也不破坏臭氧层,有利于 操作人员健康。 二氧化碳虽能引起窒息,但允许浓度比有机溶剂低10~ 100倍,不会发生中毒和爆炸事故。 它能溶解许多有机化合物,而且易分离。
例:在 101.325KPa和 15.0℃情况下在水面上收 集0.5升CO2 ,在0℃和101.325KPa时体积是多 少?已知15.0℃ 时水 的 蒸汽压为1.7065KPa.
物理化学中的概念及术语1

概念及术语BET 公式 BET formula1938年布鲁瑙尔(Brunauer)、埃米特(Emmett)和特勒(Teller)三人在兰格缪尔单分子层吸附理论的基础上提出多分子层吸附理论。
该理论与兰格缪尔理论的主要不同之处是吸附在固体表面的分子存在着范德华力仍可吸附其它分子,即形成多分子层吸附。
在吸附过程中不一定待第一层吸满后再吸附第二层。
第一层吸附的吸附热较大,相当于化学反应的吸附热,且不同于其它各层的吸附热;第二层以后的吸附热均相等且数值较小,仅相当于气体的冷凝热。
在此基础上,推出BET 公式如下:)}/)(1(1){/1()/()(***---=p p c p p p p c V V 单;其中V为被吸附物质的总体积,V(单)为单层饱和吸附时所需吸附质的体积,c 是与吸附热有关的常数,p*为指定温度下液态吸附质的饱和蒸气压。
BET 公式适用于相对压力p/p*=0.05~0.15的范围,超出此范围就会产生较大的偏差。
DLVO 理论 DLVO theory1941年由德查金(Darjaguin)和朗道(Landau)以及1948年由维韦(Verwey)和奥弗比克(Overbeek)分别提出的带电胶体粒子的稳定理论。
胶体粒子稳定的三个主要原因是,分散相粒子的带电、溶剂化作用以及布朗运动。
HLB 法 hydrophile-lipophile balance method一种表面活性剂的选用方法,是格里芬(Griffin)1945年提出来的。
HLB 代表亲水亲油平衡。
HLB 值越大表示该表面活性剂的亲水性越强。
例如,HLB 值在2~6的表面活性剂可作油包水型的乳化剂;而HLB 值在12~18的表面活性剂可作水包油型的乳化剂等。
pVT 性质 pVT property指气体的压力、体积和温度三种宏观性质。
不涉及到相变化及化学反应。
ζ电势 zeta potential见电动电势。
阿伏加德罗常数 Avogadro ’number1摩尔的任何物质所含的粒子效,称为阿伏伽德罗常数,其值为6.022045×1023”,通常以符号N A 或L 表示。
物理化学中的概念及术语1

概念及术语BET 公式 BET formu l a1938年布鲁瑙尔(Bruna u er)、埃米特(Emmet t )和特勒(Telle r )三人在兰格缪尔单分子层吸附理论的基础上提出多分子层吸附理论。
该理论与兰格缪尔理论的主要不同之处是吸附在固体表面的分子存在着范德华力仍可吸附其它分子,即形成多分子层吸附。
在吸附过程中不一定待第一层吸满后再吸附第二层。
第一层吸附的吸附热较大,相当于化学反应的吸附热,且不同于其它各层的吸附热;第二层以后的吸附热均相等且数值较小,仅相当于气体的冷凝热。
在此基础上,推出BET 公式如下:)}/)(1(1){/1()/()(***---=p p c p p p p c V V 单;其中V为被吸附物质的总体积,V(单)为单层饱和吸附时所需吸附质的体积,c 是与吸附热有关的常数,p*为指定温度下液态吸附质的饱和蒸气压。
BET 公式适用于相对压力p/p*=0.05~0.15的范围,超出此范围就会产生较大的偏差。
DLVO 理论 DLVO theor y1941年由德查金(Darja g uin)和朗道(Landa u )以及1948年由维韦(Verwe y )和奥弗比克(Overb e ek)分别提出的带电胶体粒子的稳定理论。
胶体粒子稳定的三个主要原因是,分散相粒子的带电、溶剂化作用以及布朗运动。
HLB 法 hydro p hile -lipop h ile balan c e metho d一种表面活性剂的选用方法,是格里芬(Griff i n)1945年提出来的。
HLB 代表亲水亲油平衡。
HLB 值越大表示该表面活性剂的亲水性越强。
例如,HLB 值在2~6的表面活性剂可作油包水型的乳化剂;而HLB 值在12~18的表面活性剂可作水包油型的乳化剂等。
道尔顿定律和阿玛格定律
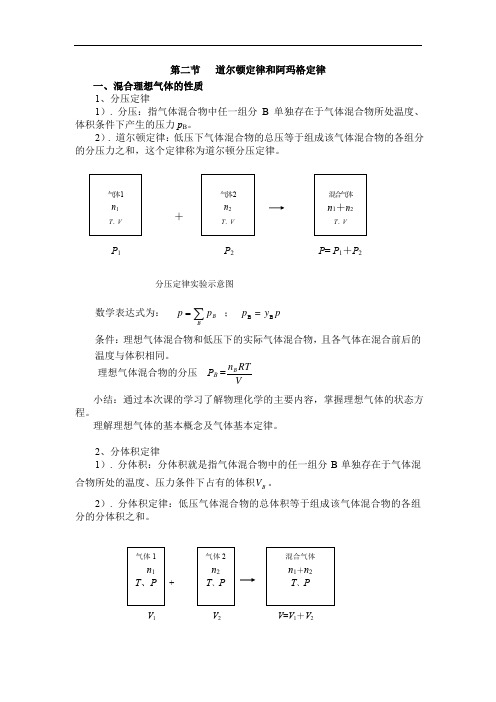
第二节 道尔顿定律和阿玛格定律 一、混合理想气体的性质
1、分压定律
1). 分压:指气体混合物中任一组分B 单独存在于气体混合物所处温度、体积条件下产生的压力p B 。
2). 道尔顿定律:低压下气体混合物的总压等于组成该气体混合物的各组分数学表达式为: ∑=B
B p p ; p y =p B B
条件:理想气体混合物和低压下的实际气体混合物,且各气体在混合前后的温度与体积相同。
理想气体混合物的分压 P B =
V
RT n B
小结:通过本次课的学习了解物理化学的主要内容,掌握理想气体的状态方程。
理解理想气体的基本概念及气体基本定律。
2、分体积定律
1). 分体积:分体积就是指气体混合物中的任一组分B 单独存在于气体混合物所处的温度、压力条件下占有的体积B V 。
2). 分体积定律:低压气体混合物的总体积等于组成该气体混合物的各组分的分体积之和。
+
V 1 V 2 V =V 1+V 2
+
P 1 P 2 P = P 1+P 2
分压定律实验示意图
气体1 n 1
T 、P 气体2 n 2 T 、P 混合气体 n 1+n 2 T 、P
气体 2 n 2 T 、V 混合气体 n 1+n 2
T 、V
气体 1
n 1
T 、V。
第1章 物质的聚集状态

盖· 吕萨克(法)
定义:
T ( 273.15 t )K
T是热力学温度,单位为开尔文,符号为K。 V 常数 ( n, p恒定) T 气体只有在低压下才服从盖· 吕萨克定律。
主目录 本章目录 上一张 下一张 返回
9
1.1.1 低压气体的经验定律
3.阿佛加德罗定律
1811年,阿佛加德罗提出:同温同压下
B
de f
B
分压定义:
主目录
pB xB p
本章目录 上一张 下一张 返回 25
例:3.0dm3的容器,内盛16g O2,28g N2,求
300K 时混合气体中 O2 、 N2 的摩尔分数、分压
解:
及混合气体的总压。 16g n(O 2 ) 0.5mol 32g mol1
n(N 2 )
变而改变。气体的状态可用 n、p、V、T来描述。
主目录 本章目录 上一张 下一张 返回 6
1.1.1 低压气体的经验定律
1.玻义尔定律 英国科学家玻义尔实验,在 U形管中加入汞,增大对 封闭气体的压力,随压力增大,封闭气体体积缩小。
主目录
本章目录
上一张
下一张
返回
7
1.1.1 低压气体的经验定律
主目录 本章目录 上一张 下一张 返回 2
第一章 物质的聚集状态
温度升高时,分子热运动加剧。物质的宏观状态就可 能发生变化,由一种聚集状态变为另一种聚集态。
例如:
熔化 冰 水 (固态) 加热 (液态) 气化 水 汽 (液态) 加热 (气态)
主目录
本章目录
上一张
下一张
返回
3
第一章 物质的聚集状态
B
道尔顿分压定律:在温度与体积一定时,混合气体的 总压p等于各组分气体的分压pB之和。
本章思考题1理想气体微观模型,理想气体状态方程来源和

b×103/ m3·mol-1
0.0266 0.0237 0.0428 0.0371 0.0305 0.0399 0.0391 0.0318 0.0398 0.0427 0.0670 0.1154
3、几点说明
1) a、b为范氏常数,恒为正值,其值由实验测得。 2) 范氏方程是半经验、半理论方程,因其考虑 了实际气体与理想气体的本质区别,其精度优 于理想气体方程 pV = nRT。 3) 当p→0, Vm→∞,范氏方程又还原成理想气体 方程。
温度升高,分子内能增加、热运动加快,单位时间、 单位面积液体表面上溢出到气相中的分子数增多。
蒸发速率=冷凝速率
饱 和 蒸 气 压
(3)温度升高,恒温线水平段升 高,即对应的压力增大,反映 了饱和蒸气压随温度升高而增 大的性质。
C
(4) 温 度 升 高 , 最 终 使 恒 温 线 水平段缩成一个点(图中C点), 此点称临界点。
van der Waals equation 的级数形式
pVm
RT
(1
b Vm
)1
a Vm
RT
(1
b Vm
b2
V
2 m
...)
a Vm
RT
(RTb Vm
a)
R
T
b
2V
2 m
A RT B ' RTb a C ' RTb2
§ 1.4 气体的液化与临界现象
一.真实气体p-Vm图
(1) 各恒温线上描述的p--Vm数据均 为平衡数据,在气-液共存即饱和蒸 气压。气-液共存部分为水平线。
1、对压缩因子图分析:
1) 压缩因子图的基本原理是对应状态原理,对应 状态近似相同的各气体,具有近似相同的压缩因 子(并非绝对相等)。
《物理化学1》习题

二、内容提要
1.理想气体 下列关系式: pV=nRT 此式称为理想气体状态方程。式中 R 是气体常数,常用的与单位是 8.314J·K-1·mol-1。 2.对于混合的理想气体有: 分压定律: 混合气体的总压力等于各组分单独存在于混合气体的温度、 体积条件下产 生压力的总和,称道尔顿分压定律。 数学式为:pB=yBp 分体积定律:混合气体中任一组分 B 的分体积 VB 是所含 nB 的 B 单独存在于混合气 体的温度、总压力条件下占有的体积,称阿马格分体积定律。 数学式为:VB =yBV 3.实际气体的范德华方程式 实际气体分子是有一定的形状和大小并且分子间有作用力。 实际气体状态方程形式很 多,最著名的是范德华方程式:(p+ n2a/V2)(V –nb)=nRT 分子间无作用力,分子体积视为零的气体。在高温低压下,任何实际 气体的行为都很接近于理想气体的行为。平衡状态的理想气体的 p、V、T 及 n 之间满足
1
B
B
f Hm ( B)
B
B
C H m ( B)
12.实际气体的节流膨胀 对于实际气体的节流膨胀过程,在已知 Q 0 和 p 0 的情况下,推理得到的结果 为 H 0 。即实际气体的节流膨胀过程是一个等焓过程( dH 0 )。定义焦耳—汤姆 T 逊系数为 J T ( ) H , 表示在节流膨胀过程中气体的温度随压力的变化率。 当 J T 0 p 时,气体经过节流膨胀后温度降低;当 J T 0 时,气体经过节流膨胀后温度升高。而理 想气体的汤姆逊系数为 J T 0 ,表示理想气体经过节流膨胀后温度保持不变。需要注 意的是,节流膨胀过程仅是简单的物理变化过程,即在变化过程中仅是体系的温度、压 力、体积发生变化,没有相变化和化学变化的产生。利用节流膨胀可以使气体致冷。
医药类大学物理化学重点 考点

【P5】:1、理想气体模型(条件):1分子大小可以忽略,2:无分子作用力。
高温,低压状态的气体看做理想气体。
2、理想气体状态方程:PV二nRTP—压力—Pa V—体积—m3 n—物质的量—摩尔T—温度—温度—KR—摩尔气体常数—8.314[J/(mol*K)]【P7】:混合气体定律适用条件:理想气体的混合物1、道尔顿分压定律:某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时所产生的压力;而气体混合物的总压强等于其中各气体分压之和,这就是气体分压定律。
Pa=naP/n =xaP2、阿马格定律:而气体混合物的总体积等于其中各体积之和,这就是气体分体积定律。
Va=naP/n=xaV Vi/V=ni/n=PiP【P15】:状态函数:只由体系状态确定的体系的各种热力学性质,称为体系的状态函数。
状态函数改变~状态改变。
状态改变~状态函数不一定改变。
(X\T) 常用的状态函数,T、P是强度性质;V、U、H、S、G广度性质。
热和功不是状态函数。
特征:殊途同归,值变相等。
周而复始,值变为零。
【P17:】功:非体积功,表面功、电功。
1、体积功:①向真空膨胀W=0,温度不变则热力学能保持不变。
∆T=0,Q=0,∆H=02、恒外压W=—P外∆V3、恒压P=P1=P2=P外:W=—P∆V④4、Wr=-nRTLn(V1/V2) (条件:理想、等温、可逆)【P23】:热力学可逆过程的特点:(可逆过程效率最高)(1)可逆过程是以无限小的变化进行的,体系始终无限接近于平衡态。
(2)循与过程原来途径相反的方向,可以使系统和环境完全恢复到原来的状态,而无任何耗散效应。
(3)在等温可逆膨胀过程中系统对环境做最大功,在等温可逆压缩过程中环境对系统做最小功。
【P24】:体积热力学能的变化,∆U=U2-U1=Q+W。
1、∆U=Qv等容. 条件:.没有非体积功的等容过程2、定压热Qp=H2一U1、∆H=Qp、焓的定义:H=U+PV恒压热=焓变条件:①Wf=o.没有非体积功的等压过程3、双原子分子Cpm=7R/2、Cv.m=5R/2、单原子分子Cvm=3R/2,Cpm=5R/2。
物理化学第一章气体的pVT性质

一、状态方程 :联系 p、V、T 之间关系的方 程称为状态方程。 二、理想气体状态方程 1. 理想气体状态方程 低压气体定律: (1)波义尔定律(R.Boyle,1662):
pV = 常数 V / T = 常数
( n ,T 一定) (n , p 一定)
(2)盖.吕萨克定律(J. Gay-Lussac,1808):
ρ ∝
a 内压力= V 2 = p i p
1 V
pi = p +
3. 范德华方程
(P +
a V2
a )(Vm b) = RT 2 Vm
n 2a (P + )( V nb ) = nRT V 2
§1-3
实际气体的PVT性质 实际气体的PVT性质 PVT
4.范德华常数及其单位 范氏方程里的两个常数a、b总称为范德华常数,常数a 标志了物质分子间所具有的相互吸引力,常数b则表示 了分子本身所具有的体积,故a与b都是与气体种类有 关的特性常数。
R=
或
PVm 1atm × 22.4140L mol = T 273.15K
= 0.082057atm L K 1 mol 1
1
(101325 N m 2 )( 22 . 4140 10 3 m 3 mol R= 273 .15 K
)
=8.3144NmK-1mol-1 =8.3144JK-1mol-1
第一章
气体的PVT性质 气体的PVT性质 PVT
§1-0 物质的聚集状态
聚集状态 1.定义:物质是由大量的不断流动着的分子、原子、 离子等微观粒子聚集而成的,所以物质所表现出来的 状态 。 2.产生原因:分子间相互作用力 运动 3.表示方法:气、液、固分别用于g、l、s表示。
1-2-1 阿马格分体积定律

用 p 除上式左右两端 则得 ∑Vi=V∑pi/p. 由道尔顿分压定律知 p=∑pi,由此可见 ∑Vi=V.
以上结果表明: 以上结果表明:混 合理想气体的体积等 于各组分的分体积之 和,这个结论称为阿 马格分体积定律。 马格分体积定律。
阿马格 分体积定律
根据理想气体物态 方程和道尔顿分压定 律可以导出阿马格分 体积定律, 体积定律,具体的推 导过程如下。 导过程如下。
设混合理想气体 中的第 i 种组分的 物质的量为νi ,分 压强为 pi,分体积 为Vi .
将理想气体物态方程 应用于混合理想气体中 的第 i 种组பைடு நூலகம்可得 pVi=νiRT=Vpi. RT= 对各种组分求和得 p∑Vi=∑νiRT=V∑pi. RT=
1-02理想气体混合物道尔顿定律和阿马格定律

道尔顿
见P8
例1.2
RT p B nB V
p pB
B
pB y B P
RT V nB p
* B
* VB yBV
2
(完)
例1.1
用管道输送天然气,当输送压力为200kPa,温度为 25℃时,管道内天然气的密度为多少?假设天然气 可看作是纯甲烷。
102理想气体混合物道尔顿定律和阿马格定律理想气体定律理想气体定律密度道尔顿分压定律道尔顿定律道尔顿亨利定律理想气体理想气体状态方程理想气体方程一定质量的理想气体
§1.2 道尔顿定律和阿马格定律
1.组成的表示
⑴摩尔分数
x
B
或 yB
n xB (或y B n x 1 , y 1
)de f
B A A
B B
B
B
liquid ⑵质量分数 wB ⑶体积分数 B
gas( wB 1)B Nhomakorabeaw
B
de f
m m
B A
A
B
de f
x V x V
B A A
m ,B m,A
( 1)
B B
1
2.混合理想气体的状态方程
B
例1.1
B
PV nRT ( nB )RT Mmix de f y BMB
今有300K,104.365kPa的湿烃类混合气体(含水蒸气的 烃类混合气体),其中水蒸气的分压为3.167kPa。现欲 得到除去水蒸气的1kmol干烃类混合气体,试求: (1)应从湿烃混合气体中除去水蒸气的物质的量; (2)所需湿烃类混合气体的初始体积。 解:(1)设湿烃类混合气体中烃类混合气(A)和水蒸气(B) 的分压分别为PA和PB,PB =3.167kPa。 PA =P - PB =101.198kPa。由公式:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用 p 除上式左右两端 则得 ∑Vi=V∑pi/p. 由道尔顿分压定律知 p=∑pi,由此可见 ∑Vi=V.
以上结果表明: 以上结果表明:混 合理想气体的体积等 于各组分的分体积之 和,这个结论称为阿 马格分体积定律。 马格分体积定律顿分压定 律可以导出阿马格分 体积定律, 体积定律,具体的推 导过程如下。 导过程如下。
设混合理想气体 中的第 i 种组分的 物质的量为νi ,分 压强为 pi,分体积 为Vi .
将理想气体物态方程 应用于混合理想气体中 的第 i 种组分可得 pVi=νiRT=Vpi. RT= 对各种组分求和得 p∑Vi=∑νiRT=V∑pi. RT=
