容量瓶以及溶液配制资料
溶液的配置实验实训报告

一、实验目的1. 熟悉实验室溶液配置的基本操作步骤和技巧。
2. 掌握容量瓶、滴定管等仪器的使用方法。
3. 培养实验操作的规范性和严谨性。
二、实验原理溶液的配置是将一定量的溶质溶解在一定量的溶剂中,得到所需浓度的溶液。
本实验采用直接配制法,通过计算、称量、溶解、移液、洗涤、定容、摇匀等步骤,配置一定物质的量浓度的溶液。
三、实验用品1. 仪器:容量瓶(100mL、250mL)、滴定管、烧杯、玻璃棒、药匙、滤纸、托盘天平、移液管、胶头滴管。
2. 药品:NaCl(固体)、蒸馏水。
四、实验步骤1. 计算:根据所需溶液的浓度和体积,计算出所需溶质的质量。
设所需溶液的浓度为c(mol/L),体积为V(L),所需溶质的摩尔质量为M (g/mol),则所需溶质的质量m(g)为:m = c × V × M2. 称量:用托盘天平准确称取计算出的溶质质量。
3. 溶解:将称量好的溶质放入烧杯中,加入少量蒸馏水,用玻璃棒搅拌使其完全溶解。
4. 移液:将溶解好的溶液用移液管移入容量瓶中。
5. 洗涤:用少量蒸馏水洗涤烧杯和玻璃棒,并将洗涤液一并移入容量瓶中。
6. 定容:向容量瓶中注入蒸馏水至距离刻度线2-3cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切。
7. 摇匀:盖好容量瓶瓶塞,反复上下颠倒,使溶液混合均匀。
五、实验结果与分析1. 实验结果:配置得到一定物质的量浓度的溶液。
2. 分析:通过实验,掌握了溶液配置的基本操作步骤,熟悉了容量瓶、滴定管等仪器的使用方法。
实验过程中,注意了操作的规范性和严谨性,保证了实验结果的准确性。
六、注意事项1. 在称量溶质时,应确保天平准确,避免误差。
2. 在溶解溶质时,应使用玻璃棒搅拌,以加速溶解。
3. 在移液时,应使用移液管,避免溶液洒出。
4. 在定容时,应使用胶头滴管,确保溶液凹液面与刻度线相切。
5. 在摇匀溶液时,应盖好容量瓶瓶塞,避免溶液洒出。
七、实验总结本次实验通过溶液配置,使我对实验室溶液配置的基本操作步骤和技巧有了更深入的了解。
实验室溶液配制

实验室溶液配制实验室所需溶液配制1.费休⽒试液,购买;2.氢氧化钠溶液,C=0、01mol/l。
氢氧化钠分⼦量40、0,准确称取氢氧化钠固体0、4g溶于200ml蒸馏⽔中,并在1L容量瓶中定容,即得到上述浓度溶液;3.中性红溶液,C=1%。
准确称取中性红固体1g溶于50ml蒸馏⽔中,并在100ml容量瓶中定容,即得到上述浓度溶液;4.溴百⾥⾹酚蓝溶液,C=1%。
准确称取溴百⾥⾹酚蓝固体1g溶于50ml蒸馏⽔中,并在100ml容量瓶中定容,即得到上述浓度溶液;5.碘化钾溶液,C=10%。
准确称取KI固体50g溶于50ml蒸馏⽔中,并在500ml容量瓶中定容,即得到上述浓度溶液;6.硫代硫酸钠溶液,C=0、1mol/l。
硫代硫酸钠分⼦量158、11,准确称取硫代硫酸钠固体15、811g溶于200ml蒸馏⽔中,并在1000ml容量瓶中定容,即得到上述浓度溶液;7.硫酸溶液,C=2mol/l,硫酸分⼦量98、08,浓度98%时密度约1、84g/ml,准确量取硫酸液体108、78ml稀释与500ml蒸馏⽔中,向⽔中加⼊硫酸⽽⾮向硫酸中加⽔,冷却后在1000ml 容量瓶中定容即可得到上述浓度溶液;8.淀粉溶液,C=0、5%。
准确称取可溶性淀粉0、5g,溶于50ml⽔中,并在100ml容量瓶中定容,即得到上述浓度溶液;9.铬酸钾溶液,C=50g/L。
准确称取铬酸钾固体50g,溶于500ml⽔中,并在1000ml容量瓶中定容,搅拌下逐滴加⼊10%的硝酸银溶液,直⾄溶液出现棕红的悬浮物为⽌、静置1昼夜,⽤⼲净的滤纸漏⽃过滤即可,不⼀定⽤饱与硝酸银溶液,⽤10%硝酸银溶液即可、配制⽅法:1克硝酸银+10毫升纯⽔溶解,置于棕⾊瓶中;10.氯化钠基准试剂,C=0、1mol/l,氯化钠分⼦量58、5,准确称取氯化钠固,5、85g溶于500ml蒸馏⽔中,并在1000ml容量瓶中定容,即得到上述浓度溶液;11.硝酸银溶液,C=0、1mol/l,硝酸银分⼦量169、87,准确称取硝酸银固体8、49g溶于200ml蒸馏⽔中,并在500ml容量瓶中定容,即得到上述浓度溶液,⽤前采⽤基准氯化钠试剂(10)标定,需保存于棕⾊试剂瓶中;12.酚酞指⽰剂,C=0、1%,准确称取酚酞固体0、1g溶于50ml蒸馏⽔中,并在100ml容量瓶中定容,即得到上述浓度溶液;13.氯化钡溶液,C=10%,准确称取氯化钡固体10g溶于50ml蒸馏⽔中,并在100ml容量瓶中定容,即得到上述浓度溶液;14.⼄醇溶液,C=1%,准确移取⼄醇(AR)1ml与100ml容量瓶中定容,即可得到上述浓度溶液;15.盐酸标准溶液,C=1 mol/l,分⼦量36、46,D154=1、20(39、11%),1、15(29、57%)、1、10(20%)、1、05(10、17%)。
溶液配置

实验常用试剂配置1.铜标准贮备溶液:称取1.000±0.005g金属铜(纯度99.9%)置于150ml烧杯中,加入20ml1+1硝酸,加溶解后,加入10ml1-1硫酸并加热至冒白烟,冷却后,加水溶解并转入1L容量瓶中,用水稀释至标缓。
此溶液每毫升含1.00mg铜。
2.铜标准溶液:吸取5.00ml铜标准贮备溶液于1L容量瓶中,用水稀至标线。
此溶液每毫升含5.0μg铜。
3.二乙基二硫代氨基甲酸钠0.2%(m/v)溶液:称取0.2克二乙基二硫代氨基甲酸钠三水合物(C5H10NS2Na •3H2O,或称铜试剂cupral)溶于水中并稀释至100ml,用棕色玻璃瓶贮存,放于暗处可用两星期。
4.EDTA-柠檬酸铵-氨性溶液:取12g乙二胺四乙酸二钠二水合物(Na-EDTA•2H2O)、2.5g柠檬酸铵[(NH4)3•C6H5O7],加入100ml水和200ml浓氨水中溶解,用水稀释至1L,加入少量0.2%二乙基二硫代氨基甲酸钠溶液,用四氯化碳萃取提纯。
4.1EDTA-柠檬酸铵溶液:将5g乙二胺四乙酸二钠二水合物(Na2-EDTA•2H2O)20g柠檬酸铵[(NH4)3•C6H5O7]溶于水中并稀释至100ml,加入4滴甲酚红指示液,用1+1氨水调至PH=8~8.5(由黄色变为浅紫色),加入少量0.2%二乙基二硫代氨基甲酸钠溶液,用四氯化碳萃取提纯。
5.氯化铵-氢氧化铵缓冲溶液将70g氯化铵(NH4Cl)溶于适量水中,加入570ml浓氨水,用水稀释至1L。
6.甲酚红指示液0.4g/L:称取0.02克甲酚红(C21H18O5S)溶于50ml195%(v/v)乙醇中。
7.碘溶液C=0.05mol/L:称12.7g碘片,加到含有25g碘化钾+少量水中,研磨溶解后用水稀释至1000mL。
8.丁二酮肟[(CH3)2C2(NOH)2]溶液5g/L:称取0.5g丁二酮肟溶解于50mL浓氨水中,用水稀释至100mL9.丁二酮肟乙醇溶液,10g/L:称取1g丁二酮肟,溶解于100mL乙醇(3.4)中。
配制溶液步骤及注意

配制500ml,0.1mol/l碳酸钠溶液步骤及注意事项所需的仪器:烧杯、容量瓶、玻璃棒、胶头滴管、分析天平、药匙、量筒步骤:第一步:计算:所需碳酸钠的质量=0.5*0.1*106=5.3克。
第二步:称量:在天平上称量5.3克碳酸钠固体,并将它倒入小烧杯中。
第三步:溶解:在盛有碳酸钠固体的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入500ml容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1—2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
误差分析:固体药品的称量与液体药品的量取是否准确;把溶液向容量瓶中转移,溶液洒了;未洗涤烧杯和玻璃棒;用待配液润洗了容量瓶;定容时水加多了或加少了;定容时未平视刻度线。
仰视、俯视对溶液浓度有何影响?★俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;★仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
三、容量瓶的使用六忌:★一忌用容量瓶进行溶解(体积不准确)★二忌直接往容量瓶倒液(洒到外面)★三忌加水超过刻度线(浓度偏低)★四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)★五忌不洗涤玻璃棒和烧杯(浓度偏低)★六忌标准液存放于容量瓶(容量瓶是量器,不是容器)1 mol/L的氢氧化钠溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体克。
②将称好的氢氧化钠固体放入烧杯中加少量蒸馏水将其溶解,待完全溶解后将溶液沿玻璃棒移入250mL的容量瓶中。
③用少量蒸馏水冲洗2-3次,将冲洗液移入容量瓶中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏低。
④向容量瓶内加水至刻度线1-2cm时,改用胶头滴管小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏低应该重新配制。
⑤最后盖好瓶盖,摇匀,将配好的溶液移入试剂瓶中贴好标签。
化学溶液的配置实验报告

一、实验目的1. 掌握化学溶液的配置方法。
2. 熟悉常用化学试剂的性质及使用方法。
3. 培养实验操作技能和严谨的科学态度。
二、实验原理化学溶液的配置是指将固体或液体溶质溶解在溶剂中,形成一定浓度的溶液。
本实验以配置0.1mol/L的NaCl溶液为例,介绍化学溶液的配置方法。
三、实验仪器与试剂1. 仪器:分析天平、烧杯、玻璃棒、容量瓶、滴定管、移液管、洗瓶、滤纸等。
2. 试剂:NaCl固体、去离子水、盐酸(1mol/L)、酚酞指示剂等。
四、实验步骤1. 称取固体NaCl:用分析天平准确称取0.8655g NaCl固体。
2. 溶解:将称取的NaCl固体放入烧杯中,加入少量去离子水,用玻璃棒搅拌至完全溶解。
3. 调整溶液体积:将溶解后的NaCl溶液转移到100mL容量瓶中,用去离子水冲洗烧杯及玻璃棒,将冲洗液一并转移到容量瓶中。
4. 定容:向容量瓶中加入去离子水至刻度线,用滴定管滴加少量盐酸(1mol/L),观察溶液颜色变化。
当溶液变为浅红色时,停止滴加。
5. 混匀:塞紧容量瓶塞,倒置摇匀,使溶液浓度均匀。
6. 标签:在容量瓶上贴上标签,注明溶液名称、浓度、配置日期等信息。
五、实验结果与分析1. 配制0.1mol/L的NaCl溶液,实验过程中注意控制溶液体积,避免浓度误差。
2. 滴加盐酸(1mol/L)观察溶液颜色变化,确保溶液浓度准确。
3. 实验过程中注意操作规范,防止污染和浪费。
六、实验总结1. 本实验通过配置0.1mol/L的NaCl溶液,掌握了化学溶液的配置方法。
2. 实验过程中,注意了常用化学试剂的性质及使用方法,提高了实验操作技能。
3. 通过本次实验,培养了严谨的科学态度和团队协作精神。
4. 在实验过程中,发现了以下问题:(1)称取固体NaCl时,由于操作不当,导致称量误差较大。
(2)调整溶液体积时,由于滴定管读数不准确,导致溶液体积偏大。
5. 针对以上问题,提出以下改进措施:(1)提高称量精度,采用更精确的分析天平。
溶液的配制

250mL
加水加少了
步骤
⑤定容、摇匀:在容量瓶中继续加水至距 刻度线1~2cm处,改用胶头滴管滴加至刻度 (液体凹液面最低处与刻度线相切)。
250mL
加水加少了 加水加多了
摇匀
把定容好的容量瓶瓶塞塞紧,用 食指顶住瓶塞,用另一只手的手 指托住瓶底,把容量瓶倒转和摇 动几次,混合均匀。
思考:摇匀后发现液面低于刻线, 能否补充水? 答: 不能,液面低于刻线是因为还有水挂壁, 当静置后就会恢复原状.
• 溶质溶于水求浓度。 • 1.将24.0gNaOH固体溶于水配成100ml溶 液,其密度为1.2g/ml,求该溶液中NaOH 的物质的量浓度以及质量分数。 • 2.标准状况下,将44.8LNH3溶于1L水中, • 得到密度为0.9g/cm3氨水,求此氨水的物 质的量浓度以及质量分数。
物质的量浓度和溶质质量分数的换算
溶液的稀释 1.如果将5mL浓硫酸稀释为20mL的稀硫 酸,得到的稀硫酸与原浓硫酸所含的硫酸 的物质的量相等吗?为什么? 2.配制250mL1.0mol/LH2SO4溶液,需要 18mol/LH2SO4溶液的体积是多少?
变式2 将10毫升2mol/L的硫酸溶液加水稀
释成40毫升溶液,其浓度是多少?
步骤
② 称量(用托盘天平称取固体溶质的 质量或用量筒量取液体溶质的体积) 称量时能将NaCl固 体直接放置于托盘 上吗? 用滤纸,NaOH等 具腐蚀性的应用 表面皿
2.称量
用托盘天平来称量固体药品 应注意哪些? 注意事项: (1)使用前要调零 (2)两个托盘上各放一张大小相同的称量纸 (3)称量时遵循左物右码的原则 (4)用镊子夹取砝码应按照从大到小的顺序 (5)称量完毕应将砝码放回盒中,游码归零
容量瓶在使用前要检查是否漏水 加水 倒立 观察
配制溶液

1、 如何将烧杯中的 液体转移到容量瓶中?
用玻棒引流,避免液体洒在瓶外。
2、引流时若有液体洒在瓶外,所 配溶液浓度会怎么变化? 溶质损失,导致所配溶液浓度偏低
转移Βιβλιοθήκη 5、洗涤转移后,用蒸馏水洗涤小烧杯和玻璃棒 2 ~ 3次,并将洗涤液全部转入容量瓶 中。 1、为什么要洗涤玻 思考? 璃棒和烧杯? 保证溶质全部转移到容量瓶中。 2、 不洗涤玻璃棒和烧杯,不 将洗涤液转入容量瓶中,所配 溶液浓度怎么变化? 洗涤 溶质损失,导致所配溶液浓度偏低
六、配制一定物质的量浓度的 溶液
物质的量浓度是生产上和科学实验上常 用的一种表示溶液组成的重要方法.因此, 我们要学会配制一定物质的量浓度的溶液.
因为要求配制的溶液比较精确,所以 我们要使用精确的仪器——容量瓶
(一)容量瓶的介绍
1、形状: 细颈,梨形, 磨口玻璃塞;
2、构造: 颈部标有刻度线, 瓶上标有容积、温度。
2.试剂与砝码的左右位置搞错( 偏低 ) 3.量取液体溶质时,俯视读数( 偏低 ) 4.定容时俯视刻度线( 偏高 ) 5.所配溶液未冷却至室温即转入容量瓶定容( 偏高 )
6. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转 入容量瓶( 偏低 ) 7. 溶解、转移、洗涤时有溶液流出容器外,使溶质 减小( 偏低 )
8. 容量瓶在使用前,用蒸馏水洗净,在瓶内有少 量水残留( 无影响 )
9. 定容摇匀后,静止时发现液面低于刻度线,再加 水到刻度线( 偏低 ) 10. 定容时加水过量越过刻度线,又取出部分溶液, 使液面降至刻度线(偏低 )
讨论
• 定容时俯视或仰视刻度线,对溶液 的浓度有何影响?
• 俯 • 视
• 仰 • 视
托盘天平的使用
溶液配置过程

溶液配置过程溶液配置是实验室中常见的操作之一,它是根据实验需求将溶质溶解在溶剂中,制成所需浓度的溶液的过程。
下面我将以配制盐酸溶液为例,来描述一下溶液配置的过程。
准备好所需的实验器材和试剂。
配制盐酸溶液所需的器材有:量筒、容量瓶、滴定管等;试剂有:盐酸和去离子水。
确保实验器材干净无杂质,试剂质量纯净。
然后,按照实验要求确定所需浓度的盐酸溶液的体积。
假设需要配制100 mL浓度为0.1 mol/L的盐酸溶液。
接下来,使用量筒量取所需体积的去离子水,将其倒入容量瓶中。
注意要将量筒放在水平的台面上,读取液面时要注意与刻度线平行,以确保准确度。
然后,使用滴定管将盐酸逐滴加入容量瓶中的去离子水中。
在加入盐酸之前,要先摇匀盐酸瓶,以保证溶液浓度均匀。
同时,要小心滴定管的使用,避免滴液过多或过少。
在滴加盐酸的过程中,可以用玻璃杯接收溶液,在加入一定体积的盐酸后,将玻璃杯中的溶液倒入容量瓶中。
这样可以避免滴定管的尖端接触到容量瓶的边缘,造成溶液的污染。
当盐酸加入到一定体积后,可以用玻璃棒搅拌溶液,使其充分混合。
搅拌的同时,可以观察溶液的颜色和透明度,以判断是否达到所需浓度。
使用量筒或滴定管,逐滴加入去离子水,直到溶液的液面接近容量瓶的刻度线。
然后,用玻璃棒搅拌溶液,使其充分混合。
经过以上步骤,我们就成功完成了盐酸溶液的配置。
在实验过程中,要注意安全操作,佩戴好防护眼镜和手套,避免溶液溅到皮肤和眼睛。
溶液配置是实验室中必不可少的操作,它直接影响到实验结果的准确性和可靠性。
通过正确操作和仔细配制,我们可以得到所需浓度的溶液,为实验提供可靠的基础。
希望以上的描述能够让读者对溶液配置的过程有一个清晰的了解。
高中化学:容量瓶配制溶液的全过程操作及注意事项

容量瓶配制溶液的全过程操作及注意事项一.用容量瓶配制溶液所用仪器:1.烧杯、容量瓶、玻璃棒、胶头滴管、分析天平、药匙(固体溶质使用)、移液管(液体溶质使用)2.容量瓶1.构造: 磨口、细颈、梨形平底2.特点: ① 容量瓶上注明温度和容积。
② 容量瓶颈部有刻度线。
3.使用范围:专门用来配制一定体积、一定物质的量浓度的溶液。
4.注意事项:① 使用前先检漏。
② 不可装热或冷的液体。
③ 不能用来溶解固体物质或存放液体或进行化学反应。
3.使用容量瓶六忌:一忌用容量瓶进行溶解(体积不准确),二忌直接往容量瓶倒液(会洒到外面);三忌加水超过刻度线(浓度偏低);四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高);五忌不洗涤玻璃棒和烧杯(浓度偏低);六忌标准溶液存放于容量瓶(容量瓶是量器,不是容器)。
二.用容量瓶配制溶液的步骤:全过程有计算,称量,溶解,冷却,转移,洗涤,定容,摇匀/装瓶八个步骤 八字方针:计,量,溶,冷,转,洗,定,摇以0.1mol/LNaCO 3溶液500ml 为例说明溶液的配制过程1. 计算:NaCO 3物质的量=0.1mol/L ×0.5L =0.05mol ,由NaCO 3摩尔质量106g/mol, 则NaCO 3质量=0.05mol ×106g/mol=5.3g2. 称量:用分析天平称量5.300g ,注意分析天平的使用。
3. 溶解:在烧杯中用100ml 蒸馏水使之完全溶解,并用玻璃棒搅拌(注意:应冷却,不可在容量瓶中溶解)4. 转移,洗涤:把溶解好的溶液移入500ml 容量瓶,,用于容量瓶瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。
为保证溶质尽可能全部转移到容量瓶中,应该用蒸馏水洗涤烧杯和玻璃棒二、三次,并将每次洗涤后的溶液都注入到容量瓶中。
轻轻振荡容量瓶,使溶液充分混合。
(用玻璃棒引流)5. 定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度,这个操作叫定容。
无机化学实验—溶液的配制

m(Na2CO3)=c(Na2CO 3)·V[Na2CO3(aq)]
=50mL×2%g/mL=1g
m(Na2CO3·10H2O)=m(Na2CO3) ×·M(Na2CO3·10H2O)/M(Na2CO3) =1g×286g/mol÷106g/mol=2.70g
化学试剂规格
容量瓶的使用
1. 构造:细颈、平底玻璃瓶, 瓶口配有磨口玻璃塞或塑料塞
2. 特点:容量瓶上标有温度、容积、刻度线 3. 用途:用来配制一定体积浓度准确的溶液
4. 注意事项: ①使用前要检查是否漏水 ②溶解或稀释的操作不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应
配制Na2CO3溶液(2% g/mL)
2、量取-量筒(移液管) 3、稀释 4、转移 5、洗涤 6、定容 7、摇匀
实验内容
1、铬酸洗液的配制:(称量纸称量);为何要用热 水?且趁热加入浓硫酸? 2、H2SO4溶液的配制:稀释时注意是浓硫酸注入 少量水的烧杯中,不是蒸馏水注入浓硫酸中,为何? 3、NaOH溶液配制:为何干燥小烧杯称量?为何先 配制成饱和溶液再稀释?为何取上层清液?为何要 用新沸过的冷水稀释?
今天实验内容:
1、Na2CO3的配制: 2、HAC溶液的配制(2mol/L):计算——定容—摇匀—贴标签 3、NH4CL缓冲溶液的配制 称取2.7gNH4CL固体—10ml蒸馏水溶解—浓氨水17.5ml—混匀后转移至容 量瓶—洗涤2-3次—加水至刻度线附件—定容—摇匀—回收至试剂瓶
不能。因为是部分溶液在润湿容 量瓶瓶颈处所致。
8. 装瓶贴签
容量瓶中不能存放溶液,因此要把配制好的溶液转移 到试剂瓶中,贴好标签,注明溶液的名称和浓度。
一定物质的量浓度溶液配制的一般步骤:
用容量瓶配制溶液的过程

用容量瓶配制溶液的过程
容量瓶是化学实验室用于配制溶液的一种容器,具有精确的容积和标尺,可以方便地控制溶液的浓度。
以下是用容量瓶配制溶液的具体过程:
1. 准备容量瓶和所需药品:首先需要选择合适的容量瓶,例如100ml、250ml或500ml的容量瓶。
同时,需要准备所需的药品和溶剂,按照比例计算出各自的摩尔浓度。
2. 加入药品和溶剂:将需要配制的药品精确称量,称取到一个干净的
烧杯中,然后加入适量的溶剂。
溶剂可以是水或其他溶解度较好的溶液。
溶剂的加入量应该足够将药品完全溶解,并且不超过容量瓶的总
容积的80%。
3. 拉平溶液:用清洁的试杯将溶液倒回容量瓶中,直至容器底部的液
面接近标记线,即容量瓶的刻度线。
此时,容量瓶中的液面往往上方
存在一个凸起的“准确液层”,需要使用滴定管滴加适量纯溶液直到液
面与标线平行。
过程中要注意滴加速度,以免溶液泡沫造成误差。
4. 摇匀和存储:使用温和的摇匀振荡器将容量瓶均匀旋转几次,使溶
液充分混合。
若准确的摩尔浓度非常重要,则可使用参照文献标准化,检验溶液浓度的精确度。
最后,将配制好的溶液经过标签标记存放在
干燥避光处保存。
通过以上步骤,就可以用容量瓶配制出精确浓度的溶液,保证实验的准确性和可重复性,提高实验的成功率和效率。
大学实验报告溶液配置

一、实验目的1. 掌握溶液配置的基本原理和方法。
2. 熟悉常用溶液的配制过程。
3. 提高实验操作技能和实验数据分析能力。
二、实验原理溶液是由溶质和溶剂组成的均匀混合物。
溶液的浓度是指溶质在溶液中的含量,通常用质量浓度(g/L)或摩尔浓度(mol/L)表示。
溶液配置是将已知浓度的溶液按照一定比例稀释或浓缩,以得到所需浓度的溶液。
三、实验仪器与试剂1. 仪器:电子天平、容量瓶、移液管、烧杯、玻璃棒、滴定管、洗瓶、滤纸等。
2. 试剂:氯化钠(NaCl)、蒸馏水、浓盐酸、氢氧化钠(NaOH)等。
四、实验步骤1. 配制0.1mol/L氯化钠溶液(1)称取1.7g氯化钠,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到100mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,用滴定管滴加浓盐酸,调节pH值为7,摇匀。
(5)贴上标签,备用。
2. 配制0.1mol/L氢氧化钠溶液(1)称取4.0g氢氧化钠,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到100mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,用滴定管滴加浓盐酸,调节pH值为7,摇匀。
(5)贴上标签,备用。
3. 配制1mol/L盐酸溶液(1)称取36.5g浓盐酸,置于烧杯中。
(2)加入适量蒸馏水,用玻璃棒搅拌溶解。
(3)将溶液转移到1000mL容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,并将冲洗液转移到容量瓶中。
(4)向容量瓶中加入蒸馏水至刻度线,摇匀。
(5)贴上标签,备用。
五、实验数据记录与分析1. 配制0.1mol/L氯化钠溶液称量:1.7g溶质:NaCl溶剂:蒸馏水浓度:0.1mol/L2. 配制0.1mol/L氢氧化钠溶液称量:4.0g溶质:NaOH溶剂:蒸馏水浓度:0.1mol/L3. 配制1mol/L盐酸溶液称量:36.5g溶质:HCl溶剂:蒸馏水浓度:1mol/L六、实验结果与讨论1. 实验结果通过以上实验,成功配制了0.1mol/L氯化钠溶液、0.1mol/L氢氧化钠溶液和1mol/L盐酸溶液,各溶液浓度符合预期。
容量瓶使用及溶液配制

配制一定物质的量浓度的溶液
(1)所用主要仪器
a.若溶质是固体时,需托盘天平,药匙,烧杯,玻璃棒,容量瓶,胶
头滴管等。
b.若溶质为液体或溶液时,应将托盘天平和药匙改为量筒,其他不
变。
(2)容量瓶的使用
c.使用前检验容量瓶是否漏水:加水,塞紧瓶塞,倒立,查漏,瓶
塞旋转180度,倒立,查漏。
d.容量瓶不能用来溶解物质。
e.不能把热的溶液转移到容量瓶中,更不能给容量瓶加热。
f.配制一定体积的溶液,需选用与要配制溶液体积相同或相近规格
的容量瓶。
常用的容量瓶有50mL,100 mL,150 mL,200 mL,250 mL,500 mL,1000 mL。
g.容量瓶不能久贮溶液,因此配制好的溶液要及时倒入试剂瓶中,
并贴上标签。
(3)配制步骤
h.计算
i.称量(或量取)
j.溶解:在烧杯中进行,可用玻璃棒搅拌,溶解后要使溶液恢复到常温。
k.转移:用玻璃棒引流,将烧杯中的溶液转移到容量瓶中。
l.洗涤:用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并把洗涤液都转移到容量瓶中。
m.定容:先缓慢地把蒸馏水直接注入容量瓶中,当液面接近刻线2~3cm处时,再改用胶头滴管逐滴加水,直到溶液的凹面正好与刻度线相切。
n.振荡,摇匀:盖紧瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶倒转和摇动多次。
o.装瓶:把配好的溶液倒入预备好的试剂瓶中,贴上标签。
标准溶液配制记录

标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,以及相关实验数据,为后续实验提供准确可靠的参考依据。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于分析化学中的定量分析。
在配制标准溶液时,需要根据溶质的化学性质和实验要求,选择适当的溶剂和溶质的质量,按照一定的比例配制而成。
三、实验步骤。
1. 准备实验所需的试剂和仪器设备,包括天平、容量瓶、移液管等。
2. 根据实验要求,选择合适的溶剂和溶质,并按照所需的浓度比例进行称量。
3. 将称量好的溶质溶解于适量的溶剂中,摇匀使其充分溶解。
4. 用容量瓶将溶液定容至刻度线,摇匀混合。
5. 将配制好的标准溶液转移至干净的密封瓶中,标注好溶液的名称、浓度、配制日期等信息。
四、实验数据记录。
| 溶质 | 质量/g | 溶剂 | 体积/mL | 浓度/mol/L | 配制日期 |。
|------|--------|------|---------|------------|----------|。
| NaCl | 5.85 | 水 | 1000 | 0.1 |2022/03/15|。
| KCl | 7.20 | 水 | 1000 | 0.2 |2022/03/16|。
五、实验结果分析。
通过本次实验的记录数据,我们成功配制出了两种浓度不同的标准溶液,分别为0.1mol/L的NaCl溶液和0.2mol/L的KCl溶液。
在实验过程中,我们严格按照配制步骤进行操作,确保了实验结果的准确性和可靠性。
六、实验总结。
本次实验记录了标准溶液的配制过程和相关数据,为后续实验提供了重要的参考依据。
在实验中,我们需要严格按照配制步骤进行操作,确保实验结果的准确性和可靠性。
同时,对于配制好的标准溶液,我们也需要做好标注和保存工作,以便后续实验的使用。
七、实验注意事项。
1. 在配制标准溶液时,需要准确称量溶质和溶剂,严格按照比例进行配制。
2. 配制好的标准溶液需要标注清楚名称、浓度、配制日期等信息,并保存在干净的密封瓶中。
溶液配制

刻度线 相切 .塞好瓶塞,反复上下颠倒,摇匀.
算称量取步骤清,溶解转移再定容。室温洗涤莫忘记, 摇匀标签便告成。
1.欲配制1 mol/L的氢氧化钠溶液 250mL,完 成下列步骤: 10.0 小烧杯 ①用 在天平上称取氢氧化钠固体 克。
②向称好的氢氧化钠固体加 适
量
蒸馏水将其溶
解,待 溶液冷却至室温 后将溶液沿 玻璃棒 移入
[讨论]
在配制溶液中哪些操作可能 引起溶液浓度的误差?
1、称量产生误差
1)称量时左盘高,右盘低
2)称量时称量物放在右盘,而砝 码放在左盘 3)量筒量取液体药品时仰视读数 4)量筒量取液体药品时俯视读数
2、溶解、转移、洗涤产生误差
5)溶解过程中有少量液体溅 出烧杯
6)未洗涤溶解用的玻璃棒和烧杯 7)洗涤液未转入容量瓶中而倒入废 液缸中
250ml
容量瓶中。
③用少量蒸馏水冲洗 2~3 次,将冲洗液移 入 容量瓶 中,在操作过程中不能损失点滴 液体,否则会使溶液的浓度偏 低 (高或 低)。 ④向容量瓶内加水至刻度线 1~2厘米 时,改 用 胶头滴管 小心地加水至溶液凹液面与刻 度线相切,若加水超过刻度线,会造成 溶液浓度 偏低 ,应该 重新配制 。 ⑤最后盖好瓶盖, 摇匀 ,将配好的溶液移 入 试剂瓶 中并贴好标签。
3、定溶误差 8)定容时仰视刻度
9)定容时俯视刻度 10)定容时液面低于刻度线 11)未等溶液冷却就定容 12)定容后发现液面高于刻度线 后,用滴管吸出少量溶液
13)摇匀后发现液面低于刻度再加水
本节小结
1、溶液的配置(稀释)
算称量取步骤清,溶解转移再定容用18mol/L(98%) 的浓硫酸配制250ml 1mol/L 的H2SO4溶液,其步骤有哪些?
溶液配制实验报告步骤(3篇)

第1篇一、实验目的1. 掌握溶液配制的基本原理和操作方法。
2. 学会使用托盘天平、移液管、容量瓶等实验器材。
3. 熟悉标准溶液的配制方法。
二、实验原理溶液配制是指将溶质溶解在溶剂中,形成一定浓度的溶液。
根据溶质和溶剂的量比,溶液可分为以下几种类型:1. 质量百分比浓度:溶质的质量与溶液总质量之比。
2. 体积百分比浓度:溶质的体积与溶液总体积之比。
3. 摩尔浓度:单位体积溶液中溶质的摩尔数。
三、实验器材1. 托盘天平2. 移液管3. 容量瓶4. 烧杯5. 玻璃棒6. 滴管7. 溶质(如NaCl、KCl等)8. 溶剂(如蒸馏水)四、实验步骤1. 准备工作(1)将实验器材洗净、擦干,并检查其完好性。
(2)根据实验要求,称取一定质量的溶质。
(3)将溶质放入烧杯中。
2. 溶解(1)向烧杯中加入适量溶剂,用玻璃棒搅拌,使溶质充分溶解。
(2)溶解过程中,注意观察溶质的溶解情况,避免过度搅拌导致溶质沉淀。
3. 转移溶液(1)将溶解后的溶液通过滴管转移到容量瓶中。
(2)转移过程中,注意不要将烧杯壁上的残留物带入容量瓶。
4. 定容(1)向容量瓶中加入溶剂,直至接近刻度线。
(2)用滴管滴加溶剂,使液面与刻度线相切。
(3)盖上瓶塞,轻轻摇匀溶液。
5. 标签贴纸(1)在容量瓶上贴上标签,注明溶液名称、浓度、配制日期等信息。
(2)将配制好的溶液放入试剂柜中保存。
五、实验注意事项1. 称取溶质时,注意准确称量,避免误差。
2. 溶解过程中,避免过度搅拌,以免溶质沉淀。
3. 转移溶液时,注意不要将烧杯壁上的残留物带入容量瓶。
4. 定容时,注意液面与刻度线相切,避免过量或不足。
5. 标签贴纸要清晰,便于识别。
六、实验数据记录1. 溶质质量(g)2. 溶剂体积(mL)3. 溶液浓度(mol/L)七、实验结果分析根据实验数据,计算溶液的浓度,并与理论值进行比较,分析误差产生的原因。
八、实验总结通过本次实验,掌握了溶液配制的基本原理和操作方法,熟悉了实验器材的使用。
配制溶液实验报告
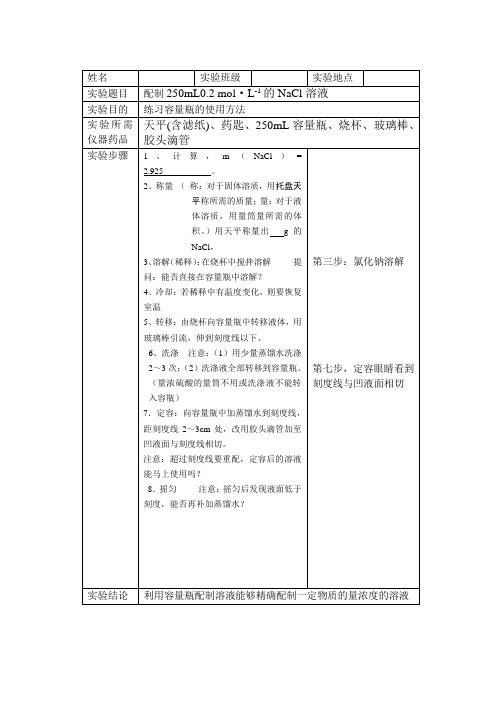
实验班级
实验地点
实验题目
配制250mL0.2 mol·L-1的NaCl溶液
实验目的
练习容量瓶的使用方法
实验所需仪器药品
天平(含滤纸)、药匙、250mL容量瓶、烧杯、玻璃棒、胶头滴管
实验步骤
1、计算,m(NaCl)=2.925。
2、称量(称:对于固体溶质,用托盘天平称所需的质量;量:对于液体溶质,用量筒量所需的:在烧杯中搅拌溶解提问:能否直接在容量瓶中溶解?
4、冷却:若稀释中有温度变化,则要恢复室温
5、转移:由烧杯向容量瓶中转移液体,用玻璃棒引流,伸到刻度线以下、
6、洗涤注意:(1)用少量蒸馏水洗涤2~3次;(2)洗涤液全部转移到容量瓶。(量浓硫酸的量筒不用或洗涤液不能转入容瓶)
7.定容:向容量瓶中加蒸馏水到刻度线,距刻度线2~3cm处,改用胶头滴管加至凹液面与刻度线相切。
注意:超过刻度线要重配,定容后的溶液能马上使用吗?
8.摇匀注意:摇匀后发现液面低于刻度,能否再补加蒸馏水?
第三步:氯化钠溶解
第七步,定容眼睛看到刻度线与凹液面相切
实验结论
利用容量瓶配制溶液能够精确配制一定物质的量浓度的溶液
容量瓶的使用和氢氧化钠标准溶液的配制实训报告

容量瓶的使用和氢氧化钠标准溶液的配制实训报告一.实验目的:1.培养同学们“通过实验手段用已知测未知”的实验思想。
2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤.3.实现学习与实践相结合。
二.实验仪器及药品:仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL 锥形瓶两个。
药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。
三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手段,用已知测未知。
即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。
酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。
本实验用草酸(二水草酸)作基准物。
⑴氢氧化钠溶液标定:H2C2O4+2NaOH=Na2C2O4+2H2O 反应达到终点时,溶液呈弱碱性,用酚酞作指示剂。
(平行滴定两次)⑵盐酸溶液标定:HCl+NaOH=NaCl+H2O反应达到终点时,溶液呈弱酸性,用甲基橙作指示剂。
(平行滴定两次)四.实验内容及步骤:1.仪器检漏:对酸(碱)滴定管进行检漏2.仪器洗涤:按要求洗涤滴定管及锥形瓶,并对滴定管进行润洗3.用移液管向两个锥形瓶中分别加入10.00mL草酸(二水草酸),再分别滴入两滴酚酞.向碱式滴定管中加入药品至零刻线以上,排尽气泡,调整液面至零刻线,记录读数。
4.用氢氧化钠溶液滴定草酸(二水草酸)溶液,沿同一个方向按圆周摇动锥形瓶,待溶液由无色变成粉红色,保持30秒不褪色,即可认为达到终点,记录读数。
5.用移液管分别向清洗过的两个锥形瓶中加入10.00 mL氢氧化钠溶液,再分别滴入两滴甲基橙。
简述用容量瓶配制一定浓度溶液的操作步骤。

简述用容量瓶配制一定浓度溶液的操作步骤。
引言:在化学实验和工业生产中,常常需要配制一定浓度的溶液。
容量瓶是一种常用的实验器皿,可以用来精确地配制一定浓度的溶液。
下面将详细介绍用容量瓶配制一定浓度溶液的操作步骤。
一、准备工作1. 确定所需溶液的浓度和体积,根据实验要求选择合适的容量瓶。
2. 准备所需溶质和溶剂,并将它们分别装在干净的容器中。
二、操作步骤1. 将容量瓶洗净并用去离子水冲洗,确保容量瓶内壁干净无杂质。
2. 用洗净的容量瓶取一定体积的溶剂,如去离子水或稀酸。
3. 将容量瓶摆放在水平台上,通过观察液面在刻度线上的位置来调整液面高度,使其与刻度线平齐。
4. 使用滴管将溶质缓慢地加入到容量瓶中,直至液面达到刻度线上。
在加入溶质时要小心,避免溅出或溶质过量。
5. 用洗净的滴管将溶质溶解均匀,可以轻轻摇晃容量瓶,避免产生气泡。
6. 将溶液量到刻度线上,使液面与刻度线平齐。
这时可以使用准确的量烧杯或滴定管,逐滴加入溶液,直至液面达到刻度线上。
7. 关闭容量瓶的塞子,用手指捏住塞子,轻轻颠瓶,使溶液充分混合均匀。
8. 清洗容量瓶外表面,确保无溶液残留。
三、注意事项1. 在操作过程中,要注意实验室的安全,佩戴实验手套和护目镜。
2. 需要使用干净的容量瓶和滴管,以避免杂质影响溶液的浓度。
3. 在加入溶质时要小心,避免溅出或溶质过量。
4. 在加入溶质后,要充分溶解均匀,可以轻轻摇晃容量瓶,避免产生气泡。
5. 配制溶液时要注意液面与刻度线的平齐,可以使用准确的量烧杯或滴定管逐滴加入溶液。
6. 混合溶液时要轻轻颠瓶,使溶液充分混合均匀。
7. 配制完溶液后,要清洗容量瓶外表面,确保无溶液残留。
四、实例例如,我们需要配制体积为500 mL的0.1 mol/L的盐酸溶液。
首先,准备所需的溶质盐酸(HCl)和溶剂去离子水。
然后,取一个干净的500 mL容量瓶,用去离子水冲洗并排空。
接下来,用准确的量烧杯或滴定管,将约250 mL的去离子水加入容量瓶中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定义:以单位体积溶液里所含溶质B的
物质的量来表示溶液的组成的物理量,
叫做溶质B的物质的量浓度。
符号:cB
表达式:cB=
nB V
单位:mol/L或mol/m3
含义:在1L溶液中含有1mol的溶质, 这种溶液中溶质的物质的量浓度就是 1mol/L。
溶质单位 溶液单位
物质的量浓度 mol
L
公式 cB= nB / V
用滤纸,NaOH等具腐蚀性的应用小烧杯
2、步骤及所用仪器
③溶解:将溶质倒入烧杯中,加入适量 的水搅拌溶解,冷却致室温.
某同学为了加快溶解 速度,溶解时所加的水为 150mL,你认为可以吗?
不可以,只能用适量
2、步骤及所用仪器
④转移和洗涤:将上述冷却后的溶液
转入指定容积的容量瓶,并用蒸馏水
洗涤小烧杯和玻璃棒2—3次,将洗涤
2、从1L 3mol/L的NaOH溶液中取出 50mL,则取出的溶液中溶质的物质的 量浓度是多少?
课堂练习
3、10mL 1mol/L的硫酸溶液比100mL1mol/L 的硫酸溶液的浓度小。这种说法是否正确, 为什么?
4、现有0.2mol/L的K2SO4溶液,当取 此溶液1L时,K+离子浓度是0.4mol/L, 当取此溶液2L时,SO42-离子的浓度为 0.4mol/L。这样说对吗?
液一并注入容量瓶。
为什么
如何将烧杯 中的液体转移到 容量瓶中?
讨论:
下列溶液中Na+的物质的量浓度最大的
是: B
A、100mL 1mol/L的NaCl溶液
B、100mL 1mol/L的Na2SO4溶液 C、100mL 0.5mol/L的Na3PO4溶液 D、400mL 0.5mol/L的Na2SO4溶液
❖ 4.标准状况下,v L气体溶于1L水中,所得
溶液的密度为p(g·ml-1),p(H2O)取1 g·ml-1, 则所得溶液的物质的量浓度是多少?
知识回顾:N,n,m,V之间的相互
转化
N ÷NA n ×M m
×NA
÷M
×22.4 ÷22.4
(标况) (标况)
V
(气体)
物质的量浓度
高一·二部化学组
邵国
❖正确理解和掌握物质的量浓度的概 念,学会有关物质的量浓度的计算.
❖通过物质的量浓度及其有关计算的 教学,培养分析推理、解题归纳的 能力.
❖ 学会配制一定物质的量浓度的溶液。
mol NaCl,则1 L NaCl溶液中含NaCl
(
1 ) mol
(2) 已知在2LNaOH溶液中含有4mol
NaOH,则1 L NaOH溶液中含 NaOH
(
2
) mol
(3) 已知在4L H2SO4溶液中含有
12mol H2SO4,则1 L H2SO4溶液中含
H2SO4(
3
) mol
一、物质的量浓度
解题思路:1.气体的物质的量 2.溶液的体积 3.物质的量浓度
课堂小结
V(气体体积)
÷Vm
×Vm
m ÷M
n
×NA
N
×M
÷NA
质量 ×V(aq) ÷V(aq) 粒子数目
cB(溶液)
容量瓶的规格
常用的有:
的所 容配 量溶配 瓶液制 进体溶 行积液 配相时 液等, .或选
稍用 大和
50ml. 100ml. 250ml. 500ml. 1000ml
运用物质的量浓度的概念计算
课堂练习
1、下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+ 的物质的量浓度相等的是
D
A、200mL0.5mol/LNaCl溶液 B、100mL1mol/LNa2CO3溶液 C、100mL0.5mol/LNa3PO4溶液 D、1L1mol/LNaOH溶液
2、在200mL某硫酸盐溶液中,含硫酸根离子1.5NA 个,含金属离子NA个,则该硫酸盐溶液的物质的量 浓度为 A
2.步骤及所用仪器 ①计算
❖nNaCl=0.1L×0.4mol·L-1=0.04mol
❖mNaCl=0.04mol×58.5g·mol-1=2.34g
❖ 实际用托盘天平称量的质量为多少?
2、步骤及所用仪器
②称量(用托盘天平称取固体溶质的 质量或用量筒量取液体溶质的体积)
称量时能将NaCl固体 直接放置于托盘上吗?
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形 成均一的、稳定的混合物,叫做溶液。 溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数=
溶质质量 溶液质量
×100%
3、稀释原则: 稀释前后,溶质的质量不变ຫໍສະໝຸດ m1 w1 = m2 w2
(1) 已知在0.5L NaCl溶液中含有0.5
容量瓶的使用注意事项
❖ 一。不能直接用容量瓶进行溶解或稀释,也不 能做反应器或者被加热,也不能长时间储存溶 液(容量瓶是量器,不是容器)
❖ 二。容量瓶容积是在瓶身所标温度下确定的, 不能将热溶液转移入容量瓶
❖ 三。一种容量瓶只能配制一定体积的溶液 ❖ 四。使用前检查是否漏水
检查方法
❖ 往瓶内加水,塞好瓶塞,用食指顶住瓶塞, 另一只手托住瓶底,把瓶倒立过来,观察瓶 塞周围是否有水漏出,如不漏出,把瓶塞旋 转1800塞紧,仍把瓶倒立过来,再检查是否 漏水。
溶质的质量分数 g g
W=m质/m液 ×100%
特点
体积相同,物质 的量浓度相同的 溶液中,所含溶 质物质的量相同, 但溶质质量不同。
质量相同,溶质质 量分数相同的溶液 中,所含溶质的质 量相同,但溶质的 物质的量不同
课堂练习
1、将40g NaOH溶于2L水中配成溶液, 其物质的量浓度为0.5mol/L。这样叙述 是否正确?为什么?
A、2.5mol/L
B、5mol/L
C、7.5mol/L
D、2mol/L
3、1mol/L的Na2SO4溶液是 BD A、溶液中含有1molNaSO4 B、1L溶液中含有142gNa2SO4 C、1molNa2SO4溶于1L水中 D、将322gNa2SO4.10H2O溶于少量水后再稀释成 1000mL。
思考:
如何配制100ml 0.4mol/L的NaCl溶液? 先计算,后配制
归纳:1、实验过程中需要什么仪器? 2、实验步骤如何进行?
实
实
误
验
验
差
仪
步
分
器
骤
析
1、主要实验仪器
托盘天平、量筒(可有可无)、 烧杯、玻璃棒、 100ml容量瓶、 胶头滴管、
2、步骤及所用仪器
① 计算 ② 称量(托盘天平) ③ 溶解(烧杯、玻璃棒) ④ 转移和洗涤( 容量瓶、玻璃棒) ⑤ 摇匀 ⑤ 定容(胶头滴管) ⑥ 振荡 ⑦ 装瓶贴签
