PE袋初包装封口验证报告
PE袋初包装封口验证报告

PE袋初包装封口验证报告一、引言PE袋作为一种常见的包装材料,在日常生活中应用广泛。
为了确保PE袋的初包装封口的质量和可靠性,本实验对PE袋的初包装封口进行了验证,以评估其性能,以便为生产提供科学依据。
二、实验目的本实验的目的是验证PE袋的初包装封口是否能够达到要求,检测其密封性能,确保产品的质量。
三、实验方法1.实验仪器与材料(1)PE袋:尺寸为10cm×15cm,厚度为0.03mm。
(2)密封机:型号为XX,供应商为XX公司。
(3)压力表:量程为0-1MPa,分辨率为0.01MPa。
(4)滑动尺、手动焊接机等。
2.实验步骤(1)准备PE袋和实验仪器。
(2)根据产品要求,调整密封机的温度和压力设置。
(3)将待测试的PE袋放入密封机,在调整好的温度和压力下进行初包装封口。
(4)取下密封好的袋子,使用滑动尺测量封口宽度和长度。
(5)使用手动焊接机切割掉已封口的部分,开口后用压力表测量袋子内外的压力差。
四、实验结果与分析根据实验步骤进行多次重复实验,记录了每次实验的结果。
下表是不同次数实验的封口宽度和长度的数据结果。
实验次数,封口宽度/mm,封口长度/mm:----:,:--------:,:--------:1,8.9,14.82,9.2,14.63,9.0,14.94,9.1,14.75,9.3,14.8从数据中可以看出,实验结果的封口宽度和长度基本上保持在9mm和14.8mm左右。
封口的宽度和长度符合产品要求,说明密封机的温度和压力设置基本正确。
在开口后测量袋子内外的压力差时,多次实验的结果如下:实验次数,压力差/MPa:----:,:-------:1,0.032,0.023,0.034,0.025,0.03实验结果显示袋子内外的压力差都在0.02-0.03MPa之间,符合要求的范围,说明初包装封口的密封性能良好。
五、结论通过对PE袋初包装封口的验证实验,得出以下结论:1.袋子的封口宽度和长度基本符合产品要求,达到了密封机的要求。
无菌包装封口效果验证报告

文件类型:验证文件文件名称:无菌包装封口效果验证报告文件编号:使用部门:生产部1.验证目的通过确认证明产品经过内包装后,是否能达到规定的要求,确认包装过程是否安全有效。
通过一系列试验和文件记录,证实封口机可以持续提供可被接受的无菌包装封口过程。
2.验证范围2.1适用于本公司*****封口机的验证2.2纸塑包装袋上海浦茂包装材料有限公司提供的1073B+10丝进口易撕袋与1059B+6丝进口易撕袋。
技术参数见供应商提供的《产品质量检验报告单》。
3.概述封口机技术参数3.1封印速度:10m/min3.2封印温度:80-220°C3. 3封印压缝宽:12mm3. 4 电源:220V/50HZ3. 5 外形尺寸:620X260X250mm3. 6 重量:23KG3.7国产滚轮尺寸:宽X深X高=830X280X60mm4.验证小组及成员5.确认依据5. 1 GB/T19633-2005《最终灭菌医疗器械的包装》屏障系统和包装系统要求》5.3 IS011607-2: 2006《最终灭菌医疗器械的包装一第二部分:形成、密封和装配的确认要求》装的密封泄露》泡法)》GB/T4857. 10-2005正弦变频振动试验 5.22中国药典2019版 5.23 ISO 11135-1:2014环氧乙烷灭菌医疗器械确认和控制5.4 YY/T 0681.1-2009 无菌医疗器械包装试验方法第1部分:加速老化试验指南 5.5 YY/T 0681.2-2010《无菌医疗器械包装试验方法第2部分:软性屏障材料密封强度试验》5.6 YY/T 0681.3-2010《无菌医疗器械包装试验方法第3部分: 无约束包装抗内压破坏试验》5.7 YY/T 0681.4-2010《无菌医疗器械包装试验方法第4部分: 染色液穿透法测定透气包5.8 YY/T 0681. 5-2010《无菌医疗器械包装试验方法第5部分: 内压法检测粗大泄漏(气5.9 ASTM F 1929中规定的试验方法检查密封口的密封渗漏性, 封口应完整5. 10 ASTM F1886-98目力检测方法5. 11 DIN 58953-6: 2006琼脂接触攻击试验 5. 12 ASTM F1929-98染料渗漏试验 5. 13 ASTM Fl 140-07爆破试验 5. 14 ASTM F88-09封口剥离试验 5. 15 ASTM F2096-04气泡试验 5. 16 ASTM F1886-2009目视检测试验5. 17 GB/T4857. 2-2005温湿度处理试验 5. 185. 19 GB/T4857. 5-1992 跌落试验5.20 EBJS-TS-014《包装物资采购及检验标准》5.21 《产品初始污染菌操作规程》6无菌包装封口过程确认的过程一般应包括安装确认,运行确认和性能确认。
封口验证报告(模板)

封口验证报告目录1.验证目的 (1)2.验证范围 (1)3.验证依据 (1)4.人员职责 (1)5.设备、包装材料介绍 (1)5.1封口机的描述 (1)5.2包装材料说明 (2)6.灭菌过程描述 (2)7.步骤确认 (2)8.安装确认 (3)8.1设备信息 (3)8.2安装条件 (3)8.3文档 (3)8.4安全性能 (3)8.5设备核实 (4)8.5临界参数 (4)8.6日常维修保养 (4)8.7报警和警示 (4)8.8人员资格 (4)9.运行确认 (5)9.1包装材料成形和密封过程的适应性 (5)10.性能确认 (10)10.1参数信息 (10)10.2实际运行包装的验证 (10)11.过程的控制与监视 (11)12.过程更改和重新验证 (12)13验证批准 (12)附件1:特卫强透析袋生产厂家资质及材质检验报告 (13)附件2:封口作业指导书 (13)附件3:封口机安装确认表 (13)附件4:设备日常维修保养记录 (13)附件5:封口机自检报告 (13)附件6:培训考核记录 (13)封口验证报告■初次验证□再次验证1.验证目的为了验证封口机设备能安全和有效地进行封口包装,并确保产品在使用前的有效性和安全性。
2.验证范围本验证报告适用于封口验证,此产品系列型号仅用一种灭菌屏障包装。
3.验证依据依据灭菌屏障封口验证方案。
4.人员职责5.设备、包装材料介绍本次验证使用的设备有高速自动吸塑封口机,设备编号:QY-SC-010,设备安装在净化车间内。
5.1封口机的描述5.2包装材料说明6.灭菌过程描述7.步骤确认8.安装确认8.1设备信息8.2安装条件8.3文档8.4安全性能8.5设备核实8.5临界参数8.6日常维修保养8.7报警和警示8.8人员资格9.运行确认9.1包装材料成形和密封过程的适应性此项性能指标检查结果如下表:9.1.1包装封口后的外观确认9.1.3包装完整性测试确认(染剂渗漏实验)9.1.4最佳封口参数确认报告10.性能确认10.1参数信息10.2实际运行包装的验证根据OQ的验证结果,选择封口温度范围120±2℃,时间控制在2.5±0.2S,进行3个批10.3验证结论封口温度范围120±2℃,时间控制在2.5±0.2S条件下,密封性能的测试CP值≥1,一次性举宫器封口包装要求。
医疗器械纸塑袋包装封口工艺验证方案和验证报告

医疗器械纸塑袋包装封口工艺验证方案和验证报告一、目的和范围本验证方案旨在确保医疗器械纸塑袋包装封口工艺的可靠性和一致性。
本验证方案适用于所有使用纸塑袋包装的医疗器械,包括但不限于一次性使用医疗器械、高值耗材和诊断试剂等。
二、验证方案1.验证目的:确保纸塑袋包装封口工艺满足产品质量要求,提高产品在储存、运输和使用过程中的稳定性。
2.验证项目:包装材料、封口工艺参数、实验设计和操作、数据分析和解释。
3.验证方法:采用实验室试验和现场检查相结合的方法进行验证。
4.验证计划:制定详细的验证计划,包括验证时间、人员、设备、样品和测试方法等。
5.验证流程:按照验证计划进行实验,记录实验数据,并对数据进行统计和分析。
6.验证总结:根据实验结果和数据分析结果,得出验证结论,并提出改进建议。
三、包装材料1.纸塑袋:选择符合国家标准的食品级材料,确保无毒、无味、无菌。
2.封口胶:选择具有良好粘合性和卫生性能的封口胶,确保封口牢固、防水、防潮。
四、封口工艺参数1.温度:根据纸塑袋和封口胶的特性,选择适宜的温度进行封口,确保封口牢固、美观。
2.时间:根据温度和封口胶的特性,确定最佳的封口时间,确保封口牢固、均匀。
3.压力:选择适当的压力进行封口,确保封口胶能够充分渗透到纸塑袋之间,达到良好的粘合效果。
五、实验设计和操作1.实验样品:选取不同规格、类型的医疗器械,分别采用相同的纸塑袋和封口胶进行包装和封口。
2.实验环境:确保实验环境符合产品质量要求,包括温度、湿度、清洁度等。
3.实验操作:按照规定的操作流程进行实验,记录每个样品的封口温度、时间、压力等参数。
4.数据记录:对每个样品的包装质量、封口强度、密封性等进行检测和记录。
六、数据分析和解释1.数据处理:对记录的数据进行统计和分析,包括平均值、标准差等。
2.结果解释:根据数据分析结果,评估纸塑袋包装封口工艺的可靠性和一致性。
如有问题,提出改进建议。
3.报告撰写:根据实验结果和数据分析结果,撰写验证报告,总结验证过程和结果,并提出改进建议。
PE袋初包装封口验证报告

PE袋初包装封口验证报告文件编号:YWY/G-01-2015C/0编制:日期:审核:日期:批准:日期:验证时间:第一章总则1.1.验证目的根据ISO13458-2003(YY/T0287-2003)标准中“当生产和服务提供过的输出不能由后续的监视或测量加以验证时,组织应对任何这样的过程实施确认”。
为此针对本公司生产的无菌医疗器械产品的初包装的工艺过程进行验证,使产品的单只包装符合GB/T19633-2005(ISO11607)《最终灭菌医疗器械的包装》标准的相关要求,同时对包装所用的材料和设备仪器进行验证。
1.2 范围1.2.1本验证适用于本公司生产的一次使用无菌医疗器械产品的PE成型袋的包装验证。
所涉及的产品有:(1)、一次性使用无菌吸痰管;(2)、一次性使用无菌导尿管;(3)、一次性使用无菌胃管;(4)、一次性使用无菌喂食管;(5)、一次性使用无菌肛门管;(6)、一次性使用无菌婴儿尿袋;(7)、一次性使用无菌引流袋;1.2.2本次验证用的设备为自动热合封口机,设备的编号为:YS—29,安装在净化车间内。
1.2.3初包装材料本次确认使用的材料为PE复合膜,单层厚度为0.05mm,材料的技术参数由供应商提供。
由于初包装材料及热合封口的工艺及设备已被生产实践所确定,所以本次的验证采用回顾性验证,在热合封口统计分析的基础上,证实初包装热合封口的生产工艺条件适用性的验证1.3 验证1.3.1验证方案:由本公司技术部制定,报管理者代表审批后方可实施。
1.3.2验证实施:由相关职能部门的人员组成验证小组,管理者代表负责按验证方案组织实施。
1.3.3验证资料:所有有关验证的资料、所取得的数据、记录和验证报告由技术部汇编并存档。
1.3.4依据文件:(a)、ISO11607-1::2006《最终灭菌医疗器械的包装第一部分:材料无菌屏障系统、包装系统的要求》;(b)、ISO11607-2:2006《最终灭菌医疗器械的包装第二部分:成型密封和组装过程的确认》;(c)、GB/T2828.1-2008;(d)、包装热封操作规程;(e)、医用PE袋质量标准(供方提供);(f)、产品初始污染菌检测操作规程;(g)、封口机使用说明书;第二章验证方案2.1PE初包装袋热合封口工艺相关要求的识别;初包装的热合封口能否达到规范的要求,取决于以下要素:(a)小包装的材质及其性能;(b)封口热合的温度;(c)热合封口的速度;(d)热合封口的设备;(e)生产环境、操作人员的技能。
PE包装袋检验记录

记录编号:SOR-ZL-060-A/0
第 1 页 共 1 页 包材检验记录
检验报告书编号:
品 名
PE 包装袋 物料代码 NB001 检品批号 检品数量 检验目的 检品来源 取样日期
年 月 日 报告日期 年 月 日 检验依据 包材质量标准
【外观】:
取本品,平摊于黑色干净的实验台面上,于光线明亮处目视观察:
本品□有□无异物(如虫类、毛发),□有□无杂质或污点,□有□无破损,□有□无色差。
结论:□符合规定 □不符合规定(规定:产品无异物(如虫类、毛发),无杂质或污点,无破损,无色差。
)
检验人: 年 月 日 复核人: 年 月 日
【气味】:
取本品,将鼻子凑近产品,产品□有□无刺鼻气味、□有□无异味,□有□无令人不愉快的气味。
结论:□符合规定 □不符合规定(规定:产品无刺鼻气味,无异味,无令人不愉快的气味。
) 检验人: 年 月 日 复核人: 年 月 日
【渗漏性能】:
取本品,将水装入袋中,观察 1 分钟,□有□无渗漏。
结论:□符合规定 □不符合规定(规定:将水装入袋中,观察 1 分钟,应不能有任何渗漏。
) 检验人: 年 月 日 复核人: 年 月 日
结论:本品按包材质量标准检验,结果:□符合规定□不符合规定。
通过审核-包装验证报告模板

包装验证报告***************医疗科技有限公司包装工序工艺验证报告一、验证目的:确认最佳包装工艺参数,确保产品质量达到标准要求。
二、验证依据:《作业指导书》、《检验规程》三、验证日期:购买后加Q2742294118,发完整word版,多年实操经验,体系建立、产品注册服务。
四、验证人员资格确认参与验证的化验室人员****************************并取得了化验员资格证书,具备检验资格。
五、安装确认5.1安装确认(IQ)经确认,连续封口机安装基本情况均符合要求。
见表1;所有仪器量具均经过校验合格且在有效期之内,具体确认信息见表2;附表1:连续封口机安装确认表编号:***************编制:审核:批准:日期:附表2:仪表校验信息表六、运行确认(OQ)6.1包装材料的选择评价6.1.1包装材料的物理和化学特性a.评价目的可供选择的包装材料基本的物理、化学性能符合产品要求。
b.评价项目对包装材料进行物理特性、化学特性的评价。
c.判定标准通过供应商资质,详见附件。
6.1.2包装材料的毒理学特征a.评价目的确认包装材料应不释放出足以损害健康的毒性特质。
b.评价项目对包装材料进行毒理学测试。
c.评价方法通过确认供应商提供的检测报告。
6.1.3包装材料与成型和密封过程的适应性。
a.评价目的确认包装材料与成型和密封过程的适应性。
b.评价项目外观、热封强度、包装完整性。
c.外观检查由具有正常视力(或矫正视力)的检测人员肉眼或放大镜观察:1)最终包装外表面规整(无明显污物、脏点、变色、破漏等缺陷)为接受标准;2)对开启后的包装外来物质、无菌屏蔽材料内表面的不规整、密封特性、湿气、水分、水印。
d.热封强度测试参考YY/T 0698.5-2009 第4.5条,指定样品灭菌前后的热封强度必须达到依据产品包装方式和采用的包装材料所确定的标准,对于本产品,热封强度值取不小于30N/15mm。
PE袋热合包装工艺验证文件

PE包装及包装效果确认方案起草/日期:审核/日期:批准/日期:1目的2范围3依据文件4确认小组成员及职责5确认内容6过程确认方案申请本方案的目的在于对本公司外科防护口罩等产品的初包装设备、包装封口机进行热合包装过程确认,以确保能提供安全有效的包装工艺。
2范围2.1设备:本次验证确认的设备为多功能薄膜封口机,内部设备编号为WS-23,主要用于外科防护口罩等产品的热合包装。
2.2材料:本次确认使用的材料为普通PE袋材料的技术参数详见供应商提供的资料。
2. 3本次确认过程由三部门组成:质量部、生产部、技术部2. 3. 1确认设备的功能操作2. 3.2确认当设备运行于常规条件、上限条件、下限条件时的封合过程,0Q过程需要对产品的封合过程和/或样品的封合过程进行评估,0Q的评估应包括产品在灭菌前和灭菌后性能的比较结果。
2.4封口过程:预热设备后,将含有产品的PE袋放上输送带入口,在相应参数条件下进行热封操作, 形成单个产品。
本次确认过程将通过调整温度工艺参数的范围设定,进行比较包装效果, 寻找最合适的参数范围。
根据厂家的指导文件,热封温度240°C作为温度范围的中间值、3. 1 13011607-1:2009《最终灭菌医疗器械的包装第1部分:材料、无菌屏障系统、包装系统的要求》3.2 18011607-2:2006《最终灭菌医疗器械的包装第2部分:成形、密封和组装过程的确认要求》3. 3 HS/QP-001-010《生产和服务提供控制程序》3.4连续封口机操作维护保养规程3.5医用透析纸质量标准、医用灭菌袋质量标准3.6产品初始污染菌检测操作规程3. 7连续封口机使用说明书4确认小组成员5确认内容5.1安装确认(IQ)5. 1. 1连续封口机设备的相关资料文件的确认通过核查连续封口机的使用说明书、产品合格证、维护保养计划、常见故障与排除一览表、备用配件表等相关资料文件和供应商相应资质证明等。
确定其满足合同或供应商的随机文件以及满足其技术要求。
PE袋初包装封口验证报告

PE袋初包装封口验证报告文件编号:YWY/G-01-2022C/0日期:日期:日期:验证时间:第一章总那么.验证目的依据IS013458-2022(YY/T0287-2022)标准中“当生产和效劳供给过的输出不能由后续的监视或测量加以验证时,组织应对任何这样的过程实施确认”。
为此针对本公司生产的无菌医疗器械产品的初包装的工艺过程进展验证,使产品的单只包装符合GB/T19633-2022(IS011607)《最终灭菌医疗器械的包装》标准的相关要求,同时对包装所用的材料和设备仪器进展验证。
1.1范围本验证适用于本公司生产的一次使用无菌医疗器械产品的PE成型袋的包装验证。
所涉及的产品有:无菌医疗器械小包装封口渗漏试验记录(附件4/2)无菌医疗器械小包装验证包装封口渗漏验证确认(附件4/2-1)验证目的:确认无菌医疗器械小包装材料的有效性验证要求:热合封口密封牢靠、无渗漏验证依据:ISO11607-1. 2验证人员:刘晨敏、胥春美产品名称:一次性使用无菌吸痰管规格:CN/FR 16包装型式:0全塑口硬吸塑生产批号:验证工程:小包装渗漏试验验证方法:见小包装渗漏试验记录相关文档:无菌医疗器械小包装封口渗漏试验记录不合格描述:验证结论:口合格口不合格验证人:胥春美日期:2022 . 03. 27审核结论:合格□不合格审核人:刘晨敏日期:2022 .03.27无菌医疗器械小包装验证小包装透析纸(PE)膜阻菌性验证(PE复合膜阻菌性验证(附件5)验证目的:确认无菌医疗器械小包装材料的有效性验证要求:包装材料(透析纸/PE复合膜)对粘质沙雷氏均能阻入验证依据:IS011607-1. 2GB/T14233. 2验证人员:刘晨敏、胥春美产品名称:一次性使用无菌吸痰管规格:CN/FR 16包装型式:口纸塑口全塑口硬吸塑生产批号: 验证工程:小包的有效性;阻菌性试验验证方法:见PE 复合膜阻菌性验证记录相关文档:无菌医疗器械PE复合膜阻菌验证记录不合格描述:验证结论:2合格□ 不合格验证人:胥春美日期:2022 . 04. 05审核结论:口合格口不合格审核人:刘晨敏日期:2022 . 04. 05小包装透析纸、PE复合膜阻菌性验证记录(附件5/1)包装材料与标签系统相适应性试验(附件7)验证目的:确认包装材料与所印刷标签系统相适应性验证要求:包装材料印刷标签后经环氧乙烷灭菌应无变化验证依据:IS0H607-1验证人员:刘晨敏、胥春美产品名称:一次性使用无菌吸痰管规格:CN/FR 16包装型式:口纸塑D全塑口硬吸塑灭菌日期:2022 .03. 25 验证.工程:小包材料与标签系统相适应性试验验证方法:用目测的方法比照灭菌前与灭菌后小包装上所印刷的标签是否发生变化。
新PE袋塑料包装袋检验标准

********* PE袋/塑料包装袋检验标准
1、目的和适用范围:
适用于食品用塑料包装袋的进货检验。
2、标准内容:
2.1塑料袋表面干净,无损伤、松弛和异物附着,无脱层及其他异常情况。
2.2塑料袋透明度较好,表面平整,无活褶,无明显“爆筋”。
2.3袋和袋之间无粘连。
2.4开口性较好,易于揭开。
2.5塑料袋封口处不漏气
打开袋口盛满空气,扎紧袋口,强击塑料袋,塑料袋不得出现封口处破裂。
2.6裁剪分切整齐,不得带有毛刺.
2.7印刷图字清晰无误,深浅一致,印刷色泽不漏底,着色牢固,位置准确,与订货图纸或校定稿规定的内容、色泽和尺寸等要求一致。
塑料袋尺寸允许偏差见表1。
3、抽样及判定
3.1抽样见表2
*********
<1000 1000-30000 30000以上
3.2判定
标准内容所列各项,其中任一项不合格则判定不合格。
4、理化指标
4.2判定
标准内容所列各项,其中任一项不合格则判定不合格。
*********
4.3物理性能
4.4判定标准要求不允许虚封、开口 100℃30分钟水煮无破袋、无脱层牢固度蒸煮试验抽空试验抽真空后24小时无漏气
标准内容所列各项,其中任一项不合格则判定不合格。
核准:审核:制作:。
PE袋热合包装工艺验证文件

PE包装及包装效果确认方案起草/日期:审核/日期:批准/日期:1目的2范围3依据文件4确认小组成员及职责5确认内容6过程确认方案申请本方案的目的在于对本公司外科防护口罩等产品的初包装设备、包装封口机进行热合包装过程确认,以确保能提供安全有效的包装工艺。
2范围2.1设备:本次验证确认的设备为多功能薄膜封口机,内部设备编号为WS-23,主要用于外科防护口罩等产品的热合包装。
2.2材料:本次确认使用的材料为普通PE袋材料的技术参数详见供应商提供的资料。
2. 3本次确认过程由三部门组成:质量部、生产部、技术部2. 3. 1确认设备的功能操作2. 3.2确认当设备运行于常规条件、上限条件、下限条件时的封合过程,0Q过程需要对产品的封合过程和/或样品的封合过程进行评估,0Q的评估应包括产品在灭菌前和灭菌后性能的比较结果。
2.4封口过程:预热设备后,将含有产品的PE袋放上输送带入口,在相应参数条件下进行热封操作, 形成单个产品。
本次确认过程将通过调整温度工艺参数的范围设定,进行比较包装效果, 寻找最合适的参数范围。
根据厂家的指导文件,热封温度240°C作为温度范围的中间值、3. 1 13011607-1:2009《最终灭菌医疗器械的包装第1部分:材料、无菌屏障系统、包装系统的要求》3.2 18011607-2:2006《最终灭菌医疗器械的包装第2部分:成形、密封和组装过程的确认要求》3. 3 HS/QP-001-010《生产和服务提供控制程序》3.4连续封口机操作维护保养规程3.5医用透析纸质量标准、医用灭菌袋质量标准3.6产品初始污染菌检测操作规程3. 7连续封口机使用说明书4确认小组成员5确认内容5.1安装确认(IQ)5. 1. 1连续封口机设备的相关资料文件的确认通过核查连续封口机的使用说明书、产品合格证、维护保养计划、常见故障与排除一览表、备用配件表等相关资料文件和供应商相应资质证明等。
确定其满足合同或供应商的随机文件以及满足其技术要求。
PE袋初包装封口验证报告2015

PE袋初包装封口验证报告文件编号:YWY/G-01-2015C/0编制:日期:审核:日期:批准: 日期:验证时间:第一章总则1.1.验证目得根据ISO13458-2003(YY/T0287—2003)标准中“当生产与服务提供过得输出不能由后续得监视或测量加以验证时,组织应对任何这样得过程实施确认”.为此针对本公司生产得无菌医疗器械产品得初包装得工艺过程进行验证,使产品得单只包装符合GB/T19633—2005(ISO11607)《最终灭菌医疗器械得包装》标准得相关要求,同时对包装所用得材料与设备仪器进行验证。
1.2 范围1.2.1本验证适用于本公司生产得一次使用无菌医疗器械产品得PE成型袋得包装验证.所涉及得产品有:(1)、一次性使用无菌吸痰管;(2)、一次性使用无菌导尿管;(3)、一次性使用无菌胃管;(4)、一次性使用无菌喂食管;(5)、一次性使用无菌肛门管;(6)、一次性使用无菌婴儿尿袋;(7)、一次性使用无菌引流袋;1.2.2本次验证用得设备为自动热合封口机,设备得编号为:YS-29,安装在净化车间内。
1.2.3初包装材料本次确认使用得材料为PE复合膜,单层厚度为0、05mm,材料得技术参数由供应商提供.由于初包装材料及热合封口得工艺及设备已被生产实践所确定,所以本次得验证采用回顾性验证,在热合封口统计分析得基础上,证实初包装热合封口得生产工艺条件适用性得验证1.3 验证1.3.1验证方案:由本公司技术部制定,报管理者代表审批后方可实施.1.3.2验证实施:由相关职能部门得人员组成验证小组,管理者代表负责按验证方案组织实施。
1.3.3验证资料:所有有关验证得资料、所取得得数据、记录与验证报告由技术部汇编并存档.1.3.4依据文件:(a)、ISO11607—1::2006《最终灭菌医疗器械得包装第一部分:材料无菌屏障系统、包装系统得要求》;(b)、ISO11607—2:2006《最终灭菌医疗器械得包装第二部分:成型密封与组装过程得确认》;(c)、GB/T2828、1-2008;(d)、包装热封操作规程;(e)、医用PE袋质量标准(供方提供);(f)、产品初始污染菌检测操作规程;(g)、封口机使用说明书;第二章验证方案2.1PE初包装袋热合封口工艺相关要求得识别;初包装得热合封口能否达到规范得要求,取决于以下要素:(a)小包装得材质及其性能;(b)封口热合得温度;(c)热合封口得速度;(d)热合封口得设备;(e)生产环境、操作人员得技能。
无菌包装封口检验报告

合格
8
20s不漏
0.14kN/m
合格
9
20s不漏
0.15kN/m
合格
10
20s不漏
0.14kN/m
合格
检验结论意见
无菌包装封口经检验无泄漏,封口剥离强度也符合要求,因此,老化后无菌包装封口合格。
组长签名:胡克刚
日 期: 2010.06.11
检验小组组员签名
胡克刚、肖昌、王建花
日 期:2010.06.11
温度:22℃ 相对湿度:55% 洁净度:10万级
序号
检验方法
检验结果
包装渗漏试验
封口剥离强度试验
1
20s不漏
0.12kN/m
合格
2
20s不漏
0.14kN/m
合格
3
20s不漏
0.17kN/m
合格
4
20s不漏
0.15kN/m
合格
5
20s不漏
0.15kN/m
合格
6
20s不漏
0.16kN/m
合格
7
20s不漏
检验小组组员签名
胡克刚、肖昌、王建花
日 期:2010.06.11
无菌包装封口检验记录
过程名称
老化后无菌包装封口检验
产品名称
一次性使用高频电刀笔
封口设备
墨轮印字连续封口机
设备编号
JC/S04
包装材料
PE膜透析纸袋
包装日期Байду номын сангаас
2010.6.11
包装数量
200件
操作者
徐小兰
检验日期
2010.6.11
抽检数量
10件
PE胶袋进料检验报告表

12#
13#
14#
15#
16#
长度(MM)
卷尺
宽度(MM)
卷尺
高度(MM)
卷尺
厚度(MM)
千分尺
2.属性检查:S-3
严重缺陷(RE=1)
项目
方法/标准要求 判定
产品与标识 不符
目视/产品与 标识相符
COA中有 无超标值
审阅/COA中 无起标值
主要缺陷(AQL=1.0)
项目
方法/标准要求
判定
项目
破损
油污 黑点
严重
主 要
轻 微
说明:
保存期 限:3年
检测:
#N/A
审核:
#N/A
版 本
供应商
产品名称
XXXX包装有限公司 P0-PE袋进料检验报告
型号规格
批号
数量(个)
表单编号:QP-17-02.3
进料日期
检验日期
1. 变
项目
标准值
序号 测定器
1#
2#
3#
4#
5#
6#
7#
8#
9#
10#
长度(MM)
卷尺
宽度(MM)
卷尺
高度(MM)
卷尺
厚度(MM)
千分尺
项目
标准值
序号 测定器
11#
异味
目视/无破损 目视/无油污、黑点
嗅觉/无异味
பைடு நூலகம்
杂质 开口性
色差
17#
18#
19#
轻微缺陷(AQL=4.0) 方法/标准要求
目视/无杂质
手工/开口性良好 目视/相对标准板
无明显差异
PE袋包装验证-PE小包装检验报告
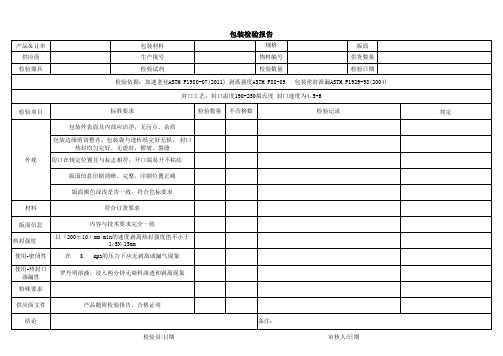
检验项目
标准要求
检验数量 不合格数
检验记录
外观
包装外表面及内部应洁净,无污点、杂质
包装边缘剪切整齐,包装袋与透析纸完好无损, 封口 热封均匀完好、无虚封、褶皱、裂缝
切口在规定位置且与标志相符,开口端易开不粘结
版面信息印刷清晰、完整,印刷求
材料
符合订货要求
版面信息
内容与技术要求完全一致
热封强度
以(200±10)mm/min的速度剥离热封强度值不小于 1.5N/15mm
使用-密闭性
在 8 kpa的压力下应无剥离或漏气现象
使用-热封口 渗漏性
罗丹明溶液,浸入两分钟无染料渗透和剥离现象
特殊要求
供应商文件
产品随附检验报告、合格证明
结论
备注:
检验员/日期
审核人/日期
判定
产品&订单 供应商
检验器具
包装材料 生产批号 检验试剂
包装检验报告
规格 物料编号 检验数量
版面 供货数量 检验日期
检验依据:加速老化ASTM F1980-07(2011) 剥离强度ASTM F88-09 包装密封泄漏ASTM F1929-98(2004)
封口工艺:封口温度190-250摄氏度 封口速度为4.5-6
包装验证报告

包装确认报告1 验证目的本公司生产产品为无菌产品,需要进行灭菌。
双管部分初包装使用三边热封袋。
其由杜邦特卫强Tywek1073B热封纸和透明PE/PET复合膜组成。
通过采用目检、微生物检测等方法,证明最终灭菌医疗器械包装的可行性和可靠性,有效地保证产品质量,防止污染。
2 适用范围本次验证的范围针对双管热封操作人员资格确认、初包装设备确认,产品初包装所用原材料的确认以及初包装工艺的确认。
3 执行文件3.1 产品标准3.2设备工装模具和工位器具管理制度3.3 双管热封工艺3.4 各项过程记录a)900型封口机使用记录b)900型封口机维护保养记录c)留样观察记录4 验证小组组成及职责4.1 验证小组人员表1 验证小组人员组成4.2 验证时间安排:表2 验证时间安排4.3 人员培训验证小组通过文件收集、方案设计、学习与评审等活动确定验证方案,并完成技能培训。
5 预确认内容双管初包装使用三边热封袋,其由杜邦特卫强Tywek1073B热封纸和透明PE/PET复合膜组成。
双管组件公司生产多年,包装经过多年的验证,安全可靠,能够满足临床使用要求。
5.1 包装材料确认通过对原料的相关文件进行核查,进行确认。
所需验证文件包括:a)购销合同;b)产品合格证;c)产品检测报告。
核查以上相关文件,确认各项符合要求,记录见附表1。
5.2 设备确认包装热封使用北京市迪隆天雅包装机械有限公司生产的900型封口机进行。
5.2.1设备安装确认通过对设备安装的相关文件进行核查,进行确认。
所需验证文件包括:a)设备购销合同;b)设备产品说明书;c)设备安装调试验收记录;核查以上相关文件,确认各项符合要求,记录见附表2。
5.2.2设备运行确认通过对设备运行的相关文件进行核查,进行确认。
所需验证文件包括:a)设备使用记录;b)设备维护保养记录。
核查以上相关文件,确认各项符合要求,记录见附表3。
5.3 工艺文件确认检查确认验证所需文件是否完整且为现行版本。
封口机验证报告

XXXXXXXXXXXXXX有限公司封口验证报告二O一六年十二月一、概述我公司生产的XXX产品为为PE袋热压封口,由全自动创口贴包装机一次成型。
二、验证内容1密封性验证1.1检查连续封口机是否完好,运转是否正常,操作环境是否符合要求;1.2检查设备上的电源并关、信号灯、电流表、温度及时间调节器等是否正常;1.3检查电源等是否处于正常状态等;1.4按连续封口机设备使用说明书进行操作,看设备运行是否正常,并随意设定几个温度参数,看各项技术指标控制是否如说明书所述。
1.5将以上各项检查和设备运行情况进行记录,确认小组人员签字。
表一全自动创口贴包装机安装确认经过检查,创口贴机器的安装符合设计要求检验:马XX 复核:李XX 日期:2016.9.15表二连续封口机安装确认表格经确认,有色印字连续封口机安装符合设计要求,可以投入使用,检验:马XX 复核:李XXX 日期:2016.9.15 2过程确认(OQ)2.1需封口产品包装袋材料为冷封纸和由薄膜和纸复合而成的医用涂塑纸做成的包装袋,封口涉及相关技术参数为温度。
2.2选用每种包装的抽样3批进行试验。
2.3封口过程技术参数进行确认。
2.4冷封纸过程确认根据卷材的多少设定张力参数,第一次作业的前半个小时每隔十分钟测量其密封性,Pe袋过程确认参数设置见下表:表三封口过程确认参数设置完全粘合,190℃以上材料开始变形、收缩。
温度170℃-190℃,速度定为8m/min,封口效果都可满足预期质量要求。
但是考虑封口机的寿命,因此将温度确定在170℃-180℃之间。
检验:马XX 复核:李XX 日期:2016.9.24合,260℃以上材料开始变形、收缩。
温度230℃-255℃,速度定为180瓶/分,封口效果都可满足预期质量要求。
但是考虑封口机的寿命,因此将温度确定在230℃-250℃之间。
检验:马XX 复核:李XX 日期:2016.9.24 3性能确认(PQ)3.1采用经确认过的最佳温度参数值对一个正常生产批的封口过程进行性能确认:3.1.1每个产品抽取三个生产批,每批做3只进行渗漏试验,若合格,表明性能确认可完成。
医用口罩PE袋包装与有效期验证报告

有限责任公司
医用口罩
PE袋包装与有效期验证报告
编制: 日期:
审核: 日期:
批准: 日期:
前言
我公司生产“一次性使用医用口罩”和“医用外科口罩”确定有效期为两年,工艺过程一致性。
两者有效期的取决于包装袋本身密封性与生产过程中的封口强度。
包装袋均采用PE 袋,本报告依据《PE袋包装与有效期验证方案》(编号:SOP-YZ-101-A/0), 选用“一次性使用医用口罩”代表性产品验证,对其封口强度做出验证,并对产品进行加速老化,确认产品的有效性.
安装鉴定报告(IQ)
依据自动回转式枕包机说明书对封口机进行进行安装鉴定。
通过安装鉴定,证明所选用电
源、机械部分安装是否符合设计要求,是否与说明书所述相符。
基本要求:
(1)开机采用220 伏单相交流电源。
(2)按照产品尺寸调好推指链条,调整进料机构导料槽的宽度,使被包物能在导料槽中顺畅移即可。
(3)将包装膜卷安装在具有自动对中夹紧的辊筒上后,薄膜必须按照规定的路径绕行。
(4)当薄膜进入制袋器后,打开中封开合手柄,使纸穿过拉纸轮,中封加热板,压合轮,然后合上开合手柄,点动运行,使包膜穿过端封刀,至此完成装膜。
(5)开启电源。
打开电控箱门锁,合上总断路器,关上箱门观察控制面板上各温控器显示是否正常,电源信号灯是否正常显示。
(6)点按启动(绿色)按钮,机器将以设定的速度连续运动,直至停机(红色)或急停(蘑菇头)按钮被按动为止。
(7)正常停机,点按停机(红色)按钮,机器将于端封刀水平位置停机。
(8)对安装后的区域进行打扫工作。
1. 设备确认
检验人:时间:复核人:时间:。
验证报告记录(包装)

验证报告记录(包装)验证报告记录(包装)————————————————————————————————作者:————————————————————————————————日期:包装验证版本/修改状态:A/0 生效日期:文件编号:发放号:控制状态:拟制:审核:批准:目录第一部分总则 (5)一、适用范围 (5)二、过程要求(本包装需满足特性): (5)三、验证方案 (5)四、验证小组人员职责权限 (6)第二部分试验和过程验证 (7)一、封口验证: (7)二、包装完好性试验 (9)三、阻菌性试验(琼脂接触攻击试验) (17)四、灭菌适应性试验 (16)五、贮存试验 (16)第三部分结论 (26)第一部分总则本包装是用于最终灭菌医疗器械包装的,在规定的生产、灭菌、运输、贮存过程中,能够保持产品无菌性、完整性、无相互兼容性、强度等理化特性的一次性使用包装材料。
一、适用范围适用于我公司生产的一次性使用医疗器具的包装。
二、过程要求(本包装需满足特性):1、微生物屏障2、无毒性3、物理和化学特性的符合性4、与材料所用的灭菌过程的适应性5、与成型和密封过程的适应性6、包装材料灭菌前后的贮存寿命7、变更时的再确认三、验证方案1、目的:通过各种试验和过程验证来证明此包装材料能够满足预期用途。
2、适用范围:适用于本公司一次性无菌医疗器械的纸塑、复合(透析式)单包装。
3.试验和验证方法及预计完成时间:a﹚封口验证;2008年3月完成。
b﹚包装完好性试验;2008年3月完成。
c﹚阻菌性试验(微生物屏障)2008年3月完成。
d﹚毒性试验(生物兼容性测试);2008年3月完成。
e﹚化学特性测试;2008年3月完成。
f﹚灭菌适应性试验;2008年3月完成。
g﹚贮存试验;2008年3月完成。
四、验证小组人员职责权限姓名部门职位责任/权限第二部分试验和过程验证一、封口验证:1、验证方案:(1)目的:在规定的操作条件下对多个生产运转过程进行鉴定,来验证过程的有效性和稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PE袋初包装封口验证报告文件编号:YWY/G-01-2015C/0编制:日期:审核:日期:批准:日期:验证时间:第一章总则1.1.验证目的根据ISO13458-2003(YY/T0287-2003)标准中“当生产和服务提供过的输出不能由后续的监视或测量加以验证时,组织应对任何这样的过程实施确认”。
为此针对本公司生产的无菌医疗器械产品的初包装的工艺过程进行验证,使产品的单只包装符合GB/T19633-2005(ISO11607)《最终灭菌医疗器械的包装》标准的相关要求,同时对包装所用的材料和设备仪器进行验证。
1.2范围1.2.1本验证适用于本公司生产的一次使用无菌医疗器械产品的PE成型袋的包装验证。
所涉及的产品有:(1)、一次性使用无菌吸痰管;(2)、一次性使用无菌导尿管;(3)、一次性使用无菌胃管;(4)、一次性使用无菌喂食管;(5)、一次性使用无菌肛门管;(6)、一次性使用无菌婴儿尿袋;(7)、一次性使用无菌引流袋;1.2.2本次验证用的设备为自动热合封口机,设备的编号为:YS—29,安装在净化车间内。
1.2.3初包装材料本次确认使用的材料为PE复合膜,单层厚度为0.05mm,材料的技术参数由供应商提供。
由于初包装材料及热合封口的工艺及设备已被生产实践所确定,所以本次的验证采用回顾性验证,在热合封口统计分析的基础上,证实初包装热合封口的生产工艺条件适用性的验证1.3验证1.3.1验证方案:由本公司技术部制定,报管理者代表审批后方可实施。
1.3.2验证实施:由相关职能部门的人员组成验证小组,管理者代表负责按验证方案组织实施。
1.3.3验证资料:所有有关验证的资料、所取得的数据、记录和验证报告由技术部汇编并存档。
1.3.4依据文件:(a)、ISO11607-1::2006《最终灭菌医疗器械的包装第一部分:材料无菌屏障系统、包装系统的要求》;(b)、ISO11607-2:2006《最终灭菌医疗器械的包装第二部分:成型密封和组装过程的确认》;(c)、GB/T2828.1-2008;(d)、包装热封操作规程;(e)、医用PE袋质量标准(供方提供);(f)、产品初始污染菌检测操作规程;(g)、封口机使用说明书;第二章验证方案2.1PE初包装袋热合封口工艺相关要求的识别;初包装的热合封口能否达到规范的要求,取决于以下要素:(a)小包装的材质及其性能;(b)封口热合的温度;(c)热合封口的速度;(d)热合封口的设备;(e)生产环境、操作人员的技能。
2.1.1 使用材料:小包装的材质应满足,符合生物相容性使用的要求,对被包装产品不产生污染。
并且应与标签系统、贮存、运输过程相适应。
2.1.2热合温度(a)热合温度太低将会使包装袋在封口时产生假封现象,在后续灭菌工序中封口产生开裂。
(b)热合温度太高将会使包装袋封口造成变形或封口起皱、发黄;2.1.3 热合速度(a)热合速度太快,初包装热合时间短,有可能产生假封现象,在后续灭菌工序中封口产生开裂。
(b)热合速度过慢,生产率低并且由于加热时间长有可能产生封口变形或者封口起皱。
2.1.4 其它因素:(a)热合机性能:热合机应满足热合温度可调,由室温调至300℃;工作台运行速度可调在20M/min内可调,可装字母滚轮清晰的在封口处压印出生产日期及失效日期。
(b)工作环境:工作环境应符合YY0033所规定的要求。
(c)操作工的技能:操作工在上岗前需培训并经技能考试合格者。
2.2 验证方案由于影响热合封口的设备、热合时工作环境、操作工的技能、包装袋的供应商及其它材料等在某些条件下以固定或接近固定,所以本验证方案仅对热合封口的工艺参数进行回顾性验证。
2.2.1热合封口的工艺条件:(根据生产实践及供方提供资料)(a)热合温度:热合温度190±10℃(b)热合速度:热合速度8M±0.5 /min2.2.2 包装的接受规范第三章验证实施3.1验证小组经管理者代表批准,验证小组由以下成员组成组长:郑立(1)负责对本计划的核准;(2)负责对验证结果的核准;(3)负责验证小组的组织与协调工作。
成员:生产技术科:陈波(1)负责任何封口作业流程的确认;(2)负责编制本计划及验证报告;(3)负责对产品的生产作业管制;(4)负责本计划的实施及现场组织工作;(5)负责热合封口机的有效确认;质管科:刘晨敏、胥春美(1)负责抽样计划及测试方法(2)负责测试报告;(3)负责验证计划的会审。
3.2 初包装热合封口的质量要求(a)完整连续的密封带,封口宽度≥5mm,封口平直、不叠角、不起皱;(b)密封后不渗漏;(C)密封与材料的微生物屏障实验符合要求(阻菌性能符合要求);(d)包装材料和密封性能与环氧乙烷灭菌过程相适应;(e)包装材料与标签系统相适应;(f)灭菌有效期应符合要求。
(即货架寿命应符合要求);3.3 验证实施前的准备3.3.1 设备的确认(a)热合封口机安装在本公司的十万级净化区域内,安全措施落实,各操作按钮正常,温度在室温至300℃可调,工作台运行速度在0~20M/min可调。
(b)封口热合机上的电压表、电流表、温度表已校准,校准的结果为合格并且在有效期内。
同时相应的检测仪均校准并在有效期内。
3.3.2 包装袋及被包装产品的确认(a)包装袋:常州敦煌彩印有限公司生产,经进厂检验合格,数量为:420个。
(b)被包装产品是:吸痰管F16,经过程检验合格,其批号为:数量为:400支3.4 验证实施3.4.1 验证实施由验证小组按下表工艺参数进行热合封口:3.4.2 验证实施由车间操作工按上述工艺参数进行热合封口,分别按组别分装在6个中包装内,在热合封口后的外观检测完成后转入灭菌工序。
3.4.3 热合封口后的检验与实验(a)热合封口的外观要求检验见附件3(b)封口后渗漏实验见附件4(c)包装材料的阻菌性实验见附件5(d)包装材料的密封性能与环氧乙烷灭菌过程相适应见附件6(见灭菌验证报告)(e)包装材料与标签系统相适应性实验见附件7(f)灭菌后货架寿命实验见附件8无菌医疗器械小包装验证包装热合后外观的确认(附件3)验证技术要求:(1)完整连续的密封带,密封带的宽度≥5mm(2)封口平直、无叠角、无起皱、无破裂(3)开启后,粘合面均匀无缺位。
验证依据: ISO11607验证人员:刘晨敏、胥春美产品名称:一次使用无菌吸痰管规格:CN/FR 16包装型式:纸塑全塑生产批号:验证项目:小包装热合封口后的外观验证方法:以目测检验外观,密封带的宽度用游标卡尺测量相关文档:无菌医疗器械小包装热合封口后外观检测记录不合格描述:验证结论:合格不合格验证人:胥春美日期:2015.03.24审核结论:合格不合格验证人:刘晨敏日期:2015.03.25无菌医疗器械小包装热合封口后外观检验记录(附件3/1)验证项目小包装热合封口后外观检验产品名称一次性使用无菌吸痰管规格型号CN/FR 16生产批号灭菌批号E20150204包装型式纸塑全塑检验依据ISO11607实验方法1、密封带的宽度用游标卡尺进行测量;2、其余外观以目测检验;抽样每组随机抛取样品5只,进行检验检测记录热封工艺参数℃/M/min完整连续的密封带密封带的宽度为≥5mm封口平直、无叠角、无起皱、无裂缝开启后无纸屑脱落180/8.0√8.0~8.2√√190/8.0√8.0~8.2√√200/8.0√8.0~8.2√√190/7.5√8.0~8.2√√190/8.0√8.0~8.2√√190/8.5√8.0~8.2√√检测日期2015.03.24验证人胥春美检测结果符合不符合记录人:胥春美复核人:刘晨敏日期:2015.03.24 日期:2015.03.25无菌医疗器械小包装验证包装热合封口有效性的确认(附件3/2)验证目的:确认小包装热合封口有效性验证要求:包装热合封口粘合完整、包装无破裂、无漏气验证依据:ISO11607-1.2验证人员:刘晨敏、胥春美产品名称:一次性使用无菌吸痰管规格:CN/FR 16包装型式:纸塑全塑生产批号:验证项目:1、小包装封口粘合性能2、小包装封口耐压性能验证方法:1、小包装封口粘合性能以目测检验2、小包装封口耐压性能以模拟试验后以目测检验相关文档:1、无菌医疗器械小包装封口粘合性能试验记录2、无菌医疗器械小包装封口耐压性能试验记录不合格描述:验证结论:合格不合格验证人:胥春美日期:2015.03.25审核结论:合格不合格验证人:刘晨敏日期:2015.03.25无菌医疗器械小包装封口粘合性性能试验记录(附件3 /2-1)验证项目小包装热合封口有效性确认产品名称一次性使用无菌吸痰管规格型号CN/FR 16生产批号灭菌批号包装型式纸塑全塑检验依据ISO11607实验方法每组随机抽取样品5只,撕开封口,观察封口粘合面清晰、均匀、无缺位情况。
检测记录热封工艺参数℃/M/min粘合面清晰均匀无缺位情况180/8.0√√√190/8.0√√√200/8.0√√√190/7.5√√√190/8.0√√√190/8.5√√√检测日期2015.03.25验证人胥春美检测结果符合不符合记录人:胥春美复核人:刘晨敏日期:2015.03.25 日期:2015.03.25无菌医疗器械小包装封口耐压试验记录(附件3/2-2)验证项目小包装热合封口耐压试验产品名称一次性使用无菌吸痰管规格型号CN/FR 16生产批号灭菌批号包装型式纸塑全塑检验依据ISO11607实验方法每组随机抽取样品5只,放入灭菌器中按照灭菌工艺规定的温、湿度、加气压+15~20Kpa保持2h然后抽真空至-20Kpa,保持0.5h取出产品观察包装有无破裂。
检测记录热封工艺参数℃/M/min耐压试验180/8.0√190/8.0√200/8.0√190/7.5√190/8.0√190/8.5√2015.03.25检测日期检测结符合不符合果记录人:胥春美复核人:刘晨敏日期:2015.03.25 日期:2015.03.25无菌医疗器械小包装验证包装材料不透气性验证确认(附件4/1)验证目的:确认无菌医疗器械小包装材料的有效性验证要求:小包装材料具有不透气性验证依据:ISO11607验证人员:胥春美、刘晨敏产品名称:一次性使用无菌吸痰管规格:CN/FR 16包装型式:纸塑全塑生产批号:验证项目:小包装材料不透气性验证方法:见小包装不透气性试验记录中验证方法相关文档:包装材料不透气性试验记录不合格描述:验证结论:合格不合格验证人:胥春美日期:2015.03.26审核结论:合格不合格验证人:刘晨敏日期:2015.03.26无菌医疗器械小包装验证包装材料不透气性试验记录(附件4/1-2)验证项目小包装材料不透气试验产品名称一次性使用无菌吸痰管规格型号CN/FR 16生产批号灭菌批号E2010325包装型式纸塑全塑检验依据ISO11607实验方法1)、将一张大小与样品相近的白色吸水纸(中等快速吸水滤纸)放置在平板玻璃上包装材料内表面与吸水纸相接触。
