第七章 电化学
第七章 电化学(4)

l g Ksp = −9.7566
K sp = 1 . 75 × 10 − 10
例7.9.3 将下列扩散过程设计成电池,并写出其电动势的能斯 特方程。
(1) H 2 (g, p1 ) → H 2 (g, p2 )
( p1>p2 )
(2) Ag + (a1 ) → Ag + (a2 )
解: (1) 阳极: 阴极:
Pt | O 2 (g, p ) | OH − H + | O 2 (g, p ) | Pt
同样,这两个电极中O2压力也必须相等。
例 7.9.2
利用表7.7.1的数据,求25℃ AgCl(s)在水中的溶度积Ksp。 解:溶解过程表示为
AgCl(s) = Ag + + Cl −
阳极 阴极
Ag = Ag + + e −
{
}
2.第二类电极
(1)金属—难溶盐电极 这类电极是在金属上覆盖一层该金属的难溶盐,然后 将它浸入含有与该难溶盐具有相同阴离子的溶液中而 构成的。 银-氯化银电极和甘汞电极。 甘汞电极
Cl − Hg 2 Cl 2 (s) Hg
电极反应为:
Hg 2 Cl 2 (s) + 2e − 2Hg + 2Cl −
当外加电压等于分解电压时,两极的电极电势分别称为氢和氧 的析出电势。 表7.10.1 几种电解质溶液的分解电压(室温,铂电极) 电解质 HCl HNO3 H2SO4 NaOH CdSO4 NiCl2 浓度c/mol·dm−3 1 1 0.5 1 0.5 0.5 电解产物 H2和Cl2 H2和O2 H2和O2 H2和O2 Cd和O2 Ni和Cl2 E分解/V 1.31 1.69 1.67 1.69 2.03 1.85 E理论/V 1.37 1.23 1.23 1.23 1.26 1.64
第7章电化学ppt课件

Q 通过电极的电量 z 电极反应的电荷数(即转移电子数), 取正值。 电极反应的反应进度, = nB/B F 法拉第常数; F = Le = 96485.309 C/mol
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
基础理论与新能源
• 锂电池
• 锂是诸金属中具有质量轻、
Li/Li+电极标准电极电势最负, 导电性和机械性能良好等优点, 自20世纪80年代以来是研究的热点之一 成为最有竞争力的高能电池之一。
祝大家学习愉快,天天进步!
7
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
法拉第电解定律
电解时电极上发生化学反应 的量与通过电解池的电量成 正比。
(MichaelFaraday,1791 —1867)英国、化学家
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
§7.1 电极过程、电解质溶液及法拉第定律
§7.1 电极过程、电解质溶液及法拉第定律
以电解池为例(两铜棒插入CuSO4)
电极①: Cu2++2e-→Cu(S)
①
② 与外电源负极相接电势低,是 负极。
发生还原反应,是 阴极。
结论
电极②: Cu(S)→ Cu2++2e-
与外电源正极相接,是 正极。 发生氧化反应,是阳极。
电解池: 阳极即正极
阴极即负极
Cu2++2e-=Cu
物理化学课件第七章-电化学
l
S
A
r
r
A
S' E
离子的电迁移
山东理工大学 33
Mx N y
c(1 )
xMz yNz
cx cy
设正离子迁移速率为 r ,单位时间向阴极方向通 过任意截面 ss' 的物质的量为 (cx Ar )mol ,所迁移
的电量为 (cx Ar )zF ,因为是单位时间,所以:
Q t
I
(cx Ar )zF
D. 导电总量全部由电子承担
山东理工大学 6
第二类导体又称离子导体,如电解质溶液、熔 融电解质等 第二类导体的特点是:
A. 正、负离子作反向移动而导电
B. 导电过程中有化学反应发生
C. 温度升高,电阻下降
D. 导电总量分别由正、负离子分担(速率,电荷)
*固体电解质,如 AgBr、PbI2 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高,
dE u ( dl )
u , u 称为正、负离子的
电迁移率,单位 m2 s1 V1。
离子的电迁移率又称为离子淌度(ionic mobility), 相当于单位电位梯度时离子迁移的速率
电迁移率的数值与离子本性、电位梯度、溶剂性 质、温度等因素有关,可以用界面移动法测量。
山东理工大学 30
离子迁移数的定义
2电解质溶液的导电机理 ①正负离子定向迁移;
②界面上分别发生氧化还原反应,电荷转移;
结果实现了化学能和电能之间的转换。
3 电极命名法: 正极(电势高) 负极(电势低)
原电池 阴极(还原反应) 阳极(氧化反应)
电解池 阳极(氧化反应) 阴极(还原反山东应理工)大学 15
法拉第定律的文字表述
物理化学-第七章-电化学

通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
物理化学第7章 电化学

放置含有1 mol电解质的溶液,这时溶液所具有的
电导称为摩尔电导率 Λ m
Λ m
def
kVm
=
k c
Vm是含有1 mol电解质的溶液
的体积,单位为 m3 mol1,c 是电解
质溶液的浓度,单位为 mol m3 。
摩尔电导率的单位 S m2 mol1
注意:
Λ 在 后面要注明所取的基本单元。 m
b、强电解质: 弱电解质:
强电解质的Λ m
与
c
的关系
随着浓度下降,Λ 升高,通 m
常当浓度降至 0.001mol dm3 以下
时,Λ 与 m
c 之间呈线性关系。德
国科学家Kohlrausch总结的经验
式为:
Λ m
=Λm (1
c)
是与电解质性质有关的常数
将直线外推至 c 0
得到无限稀释摩尔电导率Λm
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
三、法拉第定律
Faraday 归纳了多次实验结果,于1833年总结出该定律
1、内容:当电流通过电解质溶液时,通过电极 的电荷量与发生电极反应的物质的量成正比;
作电解池 阴极: Zn2 2e Zn(s)
阳极 2Ag(s) 2Cl 2AgCl(s) 2e
净反应: 2Ag(s) ZnCl2 Zn(s) 2AgCl(s)
2.能量变化可逆。要求通过的电流无限小。
二、可逆电极的种类
1、第一类电极
chap7 电化学

第七章 电化学7.0 绪言7.0.1电化学定义电化学定义:研究电能和化学能的相互转化及转换过程中有关规律的科学。
化学反应通常伴随着热的吸放(反应热效应),不涉及到电能。
而作为电化学则讨论在消耗外电功的情况下进行的反应或作为电能来源的反应。
显然,从热力学的观点看,电化学反应与一般的化学反应不同,电化学是一门独立的学科。
应该说,上述的电化学定义是相当概括的定义。
1970年,Bockris 在其名著《ModernElectrochemistry 》中把电化学定义为:电化学是研究带电界面的现象的科学,即研究电子导体和离子导体界面现象的 科学。
区分、认识电化学反应的两个关键因素: (1)反应必须发生在两类导体的界面上;(2)反应中应有电子的得失。
电化学中的能量转换: 电 能 → 化学能:电解(池);化学能 → 电 能:原电池。
7.0.2电化学与化学反应的区别以下列反应为例:+++++=+223Cu Fe Cu Fe若这个反应以化学反应的方式进行,它将具有以下的特点:(1) 反应只有当反应物在碰撞时才可能发生,及反应质点必须碰撞;(2) 在碰撞的一瞬间,当反应质点相互靠近时,电子从一个质点转移到另一个质点成为可能。
这个电子转移的实际上能否发生,取决于反应质点的内能以及内能与活化能的比值。
活化能是化学反应本性的函数;在离子反应中,这个能量通常是不大的。
电子所经过的途径也是非常小的;(3)对于简单离子反应,不管反应质点彼此相对位置如何,在反应区间的任何一点都可能发生碰撞。
因此,电子可能在空间任一方向上转移。
反应质点间碰撞的混乱性,以及由此引起的电子混乱运动;(4)由于这些特点,其能量效应采用热的方式释放。
如果这个反应以电化学的方式进行,反应条件必须改变:(1)电能的获得和损失是与电流的通过有关的,而电流是电子在一定方向上的流动。
只有当电子通过的路径与原子的大小相比很大时,电能的利用才有可能。
因此,在电化学反应中,电子从一种参加反应的物质转移到另一种物质必须经过足够长的路径。
第七章 电化学

第七章电化学教学目的与要求了解电解质溶液的导电机理和法拉第定律、离子独立运动定律理解离子迁移数、电导率, 摩尔电导率的概念。
理解电导测定的应用。
理解电解质活度和离子平均活度系数的概念。
了解离子氛的概念和Debye-Huckel极限公式。
理解可逆电池及韦斯顿标准电池,理解原电池电动势和热力学函数的关系。
掌握能斯特方程及其计算。
掌握电动势测定方法与其主要应用。
掌握各种类型电极的特征。
理解把电池反应设计成电池的方法*。
理解电极极化的原因和超电势的概念。
了解分解电压、析出电势的概念以及析出反应次序与析出电势的关系*。
教学重点与难点重点:电化学系统中的基本原理及其应用。
难点:离子氛的概念,电解质活度、离子平均活度系数和超电势的计算.作业: 7.1 7.5 7.7 7.11 7.13 7.16 7.19 7.25 7.29 7.30 7.36 7.40 电化学主要研究电能和化学能相互转化的一门科学。
是物理化学的一个重要分支。
研究的主要内容:电解质溶液、电化学平衡电极过程热力学、应用问题7-1 电解质溶液的导电机理及法拉第定律一、基本概念1、导体分类第一类导体(电子导体):依靠电子在电场下作定向移动导体。
如金属、石墨等A.自由电子作定向移动而导电B.导电过程中导体本身不发生变化C.温度升高,电阻也升高D.导电总量全部由电子承担第二类导体(又称离子导体),如电解质溶液、熔融电解质等。
依靠正负离子在电场作用下移动导电。
A.正、负离子作反向移动而导电B.导电过程中有化学反应发生C.温度升高,电阻下降D.导电总量分别由正、负离子分担2、电池(电解池、原电池)(1)电解池装置(2)原电池装置3. 阴极、阳极和正、负极的确定①按电势的高低高→正极低→负极②按得失电子的不同失电子,发生氧化反应→阳极得电子,发生还原反应→阴极4. 分析对照图讲解原电池中:负极(阳极),正极(阴极)电解池中:负极(阴极),正极(阳极)5. 电解质溶液的导电机理正、负离子的定向移动以及在电极溶液界面上发生化学反应而实现。
第7章-电化学基础
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
物理化学第七章电化学

第七章电化学7.1电极过程、电解质溶液及法拉第定律原电池:化学能转化为电能(当与外部导体接通时,电极上的反应会自发进行,化学能转化为电能,又称化学电源)电解池:电能转化为化学能(外电势大于分解电压,非自发反应强制进行)共同特点:(1)溶液内部:离子定向移动导电(2)电极与电解质界面进行的得失电子的反应----电极反应(两个电极反应之和为总的化学反应,原电池称为电池反应,电解池称为电解反应)不同点:(1)原电池中电子在外电路中流动的方向是从阳极到阴极,而电流的方向则是从阴极到阳极,所以阴极的电势高,阳极的电势低,阴极是正极,阳极是负极;(2)在电解池中,电子从外电源的负极流向电解池的阴极,而电流则从外电源的正极流向电解池的阳极,再通过溶液流到阴极,所以电解池中,阳极的电势高,阴极的电势低,故阳极为正极,阴极为负极。
不过在溶液内部阳离子总是向阴极移动,而阴离子则向阳极移动。
两种导体:第一类导体(又称金属导体,如金属,石墨);第二类导体(又称离子导体,如电解质溶液,熔融电解质)法拉第定律:描述通过电极的电量与发生电极反应的物质的量之间的关系=Fn=FzQξ电F -- 法拉第常数; F = Le =96485.309 C/mol = 96500C/molQ --通过电极的电量;z -- 电极反应的电荷数(即转移电子数),取正值;ξ--电极反应的反应进度;结论: 通过电极的电量,正比于电极反应的反应进度与电极反应电荷数的乘积,比例系数为法拉第常数。
依据法拉第定律,人们可以通过测定电极反应的反应物或产物的物质的量的变化来计算电路中通过的电量。
相应的测量装置称为电量计或库仑计coulometer,通常有银库仑计和铜库仑计 。
7.2 离子的迁移数1. 离子迁移数:电解质溶液中每一种离子所传输的电量在通过的总电量中所占的百分数,用 tB 表示1=∑±=-++t 或显然有1:t t离子的迁移数主要取决于溶液中离子的运动速度,与离子的价数无关,但离子的运动速度会受到温度、浓度等因素影响。
物理化学答案——第七章-电化学

第七章 电化学(一)基本公式和内容提要1 Faraday (法拉第)定律定义:当电流通过电解质溶液时,通过每个电极的电量与发生在该电极上电极反应的物质的量成正比。
Q = nzF2 离子迁移数定义:每种离子所传输的电量在通过溶液的总电量中所占的分数,以t 表示 Q r t Q r r ++++-==+, Q r t Qr r ---+-==+3 电导G ,电导率κ,摩尔电导率m Λ1I G RU -==1κρ=, A G lκ=m m V cκκΛ== 1c e l ll K R R Aκρ===其中,cell l K A=为电导池常数,c 为电解质的浓度,单位是mol/m 34 离子独立运动定律m ∞Λ = v+()m A λ∞+ + v-()m B λ∞-对于强电解质,在浓度较低的范围内,有下列经验关系(科尔劳乌施经验关系):(1m m β∞Λ=Λ-对于弱电解质: m m α∞Λ=Λ (其中,α为解离度)5 离子平均活度a ±和离子平均活度系数γ±电解质的活度:(/)v v v va a a a m m θγ+-+-±±±===其中,1/()v v v γγγ+-±+-= , 1/()v v vm m m +-±+-=6 德拜-休克尔极限公式ln Az z γ±+-=-式中I 为溶液离子强度212i iI m z =∑;在298 K 的水溶液中,11221.172kg molA -=,上式适用于10.01m ol kg I -≤ 的稀溶液。
7 可逆电池热力学r m G n E Fθθ∆=- (只做电功) r mG nEF ∆=-(只做电功)ln R T E K nFθθ=()()r mr m p pG ES nF T T∂∆∂∆=-=∂∂式中,()p E T∂∂是电池电动势随温度的变化率,称为电池电动势的温度系数。
第七章电化学-PPT课件

Q t Q Q U U U
Q U t Q Q U U
故有
t U t U
31
4. 迁移数测定的方法 (1) 希托夫法 根据迁移数的定义,将电解池划分为 三个区:阴极区、阳极区和中间区。
Q Q
Q t Q Q Q t Q Q
(3) 影响离子迁移数因素 从上式可见,离子迁移数与溶液中正、 负离子在电场中运动的速率有关。
28
离子在电场中运动的速率除了与离子的 本性(包括离子半径、离子水化程度、所带 电荷等)以及溶剂的性质(如粘度等)有关以 外,还与外加电场的电位梯度有关,电位梯 度越大,推动离子运动的电场力也越大。 影响离子迁移数因素:温度、溶液浓度 溶质特性、溶剂特性。一般情况下,温度升 高,正、负离子的迁移数趋于相等。 离子迁移数是一比值,为无量纲的纯数。
+ -
24
+
-
25
(3) 电解时 正负离子运动规律 A. 向阴、阳两极方向迁移的正、负离子的 物质的量总和(电量)恰等于通入溶液的总电 量(法拉第数)。 通入溶液的总电量 = Q+ + QB.
正离子迁移的电量Q+ 负离子迁移的电量Q负离子运动速率正离子迁出阳极区的物质的量n+ 负离子迁出阴极区的物质的量n正离子迁入阴极区的物质的量n+
Q t Q Q
32
Q t Q Q
=
正离子迁出阳极区的物质的量n+ 通过电解池电荷的物质的量n
=
=
正离子迁出阳极区的物质的量n+
电极反应的物质的量n 正离子迁出阳极区时所迁移的电量Q+ 通过电解池的总电量
物理化学第七章电化学

§7-2 离子的迁移数
通电前后各区域物质的量的变化情况:
上述结果表明: 电解后:三个区域的溶液都是电中性的 电解后,两电极附近的阴极区和阳极区中,浓度变化不相同。
Q u 1 = n阴 Q_ u 3 式中 n阴 、 n阳 分别表示阴极区和阳极区内电解质克当量数(物质 的量)的减少。 2、离子的迁移数 某种离子的迁移数ti是指该离子迁移的电量Q+与通过溶液的总电 n阳
§7-1 电化学的基本概念和法拉第定律
如图所示:
§7-1 电化学的基本概念和法拉第定律
直流电源与两电极相连接,电流方向是电源外电路中由正极流 向负极,而电子流动的方向正好与之相反,是由电源外电路中由 负极流向正极。 电极反应 :电子流到电极上,那么在电极上就会进行有电子得失 的化学反应 规定 :发生氧化反应(也就是失去电子的反应)的电极就称为阳 极 发生还原反应(也就是得到电子的反应)的电极称为阴极。
m
§7—3 溶液的电导率和摩尔电导率
2、电导的测定,电导率和摩尔电导率的计算: 电导是电阻的倒数,因而可 电阻箱电阻 通过测定电解质溶液在某一 电导池中的电阻来确定其电 电可 导变 导,测定电阻可通过惠茨通 池电 电容 (wheatstone)电桥: 容( 如图示: )抵
消
A
D
阻待 测 电
B C
检零器
,这种离子的浓度反而降低了。
电解质实例: 1、两个惰性电极组成的电解池,假想可分为三个部分: 阴极区、中间区、阳极区 2、电解池中的溶液含有16克当量/mol的1—1型电解质。 3、通过电解池的总电量为4F(4mol F) 4、负离子的迁移速度U-是正离子迁移速度U+的3倍。
§7-2 离子的迁移数 如图所示:
第7章 电化学极化 ppt课件

Tafel曲线
• lg|J|对于η作图所得半对数极化曲线称为Tafel曲线
阴极极化 Tafel曲线
• β可通过斜率得到,J0可pp通t课件过截距得到 41
(3) 低过电势下的近似公式:线 性极化公式
• η<12mV或J<0.5J0时,可使用线性极化公式,误 差<1%
• 线性极化公式的误差受传递系数影响较大,相对而 言,Tafel公式适用条件基本不受传递系数影响。
电化学原理
高鹏 哈尔滨工业大学(威海)
ppt课件
1
第7章 电化学极化
• 7.1 电化学动力学理论基础 • 7.2 电极动力学的Butler-Volmer模型 • 7.3 单电子反应的电化学极化 • 7.4 多电子反应的电极动力学 • 7.5 电极反应机理的研究 • 7.6 分散层对电极反应速率的影响 • 7.7 平衡电势与稳定电势
• 精细平衡原理:平衡时体系中每一个基元反应在 正、逆两个方向进行反应的速率相等。 – 在复杂反应中如果有一个决速步骤,则它必然 是逆反应的决速步骤。
ppt课件 6
v v v0
(3)绝对电流密度与交换电流密度
ppt课件 7
ppt课件 8
(4)过渡态理论
ppt课件 9
ppt课件 10
ppt课件 67
习题
ppt课件 68
7.6 分散层对电极反应速率的影响
• ψ1效应:分散层电势 ψ1对电子转移步骤反应速度的 影响。 –Tafel曲线不是直线 –k、J0是电势的函数,也是支持电解质浓度的函 数
ppt课件 13
(8)电荷转移的微观理论
• 建立在量子力学和统计热力学基础之上 • 电子迁移的Marcus理论在电化学研究中已有广泛的
电化学原理-第七章-气体电极过程

则: H 平
常数
RT F
ln
c OH
1
RT
F
ln
jc
减小59mV
pH值增大 一个单位
不变时
(7.21)
与实验结果吻合
2、迟缓放电机理的实验依据
当酸浓度很低时,由于 1效应,使酸的浓度 变化时, 不H 随之改变。(图7.2现象)
H
常数 1
RT F
ln
c H
1
1
RT
F
ln
jc
两项影响抵消
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
在浓的纯酸溶液中, 析氢过电位随氢离子 浓度升高而降低。
高过电位金属:
c 0.5 ~ 1.0mol / L
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
同一过电位下,高浓 度对应的电流密度 (反应速度)比低浓 度高很多。
析氢过电位 a b log j (7.1)
0.1~ 0.14V 电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
二、析氢过电位及其影响因素
在很低的电流密度下有:
析氢过电位
j (7.2)
电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
1
常数
2RT F
ln( a)
RT F
ln
cH
(3.50)
2、迟缓放电机理的实验依据
当酸浓度较高时,可忽略 效1 应,使 随H cH 升高而降低。(图7.2现象)
H
常数 1
物理化学第七章 电化学

CdCl2 a Cd
Q Id t
t 电流表:指示测定时,电路中 的电流变化。
界面移动法可以较精确地测定离子迁移数,关键是如 何寻找一种指示溶液,能与被测溶液之间形成一清晰界面。 形成清晰界面的条件:
n电解后=该离子电解前的物质的量n电解前±该离子参与 电极反应的物质的量n反应±该离子迁移的物质的量n迁
移
由实验数据计算离子的迁移数时,如果所用电极也参加电极 反应时,应加以考虑。
例:用两个银电极电解AgNO3水溶液,在电解前,溶液中每1kg 水含43.50mnol AgNO3。实验后,银库仑计中有0.723mmol 的Ag 沉积。由分析知,电解后阳极区有23.14g水和1.390mmolAgNO3。 试计算t(Ag+)和t(NO3-)。 解:用银电极电解AgNO3溶液时,电极反应:
导电机理 电子导体:电子定向运动 离子导体:离子在溶液中定向迁移 电流流经导体 不发生化学变化 发生电解反应 温度升高 导电性下降 导电性上升
原电池和电解池的共同特点: 当外电路接通时在电极与溶液的界面上有电子得失的 反应发生,溶液内部有离子做定向迁移运动。
电极反应:把电极上进行的有电子得失的化学反应. 两个电极反应的总和对原电池叫电池反应,对电解池叫电解 反应。 注意:阴离子在阳极失去电子,失去电子通过外线路流向电源 正极.阳离子在阴极得到电子. 发生氧化反应的电极叫阳极,发生还原反应的电极叫阴极. 正负极依电势高低来定.
阳极:Ag→Ag++e阴极:Ag++e→Ag
电解前阳极区在23.14g水中有AgNO3为:
43.50 23.14 1.007mmol 1000
由库仑计中有0.723mmol的Ag沉积,则在电解池的阳极也有相 同数量的Ag被氧化为Ag+ 所以Ag+迁出阳极区的摩尔数为: (n电解前+n反应)-n电解后=1.007+0.723-1.390=0.340mmol
第7章 电化学习题答案

第7章 电化学7.1 用铂电极电解CuCl 2溶液。
通过的电流为20 A ,经过15 min 后,问:(1)在阴极上能析出多少质量的Cu? (2) 在27 °C ,100 kPa 下阳极上能析出多少体积的Cl 2(g )? 解: Pt 电极电解CuCl 2溶液时的电极反应,为电极反应的反应进度为因此:7.2 用Pb(s)电极电解Pb (NO 3)2溶液,已知溶液浓度为1 g 水中含有Pb (NO 3)2 1.66 × 10-2 g 。
通电一定时间后,测得与电解池串联的银库仑计中有0.1658g 的银沉积。
阳极区的溶液质量为62.50 g ,其中含有Pb (NO 3)2 1.151g ,计算Pb 2+的迁移数。
解:1231229.331])(NO [9.107)(--∙=∙=mol g Pb M molg Ag M用Pb (s )电极电解Pb (NO 3)2溶液时的阳极反应为-++→e Pb Pb 22设电解过程中水量保持不变,电解前阳极区Pb (NO 3)2的物质的量为molmol mol g Pb Pb n 312232310075.322.3310184.122.331)]151.150.62(11066.1[])(NO M[])(NO m[---⨯==∙-⨯⨯==电解前电解后阳极区Pb (NO 3)2的物质的量为mol 10475.3mol 22.331151.1])(NO M[])(NO m[3-2323⨯===)(电解后Pb Pb n电解过程中因电极反应溶解下来的Pb 2+的物质的量为mol mol Ag n n 3107683.0)9.1071658.0(21)(21-⨯=⨯==反应 Pb 2+迁移的物质的量molmol 4310683.310475.3-7683.0075.3n -n n n --⨯=⨯+=+=)(电解后反应电解前迁移于是,479.0107683.010683.3n n )(342=⨯⨯==--+molmol Pb t 反应迁移 7.3 用银电极电解AgNO 3溶液。
物理化学电子课件第七章电化学基础

第二节 电解质溶液
一、电导和电导率 图7-4所示为几种电解质溶液的电导率与浓度的关系。
第二节 电解质溶液
二、摩尔电导率
因为电解质溶液的电导率与浓度有关,因此不能用电导率来比较 不同浓度、不同类型的电解质的导电能力,需要引入摩尔电导率的概 念。
第二节 电解质溶液
三、电导的测定
电导是电阻的倒数,因此测量电解质溶液的电导实际上是测量其 电阻。测量溶液的电阻可利用惠斯通电桥,如图7-5所示。
第二节 电解质溶液
第三节 可逆电池及原电池热力学
一、可逆电池
(1)充电、放电反应必须可逆,即化学可逆和物质可逆,要求
(2)反应要在无限接近电化学平衡条件下进行,即可逆电池的 能量转移必须是热力学可逆的,要求电池必须在电流趋于无限小(即
I 0)的状态下工作。放电时对外所做的电功和充电时消耗的电功 大小相等,保证当系统恢复原状时环境也能复原,不留下任何变
第一节 电化学的基本概念
三、离子的电迁移和迁移数
3. 离子迁移数 t有多种测定方法,这里主要介绍希托夫(Hittorf) 法。其原理是:分别测定离子迁出或迁入相应电极区的物质的量及发 生电极反应的物质的量,然后通过物料衡算得到离子迁移数。实验装 置如图7-3所示。
第一节 电化学的基本概念
三、离子的电迁移和迁移数 实验测定中的物料衡算思路为:电解后某离子剩余的物质的量
二、法拉第电解定律
1833年,英国科学家法拉第(Faraday)在研究了大量电解过程后提出 了著名的法拉第电解定律——电解时电极上发生化学反应的物质的量与 通过电解池的电荷量成正比,简称为法拉第定律,其数学表达式为:
第一节 电化学的基本概念
三、离子的电迁移和迁移数
通电于电解质溶液后,溶液中承担导电任务的阴、阳离子分别向 阳极和阴极移动,同时在相应的两个电极界面上发生氧化或还原作用。 这种在电场作用下阴、阳离子分别向两极运动的现象称为电迁移。电 迁移是电解质溶液导电的必要条件。即
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
17
(2) 韦斯顿(Weston)标准电池 韦斯顿标准电池是高度可逆的电池
阳极: Cd+SO42-+8/3H2O(l)
CdSO4.8/3H2O(s) + 2e阴极: Hg2SO4(s) +2e-2Hg(l)+SO42电池反应: Cd+ Hg2SO4(s) + 8/3H2O(l) 2Hg(l)+ CdSO4.8/3H2O(s) 电池图示表示:
ν+
b- )
ν- 1/ν
= [(2b) b] = 4
1/3 -5
2
1/3
1/3
b
a± =γ±(b±/b )= 0.265×4 a = a± = 0.0421 = 7.46×10
ν 3
θ
×0.1 = 0.0421
例: 计算25℃下,0.005 mol kg-1的Na2SO4水溶液的 I、γ±。
解: I=1/2∑bBZB2 = 0.5×(0.005×2×12+0.005×22)
15
(2)金属-难溶氧化物电极 以锑-氧化锑电极为例:在锑棒上覆盖一层三氧化二锑,
将其浸入含有H+或OH-的溶液中就构成了锑-氧化锑电极。
酸性:
H+, H2O|Sb2O3 (s)|Sb 2Sb+3H2O(g)
碱性:
OH-, H2O|Sb2O3 (s)|Sb 2Sb+6OH-
电极反应:Sb2O3 (s)+6H++6e-
根据热力学原理可知,恒T、p时: 1mol化学反应可放热Qm=rHm, 如在电池中自发进行,则电池对外所能做的最大功:
Wr ΔrGm
效率: ΔG ΔH
恒温恒压下反应的G即为理论上电 池能将化学能转化为电能的那部分能量 。
5
例如:反应
H 2 (g) +
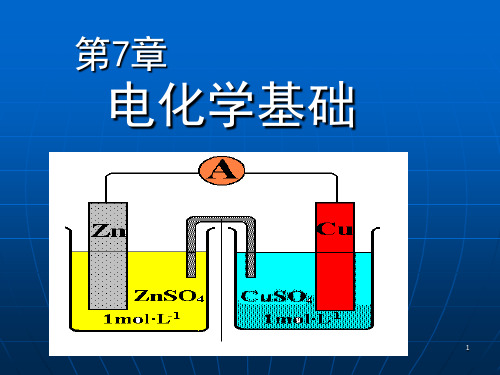
1 O 2 (g) === HCu-Zn电池
阳极: 阴极: Zn Zn2+ + 2eCu2+ + 2e- Cu
电池反应:Zn+Cu2+ Zn2++Cu
电池表示: Zn|ZnSO4(a1)¦ CuSO4(a2)|Cu
8
IUPAC(International Union of Pure and Applied Chemistry)
=0.015 mol kg-1
lg Az z I 0.509 z z I
0.5091 (2) 0.015 mol kg1 0.1247
0.75
§7.5 可逆电池及其电极种类
原电池是利用电极上的氧化还原反应实现化学能转化为 电能的装置。 自发反应 原电池装置 电能
12
(3) 氧电极 结构:将镀有铂黑的铂片浸入含有H+或OH-的溶液中,并 不断通O2(g)就构成了酸性或碱性氧电极 酸性: H+, H2O | O2(g) | Pt 电极反应:O2(g)+4H++4e-2H2O
标准电极电势:E {O 2 (g) H } 1.229 V
碱性: OH-, H2O | O2(g) | Pt
成了酸性或碱性氢电极。
11
酸性:
H+ | H2(g) | Pt
电极反应:2H++2e-H2(g) 标准电极电势:E{H H2 (g)} 0
优点:电动势随温度改变很小。
碱性: OH–, H2O | H2(g) | Pt
电极反应:2H2O+2e-H2(g)+2OH-
标准电极电势: E {OH H (g)} RT ln K 2 w F -0.828 V
a a a
b b
a a a a
2. 德拜-休克尔(Debye-Hückel)极限公式——稀 溶液中求某电解质平均离子活度因子的计算公式:
lg Az z I
在298.15 K水溶液中:
A =0.509(mol-1.kg)1/2
21
4. Qr,m的计算
恒温、可逆反应时:
Qr ΔS T
Qr,m
E 0 T p E 0 T p E 0 T p
E TΔ r Sm zFT T p
电池恒温可逆放电,不吸放热; 电池恒温可逆放电,吸热;
电极反应:Sb2O3 (s) +3H2O+6e-
优点:锑-氧化锑电极为固体电极,应用起来很方便。
16
3. 氧化-还原电极
如: Fe3+, Fe2+ Pt , Fe3+ + e Fe2+
Co3+, Co2+ Pt ,
质都在溶液中。
Co3+ + e Co2+
Pt 只起输送电子的作用,参加氧化-还原反应的物
Cd(汞齐)|CdSO4.8/3H2O(s)|CdSO4饱和溶液| Hg2SO4(s) |Hg
(电极反应可逆,没有液接电势,所以在I0时是高度可逆的电池)
优点:电动势稳定,随温度改变很小 用途:配合电位计测定原电池的电动势
18
2. 电池电动势的测定
电池电动势的测定必须在电流无限接近于零的条件下进行。 波根多夫(Poggendorf)对消法: 三个电池: 工作电池
标准电池
待测电池 一个检流计
一个滑线电阻
检流计中无电流通过时:
AB Ex EN AB
19
§7.7 原电池热力学 1. 由E计算rGm
例:Zn + CuSO4 === Cu + ZnSO4
恒温、恒压、可逆条件下: ΔrGT , p Wr 每摩尔电池反应所做的可逆电功为:
rGm
Wr zFE
甘 汞 电 极 银-氯化银电极
14
以甘汞电极为例: 电极表示:Cl-|Hg2Cl2(s)|Hg 电极反应:电极反应可认为分两步进行: Hg2Cl2(s) Hg22+ + 2ClHg22+ + 2e 2Hg Hg2Cl2(s) +2e-2Hg +2Cl-
(1) (2) (3)
优点:容易制备,电极电势稳定。故在测量电 池电动势时常作为参比电极
电池恒温可逆放电,放热。
22
5 能斯特方程
对于任意化学反应: 0 B B
B
rGm rGm RT ln (aB ) B B
所以
zFE zFE RT ln( a B ) B
O
B
整理,得
RT EE ln( a B ) B B zF
O
— 能斯特(Nernst)方程
10
§7.6 电极的种类 1. 第一类电极
金属电极
惰性金属+气体电极:氢电极、氧电极、卤素电极。
(1)金属电极和卤素电极:均较简单,如 Zn2+|Zn: Zn2++2e-Zn Cl- | Cl2|Pt: Cl2(g)+2e-2Cl(2)氢电极 结构:将镀有铂黑的铂片浸入含有H+ 或OH-的溶液中,并不断通H2(g)就构
Zn片: Cu片:
Zn Zn2+ + 2e2H+ + 2e- H2
H2SO4
Zn+2H+ Zn2++H2
充电时:
Zn片: Cu片:
2H+ + 2e- H2 Cu Cu2+ + 2e2H+ + Cu H2 + Cu2+
在电池充放电的过程中,电极、电池反应均不一样, 故不是可逆电极。
z 电池反应的电荷数; F 法拉第常数(C/mol); E 电池电动势; - 系统对环境作功
Δ rGm zFE
(测E rGm)
该式说明,可逆电池的电能来源于化学反应的做功能力的变化。 对于G<0的反应,在恒T、p可逆条件下,吉布斯函数的减少可全部 转化为电功。
20
2. 由 E / T p 计算rSm
6
1. 可逆电池
电池的可逆包括三方面的含义: (1) 化学可逆性 即物质可逆。要求两个电极在充电时 均可严格按放电时的电极反应式逆向进行。 (2) 热力学可逆性 即能量可逆。要求电池在无限接近 平衡的状态下工作。要满足能量可逆的要求,电池必须在电流趋 于无限小、即I0的状态下工作。 (3) 实际可逆性 即没有由液接电势等因素引起的实际 过程的不可逆性。严格说来,由两个不同电解质溶液构成的具有 液体接界的电池,都是热力学不可逆的,因为在液体接界处存在 不可逆的离子扩散。 不过在一定精度范围内,人们为研究方便往往会忽略一 些较小的不可逆性。
Qr = T rSm= 298.15 K(-125.4 JK-1mol -1) = -37.39 kJmol
电解质离子的平均活度与平均活度系数
平均离子活度和平均离子活度因子
若B电解质C+A-的质量摩尔浓度为b,活度为a。 并定义离子的平均活度、平均活度系数与平均质量 摩尔浓度分别为 1 /
b b b
1 / 1 /
离子强度:溶液中每种离子的质量摩尔浓度乘 以该离子电荷数的平方,所得诸项之和的一半 称为离子强度,即
1 2 I bB zB 2
例:实验测得25℃时0.1 mol/kg H2SO4的γ±= 0.265,求H2SO4的活度。
解:对于H2SO4, ν+= 2, ν- = 1; ν= ν+ + ν- = 3; b+ =ν+b = 2b, b- =ν-b = b, b±=(b+
