第十一章 醛和酮
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
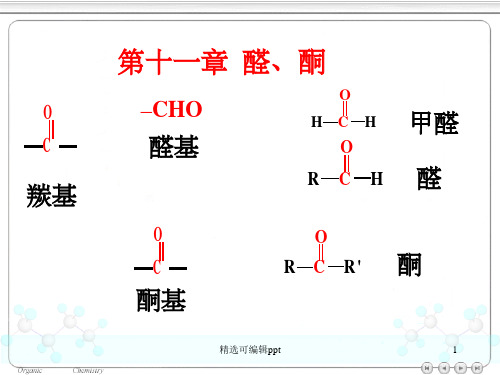
O C
羰基
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
第十一章 醛和酮
SO 3Na CH 3CH 2CH 2CHO +NaHSO 3 CH 3CH 2CH 2CH OH
SO 3Na Na 2CO 3 CH 3CH 2CH 2CH CH 3 CH 2CH 2CHO +Na 2SO 3 +NaHCO 3 H 2O OH
第十一章 醛和酮
Chapter 11 Aldehyde and Ketone
δ
+
δ
C
O
Company Logo
Contents
1
醛和酮的分类和命名★
醛和酮的物理性质◎
2
3 4
2
醛和酮的化学性质★
醛和酮的制备◎
Company Logo
第一节 醛和酮的分类和命名
醛和酮均含有羰基的化合物
O C
羰基碳原子上同时连有两个烃基的叫酮 羰基碳原子上至少连有一个氢原子的叫醛。
27
6、CH 3CC 6H 5 O
7、C 6H 5CHO
O
3>2>1>8>7>4>5>6
Company Logo
第三节 醛和酮的化学性质 2、与亚硫酸氢钠加成
醛酮与饱和(40%)亚硫酸氢钠溶液作用,很快 生成白色沉淀物。
R (R')H HO C =O + :S O Na
R C (R')H
OH SO3Na
-羟基磺酸钠易溶于水,不溶于饱和亚硫酸
氢钠,而是以白色晶体析出。
28
=
O
α- 羟基磺酸钠
Company Logo
第三节 醛和酮的化学性质
(1) 反应的应用范围:★ 所有的醛、脂肪族甲基酮、≤C8的环酮 (2) 应用: (A) 用于定性鉴别★ α-羟基磺酸钠易溶于水,但不溶于饱和的 NaHSO3溶液而析出无色针状结晶,故可定性 鉴别。
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
有机化学--第十一章 醛 和 酮

等氧化剂所氧化,例如:
常把次卤酸钠的碱溶液与醛或酮作用生成三卤甲烷的 反应称为卤仿反应。
52
如果用次碘酸钠(碘加氢氧化钠)作试剂,产生具有特殊气味的黄
色结晶的碘仿(CHI3),这个反应称为碘仿反应。可通过碘仿反应来 鉴定具有 构的醛和酮,以及 结构的醇,因为次
碘酸钠又是一个氧化剂,能将
结构的醛或酮:
结构的醇氧化成含
53
生成α-羟基腈,此法优点是可避免使用有毒的氰化氢,
而且其产率也较高。例如:
33
3.与醇加成
在干燥氯化氢或浓硫酸的作用下,一分子醛或酮与
一分子醇发生加成反应,生成的化合物分别称为半缩醛
或半缩酮。
34
半缩醛(酮)一般是不稳定的,它易分解成原来的醛
(酮),因此不易分离出来,但环状的半缩醛较稳定,能
够分离得到。例如:
当醛、酮进行加成反应时,一般是试剂带负电荷
(亲核)的部分先向羰基碳原子进攻,然后是带正电荷
(亲电)的部分加到羰基氧原子上。决定反应速率的是第 一步,即亲核的一步,所以称为亲核加成反应。
18
亲核加成反应的难易取决于羰基碳原子的亲电性的
强弱、亲核试剂亲核性的强弱,以及电子效应和空间效
应等因素。芳香族羰基化合物进行亲核加成反应困难的 原因是羰基与芳环共轭;同时芳环有较大的体积,能产
14
脂肪醛及芳醛分子中,与羰基相连接的氢在核磁共振谱中的特
征吸收峰出现在极低的低场,化学位移值δ=9~10。醛基质子的化学 位移值是很特征的,这一区域内的吸收峰可用来证实醛基(—CHO)的
存在。
15
与其它吸电基一样,羰基对于与其直接相连的碳原子上的质 子也产生一定的去屏蔽效应。
16
有机化学第11章 醛和酮

O H3C C CH3
NaCN H2S O4
CH3 CH2=C-COOCH3
(CH3)2CCN OH
H2O
CH3 CH2=C-CN
CH3OH
CH3
H
CH2=C-COOCH3
α-甲基丙烯酸甲酯
2、与格氏试剂的加成反应
δ C
δ O
+ δR δMgX
无水乙醚
OMgX H2O C
R C OH + HOMgX
R
C H (R )
O
+ CH3-CH-CH3 ( i - Pr -O-)3Al
R CH OH
OH
H (R )
+ CH3-C-CH3 O
可逆反应,正反应称为麦尔外因-庞多夫-维尔莱还原反应, 其逆反应称为奥本奥尔氧化反应。 反应的专一性高,只使羰基与醇羟基互变而不影响其它基团, 故为一级醇、二级醇与醛酮对应转变的重要方法。
4-甲基-3-乙基己醛
2-甲基-3-戊酮
2-苯丙醛
例如:
CH3-C=CHCH 2CH2-CH-CH 2CHO
CH3
CH3
3,7 二甲基 6 辛烯醛
H3C O
3 甲基环戊酮
O
O
O
C-CH 2CH3
C-CH 3
2 环己烯酮
1 环己基 1 丙酮
1 苯基 1 乙酮
多元醛酮:称某二醛或酮
当酮羰基和醛羰基共存时,酮羰基称羰基、酰基或氧代;
醛的异构现象是碳链异构。 酮的异构现象是碳链异构和羰基的位置异构。
三、醛酮的命名
1、IUPAC命名法
选择含羰基的最长链为主链;从近羰基的一端开始编号, 醛基总在链端;取代基位次和名称写于母体名称之前。
理学第十一章醛和酮

O
Ar C OH + H-
O
Ar C H + H-
O-
+
Ar C H H
H2O
OH Ar C H
H
反应实例
CHO +;
CH2OH
CHO + NaOH O
COO-Na+ +
CH2OH
O
O
分子内的Cannizzaro反应
CHO 浓 NaOH CHO H2O
HOCH2-COONa H3O
还原反应选择性还原羰基为 醇.
(4)活泼金属 Na,Mg等 + 酸(醇,水 or 碱)
还原 RCH=O
RCH2—OH 伯醇
(5) 双分子还原: 活泼金属 Na,Mg等 + 酸(醇,水 or NH3) 酮在上述条件下则会进行双分子还原,生成邻二醇
酮的双分子还原,如:
——片呐醇(pinacol)的合成及Pinacol重排
Gattermann-Koch 反应
O CH2 C
AlCl 3 + CO +HCl
OHC
O CH2 C
(2) 芳烃的控制氧化:
CH3
[O]
CHO
[ O ]= (1) MnO2 + 65% H2SO4 (2) H3O
(1) CrO3 + Ac2O (2) H3O
芳环上必须有-CH3
[ O ]= O2, 135℃,(CH3COO)2Mn 芳环上必须有-CH2-
3)自氧化还原反应—Cannizzaro反应
• 无 - 活泼H原子的醛,在强碱作用下,发生分子 间氧化-还原反应,1个分子醛基H以负氢的形式转 移给另1个分子,结果1分子被氧化成酸,而另1分 子则被还原为1级醇,故又称为 歧化反应,例如:
第十一章 醛和酮

魏悌希(Wittig)发现的此反应对有机合成作出了巨大的贡献,特 别是在维生素类化合物的合成中具有重要的意义,为此他获得了1979 年的诺贝尔化学奖。
3. 氮亲核试剂 醛或酮和氨及其衍生物加成时,所得到的产物往往不
稳定,常进一步脱水生成含有碳氮双键的化合物。
①和氨反应: 醛或酮和氨反应生成羟胺,羟胺很不稳定,脱水得到 亚胺。
低频位移;
1559~1450 cm-1为苯环骨架伸缩振动,3060~3010 cm-1 为苯环上C—H键的伸缩振动。
2. 核磁共振谱
和羰基相连的氢(醛基氢)的化学位移特别大,在10左
右,这是碳氧双键的磁各向异性效应和氧原子的吸电子 诱导效应共同作用的结果。 与羰基相连的甲基、亚甲基氢化学位移值在2.0~2.5
第十一章 醛和酮
醛和酮的结构、命名、制法; 醛和酮的物理性质及光谱性质; 醛和酮的化学性质及它们之间的差异;
羰基的亲核加成反应历程;
重要的醛酮和不饱和羰基化合物的性质。 醛和酮的化学性质和制备; 羰基的亲核加成反应历程。
醛和酮分子中都含有羰基。
(H) R C
醛
O H
O C H
(醛基)
O′
′
′
CH3CH2CH2CHO
例:BrCH2CH2CH2CHO
CH3CH2CH2CCH2CH2CH3
-溴丁醛
2. 衍生物命名法
酮有时使用,按照和羰基相连的两个烃基来命名。
O CH3CH2CCH2CH3
二乙基酮
O CH3CH2CCH3
甲基乙基酮
O CCH3
甲基环己基酮
四、醛酮的结构
马上脱水生成亚胺,称为Schiff碱。
脂肪族亚胺一般不稳定,容易分解;芳香族亚胺则较稳
有机化学第五版第十一章醛和酮

丙基α-萘基酮; 1-〔1-萘基〕-1-丁酮
第二节 醛、酮的构造,物理性质和光谱性质 Structure, Physical Properties & Spectrum
一、Structure
(1) 羰基是sp2杂化的平面型构造; (2) 羰基是极化的、极性的共价键,羰基碳上带有局部正电荷。
醛、酮羰基的构造
R=H
OH
C
R
CC
H
H
OH
C
H
CC
H
R
OH O
H+
C C CH3
cis-烯基醇
trans-烯基醇
O
C
CC
CH3
-羟基酮
, b-不饱和酮
3. 与格氏试剂的加成反响
(1) 格氏试剂 (RMgX)中的R是碳负离子,具有强的亲核性,是重要的亲核试剂, 由它进攻碳正离子是碳-碳结合的重要方法;
(2) 格氏试剂与醛酮反响后再经水解得一系列的醇,是醇的重要制备方法;
( 6 H C 5 ) 3 P C 6 H = 5 + H C 6 H 5 C = C H O C 6 H 5 C = C 6 H 5 H
〔2〕IR: C=O在1750~1680cm-1之间有强吸收峰〔鉴别羰基〕;
~2720cm-1对应-CHO中C-H伸缩振动,区别是否为醛 基。 羰基上连有共轭基团时,该吸收向低波数方向移动。 环烷酮类的频率受环大小的影响。
Acetaldehyde
〔2〕IR: C=O在1750~1680cm-1之间有强吸收峰〔鉴别羰基〕;
如氨的衍生物为仲氨,那么当有α-H存在时,醛、酮可与 之反响生成烯胺,烯胺在有机合成上是个重要的中间体。
R R C H 2CO +N H R 2
第十一章醛和酮

第十一章醛和酮教学目的:能正确命名醛、酮,掌握羰基亲核加成反应的历程和影响反应速度的因素,了解其在分离、鉴别、有机合成中的应用。
掌握醛、酮的主要化学性质及其在分离、鉴别、有机合成中的应用。
教学重点:羰基亲核加成反应,醛、酮的化学性质教学难点:羰基亲核加成反应历程。
第一节醛、酮的分类,同分异构和命名一、分类根据烃基的不同可以分为脂肪醛、酮和芳香醛、酮。
脂肪醛CH3CH2CHO 脂肪酮CH3COCH3脂环醛CHO脂环酮O=芳香醛CHO芳香酮COCH3根据烃基是否含有重键又可以分为饱和醛、酮和不饱和醛、酮。
不饱和醛CH3CH=CHCHO不饱和酮CH3CH=CHCOCH3根据羰基的个数可以分为一元醛、酮和多元醛、酮。
二元醛CH2CHOCH2CHO二元酮CH3CH2COCH2COCH3二、同分异构现象醛的同分异构---碳链异构引起。
酮的同分异构---碳链异构、碳基位置异构。
同碳数饱和一元醛酮,分子式CnH 2n O ,互为同分异构:三、命名1. 系统命名法:(1)选择含羰基最长碳链作主链,称为某醛或某酮;(2)由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置。
酮基的位置则需用数字标明,写在“某酮”之前,并用数字标明侧链所在的位置及个数,写在母体名称之前。
例如:2- 甲基丙醛 2- 苯基丙醛3-甲基-6-庚炔醛C 6H 5CHCHOCH 37HCCCH 2CH 2CHCH 2CHOCH 3654321CH 3CHCHOCH 3CH 3COCH 3丙酮CH 3COCH 2CH 3丁酮CH 3CO(CH 2)CH 32-己酮CH 3COCH 2COCH 2CH 32,4-己二酮COCH 2CH 31-苯-1-乙酮(苯乙酮)1-环己基-1-丙酮COCH 32. 普通命名法醛的命名与醇的习惯命名法相似,称某醛;脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮。
例如:CH 3CHO 乙醛 CH 3CH (CH 3)CHO 异丁醛甲基乙基酮甲基苯基酮(1-苯基-1-乙酮)CH 3C OCH 3C 2H 5C O另外,醛、酮命名时习惯上还采用希腊字母α、β、γ等,α碳指与醛基或酮基直接相连的碳原子。
有机化学 第十一章 醛和酮

酮羰基约在1715cm-1。
羰基与芳环或烯键共轭,频率降低。
1HNMR
O C H 9~10ppm
O CH2 C H 2.0~2.5ppm
MS
O R C R + C6H5C O m/z = 105
C6H5C O
C6H5 + CO m/z = 77
第三节
醛酮的化学性质
醛酮的结构与反应性
羰基亲核加成 及氢化还原
酸催化
C=O + H
+
C=OH
+
-H+ H2N-Z,
H+
H2O
+
H
C----N-Z
C=N-Z + H2O + H+
反应需在弱酸性的条件下进行。
应用:
a 提纯、鉴别醛酮
重结晶 稀酸
C=O + H2N-Z
C=N-Z
C=O
b 保护羰基
A B C=O + H2NR
A B
C=NR
参与反应
稀酸
A' B'
C=O
Nu C OH
[
+ C=OH
+ ] C-OH
Nu-
醛、酮的反应活性:
R H
R C=O > R'
C=O >
Ar R'
C=O
1. 与氢氰酸的加成反应
OH C=O
+ H
CN
C CN
α -羟基腈
例:
O CH 3CCH 3
N aCN , H 2 SO 4
OH CH 3CCH 3 CN
α -羟基腈是很有用的中间体,由它可
有机化学 第十一章 醛 和 酮

4.与醇的加成反应
R 无水HCl R OH C O + R''OH C H H OR'' ( R' ) ( R' ) 半缩醛(酮 ) 不稳定 一般不能分离出来 R''OH 干 HCl R H ( R' ) C OR'' OR'' + H2O ( 缩醛 酮) ,双醚结构。 对碱、氧化剂、还原剂稳定, 可分离出来。 酸性条件下易水解
R H (R')
CH OH
OH
CH3CH2CH2CH2CH2OH (C=C, C=O 均被还原 )
如要保留双键而只还原羰基,则应选用金属氢化物为 还原剂。
23
2、金属氢化物为还原剂还原 1)LiAlH4还原
CH3CH=CHCH2CHO ① LiAlH 4 干乙醚 ② H2O
CH3CH=CHCH2CH2OH ( 只还原 C=O )
C H δ C δ O R (H ) 酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳 涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应 卤代反应
8
一、亲核加成反应
1.与氢氰酸的加成反应
C O + HCN α C OH CN 羟基睛
反应范围:醛、脂肪族甲基酮。ArCOR和ArCOAr难反应。αβγδ α-羟基腈是很有用的中间体,它可转变为多种化合物, 例如: CH 3 CH 3
C O 无水 NH2-NH2 加成,脱水 C N-NH2 KOH 或 C2H5ONa C 2H5OH 200 ℃ 加压 回流 50~100h CH2 + N2
4
1946年-黄鸣龙改进了这个方法。 改进:a 将无水肼改用为水合肼;碱用NaOH;用高沸 点的缩乙二醇为溶剂一起加热。加热完成后,先蒸去水和 过量的肼,再升温分解腙。
第十一章 醛和酮习题答案

第十一章醛和酮习题答案⒉解:饱和一元醛酮的通式为CnH2nO,由题意12n+2n+16=86, ∴n=5 故该化合物的分子式为C5H10O∴饱和一元醛有:饱和一元酮有:⒊解:沸点高低顺序为⑷<⑵<⑴<⑶,固有机物沸点随分子量增加而增加,故⑷沸点最低.在⑴⑵⑶中,只有⑶可形成分子间氢键,故沸点最高. ⑴与⑵相比, ⑴是羰基化合物,极性较强,分子间作用较大,而⑵为醚,分子极性小,所以沸点比⑴低.5.⒍解:先用UV谱将它们区别:在近紫外有强吸收的为A组[(1)和(4)], 无强吸收的为B组[(2)和(3)]A组:用UV: (1)和(4)为共轭酮,但(4)共轭系统比(1)长,且在紫外区(4)向红移比(1)大,故吸收波长大的为(4)B组:用IR: (2)为环戊酮γC=O吸收峰在1740cm-1左右, (3)为环己酮γC=O在1715cm-1左右, NMR (2)有三组氢的吸收峰,而(3)则有四组氢的吸收峰.⒎解:用Schiff试剂,检验废水;如显紫红色表示可能有醛存在,再加多量H2SO4,紫红色不褪,示有甲醛。
8.解:HCN对羰基加成是亲核加成,能降低羰基碳原子上电子云密度的结构因素将会使K值增大,故K值顺序是:(6)<(4)<(3),而羰基碳原子的空间位阻愈小,则K值增大,故K 值的顺序是:(1)<(2)<(5)<(6) 综合考虑:则K值顺序是(1)<(2)<(5)<(6)<(4)<(3).9.解:根据Mecrwein-pondorf反应规规律,进行下列反应, 可得R-(-)-6-甲基-2-庚醇在此还原过程中,生成的过渡态可能有两种构象(Ⅰ) 和(Ⅱ)在(Ⅰ)中两个大基团处于反式,较(Ⅱ)稳定,为优势构象。
因此,经由(Ⅰ)所生成的 R-(-)-6-甲基-2-庚醇为优势产物。
选用(S)-2-苯基丙醛为原料,进行下列反应,可得所需产物。
第十一章醛和酮

(二)炔烃水合
R-C≡C-R’ + H2O
Hg2+ H2SO4
O R-C-CH2-R’
HC≡CH + H2O
HgSO4 CH3CHO
H2SO4
炔烃的硼氢化-氧化也可制备醛酮:
R-C≡C-H B2H6
H2O2 OH-
RCH2CHO
第十一章醛和酮
(三)同碳二卤化物水解
由于芳环侧链上的α-H容易被卤代,此法主要用 于制备芳香族醛和酮。如:
CH3(CH2)6CH2OH CH2CH2,25℃ CH3(CH2)6CHO
3、一个特殊的氧化剂—oppenauer氧化剂 它可将不饱和醇氧化成不饱和醛酮,而保留双键
(CH3)2C=CH +(CH3)2C=O [(CH3)2CHO]3Al (CH3)2C=CH +(CH3)2COH
CH2CH2OH
苯回流
RCOCl
R’MgX
H2O
RCOR’
R’C≡CNa
RCOC≡CR’
以上是制备醛酮的主要方法,此外,还有烯烃的 氧化等。
H2C=CH2 + O2
CuCl2-PdCl2 CH3CHO
乙醛的工业制法
第十一章醛和酮
异丙醇铝+异丙醇的还原机理
R
R
O=C— R’
[(CH3)2CHO]3Al + R’—C=O
Cl
-CH2-
Cl2
光
-C-
Cl
Clቤተ መጻሕፍቲ ባይዱ
O
-C-
+ H2O CaCO3
-C-
Cl
第十一章醛和酮
(四)付-克酰基化反应
付-克酰基化反应
AlCl3
第十一章 醛和酮

第十一章醛和酮第一节醛、酮的分类和命名一、分类二、同分异构现象醛酮的异构现象有碳连异构和羰基的位置异构。
三、醛酮的命名选择含有羰基的最长碳链为主链,从靠近羰基的一端开始编号。
例如:碳原子的位置也可用希腊字母表示。
例如:第二节醛、酮的结构、物理性质和光谱性质一、醛、酮的结构醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O = σ+π 与相似C=O双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
二、光谱性质UVIR羰基有共轭时吸收频率移向低波数1HNMR 醛基氢的δ= 9-10,羰基α-H的δ= 2.0-2.5第三节醛、酮的化学性质醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。
所以羰基易与亲核试剂进行加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H)较活泼,能发生一系列反应。
亲核加成反应和α-H的反应是醛、酮的两类主要化学性质。
醛、酮的反应与结构关系一般描述如下:一、亲核加成反应1.与氢氰酸的加成反应反应范围:醛、脂肪族甲基酮。
ArCOR和ArCOAr难反应。
α-羟基腈是很有用的中间体,它可转变为多种化合物,例如:2.与格氏试剂的加成反应式中R也可以是Ar。
故此反应是制备结构复杂的醇的重要方法。
这类加成反应还可在分子内进行。
例如;3.与饱和亚硫酸氢钠(40%)的加成反应产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。
故此反应可用以提纯醛、酮。
1)反应范围: 醛、甲基酮、七元环以下的脂环酮。
2)反应的应用a 鉴别化合物b 分离和提纯醛、酮c 用于制备羟基腈,是避免使用挥发性的剧毒物HCN而合成羟基腈的好方法。
醛酮的分类和命名

第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名1.醛、酮的系统命名以包含羰基的最长碳链为主链,看作母体。
从靠近羰基的一端开始,依次标明碳原子的位次。
在醛分子中,醛基总是处于第一位,命名时可不加以标明。
酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。
α是指官能团羰基旁第一个位置,β是指第二个位置…。
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
ⅲ当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
2. 酮还有另一种命名法根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
后面是母体如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
英文羰基做取代基时用“oxo”(氧代)表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
第二节醛、酮的物理性质和光谱性质一、物理性质除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。
低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。
低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。
碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
第十一章醛和酮

加成反应 烯烃的加成一般为亲电加成; 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
与氰化氢加成
产物是有用的合成中间体,可转化成α-羟基酸等。
用无水液体氢氰酸为原料可以得到理想结果,但 HCN易挥发,剧毒,限制了使用。在实际合成中多 采用现场制备的方法合成。
2-甲基-4-苯基 丁醛
O
1-苯基-2-丁酮
比较简单的酮常用羰基两边烃基的名称来命名(小取 代基在前:
醛酮的物理性质
室温下,甲醛为气体(污染、防腐),12个碳原子 以下的醛酮为液体,高级醛酮为固体。
低级醛有刺鼻的气味, 中级醛(C8-C13)则有果香。 低级醛酮的沸点比相对分子量相近的醇低。(分子
O
H +
H 3 CC H 3 +C H 3 O H
O H
H +
O C H 3
H 3 C C H 3
H 3 C C H 3
O C H 3 C H 3 O H O C H 3
O + C 2 H 5 O HH + C 2 H 5 O O C 2 H 5 + H 2 O
恒沸液或分水器
O
HO OH +
OO
常用1,2-或1,3-二元醇与生成环状缩醛以保护羰基。
C H O
H O
O
H 3 C O B r+ H O O H H + H 3 C O O B r d r y M e g t h e r
O
O
H +
H 2 O H 3 C
O H
C H O + H OO HH +
O OO H s 2 O O 2 4 H OO H O OH H 2 + O H OO H C H O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在碱催化下,反应很难停留在一取代阶段, 当α-C上有三个H,如乙醛或甲基酮,则3个H 都可被取代得到三卤代物。
(1)
●
卤仿反应
(1)由于卤代反应生成的三卤代物的三个卤原 子的吸电子诱导效应,使得羰基碳原子的正电 性更强,在碱性溶液中很容易受 OH - 进攻, 形成氧负离子中间体,然后发生C-C键断裂, 生成三卤甲烷和羧酸盐。
第十一章 醛 和 酮
第一节 醛、酮的定义,分类结构和命名 第二节 醛、酮的制法 第三节 醛、酮性质
第四节 亲核加成反应历程
第一节 醛、酮的定义、分类、结构和命名
* 定义
●
醛、酮分子中都含有羰基(-CO-),称为羰基 化合物。
●
羰基碳原子上至少连有一个氢原子的叫做醛 羰基碳原子上连有两个烃基的叫做酮(R-CO-
二、化学性质 * 概述 羰基的许多反应是醛、酮所共有的,但由 于醛、酮在结构上的区别,化学性质也有所差 异。醛、酮发生化学反应的主要部位如下:
* 亲核加成反应 ● 与氢氰酸加成
(1、2)
●
与亚硫酸氢钠加成
●
与醇加成
醇是含氧的亲核试剂,在干燥氯化氢 存在下,能与醛加成生成半缩醛。若醇过 量,则可生成缩醛。
(2)通常把含有 “CH3CO-” 结构的醛或酮在碱 性溶液中与卤素作用生成卤仿的反应称卤仿反 应。当卤原子是I2时,产生的碘仿为黄色晶体, 且有特殊气味,所以常用碘仿反应来鉴定具有
“CH3CO-”结构的醛、酮。
(3)具有“CH3CH(OH)-”结构的醇也能发生 碘仿反应,因为 NaOI可将“CH3CH(OH)-” 氧化成“CH3CO-”,所以碘仿反应也可以用于鉴 别有此结构的醇。
●
命名举例
第二节 醛、酮的制法
* 醇的氧化和脱氢
伯醇和仲醇通过氧化或脱氢反应,可以分
别生成醛和酮。醇的氧化易使醛继续氧化→酸, 可用此法制备易挥发的低级醛类。此法更适于 制酮,脱氢制得的醛、酮纯度很高,但条件苛 刻,主要是工业制法。 * 炔烃水合(详见炔与水的加成) 乙炔水合生成乙醛,其它炔烃水合均生成酮,
* 芳烃侧链的氧化
芳环侧链上的α-H容易被氧化,控制反应
条件,可制备相应的芳醛或芳酮。芳环上的甲
基可被氧化成醛,但由于可继续氧化成羧基, 所以制芳醛时,必须选择适当的氧化剂。
* 羰基合成
烯烃与一氧化碳和氢气在某些金属的羰基 化合物的催化下,在加热、加压条件下可发生 反应,生成多一个碳原子的醛,这个反应叫羰 基合成。是增长碳链的方法之一。例如:
* 与氨的衍生物的缩合(加成-消除)反应 反应先加成再脱去一分子水,就相 当于分子间脱去一分子水。
(1)
说明:
(1)此反应一般要在弱酸催化下进行。
(2)反应后的产物大部分是固体,具有一定的
熔点,在稀酸的作用下能水解回到原来的醛、 酮,故常用于醛酮的分离、提纯和鉴别。在 实验室常用2.4一二硝基苯肼来鉴别பைடு நூலகம்、酮。 (3)氨的衍生物可与羰基加成又称羰基试剂。
(3)乙醛进行缩合反应历程 首先是碱夺取α-H 形成碳负离子。形成
的碳负离子作为亲核试剂,进攻另一分子乙
醛的羰基碳原子发生亲核加成反应,生成β-
羟基醛。
通过羟醛缩合反应可以增长碳链,也可制 取α、β不饱和醛。
(4)具有α-H的酮也能起类似的反应,但比醛 困难。
●
卤代反应
醛、酮分子中的α-H 容易被卤原子取 代生成α-卤代醛、酮
* α-H的反应
●
羟醛缩合反应
(1)含α-H 的醛在稀碱的作用下,一分子醛的 α-H 加到另一分子醛的氧原子上,其余部分 加到羰基碳原子上,生成β-羟基醛(醇醛), 这个反应叫做羟醛缩合反应或醇醛缩合反应。
(2)含α-H 的两种不同的醛进行上述反应,则 生成四种不同的β-羟基醛的混合物,无实际意 义。若一种为不含α-H 的醛,则可得到收率较 好的某一种产物,如:
第三节 醛、酮性质
一、物理性质 除甲醛在常温下是气体外,十二个碳以下 为液体,高级醛、酮是固体。分子间无氢键。 醛、酮的沸点比相应的醇要低,由于羰基的极 性较强,所以沸点比相应的烃类高。如: 甲醇 分子量 32 Pb=64.7℃ 甲醛 分子量 30 Pb=-21℃ 乙烷 分子量 30 Pb=-88.6℃ 低级醛、酮能溶于水,一般醛、酮都可溶 于有机溶剂,丙酮本身就是良好的溶剂。
2
*
●
命名 习惯命名法(简单的醛、酮)
(1)醛:与醇相似,以相应的烃基为母
体(包括羰基碳)称为“某醛”。 (2)酮:在“甲酮”的前面加上羰基所 连的两个烃基的名称,先简后繁(不饱 括羰基碳)。
●
系统命名法
(1) 脂肪族醛、酮:选择含羰基的最长 碳链为主链,从靠近羰基的一端开始编 号,标明羰基的位次,醛命名时不必标 出羰基的位次。 (2) 芳香族醛、酮:脂肪链为主链,芳 环做为取代基。
在工业上此法主要用于生产乙醛。
* 同碳二卤化物水解 同碳二卤化物水解能生成相应的羰基化合物。 例如:
* 付列德尔一克拉夫茨酰基化反应
此法是制备芳酮较好的方法。
* 在AICI3-Cu2Cl2存在下,芳烃与CO和HCl作用, 可以生成环上引入一个甲酰基的产物,这个反应 叫做伽特曼一科赫反应。此反应常用来由烷基苯 制取相应的芳醛。
(R-CH0)
●
R’)。R=R’时称单酮,R≠R'时称混酮。
* 分类
●
根据醛、酮分子中烃基不同可分为脂肪族醛、
酮和芳香族醛、酮。
●
根据分子中是否有不饱和键,又可分为饱和醛、
酮和不饱和醛、酮。
●
根据分子中羰基的数目分为一元、二元或多元
醛、酮。
* 结构
羰基的碳氧双键由一个σ键和一个π键组
成。羰基碳原子为SP 杂化,其中一个SP2杂化 轨道与氧原子的一个 2P 轨道形成σ键,另外 两个SP2杂化轨道分别与氢原子 S 轨道和烃基 中的α-C的SP3杂化轨道形成σ键,这三个σ键 处在同一平面上,夹角接近120°。羰基碳上 剩余的P轨道与氧的另一个P轨道均垂直于三个 σ键所在平面,侧面重叠,形成π键。最简单 的甲醛分子结构如图。
●
与格氏试剂加成-- 可用此法制伯、仲、叔醇
●
与水加成 水是一个很弱的含氧亲核试剂,它能与 醛反应生成水合物。
由于加成产物同碳上有两个羟基,因此很 不稳定,往往只能存在于水溶液中。如果醛基 与一个很强的吸电子基相连,如三氯乙醛,这 时醛基碳原子正电性增强,它能与水加成生成 稳定的水合物,可以被单独分离出来。
