乙醇质量标准 版药典
美国药典无水乙醇标准

Dehydrated AlcoholC 2H 6O 46.07Ethanol.Ethyl alcohol [64-17-5].» Dehydrated Alcohol contains not less than 99.2 percent, by weight,corresponding to not less than 99.5 percent, by volume, at 15.56, of C 2H 5OH. Packaging and storage — Preserve in tight containers, protected from light. USP Reference standards 11—USP Dehydrated Alcohol RS .Clarity of solution — [NOTE —The Test solution is to be compared to Referencesuspension A and to water in diffused daylight 5 minutes after preparation of Reference suspension A.]Hydrazine solution — Transfer 1.0 g of hydrazine sulfate to a 100-mL volumetric flask, dissolve in and dilute with water to volume, and mix. Allow to stand for 4 to 6 hours. Methenamine solution — Transfer 2.5 g of methenamine to a 100-mL glass-stoppered flask, add 25.0 mL of water, insert the glass stopper, and mix to dissolve.Primary opalescent suspension — [NOTE —This suspension is stable for 2 months,provided it is stored in a glass container free from surface defects. The suspension must not adhere to the glass and must be well mixed before use.] Transfer 25.0 mL ofHydrazine solution to the Methenamine solution in the 100-mL glass-stoppered flask. Mix, and allow to stand for 24 hours.Opalescence standard — [NOTE —This suspension should not be used beyond 24 hours after preparation.] Transfer 15.0 mL of the Primary opalescent suspension to a 1000-mL volumetric flask, dilute with water to volume, and mix.Reference suspensions — Transfer 5.0 mL of the Opalescence standard to a 100-mL volumetric flask, dilute with water to volume, and mix to obtain Reference suspension A. Transfer 10.0 mL of the Opalescence standard to a second 100-mL volumetric flask, dilute with water to volume, and mix to obtain Reference suspension B.Test solution A: substance to be examined.Test solution B — Dilute 1.0 mL of Test solution A with water to 20 mL, and allow to stand for 5 minutes before testing.Procedure — Transfer a sufficient portion of Test solution A and Test solution B toseparate test tubes of colorless, transparent, neutral glass with a flat base and an internal diameter of 15 to 25 mm to obtain a depth of 40 mm. Similarly transfer portions ofReference suspension A, Reference suspension B, and water to separate, matching test tubes. Compare Test solution A, Test solution B, Reference suspension A, Reference suspension B, and water in diffused daylight, viewing vertically against a blackbackground (see Visual Comparison under Spectrophotometry and Light-Scattering 851). [NOTE —The diffusion of light must be such that Reference suspension A can readily bedistinguished from water, and Reference suspension B can readily be distinguished from Reference suspension A.] Test solution A and Test solution B show the same clarity as that of water, or their opalescence is not more pronounced than that of Reference suspension A.Color of solution —Standard stock solution — Combine 3.0 mL of ferric chloride CS, 3.0 mL of cobaltous chloride CS, 2.4 mL of cupric sulfate CS, and 1.6 mL of dilute hydrochloric acid (10 g per L).Standard solution — [NOTE —Prepare the Standard solution immediately before use.]Transfer 1.0 mL of Standard stock solution to a 100-mL volumetric flask, dilute with dilute hydrochloric acid (10 g per L) to volume, and mix.Test solution: substance to be examined.Procedure — Transfer a sufficient portion of the Test solution to a test tube of colorless, transparent, neutral glass with a flat base and an internal diameter of 15 to 25 mm to obtain a depth of 40 mm. Similarly transfer portions of Standard solution and water to separate matching test tubes. Compare the Test solution, Standard solution, and water in diffused daylight, viewing vertically against a white background (see Visual Comparisonunder Spectrophotometry and Light-Scattering 851). The Test solution has theappearance of water or is not more intensely colored than the Standard solution. Identification —A: It complies with the test for Specific gravity.B: Infrared Absorption 197F or 197S neat.Specific gravity 841: not more than 0.7962 at 15.56, indicating not less than 99.2%of C 2H 5OH, by weight.Acidity or alkalinity—Phenolphthalein solution— Dissolve 0.1 g of phenolphthalein in 80 mL of alcohol, and dilute with water to 100 mL.Procedure— To 20 mL of alcohol, add 20 mL of freshly boiled and cooled water and 0.1 mL of Phenolphthalein solution. The solution is colorless. Add 1.0 mL of 0.01 N sodium hydroxide. The solution is pink (30 ppm, expressed as acetic acid).Ultraviolet absorption— Record the UV absorption spectrum of the test material from 200 to 400 nm in a 5-cm cell: maximum absorbance 0.40 at 240 nm, 0.30 between 250 and 260 nm, and 0.10 between 270 and 340 nm. Examine between 235 and 340 nm, in a 5-cm cell, using water as the compensation liquid. The absorption curve is smooth.Volatile impurities—Test solution A: substance to be examined.Test solution B— Add 150 µL of 4-methylpentan-2-ol to 500.0 mL of the substance to be examined.Standard solution A— Dilute 100 µL of methanol with the substance to be examined to 50.0 mL. Dilute 5.0 mL of the solution with the substance to be examined to 50.0 mL.Standard solution B— Dilute 50 µL of methanol and 50 µL of acetaldehyde with the substance to be examined to 50.0 mL. Dilute 100 µL of the solution with the substance to be examined to 10.0 mL.Standard solution C— Dilute 150 µL of acetal with the substance to be examined to 50.0 mL. Dilute 100 µL of the solution with the substance to be examined to 10.0 mL.Standard solution D— Dilute 100 µL of benzene with the substance to be examined to 100.0 mL. Dilute 100 µL of the solution with the substance to be examined to 50.0 mL.Chromatographic system (see Chromatography 621)— The gas chromatograph is equipped with a flame-ionization detector, maintained at about 280, and a 0.32-mm × 30-m fused silica capillary column bonded with a 1.8-µm layer of phase G43. The carrier gas is helium with a linear velocity of about 35 cm per second and a split ratio of 1:20. The column temperature is maintained at 40 for the first 12 minutes after an injection is made and is increased from 40 to 240 from 12 to 32 minutes after injection. During the periodof 32 to 42 minutes after an injection is made the column temperature is maintained at 240. The injection port temperature is maintained at 200. Chromatograph Standardsolution B, and record the peak responses as directed for Procedure: the resolution, R, between the first major peak (acetaldehyde) and the second major peak (methanol) is not less than 1.5.Procedure— Separately inject equal volumes (1.0 µL) of Test solution A, Test solution B,Standard solution A, Standard solution C, and Standard solution D into thechromatograph, record the chromatograms, and measure the major peaks. Calculate the concentration of methanol in Test solution A: not more than half the area of thecorresponding peak in the chromatogram obtained with Standard solution A (200 ppm). Calculate the sum of the contents of acetaldehyde and acetal, expressed asacetaldehyde, using the following formula:[(10 × A E )/(A T – A E )] + [(30 × C E )/(C T – C E )]in which A E is the area of the acetaldehyde peak in the chromatogram obtained with Test solution A; A T is the area of the acetaldehyde peak in the chromatogram obtained with Standard solution B; C E is the area of the acetal peak in the chromatogram obtained with Test solution A; and C T is the area of the acetal peak in the chromatogram obtained with Standard solution C: not more than 10 ppm, expressed as acetaldehyde is found. Calculate the content of benzene using the following formula:(2B E )/(B T – B E )in which B E is the area of the benzene peak in the chromatogram obtained with Test solution A, and B T is the area of the benzene peak in the chromatogram obtained with Standard solution D: not more than 2 ppm is found. If necessary, the identity of benzene can be confirmed using another suitable chromatographic system (stationary phase with a different polarity).The total of all other impurities in the chromatogram obtained with Test solution B is not more than the area of the peak due to 4-methylpentan-2-ol in the chromatogram obtained with Test solution B (300 ppm). Disregard any peaks that are 0.03 times the area of the peak corresponding to 4-methylpentan-2-ol in the chromatogram obtained with Test solution B (9 ppm).Limit of nonvolatile residue — Evaporate 100 mL in a tared dish on a water bath, and dry at 100 to 105 for 1 hour: the weight of the residue does not exceed 2.5 mg.Auxiliary Information — Please check for your question in the FAQs before contacting USP.USP32–NF27Page 1442Pharmacopeial Forum: Volume No. 30(5) Page 1847Chromatographic Column—DEHYDRATED ALCOHOLChromatographic columns text is not derived from, and not part of, USP 32 or NF 27.。
75%乙醇消毒液质量标准2020版

编号:替代:技术质量部制定人:制定日期:印数:3份总页数:2页生产管理部审核人:审核日期:颁发部门:技术质量部技术质量部批准人:批准日期:生效日期:分发至:技术质量部、物控部、生产技术部贵州省欣紫鸿药用辅料有限公司75%乙醇消毒液质量标准1.范围 (2)2.规范性引用文件 (2)3.技术要求 (2)4.应用范围 (2)5.检验方法 (2)6.检验规则 (2)7.标志、包装、运输、贮存 (3)第1页共3页1.范围本标准规定了本消毒液的技术要求、检验方法、检验规则、标志、运输与贮存。
本标准适用于以乙醇为主要原料配制而成的乙醇消毒液。
2.规范性引用文件GB26373-2010乙醇消毒剂卫生标准《消毒技术规范》2002版中国药典2015年版GB31640-2016食品安全国家标准食用酒精定量包装商品计量监督管理办法GB/T191包装储运图示标志3.技术要求3.1原料3.1.1乙醇应符合中国药典2015年版乙醇的规定或GB31640-2016食用酒精的要求。
3.1.2纯化水应符合中国药典2015年版纯化水的要求。
3.2质量要求检验项目检验标准检验方法性状本品为无色透明液体。
无杂质,无沉淀,具有乙醇固有气味。
《GB26373-2010乙醇消毒剂卫生标准》含量75%±5%(V/V)《消毒技术规范》2002版-2.2.1.2.11乙醇(C2H6O)含量的测定净含量标示量±3%《定量包装商品计量监督管理办法》3.3稳定性有效期:暂定1年3.4杀菌效果应符合中华人民共和国卫生部《消毒技术规范》2002年版的要求。
3.5净含量应符合国家质量监督检验检疫总局【2005】第75号令《定量包装商品计量监督管理办法》的规定。
3.6包装密封性将完整包装倒立放置24小时无任何泄漏。
4.应用范围本品适用于皮肤表面消毒和一般物体表面消毒。
5.检验方法5.1外观将本品至于无色透明玻璃瓶或玻璃杯中,灯检无杂质,符合本校准要求。
乙醇相对密度表对不上 中国药典

乙醇相对密度表对不上中国药典标题:乙醇相对密度表与中国药典之辨析导言:中国药典是指定我国药品、中草药及化妆品的质量标准的权威性文书,其严格约束着药品相关行业的生产、销售和使用。
然而,近年来有关乙醇相对密度表与中国药典之间出现的差异引起了广泛关注。
本文旨在探讨这一现象的原因,并分析其可能对药物质量标准和行业发展产生的影响。
一、乙醇相对密度表的定义与作用1. 乙醇相对密度的概念乙醇相对密度是指乙醇在20℃下与水的相对密度。
它是衡量乙醇纯度和浓度的重要指标之一。
2. 乙醇相对密度表的作用乙醇相对密度表是一种衡量乙醇纯度和浓度的参考工具。
它通常由国际标准化组织(ISO)或其他相关权威机构发布,并被广泛应用于医药、化工和酒精饮料等领域。
二、中国药典对乙醇相对密度的要求1. 中国药典中的乙醇相对密度标准根据中国药典2015年版,乙醇相对密度的要求为20℃时,乙醇与水的相对密度应在0.7918至0.7932之间。
2. 乙醇相对密度表与中国药典标准的差异近些年来,一些实验显示,乙醇相对密度表中所列的数值与中国药典中要求的数值存在差异。
一些乙醇样品的相对密度超出了中国药典的规定范围。
三、乙醇相对密度表与中国药典之间的差异分析1. 分析乙醇相对密度表的发布机构和方法乙醇相对密度表通常由国际标准化组织(ISO)或其他权威机构发布。
这些机构根据世界范围内的乙醇样本收集与测试结果,经过数学统计和分析,得出相对密度表中的数值。
然而,这些测试方法和样本选择可能与中国药典的要求存在差异。
2. 分析中国药典的制定和更新机制中国药典的制定和更新通常依据中国国内的实际检验结果和专家意见。
但由于乙醇纯度和浓度在不同的行业和领域中的应用有所差异,中国药典对乙醇相对密度的要求可能更加注重对医药和化妆品行业的需求。
四、乙醇相对密度差异的影响及对策1. 对乙醇纯度和浓度的影响乙醇相对密度表与中国药典的差异可能引起乙醇纯度和浓度测量的不准确,从而影响相关产品的质量和合规性。
药典溶剂残留标准

三氯醋酸
三氟醋酸
第二类溶剂(应该限制使用)
乙腈
氯苯
三氯甲烷
环己烷
1,2-二氯乙烯
二氯甲烷
1,2-二甲氧基乙烷
N,N-二甲基乙酰胺
N,N-二甲基甲酰胺
二氧六环
2-乙氧基乙醇
乙二醇
甲酰胺
正己烷
甲醇
2-甲氧基乙醇
甲基丁基酮
甲基环己烷
N-甲基吡咯烷酮
硝基甲烷
吡啶
四氢噻吩
四氢化萘
四氢呋喃
甲苯
1,1,2-三氯乙烯
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
溶剂名称
限度%
溶剂名称
限度%
第一类溶剂(应该避免使用)
苯
四氯化碳
1,2-二氯乙烷
1,1-二氯乙烯
1,1,1-三氯乙烷
0.0002
0.0004
0.0005
0.0008
0.15
第四类溶剂(尚无足够毒理学资料)
1,1-二异氧基丙烷
1,1-二甲氧基甲烷
2,2-二甲氧基丙烷
异辛烷
异丙醚
甲氧异丙基酮
甲氧四氢呋喃
醋酸
丙酮
甲氧基苯
正丁醇
仲丁醇
乙酸丁酯
叔丁基甲基醚
异丙基苯
二甲亚砜
乙醇
乙酸乙酯
乙醚
甲酸乙酯
甲酸
正庚烷
乙酸异丁酯
乙酸异丙酯
乙酸甲酯
3-甲基-1-丁醇
丁酮
甲基异丁基酮
异丁酮
异丁醇
中国药品检验标准操作规范2010版乙醇量测定法

文件内容:1、主题内容和适用范围 (2)2、引用标准 (2)3、简介 (2)4、仪器与用具 (2)5、试药 (2)6、操作方法 (3)7、结果判定 (3)8、注意事项 (4)9、更改信息 (4)颁发部门:分发清单:1 主题内容和适用范围本程序规定了乙醇量测定法中气相色谱法测定的方法和注意事项,使其规范化、标准化,并描述了更改信息。
2 引用标准中国药典2010年版一部附录Ⅸ M“乙醇量测定法”、中国药品检验标准操作规范2010年版P184“乙醇量测定法(气相色谱法)”。
3 简介乙醇量气相色谱法测定,以正丙醇为内标物、使用氢火焰离子化检测器,测定各种制剂在20℃时乙醇(C2H5OH)的含量(%)(ml/ml)。
该法测定前不必对供试品进行不同方法的预处理,操作方便、结果准确、重现性良好。
4 仪器与用具4.1气相色谱仪、配氢火焰离子化检测器。
4.2色谱工作站、数据处理机或记录仪(参阅气相色谱法和气相色谱仪标准操作规程)。
4.3色谱柱4.3.1毛细管柱采用键合交联聚乙二醇为固定液的毛细管柱。
4.3.2填充柱柱材料、内径、长度均无特殊规定。
载体为二乙烯苯-乙基乙烯苯型高分子多孔小球,60~80目或80~100目均可,装柱前应过筛选颗粒相近部分;商品型号国内有401~403有机担体,国外有Porapak Q、R等,均可使用;系统适用性试验能达到《中国药典》要求即可。
一般可用2m长得不锈钢柱。
4.4进样系统4.4.1自动进样器(参阅气相色谱仪标准操作规程)。
4.4.2微量注射器以10μl微量注射器为宜。
4.5氮钢瓶装高纯氮(纯度大于99.999%)。
4.6氢气发生器、空气发生器或相应的钢瓶装气。
4.7温度计 0~60℃或0~100℃。
4.8量瓶、移液管。
5 试药5.1无水乙醇色谱纯或分析纯,使用前需用本法确定不含正丙醇。
5.2正丙醇色谱纯或分析纯,使用前需用本法确定不含乙醇。
5.3水纯化水。
6 操作方法6.1标准溶液的制备精密量取恒温至20℃的无水乙醇4ml、5ml、6ml,分别置100ml量瓶中,分别精密加入恒温至20℃的正丙醇5ml,加水稀释至刻度,摇匀,即得。
《中国药典》2020版—乙醇—羟丙甲纤维素国家药用辅料标准

乙 醇YichunEthanolH 3CC 2H 6O 46.07【性状】本品为无色澄清液体;微有特臭;易挥发,易燃烧,燃烧时显淡蓝色火焰;加本品作为供试品溶液(a)刻度,摇匀,精密量取 50µl ,置 25ml 量瓶中,用本品稀释至刻度,摇匀,作为对照溶液(d )。
照气相色谱法测定(通则 0521),以 6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;起始温度为 40℃,维持 12 分钟,以每分钟 10℃的速率升温至 240℃,维持 10 分钟;进样口温度为 200℃,检测器温度为 280℃;载气为氦气或氮气。
取对照溶液(b )1μl 注入气相色谱仪,记录色谱图,乙醛峰与甲醇峰的分离度应符合要求。
精密量取对照溶液(a )、(b )、(c )、(d )和供试品溶液(a )、(b )各 1µl ,分别注入气相色谱仪,记录色谱图。
供试品溶液(a )色谱图中如有杂质峰,甲醇峰面积不得大于对照溶液(a )中甲醇峰面积的 0.5 倍(0.02%);含乙醛和乙缩醛的总量按公式(1)计算,总量不得过0.001%(以乙醛计);含苯按公式(2)计算,不得过0.0002%。
供试品溶液(b)色谱图中其他各杂质峰面积的总和不得大于4-甲基-2-戊醇的峰面积(0.03%,以4-甲基-2-戊醇计)。
乙醛和乙缩醛的总含量%= (0.001%×A E)/(A T–A E) + (0.003%×C E)/(C T–C E)×(M r1/M r2) (1)式中A E为供试品溶液(a)中乙醛的峰面积;A T为对照溶液(b)中乙醛的峰面积;C E为供试品溶液(a)中乙缩醛的峰面积;C T为对照溶液(c)中乙缩醛的峰面积;。
通则0711乙醇量测定法中华人民共和国药典2015年版四部

0711 乙醇量测定法—、气相色谱法本法系采用气相色谱法(通则0521) 测定各种含乙醇制剂中在20℃时乙醇(C2H5OH )的含量(%) (ml /ml ) 。
除另有规定外,按下列方法测定。
第一法(毛细管柱法)色谱条件与系统适用性试验采用(6% )氰丙基苯基- (94%)二甲基聚硅氧烷为固定液的毛细管柱;起始温度为40℃,维持2分钟,以每分钟3℃的速率升温至65℃,再以每分钟25℃的速率升温至200℃,维持10分钟;进样口温度200℃;检测器(FID )温度220℃;采用顶空分流进样,分流比为1:1;顶空瓶平衡温度为85℃,平衡时间为20分钟。
理论板数按乙醇峰计算应不低于10000,乙醇峰与正丙醇峰的分离度应大于2 .0。
校正因子测定精密量取恒温至20℃的无水乙醇5ml,平行两份;置100ml量瓶中,精密加入恒温至20的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀,精密量取该溶液lml ,置100ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为对照品溶液。
精密量取3ml,置10ml顶空进样瓶中,密封,顶空进样,每份对照品溶液进样3次,测定峰面积,计算平均校正因子,所得校正因子的相对标准偏差不得大于2.0% 。
测定法精密量取恒温至20的供试品适量(相当于乙醇约5 ml ) ,置100ml量瓶中,精密加入恒温至20 ℃的正丙醇5 ml,用水稀释至刻度,摇匀,精密量取该溶液lml ,置100ml 量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为供试品溶液。
精密量取3 ml ,置10ml顶空进样瓶中,密封,顶空进样,测定峰面积,按内标法以峰面积计算,即得。
【附注】毛细管柱建议选择大口径、厚液膜色谱柱,规格为30m×0.53mm×3.00um。
第二法(填充柱法)色谱条件与系统适用性试验用直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球作为载体,柱温为120~150℃。
乙醇质量标准及检验操作规程
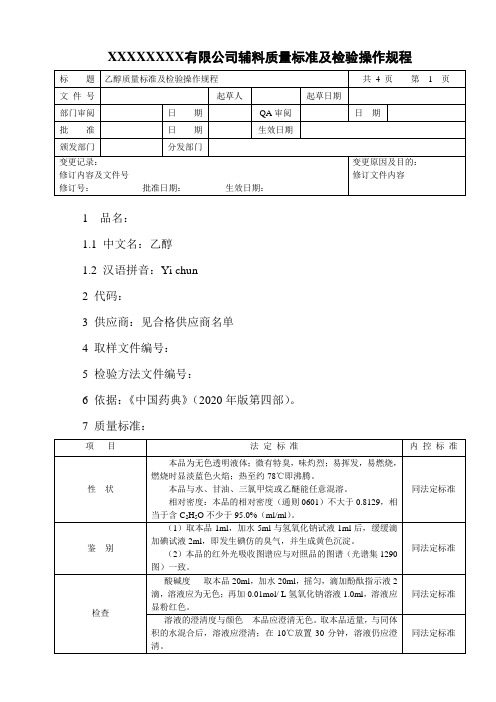
XXXXXXXX有限公司辅料质量标准及检验操作规程1 品名:1.1 中文名:乙醇1.2 汉语拼音:Yi chun2 代码:3 供应商:见合格供应商名单4 取样文件编号:5 检验方法文件编号:6 依据:《中国药典》(2020年版第四部)。
7 质量标准:8 检验操作规程:8.1 性状:(1)本品为无色透明液体;微有特臭,味灼烈;易挥发,易燃烧,燃烧时显淡蓝色火焰;热至约78℃即沸腾。
(2)本品与水、甘油、三氯甲烷或乙醚能任意混溶。
(3)相对密度:本品的相对密度(附录10)不大于0.8129,相当于含C2H5O 不少于95.0%(ml/ml)。
8.2鉴别:8.2.1取本品1ml,加水5ml与氢氧化钠试液1ml后,缓缓滴加碘试液2ml,即发生碘仿的臭气,并生成黄色沉淀。
8.2.2本品的红外光吸收图谱应与对照品的图谱一致。
8.3检查:8.3.1酸碱度:取本品20ml,加水20ml,摇匀,滴加酚酞指示液2滴,溶液应为无色;再加0.01mol/ L氢氧化钠溶液1.0ml,溶液应显粉红色。
8.3.2溶液的澄清度与颜色:本品应澄清无色。
取本品适量,与同体积的水混合后,溶液应澄清;在10℃放置30分钟,溶液仍应澄清。
8.3.3吸光度取本品,以水为空白,照紫外-可见分光光度法(附录5)测定吸光度,在240nm的波长处不得过0.08;250~260nm的波长范围内不得过0.06;270~340nm的波长范围内不得过0.02。
8.3.4挥发性杂质:照气相色谱法测定(附录9)。
色谱条件与系统适用性试验以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液;起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟;进样口温度为200℃;检测器温度为280℃。
对照溶液(b)中乙醛峰与甲醇峰之间的分离度应符合要求。
测定法精密量取无水甲醇100ul,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(a);精密量取无水甲醇50ul,乙醛50ul,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100ul,置10ml量瓶中,用供试品稀释至刻度,摇匀,作为对照品溶液(b);精密量取乙缩醛150ul,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100ul,置10ml量瓶中,用供试品稀释至刻度,摇匀,作为对照品溶液(c);精密量取苯100ul,置100ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100ul,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照品溶液(d);取供试品作为供试品溶液(a);精密量取4-甲基-2-戊醇150ul,置500ml量瓶中,加供试品稀释至刻度,摇匀,作为供试品溶液(b)。
通则0711-乙醇量测定法-中华人民共和国药典2015年版四部

0711乙醇量测定法―、气相色谱法本法系采用气相色谱法(通则0521)测定各种含乙醇制剂中在20E时乙醇(C2H5OH )的含量(%)(ml /ml)。
除另有规定外,按下列方法测定。
第一法(毛细管柱法)色谱条件与系统适用性试验米用(6%)氰丙基苯基-(94%)二甲基聚硅氧烷为固定液的毛细管柱;起始温度为40T,维持2分钟,以每分钟3C的速率升温至65T,再以每分钟25r的速率升温至200C,维持10分钟;进样口温度200r ;检测器(FID )温度220r;采用顶空分流进样,分流比为1: 1;顶空瓶平衡温度为85r,平衡时间为20分钟。
理论板数按乙醇峰计算应不低于10000, 乙醇峰与正丙醇峰的分离度应大于 2 .0。
校正因子测定精密量取恒温至20r的无水乙醇5ml,平行两份;置100ml 量瓶中,精密加入恒温至20的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀,精密量取该溶液lml,置100ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为对照品溶液。
精密量取3ml,置10ml顶空进样瓶中,密封,顶空进样,每份对照品溶液进样3次,测定峰面积,计算平均校正因子,所得校正因子的相对标准偏差不得大于 2.0%。
测定法精密量取恒温至20的供试品适量(相当于乙醇约5 ml ),置100ml 量瓶中,精密加入恒温至20 r的正丙醇5 ml,用水稀释至刻度,摇匀,精密量取该溶液lml,置100ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为供试品溶液。
精密量取 3 ml ,置10ml顶空进样瓶中,密封,顶空进样,测定峰面积,按内标法以峰面积计算,即得。
【附注】毛细管柱建议选择大口径、厚液膜色谱柱,规格为30mx0.53mm><3.00um。
第二法(填充柱法)色谱条件与系统适用性试验用直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球作为载体,柱温为120~150r。
乙醇质量标准(2015版药典)
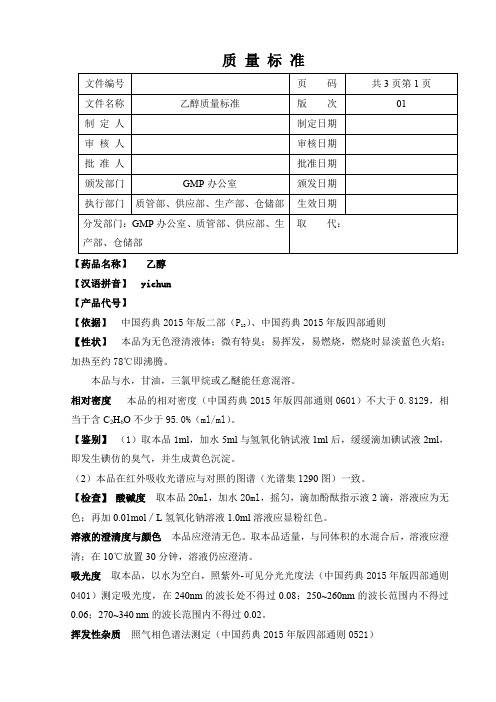
测定法 精密量取无水甲醇 100µl,置 50ml 量瓶中,用供试品稀释至刻度,摇匀,精密
量取 5ml,置 50ml 量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(a);精密量取
无水甲醇 50µl,乙醛 50µl,置 50ml 量瓶中,用供试品稀释至刻度,摇匀,精密量取 100µl,
置 10ml 量瓶中,用供试品稀释至刻度,摇匀,作为对照品(b);精密量取乙缩醛 150µl,
式中
AE 为供试品溶液(a)中乙醛的峰面积 AT 为对照品溶液(b)中乙醛的峰面积 CE 为供试品溶液(a)中乙缩醛的峰面积 CT 为对照品溶液(c)中乙缩醛的峰面积 苯含量%=(0.0002%BE)/(BT-BE) 式中 BE 为供试品溶液苯的峰面积
(公式 2)
质量标准
文件编号
页码
共 3 页第 3 页
文件名称
乙醇质量标准
版次
01
BT 为对照溶液苯的峰面积 不挥发物 取本品 40ml,置 105℃恒重的蒸发皿中,于水浴上蒸干后,在 105℃干燥 2
小时,遗留残渣不得过 1mg。
【类别】 消毒防腐药,溶剂。
【贮藏】 避光,密封保存。
【贮存期】 暂定 3 年。ຫໍສະໝຸດ 【供应商】【操作规程】
清;在 10℃放置 30 分钟,溶液仍应澄清。 吸光度 取本品,以水为空白,照紫外-可见分光光度法(中国药典 2015 年版四部通则 0401)测定吸光度,在 240nm 的波长处不得过 0.08;250~260nm 的波长范围内不得过 0.06;270~340 nm 的波长范围内不得过 0.02。 挥发性杂质 照气相色谱法测定(中国药典 2015 年版四部通则 0521)
质量标准
文件编号 文件名称
2010版药典药用乙醇

乙醇YichunEthanol[修订]【检查】酸碱度取本品20ml,加水20ml,摇匀,滴加酚酞指示液2滴,溶液应为无色;再加0.01mol/L氢氧化钠溶液1.0ml,溶液应显粉红色(0.003%,以醋酸计)。
溶液的澄清度与颜色本品应澄清无色。
取本品适量,与同体积的水混合后,溶液应澄清;在10℃放置30分钟,溶液仍应澄清。
挥发性杂质照气相色谱法测定(中国药典2005年版二部附录Ⅴ E)。
色谱条件与系统适用性试验采用6%氰丙基苯基-94%二甲基聚硅氧烷毛细管柱;氢火焰离子化检测器(FID);分流进样,采用程序升温方式,40℃保持12min,然后以每分钟10℃的速度升温至240℃,保持10min,进样口温度200℃,检测器温度280℃。
对照溶液(b)中乙醛峰与甲醇峰之间的分离度应大于1.5。
对照溶液(a):精密量取无水甲醇100μl,用供试品稀释至50ml,摇匀,精密量取5.0ml,用供试品稀释至50ml,摇匀,作为对照溶液(a)。
对照溶液(b):精密量取无水甲醇50μl,乙醛50μl,用供试品稀释至50ml,摇匀,精密量取100μl,用供试品稀释至10ml,摇匀,作为对照溶液(b)。
对照溶液(c):精密量取乙缩醛150μl,用供试品稀释至50ml,摇匀,精密量取100μl,用供试品稀释至10ml,摇匀,作为对照溶液(c)。
对照溶液(d):精密量取苯100μl,用供试品稀释至100ml,摇匀,精密量取100μl,用供试品稀释至50ml,摇匀,作为对照溶液(d)。
供试品溶液(a):取供试品作为供试品溶液(a)。
供试品溶液(b):精密量取4-甲基-2-戊醇150μl,加供试品稀释至500ml,摇匀,作为供试品溶液(b)。
测定法分别取对照溶液(a)、(b)、(c)、(d)和供试品溶液(a)、(b)各1μl,分别注入气相色谱仪,记录色谱图,供试品溶液如出现杂质峰,应符合下列要求。
①甲醇供试品中甲醇峰面积不得大于对照溶液(a)主峰面积的1/2(0.02%);②乙醛和乙缩醛供试品中乙醛和乙缩醛的总量按下式计算,总量不得过0.001%(以乙醛计);[(10⨯A E)/(A T-A E)]+[(30⨯C E)/(C T-C E)]A E=供试品溶液(a)中乙醛的峰面积A T=对照溶液(b)中乙醛的峰面积C E=供试品溶液(a)中乙缩醛的峰面积C T=对照溶液(c)中乙缩醛的峰面积③苯供试品中苯的量按下式计算,不得过0.0002%;(2B E)/(B T-B E)B E=供试品溶液中苯的峰面积B T=对照溶液中苯的峰面积④其他杂质总量供试品溶液(b)中其他各杂质峰面积的总和不得大于4-甲基-2-戊醇的峰面积(0.03%,以4-甲基-2-戊醇计)。
药用乙醇出厂检验鉴定书
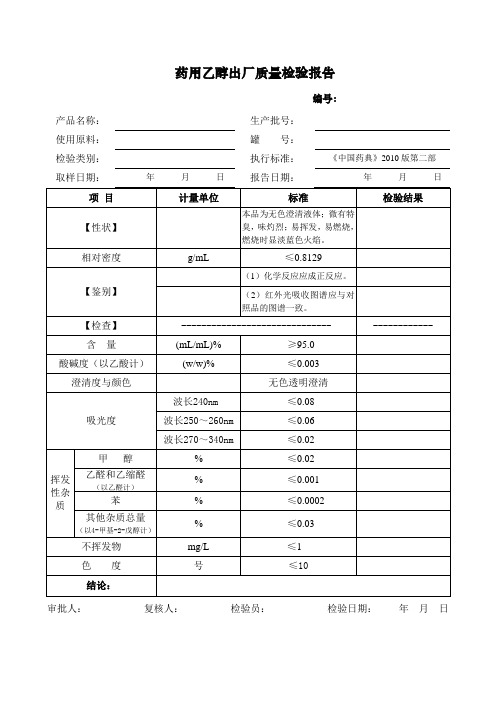
挥发性杂质
甲醇
%
≤0.02
乙醛和乙缩醛
(以乙醛计)
%
≤0.001
苯
%
≤0.0002
其他杂质总量(以4-甲基-2-戊醇计)
%
≤0.03
不挥发物
mg/L≤1色度ຫໍສະໝຸດ 号≤10结论:
审批人:复核人:检验员:检验日期:年月日
药用乙醇出厂质量检验报告
编号:
产品名称:
生产批号:
使用原料:
罐号:
检验类别:
执行标准:
《中国药典》2010版第二部
取样日期:
年月日
报告日期:
年月日
项目
计量单位
标准
检验结果
【性状】
本品为无色澄清液体;微有特臭,味灼烈;易挥发,易燃烧,燃烧时显淡蓝色火焰。
相对密度
g/mL
≤0.8129
【鉴别】
(1)化学反应应成正反应。
(2)红外光吸收图谱应与对照品的图谱一致。
【检查】
------------------------------
------------
含量
(mL/mL)%
≥95.0
酸碱度(以乙酸计)
(w/w)%
≤0.003
澄清度与颜色
无色透明澄清
吸光度
波长240nm
≤0.08
波长250~260nm
≤0.06
波长270~340nm
2020版中国药典药用乙醇检验方法

2020版我国药典药用乙醇检验方法一、概述在我国传统医药及现代医药生产中,药用乙醇是一种重要的溶剂和提取剂,广泛用于药物及保健品的生产过程中。
为了确保药用乙醇的质量和安全性,在我国药典的监管下,对药用乙醇的质量指标和检验方法进行了详细规定。
二、药用乙醇的性状与质量标准1. 外观:应无色透明液体,无悬浮物和沉淀。
2. 含量:饱和碘化钾溶液中的碘量不少于97.0。
3. 气味:有乙醇特有气味。
三、药用乙醇的检验方法1. 含量测定(1)试剂及仪器:饱和碘化钾溶液,氢氧化钠溶液,电热套装置。
(2)操作步骤:a. 取适量药用乙醇置于玻璃烧杯中,用电热套进行加热至50-60℃。
b. 在加热的同时搅拌药用乙醇,慢慢加入少量饱和碘化钾溶液直至药用乙醇褪色。
c. 加入少量氢氧化钠溶液并再次进行加热搅拌,至出现黄色沉淀为止。
d. 冷却后用蒸馏水洗涤的烧杯转移到100ml容量瓶中,加入蒸馏水至刻度,振荡均匀,静置,取上清液测定光密度。
2. 气味检验用嗅觉判断药用乙醇是否有乙醇特有气味。
四、结论根据我国药典规定的药用乙醇的性状与质量标准,药用乙醇的检验方法可以有效确保其质量和安全性。
在药物和保健品生产中,按照规范的检验方法进行检验,是保证产品质量的重要环节。
五、参考文献1. 我国药典2020版2. 《药品质量控制技术指南》3. 《药用乙醇质量分析方法》药用乙醇在医药生产中的重要性不言而喻。
作为溶剂和提取剂,它在中药提取、药物制剂、药物溶解和稀释等方面发挥着至关重要的作用。
确保药用乙醇的质量和安全性至关重要,这就需要对其进行详细的检验和规范。
在我国药典中,对药用乙醇的质量指标和检验方法作出了详细的规定。
首先是对其外观的要求,药用乙醇应呈无色透明液体,不应该有悬浮物和沉淀。
这一点十分重要,因为任何的杂质都可能对药物的提取和制剂产生影响,甚至对人体造成危害。
其次是药用乙醇的含量,要求在饱和碘化钾溶液中的碘量不少于97.0,这一指标直接关系到其纯度和质量。
欧洲药典 10.0 乙醇96%

01/2015:1317修正10.0乙醇(96%)(1)Ethanolum(96 per centum)定义含量:-乙醇(C2H6O,Mr 46.07):用醇定量法表(5.5)由相对密度计算得到,在20 ℃含量为95.1% V/V(92.6% m/m)至96.9% V/V(95.2% m/m)。
-水分。
◆特征外观:无色,澄清,易挥发,可燃性液体,具吸湿性。
溶解性:可与水和二氯甲烷混溶。
燃烧产生蓝色、无烟火焰。
沸点:约78℃◆鉴别第一鉴别:A, B第二鉴别:A, C, DA 与相对密度检测一致(见检测)B 红外吸收光谱(2.2.24)。
比较欧洲药典乙醇(96%)的对照光谱。
◇C 取本品0.1 ml置试管中,加入1ml 10g/l的高锰酸钾R溶液和0.2 ml稀硫酸R溶液,混匀。
立即用含0.1g亚硝基铁氰化钠R和0.5g六水哌嗪R与5ml水R新配制的溶液湿润过的滤纸将其覆盖。
几分钟之后,纸上呈现深蓝色;10 - 15分钟后变淡。
D取本品0.5 ml加入5ml水R、2 ml稀氢氧化钠溶液R,然后缓缓加入2ml 0.05M的碘。
在30分钟内形成黄色沉淀。
◇检测外观。
本品与水R对比呈澄清(2.2.1)、无色(2.2.2,方法II)。
取本品1.0 ml用水R稀释至20 ml,放置5分钟后,稀释液与水R相比,仍保持澄清(2.2.1)。
(1)本章已通过药典协调。
见章节5.8.药典协调。
酸碱度。
取本品20 ml加入20 ml无二氧化碳的水R和0.1 ml酚酞溶液R.溶液应为无色。
加入1.0ml 0.01M的氢氧化钠,溶液应呈粉红色(以乙酸含量30 ppm计表现的颜色)。
相对密度(2.2.5)0.805 - 0.812。
吸光度(2.2.25):在240 nm最大值为0.40,在250 nm 至260 nm 最大为0.30,在270 nm至340 nm 最大为0.10吸收光谱呈平滑的曲线。
图谱显示一稳定下行的曲线,无其他可见峰或肩峰。
药典溶剂残留标准国家标准

药典溶剂残留标准国家标准药典溶剂残留标准国家标准是指在药品生产过程中,对于药物中残留的溶剂成分所做的国家标准规定。
溶剂残留是指在制药过程中使用的有机溶剂,如乙醇、丙酮、乙酸乙酯等,由于挥发不完全或者反应不完全而残留在最终的药品产品中。
这些残留物可能会对人体健康造成危害,因此有必要对其进行严格的控制和监测。
国家药典对于药品中溶剂残留的标准是非常严格的,它们不仅要求对于溶剂的种类和使用量进行限制,同时也规定了对于残留物的检测方法和限量要求。
这些标准的制定是为了保障药品的质量和安全,确保患者在使用药品时不会受到溶剂残留物的危害。
在药品生产中,溶剂残留的控制是一个非常重要的环节。
首先,药品生产企业需要选择合适的溶剂,并严格按照国家标准的要求来使用和控制溶剂的使用量。
其次,生产过程中需要采取适当的工艺措施,确保溶剂能够充分挥发和反应,减少残留物的生成。
最后,在成品药品中需要进行严格的残留物检测,确保药品符合国家标准的要求。
对于溶剂残留标准的监测,国家药典规定了一系列的检测方法和限量要求。
这些方法包括气相色谱法、液相色谱法等,可以对不同种类的溶剂残留进行快速、准确的检测。
同时,国家标准也对于不同种类的药品制剂规定了不同的残留限量,以确保药品的安全性和有效性。
总的来说,药典溶剂残留标准国家标准的制定和执行,对于保障药品质量和患者健康起着非常重要的作用。
药品生产企业需要严格按照国家标准的要求来控制和监测溶剂残留,确保药品的质量和安全。
同时,监管部门也需要加强对于药品生产过程的监督和检查,确保药品生产符合国家标准的要求。
在未来,随着药品监管的不断加强和技术的不断进步,相信药典溶剂残留标准国家标准会不断得到完善和提高,为我国的药品质量和患者健康保驾护航。
同时,也希望药品生产企业和监管部门能够共同努力,确保药品的质量和安全,为人民群众提供更加优质的药品产品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文件编号页码共3页第1页文件名称乙醇质量标准版次01
制定人制定日期
审核人审核日期
批准人批准日期
颁发部门GMP办公室颁发日期
执行部门质管部、供应部、生产部、仓储部生效日期
分发部门:GMP办公室、质管部、供应部、生
取代:
产部、仓储部
【药品名称】乙醇
【汉语拼音】yichun
【产品代号】
)、中国药典2015年版四部通则
【依据】中国药典2015年版二部(P
13
【性状】本品为无色澄清液体;微有特臭;易挥发,易燃烧,燃烧时显淡蓝色火焰;加热至约78℃即沸腾。
本品与水,甘油,三氯甲烷或乙醚能任意混溶。
相对密度本品的相对密度(中国药典2015年版四部通则0601)不大于0.8129,相当于含C2H6O不少于95.0%(ml/ml)。
【鉴别】(1)取本品1ml,加水5ml与氢氧化钠试液1ml后,缓缓滴加碘试液2ml,即发生碘仿的臭气,并生成黄色沉淀。
(2)本品在红外吸收光谱应与对照的图谱(光谱集1290图)一致。
【检查】酸碱度取本品20ml,加水20ml,摇匀,滴加酚酞指示液2滴,溶液应为无色;再加0.01mol∕L氢氧化钠溶液1.0ml溶液应显粉红色。
溶液的澄清度与颜色本品应澄清无色。
取本品适量,与同体积的水混合后,溶液应澄清;在10℃放置30分钟,溶液仍应澄清。
吸光度取本品,以水为空白,照紫外-可见分光光度法(中国药典2015年版四部通则0401)测定吸光度,在240nm的波长处不得过0.08;250~260nm的波长范围内不得过0.06;270~340nm的波长范围内不得过0.02。
挥发性杂质照气相色谱法测定(中国药典2015年版四部通则0521)
文件编号页码共3页第2页
文件名称乙醇质量标准版次01
色谱条件现系统适用性试验以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液;起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟;进样口温度为200℃;检测器温度为280℃。
对照溶液(b)中乙醛峰与甲醇峰之间的分离度应符合要求。
测定法精密量取无水甲醇100µl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密
量取5ml,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(a);精密量取
无水甲醇50µl,乙醛50µl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100µl,置10ml量瓶中,用供试品稀释至刻度,摇匀,作为对照品(b);精密量取乙缩醛150µl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100µl,置10ml量瓶中,用供
试品稀释至刻度,摇匀,作为对照溶液(c);精密量取苯100µl,置100ml量瓶中,用
供试品稀释至刻度,摇匀,精密量取100µl,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(d);取供试品作为供试品溶液(a);精密量取4-甲基-2戊醇150µl,,置500ml量瓶中,加供试品稀释至刻度,摇匀,作为供试品溶液(b)。
精密量取对照溶
液(a)、(b)、(c)、(d)和供试品溶液(a)、(b)各1µl,分别注入气相色谱仪,记录
色谱图,供试品溶液(a)如出现杂质峰,甲醇峰面积不得大于对照溶液(a)主峰面积
的0.5倍(0.02%);含乙醛和乙缩醛的总量按公式(1)计算,总量不得过0.001%(以
乙醛计);含苯按公式(2)计算,不得过0.0002%;供试品溶液(b)中其他各杂质峰面
积的总和不得大于4-甲基-2戊醇的峰面积(0.03%,以4-甲基-2戊醇计)。
乙醛和乙缩醛的总含量%=[(0.001%×A
E )/(A
T
-A
E
)]+[(0.003%×C
E
)/(C
T
-C
E
)]
(公式1)
式中A
E
为供试品溶液(a)中乙醛的峰面积
A
T
为对照品溶液(b)中乙醛的峰面积
C
E
为供试品溶液(a)中乙缩醛的峰面积
C
T
为对照品溶液(c)中乙缩醛的峰面积
苯含量%=(0.0002%B
E )/(B
T
-B
E
)(公式2)
式中B
E
为供试品溶液苯的峰面积
文件编号页码共3页第3页文件名称乙醇质量标准版次01
为对照溶液苯的峰面积
B
T
不挥发物取本品40ml,置105℃恒重的蒸发皿中,于水浴上蒸干后,在105℃干燥2小时,遗留残渣不得过1mg。
【类别】消毒防腐药,溶剂。
【贮藏】避光,密封保存。
【贮存期】暂定3年。
【供应商】
【操作规程】。
