化学反应的限度完整版本ppt课件
合集下载
化学限度PPT教学课件

田鼠、金花鼠、林猫、红狐、山雀、旋 木雀和啄木鸟。
田鼠
金花鼠
林猫
红狐
山雀
旋木雀
啄木鸟
4、特点: 植物发育良好,种类也很丰富。
(三)、热带雨林
1、气候特点: 温度和湿度很高
2、主要植物: 常绿植物。在lOkm2的热带雨林中就含
有l500种开花植物和750种树木。
3、主要动物:
猴类、长臂猿、黑猩猩和大猩猩、鹦鹉 科鸟类等。
判断是否达到化学平衡 的两个重要标志
自然界和生产中有许多化学反 应都是可逆反应,可逆反应在 一定条件下不能进行到底,反 应进行到一定限度就将建立起 化学平衡状态。
1.下列关于化学平衡的说法中,正确的是 (C )
A.当反应达到化学平衡时,反应物已完全转 化为生成物
B当反应达到化学平衡时,正逆反应均已停止
鹦鹉科鸟类和猿猴,是热带雨林的特有动物。
长臂猿
黑猩猩
大猩猩
4、特点:
热带雨林中的生物种类约占地球已知 种类的一半,是地球上最丰富的生物基因 库。
二、草原
1、气候特点: 年降雨量在250~800mm之间
2、主要植物: 几乎完全由禾本科植物和阔叶草本植
物(主要是豆科和菊科)组成。
3、主要动物:
野驴、黄羊、黄鼠和鼠兔等。以及是非洲 草原的鸵鸟、美洲鸵和澳洲草原的鸸鹋等失去 飞翔能力的鸟类。
事实表明,许多反应是可逆的。 在同一反应条件下,既可以向 正反应方向进行,又可以向逆 反应方向进行。
1.可逆反应
(1)定义:在同一反应条件下, 既可以向正反应方向进行,同 时又可以向逆反应方向进行的 反应。
可逆反应用 表示
拔河比赛与我们现在所学的“可逆反应” 两者有无相通之处呢?
田鼠
金花鼠
林猫
红狐
山雀
旋木雀
啄木鸟
4、特点: 植物发育良好,种类也很丰富。
(三)、热带雨林
1、气候特点: 温度和湿度很高
2、主要植物: 常绿植物。在lOkm2的热带雨林中就含
有l500种开花植物和750种树木。
3、主要动物:
猴类、长臂猿、黑猩猩和大猩猩、鹦鹉 科鸟类等。
判断是否达到化学平衡 的两个重要标志
自然界和生产中有许多化学反 应都是可逆反应,可逆反应在 一定条件下不能进行到底,反 应进行到一定限度就将建立起 化学平衡状态。
1.下列关于化学平衡的说法中,正确的是 (C )
A.当反应达到化学平衡时,反应物已完全转 化为生成物
B当反应达到化学平衡时,正逆反应均已停止
鹦鹉科鸟类和猿猴,是热带雨林的特有动物。
长臂猿
黑猩猩
大猩猩
4、特点:
热带雨林中的生物种类约占地球已知 种类的一半,是地球上最丰富的生物基因 库。
二、草原
1、气候特点: 年降雨量在250~800mm之间
2、主要植物: 几乎完全由禾本科植物和阔叶草本植
物(主要是豆科和菊科)组成。
3、主要动物:
野驴、黄羊、黄鼠和鼠兔等。以及是非洲 草原的鸵鸟、美洲鸵和澳洲草原的鸸鹋等失去 飞翔能力的鸟类。
事实表明,许多反应是可逆的。 在同一反应条件下,既可以向 正反应方向进行,又可以向逆 反应方向进行。
1.可逆反应
(1)定义:在同一反应条件下, 既可以向正反应方向进行,同 时又可以向逆反应方向进行的 反应。
可逆反应用 表示
拔河比赛与我们现在所学的“可逆反应” 两者有无相通之处呢?
化学课件《化学反应的限度》优秀ppt19 鲁科版

为0.10 mol,求CH4的平衡转化率(计算结果保留两位 有效数字)。
解析:设CH4的初始物质的量为x mol,
则
CH4(g) + H2O(g)===CO(g)+3H2(g)
初始浓度/mol·L-1 0 0
栏
平衡浓度/mol·L-1
目 链
K===27
接
解得:x=0.11
栏
物质的起始浓度而改变,仅取决于反应的本性。反
目 链
接
应一定,温度一定,平衡常数就是定值。在恒定的
温度下,可逆反应无论从正反应开始还是从逆反应
开始,最后都能达到同一平衡状态。因此我们说平
衡常数是反应的特性常数。
(5)若用任意状态的浓度幂之积的比值(称为浓度商,用
Qc表示)与Kc相比较,可判断可逆反应是否达到平衡状
N2+3H2
2NH3。
(2)注意:
①可逆反应的前提:反应物和产物必须同时存在于同一反
应体系中,而且在相同条件下,正逆反应都能自发进行;
②表示方法:在可逆反应的化学方程式中,用“ 来表示; ③重要的可逆反应:盐类水解、酯的水解等;
”号 栏
目 链 接
④可逆反应的特征:难以进行到底,存在平衡状态。
2.化学平衡状态。 如下图所示:
章 化学反应的方向、限度与速率 节化学反应的限度
知识点一 化学平衡状态
1.可逆反应。
(1)定义:在同一条件下,既能向正反应方向进行,
又能向逆反应方向进行的反应。
栏 目
例如:在N2和H2的反应中,无论怎样改变反应条件
链 接
都不能使N2和H2完全转化为NH3。这是因为在N2和
H2生成NH3的同时,NH3也分解生成N2和H2。即:
化学反应的限度pptPPT课件
第17页/共19页
小结: 1.可逆反应的特征
反应有一定的限度(转化率低于100%)、反 应物和生成物并存、正逆反应同时进行、反应 条件相同、一定条件下可以达到平衡
2.化学平衡状态的特征 逆、等、动、定、变。 3.化学平衡状态的判断
第18页/共19页
谢谢您的观看!
第19页/共19页
在同一条件下向正反应方向进行的 同时又向逆反应方向进行的反应.
用
表示。 例:
正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。
速率
含义
与浓度关系
V正
单位时间反应物浓度的减少 决定于反应物浓度 或生成物浓度的增加
V逆
单位时间反应物浓度的增加 或生成物浓度的减少
决定于生成物浓度
第3页/共19页
可逆反应的特点: ①不能进行到底,反应物的转化率不 能达到100%,反应体系中得到的总是 反应物与生成物的混合物。 ②正逆反应同时进行
练习
1. 在一定温度下,可逆反应
A(气)+3B(气)
( AD )
2C(气)达到平衡的标志是
A. C的生成速率与C分解的速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率 相等 (数值)
D. 单位时间生成nmolA,同时生成2nmolC
第16页/共19页
( AC )
A. C的生成速率与C分解的速率相等 B. 单位时间内生成nmolA,同时生成3nmolB C. A、B、C的浓度不再变化 D. A、B、C的分子数比为1:3:2
第13页/共19页
【例2】下列说法可以证明反应N2+3H2
2NH3 已达平衡状态的是(
化学反应的限度ppt课件

所需用量,而且高炉顶部排出的气体中总含有没有利用的CO。
这使炼铁工程师疑惑不解。
猜想:炼铁工程师们认为是CO与铁矿石接触不充分造成的。
措施:设法增加高炉的高度,以增加接触时间。
结果:高炉尾气中CO的比例竟然没有改变。
直到19世纪下半叶,法国化学家勒夏特列经过深入的研究,才
将这一谜底揭开。原来,产生上述现象的原因是:C + CO2 ⇌2CO
②单位时间内生成a mol A,同时生成3a mol B
③B的浓度不再变化
④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1∶3∶3
⑥混合气体的密度不再变化。
A.①②④ B.①③④⑥ C.①③⑥ D.①③④⑤
【应用体验3】经过化学家长期研究发现高炉中:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)是可逆反应,一定温度下,
23.1
31.4
/%
N2 + 3H2
高温、高压
催化剂
2NH3
压强/MPa
NH3
含量
温度/℃
0.1
10
20
30
60
100
200
15.3
81.5
86.4
89.9
95.4
98.8
300
2.2
52.0
64.2
71.0
84.2
92.6
400
0.4
25.1
38.2
47.0
65.2
79.8
500
0.1
10.6
19.1
D.单位时间内有1 mol O2生成, 同时有 2 mol SO3 生成 ;
E.单位时间内有2 mol SO2生成,同时有 2 mol O2 消耗 ;
这使炼铁工程师疑惑不解。
猜想:炼铁工程师们认为是CO与铁矿石接触不充分造成的。
措施:设法增加高炉的高度,以增加接触时间。
结果:高炉尾气中CO的比例竟然没有改变。
直到19世纪下半叶,法国化学家勒夏特列经过深入的研究,才
将这一谜底揭开。原来,产生上述现象的原因是:C + CO2 ⇌2CO
②单位时间内生成a mol A,同时生成3a mol B
③B的浓度不再变化
④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1∶3∶3
⑥混合气体的密度不再变化。
A.①②④ B.①③④⑥ C.①③⑥ D.①③④⑤
【应用体验3】经过化学家长期研究发现高炉中:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)是可逆反应,一定温度下,
23.1
31.4
/%
N2 + 3H2
高温、高压
催化剂
2NH3
压强/MPa
NH3
含量
温度/℃
0.1
10
20
30
60
100
200
15.3
81.5
86.4
89.9
95.4
98.8
300
2.2
52.0
64.2
71.0
84.2
92.6
400
0.4
25.1
38.2
47.0
65.2
79.8
500
0.1
10.6
19.1
D.单位时间内有1 mol O2生成, 同时有 2 mol SO3 生成 ;
E.单位时间内有2 mol SO2生成,同时有 2 mol O2 消耗 ;
6.2.2 化学反应限度 课件 (共13张PPT) 高中化学 人教版(2019)必修第二册

分析: 试管中同时 存在I2与Fe3+
环节一 · 感受反应限度
什么是化学反应的限度?
并非所有的反应都能进行到底, 一个反应在该条件下,能达到的最大程度,就是反应的限度
限度决定了该条件下反应物的最大转化率
(转化量/起始量)
环节二 · 探究 · 反应产生限度的原因
【工业 · 接触法制硫酸】
资料卡片1
S 16O 18O
SO2 + 18O2 → SO3
SO3 → SO2+ O2
环节二 · 探究 · 反应产生限度的原因
SO2与O2反应生成SO3的同时 , SO3分解得到SO2和O2
高温
2SO2 + O2
2SO3
催化剂
可逆反应
同一条件下,同时向正、逆 两个方向进行的化学反应
(可逆反应) 反应物
生成物
思考4-1
①、合成氨反应中,温度越低,氨气的产率越高,为什么工业 生产时选择用500℃左右的高温,而不用更低的反应温度?
②、工业生产时,确定反应条件需要综合考虑哪些因素?
接触法制备硫酸的第二步,利用 SO2与O2反应得到SO3 但是在实际生产中,人们发现,即 使通入过量O2,仍然无法使SO2完 全转化。 反应炉中始终同时存在SO2、O2、 与SO3
环节二 · 探究 · 反应产生限度的原因
思考2-1 为什么达到反应限度时,SO2、O2、SO3同时存在?
观点1:只有部分SO2与O2发生反应,而生成的SO3并未分解 观点2:SO2与O2全部转化成SO3后 ,部分SO3又分解生成SO2和O2 观点3:SO2与O2反应生成SO3的同时 , SO3分解得到SO2和O2
②、逆反应速率何时最小? 反应后,逆反应速率如何变化?
化学必修Ⅱ人教新课标2.3.2化学反应的限度(共13张ppt) (共13张PPT)

多数反应为可逆反应,典型的可逆反应有:
催化剂
N2+3H2
2NH3
高温高压
NH3 +H2O
NH3 ·H2O
SO2 +H2O
催化剂
2SO2+O2 高温 H2 + I2
H2SO3 2SO3
2HI
练习:
• 对于可逆反应2SO2+O2
2SO3,在
混合气体中充入一定量的18O2足够长时
间后,18O原子( D )
(2)空气用量对煤燃烧的影响
空气不足,煤得不到充分燃烧;且污染环境。 空气过量,浪费能源,因为废气要带走能量
(3)应选择保温性能好,提高炉膛温度的材料
保温隔热,防止热量散失
(4)煤燃烧后废气中热量的利用
将废气通过装有冷却水的管道,充分吸收
(1)尽可能使燃料充分燃烧,提高能量的转化率. (2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
✓ 增大廉价反应物的浓度、或增大气体反应物的压强,以提
高原料的利用率或转化率。
❖ 关于有害或人类不需要的化学反应
抑制
✓ 降低反应温度、使用负催化剂等,降低反应速率;
✓ 隔离会引发反应的物质,如在金属表面形成保护层、森林火 灾时制造隔离带等。
以“提高煤的燃烧效率”为例
(1)煤的状态与煤燃烧的关系
使煤与氧气接触面积越大,燃烧越充分,反应速率越快。
一.化学反应速率
• 概念:衡量化学反应进行的快慢程度的物理量。 • 计算公式: v =Δc/Δt • 影响因素: ➢内因——反应物的性质(决定因素) ➢外因——浓度、温度、催化剂、固体的表面积、
反应物的状态等。
3 化学反应的速率和限度
化学反应的限度ppt课件PPT课件

速
率
·正反应
ひ正=ひ逆 ≠ 0
O·时间ຫໍສະໝຸດ ·逆反应O时间
2SO2+O2
2SO3
探究2:从数据与图像中你得出的该反应进行过程中浓度、速
率随时间变化的特点
第11页/共24页
从数据与图像中你得出的该反应进行过程中 浓度、速率随时间变化的特点
反应开始时,反应物浓度最大,正反应 速率最大;生成物浓度为零,逆反应速 率为零。 随着反应的进行,反应物浓度降低,正 反应速率减小;生成物浓度增大,逆反 应速率增大。
第4页/共24页
随堂练习
催化剂
18O2 + 2 SO2 △ 2SO3, 此化学反应进行到最后,混合物中 含18O的粒子有 SO2、O2、SO3 。
第5页/共24页
研究素材
在一定条件下,有人将一定质量的胆矾放入它 的饱和水溶液中,过了一天之后再来看时,发现许 多小的颗粒不见了,而大的颗粒变得更大,取出干 燥后称量,发现质量却与原来一样。
第20页/共24页
3.在一定的温度下,可逆反应:A(g)+ 3B(g)
=== 2C(g)达到平衡的标志是
A、C、
A.C的生成速率与C的分解速率相等。
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
21
第21页/共24页
4、下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温
下已达平衡状态的是( B )
• 反应容器内压强不随时间变化 • P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D.反应容器内总物质的量不随时间而变化
化学反应的限度Pppt课件

(2)条件改变化学平衡状态会移动,但 一段时间后会达到新的平衡。
2.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g) 的是( )
2NH3(g),能说明反应已达到平衡状态
√ H.断开3molH—H键的同时生成3molH—H键
× I.断开3molH—H键的同时生成6molN—H键
√ J.断开1molN—N键的同时断开6molN—H键
(E)混合气的平均相对分子质量不变
28
1.在一定温度下,反应A2(g)+B2(g) 衡状态的标志是( )
2AB(g) 达到平
A.单位时间生成n molA2同时生成n molAB B.容器内的总压强不随时间变化
C.单位时间生成2n molAB同时生成n molB2 D.单位时间生成n molA2同时生成n molB2
2、化学平衡状态的判断依据
①V(正)=V(逆)时 ②反应物、生成物的浓度保持不变时
试卷
其它的判断方法: 颜色、压强、密度等等不变时
2.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g) 的是( )
2NH3(g),能说明反应已达到平衡状态
√ A.断开3molH—H键的同时生成3molH—H键 × B.断开3molH—H键的同时生成6molN—H键 √ C.断开1molN—N键的同时断开6molN—H键 × D.3V正(N2)=V正(H2) √ E.3V正(N2)=V逆(H2)
× E、消耗3molH2的同时,生成2molNH3 √ × FG、.Nc(2N的H浓3)度∶保c(N持2不)∶变c(H2)=2∶1∶3
2.对于一定条件下的可逆反应,容器的体积保持不变 N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态 的是( )
2.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g) 的是( )
2NH3(g),能说明反应已达到平衡状态
√ H.断开3molH—H键的同时生成3molH—H键
× I.断开3molH—H键的同时生成6molN—H键
√ J.断开1molN—N键的同时断开6molN—H键
(E)混合气的平均相对分子质量不变
28
1.在一定温度下,反应A2(g)+B2(g) 衡状态的标志是( )
2AB(g) 达到平
A.单位时间生成n molA2同时生成n molAB B.容器内的总压强不随时间变化
C.单位时间生成2n molAB同时生成n molB2 D.单位时间生成n molA2同时生成n molB2
2、化学平衡状态的判断依据
①V(正)=V(逆)时 ②反应物、生成物的浓度保持不变时
试卷
其它的判断方法: 颜色、压强、密度等等不变时
2.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g) 的是( )
2NH3(g),能说明反应已达到平衡状态
√ A.断开3molH—H键的同时生成3molH—H键 × B.断开3molH—H键的同时生成6molN—H键 √ C.断开1molN—N键的同时断开6molN—H键 × D.3V正(N2)=V正(H2) √ E.3V正(N2)=V逆(H2)
× E、消耗3molH2的同时,生成2molNH3 √ × FG、.Nc(2N的H浓3)度∶保c(N持2不)∶变c(H2)=2∶1∶3
2.对于一定条件下的可逆反应,容器的体积保持不变 N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态 的是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
能完全转化为生成物。 ⑵在可逆反应进行时,正反应和逆反应 是同时进行的。 ⑶不同化学反应的限度是不同的。
3、注意:可逆反应方程式书写时要用“ ”符号。
可逆反应 反应物
生成物
N2+3H2
催化剂 高温高压
2NH3
2SO2+O2
催化剂 高温
2SO3
SO2 +H2O
H2SO3
NH3 +H2O
NH3 ·H2O
高温
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)
化学反应的可逆性是否普遍存在?
实验
①1mL0.1mol/LFeCl3 溶液与 5mL0.1mol/LKI溶液 反应
②在反应①的溶液中 加CCl4,振荡,静置
③取②的上层溶液,滴 加KSCN溶液
现象
试管内溶液由无色变 为棕黄色
试管内液体分层,下 层呈紫红色 试管内液体变为血红 色
某温度和压强下的密闭容器中,2SO2+O2
催化剂 △
2SO3
时间
(min)
物质的量
0 10
20
30 40 50 60 70
浓度(mol/L)
SO2
1 0.7 0.5 0.35 0.2 0.1 0..25 0.18 0.1 0.05 0.05 0.05
SO3
0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
结论
______
Fe3+与I-发生化学 反应生成了I2 溶液中还有Fe3+
说在明应一:也在能定能相得条反同到件应的2下生条成m件把F下o与el,3S2+F与Ome33Io+吗-与,l即S?I:O-能22F发与e3生+1+m反2I应o- l生O2成2置FFe于e22++密+和I2闭I2,容Fe器2+和中I反2
随堂练习5
在一定温度下,体积不变的容器中,
2NO2(g)(红棕色)
N2O4 (g) (无色)的可逆反应中,
下列情况属于平衡状态的是(BC)
A.N2O4不再分解 B.体系压强保持不变
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1 E.v正(NO2) = 2v逆(N2O4)
能够说明 N2 + 3H2
2NH3反应在一定温度密闭 平
刚性容器中已达到平衡状态的是 :
衡
①容器内N2、H2、NH3三者共存
状
②容器内N2、H2、NH3三者浓度相等
态
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
的
④⑤⑥tt某mm时iinn内内间生 ,内成 生断裂成1m13ommlNooHllHN32-同同H时键时消的消耗同耗0时3.m5,mo断loHlN裂2 2 6molN-H键判断
随堂练习3
对于可逆反应M+N
Q达到平衡时,
下列说法正确的是( C )
A. M、N、Q三种物质的浓度一定相等 B. M、N全部变成了Q C. M、N、Q的浓度都保持不变 D. 反应已经停止
随堂练习4
在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志 (BC)
A. A生成的速率与C分解的速率相等 B. A、B、C的浓度不再变化 C. 单位时间生成n molA同时消耗3n molB D. A、B、C的分子数之比为1:3:2 E. A、B、C物质的量相等
C.电解水生成H2和O2,H2和O2转化成H2O D.SO2溶于水和H2SO3分解
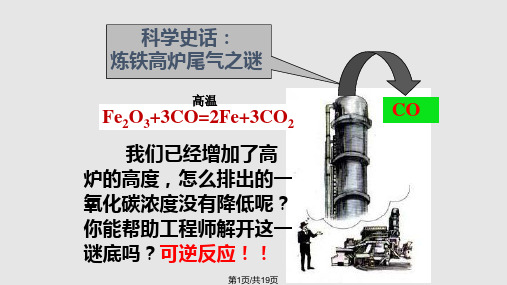
在19世纪的英国,炼铁工业快 速发展,但是化学家们发现炼铁高炉 排出的废气含有大量的一氧化碳气体, 刚开始他们认为是因为铁的氧化物和 一氧化碳反应时间不够长,导致反应 不完全,于是他们把高炉建的非常高, 以增加反应时间,后来发现高炉排出 的一氧化碳气体并没有减少,为什么 会出现这种现象?
(6)
时,化学平衡即发生移动
随堂练习1
对化学反应限度的叙述不正确的是( B )
A.任何可逆反应都有一定的限度 B.化学反应的限度是不可改变的 C.化学反应的限度与时间的长短无关 D.化学反应达到限度时,正逆反应的速率相等
随堂练习2
可逆反应达到平衡的重要特征( D)
A.反应停止了 B.正、逆反应速率都为零 C.反应物和生成物的浓度相等 D.正、逆反应的速率相等
在19世纪的英国,炼铁工业快 速发展,但是化学家们发现炼铁高炉 排出的废气含有大量的一氧化碳气体, 刚开始他们认为是因为铁的氧化物和 一氧化碳反应时间不够长,导致反应 不完全,于是他们把高炉建的非常高, 以增加反应时间,后来发现高炉排出 的一氧化碳气体并没有减少,为什么 会出现这种现象?
高温
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)
•此条件下进行到什么时候达到了这个反应的限度? •此时的反应是否停止了? •此时为何3种物质的浓度保持不变?
图象分析 2SO2+O2
催化剂
△ 2SO3
动态平衡
化学平衡状态
浓 度
·反应物 生成物
速 率
·v正
·O
t1
时间
·v逆
O
t1
时间
2、化学平衡状态 动 态 平 衡
在一定条件下的可逆反应里,正反应速率和 逆反应速率相等,反应混合物中各组分的浓度保 持不变的状态,称为化学平衡状态。
在已达到平衡的可逆反应2SO2+O2 催化剂 2SO3 中充入由18O组成的氧气一段时间后,18O原子
A.只存在于O2中
D
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.SO2,SO3和O2中都存在
C 下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2在一定条件下可以生成NH3,同时NH3又可以 分解为N2和H2
概念的理解: 前提 : 一定条件下的可逆反应
实质 : ひ正=ひ逆 ≠ 0
标志 : 反应混合物中各组分的浓度保持不变
3、化学平衡的特征 (1) 逆—— 可逆反应
动态平衡
(2) 等—— ひ正=ひ逆 ≠ 0
(3) 动—— 动态平衡
(4) 定—— 平衡状态时,反应混合物中各
(5)
组分的浓度保持不变
(5) 变—— 当浓度、压强、温度等条件改变
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
氯水中含有哪些微粒?写出氯气与 水反应的化学方程式.
氯水中含有的微粒:
Cl2,H2O, HCIO,H+,Cl-, ClO-,OH-,
Cl2+H2O
HCl+HClO
一、可逆反应
1、概念:在相同条件下,既可以向正反应方向
进行,又可以向逆反应方向进行的化 学反应。
2、特点:⑴可逆反应是有一定限度的,反应物不
3、注意:可逆反应方程式书写时要用“ ”符号。
可逆反应 反应物
生成物
N2+3H2
催化剂 高温高压
2NH3
2SO2+O2
催化剂 高温
2SO3
SO2 +H2O
H2SO3
NH3 +H2O
NH3 ·H2O
高温
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)
化学反应的可逆性是否普遍存在?
实验
①1mL0.1mol/LFeCl3 溶液与 5mL0.1mol/LKI溶液 反应
②在反应①的溶液中 加CCl4,振荡,静置
③取②的上层溶液,滴 加KSCN溶液
现象
试管内溶液由无色变 为棕黄色
试管内液体分层,下 层呈紫红色 试管内液体变为血红 色
某温度和压强下的密闭容器中,2SO2+O2
催化剂 △
2SO3
时间
(min)
物质的量
0 10
20
30 40 50 60 70
浓度(mol/L)
SO2
1 0.7 0.5 0.35 0.2 0.1 0..25 0.18 0.1 0.05 0.05 0.05
SO3
0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
结论
______
Fe3+与I-发生化学 反应生成了I2 溶液中还有Fe3+
说在明应一:也在能定能相得条反同到件应的2下生条成m件把F下o与el,3S2+F与Ome33Io+吗-与,l即S?I:O-能22F发与e3生+1+m反2I应o- l生O2成2置FFe于e22++密+和I2闭I2,容Fe器2+和中I反2
随堂练习5
在一定温度下,体积不变的容器中,
2NO2(g)(红棕色)
N2O4 (g) (无色)的可逆反应中,
下列情况属于平衡状态的是(BC)
A.N2O4不再分解 B.体系压强保持不变
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1 E.v正(NO2) = 2v逆(N2O4)
能够说明 N2 + 3H2
2NH3反应在一定温度密闭 平
刚性容器中已达到平衡状态的是 :
衡
①容器内N2、H2、NH3三者共存
状
②容器内N2、H2、NH3三者浓度相等
态
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
的
④⑤⑥tt某mm时iinn内内间生 ,内成 生断裂成1m13ommlNooHllHN32-同同H时键时消的消耗同耗0时3.m5,mo断loHlN裂2 2 6molN-H键判断
随堂练习3
对于可逆反应M+N
Q达到平衡时,
下列说法正确的是( C )
A. M、N、Q三种物质的浓度一定相等 B. M、N全部变成了Q C. M、N、Q的浓度都保持不变 D. 反应已经停止
随堂练习4
在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志 (BC)
A. A生成的速率与C分解的速率相等 B. A、B、C的浓度不再变化 C. 单位时间生成n molA同时消耗3n molB D. A、B、C的分子数之比为1:3:2 E. A、B、C物质的量相等
C.电解水生成H2和O2,H2和O2转化成H2O D.SO2溶于水和H2SO3分解
在19世纪的英国,炼铁工业快 速发展,但是化学家们发现炼铁高炉 排出的废气含有大量的一氧化碳气体, 刚开始他们认为是因为铁的氧化物和 一氧化碳反应时间不够长,导致反应 不完全,于是他们把高炉建的非常高, 以增加反应时间,后来发现高炉排出 的一氧化碳气体并没有减少,为什么 会出现这种现象?
(6)
时,化学平衡即发生移动
随堂练习1
对化学反应限度的叙述不正确的是( B )
A.任何可逆反应都有一定的限度 B.化学反应的限度是不可改变的 C.化学反应的限度与时间的长短无关 D.化学反应达到限度时,正逆反应的速率相等
随堂练习2
可逆反应达到平衡的重要特征( D)
A.反应停止了 B.正、逆反应速率都为零 C.反应物和生成物的浓度相等 D.正、逆反应的速率相等
在19世纪的英国,炼铁工业快 速发展,但是化学家们发现炼铁高炉 排出的废气含有大量的一氧化碳气体, 刚开始他们认为是因为铁的氧化物和 一氧化碳反应时间不够长,导致反应 不完全,于是他们把高炉建的非常高, 以增加反应时间,后来发现高炉排出 的一氧化碳气体并没有减少,为什么 会出现这种现象?
高温
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)
•此条件下进行到什么时候达到了这个反应的限度? •此时的反应是否停止了? •此时为何3种物质的浓度保持不变?
图象分析 2SO2+O2
催化剂
△ 2SO3
动态平衡
化学平衡状态
浓 度
·反应物 生成物
速 率
·v正
·O
t1
时间
·v逆
O
t1
时间
2、化学平衡状态 动 态 平 衡
在一定条件下的可逆反应里,正反应速率和 逆反应速率相等,反应混合物中各组分的浓度保 持不变的状态,称为化学平衡状态。
在已达到平衡的可逆反应2SO2+O2 催化剂 2SO3 中充入由18O组成的氧气一段时间后,18O原子
A.只存在于O2中
D
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.SO2,SO3和O2中都存在
C 下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2在一定条件下可以生成NH3,同时NH3又可以 分解为N2和H2
概念的理解: 前提 : 一定条件下的可逆反应
实质 : ひ正=ひ逆 ≠ 0
标志 : 反应混合物中各组分的浓度保持不变
3、化学平衡的特征 (1) 逆—— 可逆反应
动态平衡
(2) 等—— ひ正=ひ逆 ≠ 0
(3) 动—— 动态平衡
(4) 定—— 平衡状态时,反应混合物中各
(5)
组分的浓度保持不变
(5) 变—— 当浓度、压强、温度等条件改变
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
氯水中含有哪些微粒?写出氯气与 水反应的化学方程式.
氯水中含有的微粒:
Cl2,H2O, HCIO,H+,Cl-, ClO-,OH-,
Cl2+H2O
HCl+HClO
一、可逆反应
1、概念:在相同条件下,既可以向正反应方向
进行,又可以向逆反应方向进行的化 学反应。
2、特点:⑴可逆反应是有一定限度的,反应物不
