第六节 α,β- 不饱和醛、酮
第六节_α_β-_不饱和醛、酮.

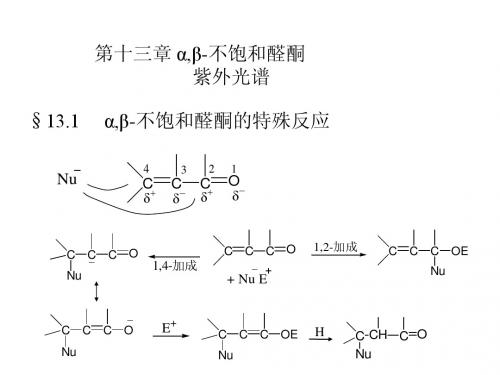
Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
第十三章 α,β-不饱和醛酮
Ag(NH3)2OH
CH2=CHCOOH
HCN
NaBH4
NC-CH2CH2-CHO
CH2=CHCH2OH
CH3CCH2CH2CH2CHO
作业:
• P326,习题1(2),(3) • 习题2(1), (3), (5), (7), (9), (11)
• P327, 习题3(1),(3)
•
习题4(2),(4),(6)
B带
π *
O
E带
B带
204
255
211
270
230
280
235
287
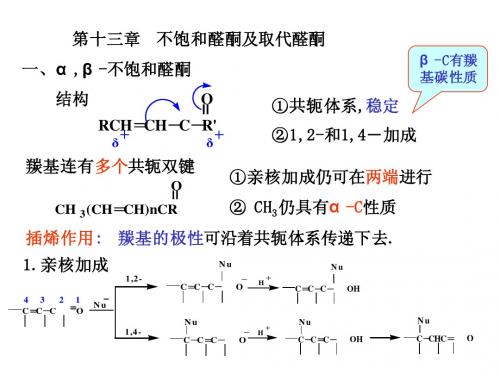
三. 几个概念
生色团:吸收紫外光,在200nm以上显示吸收峰的基团。
助色团:不吸收紫外光,但能使生色团的λ 值位移的基团。
-OH, -NR2,-OR
红移: λ
蓝移: λ
λ 增色:
λ 减色:
max
A(ε )
处的ε
增色
蓝移
红移
减色
λ
max处的ε
二醌的分类苯醌萘醌蒽醌三命名p319四化学性质1加成1羰基的加成羰基试剂格氏试剂等亲核试剂ooh2nohnohoh2nohnohnoh对苯醌单肟对苯醌双肟2烯键的加成卤素卤化氢等亲电试剂oocl2ooclclcl2ooclclclcl314加成不饱和羰基化合物亲核加成oohclohoclhohcloh2还原反应易oo2h2e2eohoh五醌的制法ohohooonh2onh2ohooo1氨基2萘酚12萘醌2
紫外--可见光谱
2. 基本原理:
紫外光谱是由于分子中的价电子跃迁而产生的.
σ 电子
ΔE
π 电子
激发态 基态
UV Δ E=hυ
兰州大学《有机化学》PPT课件:14 不饱和醛酮酸

Xiezx -Lzu2一、α,β-不饱和醛酮二、醌三、羟基醛酮四、不饱和酸及其衍生物内容Xiezx -Lzu3C=C C=OC C C=O C C C=O C C=C O+_Br BrBr C=C C O +_+_C=C C OLi R C=C C OHRC C=C OH NuRLiH O1.Nu (1)(2)(3)(1)(2)(3)2.H C C C=O NuC=C 亲电加成C=O 亲核加成1,4-共轭加成α,β-不饱和醛酮的加成反应1、分类一、α,β-不饱和醛酮Xiezx-Lzu4C C=C OHNu H +互变异构C=C C=O+Nu -C C=C O -Nu C C C=O _Nu C C C=ONu H在碱性条件下1,4-加成反应的机理Xiezx-Lzu5C C=C OHC=C C OH++C=C C=O + H+Z -互变异构C C=C OH C C C=O ZZH在酸性条件下1,4-加成反应的机理Xiezx -Lzu61.卤素、HOX 不发生共轭加成,只在C=C 双键上发生亲电加成。
2.HX 、HCN 、NH 3及NH 3的衍生物等与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主。
3.不饱和醛与RLi, RMgX 反应时以C=O 双键的1,2-亲核加成为主。
与R 2CuLi 反应,以1,4加成为主。
4.不饱和酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R 2CuLi,主要得1,4-加成产物,使用RMgX,如有亚铜盐如CuX 做催化剂,主要得1,4-加成产物,如无亚铜盐做催化剂,发生1,2加成还是1,4-加成,与反应物的空间结构有关,空阻小的地方易发生反应。
α,β-不饱和醛酮加成反应的规律Xiezx -Lzu7C 6H 5CH=CHCOC 6H 5KCN,HOAc EtOH C 6H 5CHCH 2COC 6H 5CNRCH=CHR'KCN, HOAc EtOHN. R.(1)93-96%C 6H 5CH=CHCOCH 3C 6H 5CHCH 2COCH 3NHN+(2)(3)1,4-产物85%HX 、HCN 、NH 3及NH 3的衍生物与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主.CH 2=CH-CH=O+ HCl-15o CClCH 2CH 2CH=O例子Xiezx -Lzu8(CH 3)2C=CHCOCH 3CH 2=CH-CCH 2COCH 3+(CH 2=CH -)2CuLi1. Et 2O2. H 2OCH 3CH 3(4)72%1. Et 2O2. H 2OOCH 3+(CH 3)2CuLi OCH 3CH 3(5)98%R 2CuLi 与α,β-不饱和醛酮的加成反应,以1,4-加成为主。
第八章 醛和酮(一)醛和酮的命名(二)醛和酮的结构(三)醛和

N
六亚甲基四胺(乌咯托品)
(己)与Wittig试剂加成
Ph3P + CH3CH2Br C6H6
PhLi
Ph3PCH2CH3 Br
Ph3P=CHCH3 + C6H6+LiBr
Ph3P CHCH3
O CH3 C CH3 + Ph3P=CHCH3
O PPh3 CH3 C CHCH3
CH3
O PPh3 CH3 C CHCH3 0oC CH3 C CHCH3 + Ph3P O
C
O
92%
(4)羧酸衍生物的还原
COCl
LiAl(OBu-t)3H OCH3 乙醚,-78 oC
CH3
H+/H2O
CHO
OCH3 CH3
60%
CH3(CH2)10
COOC2H5
Al(Bu-n)2H 己烷,-78 oC
H+/H2O CH3(CH2)10 CHO 88%
(5)芳烃的氧化
V2O5 CH3 + O2(air) 350-360oC
CH CCOOH CH3
(丙)Mannich反应
O CCH3 HCHO
HN(CH3)2 HCl
O CCH2CH2N(CH3)2
H3C
CO +HCl AlCl3_ CuCl, 20oC
H3C
CHO
(四)醛和酮的物理性质
沸点:介于烃、醚与醇、酚之间。
CH3CH2CH2CH3 CH3OCH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH
沸点/ oC -0.5
8
49
56
97
CH2CH3
CHO
不饱和醛酮

2.β-羟基醛酮
易脱水而一般的醇在碱性溶液中是稳定的. 酸催化:通过烯醇脱水 碱催化:通过烯醇盐进行
3. γ-和δ -羟基醛酮
与环状半缩醛形成动态平衡, 既有羟基醛酮的性质,又有环状半缩醛的反应.
CH3CH(OH)CH2COCH3
H2SO4
OH-
CH3CH=CH-COCH3 (比一元醇快)
CH3CH=CHCOCH3
1) RMgX
1,2-加 成 产 物 为 主 不 饱 和 醛 (1,2-加 成 产 物 为 主 )
2)H2O
不 饱 和 酮 甲 基 酮 (1,2-加 成 为 主 )
其 他 酮 (1,4-加 成 为 主 )
例:
KCN ,HOAc
C6H5CH=CHCOC6H5
EtOH
C6H5CH(CN)CH2COC6H5 (93-96%)
反应特点
亲核加成 亲电加成
1,2-加 成 和 1,4-加 成 ( 共 轭 加 成 )
二 反应(Reactions)
通式 C=C C=O + HNu 43 21
1,2-加 成
Nu
C=C CHOH
1,4-加成 [C-C=C-OH]
H
Nu
重排 C-C-C=O 羰基化合物
( 表 现 上 3,4-加 成 )
练习:完成下列转变:
O KOH
+ CH2=CHCOCH3
O
O CH2CH2COCH3
O
O CH2CH2COCH3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
OH-
OH-
or
+
O
【有机化学】α, β-不饱和醛酮 、 醌、羟基醛酮 、酚醛和酚酮、紫外光谱

+ HCN(CH3)2 2) H2O
DMF
CHO 主要产物
反应机理:
POCl3 +
O
O H C N(CH3)2 Cl
: :
Cl2PH-O-CH-N(CH3)2
O
Cl2P O C=N+(CH3)2Cl-
H
H Cl
C=N+ (CH3)2Cl2PHO2-
OH
+
H
+
Cl C=N(CH3)2
OH
H2O
Cl C N(CH3)2 H
一 反应
1. 1-羟基酮的反应
(1) 银镜反应
(2) 与苯肼作用生成脎(osazones)(成脎反应).
CH2OH
OH-
R-C=O
1-羟基酮
CHOH OH-
R-C-OH 烯二醇
CHO
R-CH-OH a-羟基醛
C6H5COCH2OH + 3 C6H5NHNH2
N
H3C C
N
HC H N
C6H5
+
C6H5NH2
ArCHO
CN-
O-
Ar-C-H
H2O
OH-
OH
Ar-C-H
CN
CN
OH-
OH
Ar-C-
H2O
CN
ArCHO OHO-
O- OH
Ar-C-C-Ar
H2O
OH-
H CN
OHOH OH-
Ar-C-C-Ar
H2O H CN
-CN-
OHO
Ar-C-C-Ar +CN+ Ar-C-C-Ar
H CN
H
《醛酮不饱和》课件

香料合成
香料合成是另一个重要的应用领域。醛酮不饱和具有独特 的香味和香气,因此在香料合成中具有广泛的应用。它可 以作为香料合成的起始原料或中间体,通过一系列的化学 反应,制备出各丙二酸酯法是一种通过丙二酸酯得到不饱和键的方法。
详细描述
该方法通常使用丙二酸酯与醇或碱进行反应,通过消除反应引入不饱和键。该方法选择性较好,但需 要使用较昂贵的丙二酸酯作为原料。
03
醛酮不饱和的应用领域
合成高分子材料
高分子材料是现代工业和科技领域不可或缺的重要材料,而醛酮不饱和作为一类 重要的有机化合物,在合成高分子材料方面具有广泛的应用。它可以作为聚合反 应的单体,通过与其他单体进行共聚反应,制备出各种具有特殊性能的高分子材 料。
例如,利用醛酮不饱和可以合成出具有优异力学性能、耐高温性能、耐腐蚀性能 等的高分子材料,广泛应用于航空航天、汽车、电子、化工等领域。
药物合成
药物合成为醛酮不饱和提供了一个重要的应用领域。许多药 物分子中含有醛酮不饱和结构,这些结构对于药物的活性至 关重要。利用醛酮不饱和作为中间体或起始原料,可以合成 出各种具有治疗作用的药物。
循环利用
研究废弃物的循环利用技术,实现资源的 高效利用。
生物降解
研究生物降解技术,使废弃物能够自然降 解,减少对环境的污染。
谢谢您的聆听
THANKS
利用生物酶进行催化反应,实现温和条件 下的高效转化。
应用领域的拓展
药物合成
利用醛酮不饱和化合物的 特性,开发新药物或改进
现有药物。
功能性材料
开发具有特殊性能的醛酮 不饱和化合物,用于新材
第十三章不饱和醛酮和取代醛酮
反应机理见第二版教科书 390 页
=
2. Reimer-Tiemann(赖默-悌曼)反应
酚与氯仿在碱性溶液中加热,生成邻(主要)和对羟基苯甲醛。
OH 10%NaOH OH CHO + CHCl3 + OH
CHO
-
CHCl3 + OH
CCl3 -H2O
O H
-Cl
-
CCl2 (二氯卡宾)
OH
O
-
CCl2
* n * * n *
非共轭体系,n * 在200nm 以上有吸收(>C=O)
共轭体系 ,n *, *在200nm 以上有吸收(丁二烯) 共轭导致红移
π *
E
E
π
表示法 波长: λmax
溶剂
消光系数:ε=
A cl
2.UV与化合物分子结构 (1)饱和有机化合物 无紫外吸收. RH, ROH, RX, RNH2
Nu
1 ,2 Nu
C=C-C-
O
H
C=C-C-
OH
=
4 3 2 C=C-C
1 O
Nu
Nu
1 ,4 H
Nu
Nu
OH
C-C=C-
O
C-C=C-
C-CHC=
O
O KCN CH=CH-C CH3COOH
O CH-CH2-C CN
1,4-加成
O CH3CH=CH-C-CH3 CH3Li H2O
OH CH3CH=CH-C-CH3 CH3
以上人名反应见第二版教科书 390 -392页
五、紫外光谱(UV) 1.基本原理 (1)紫外光 紫外光谱的形成
波长(λ): 4 ~ 400 nm 4 ~ 200 nm 远紫外 200 ~ 400 nm 近紫外
醛和酮

第十一章 醛和酮● 教学基本要求1、掌握醛、酮的结构、命名法、化学性质及其制法;2、掌握醛、酮的亲核加成反应历程;3、了解α,β-不饱和醛、酮的特性。
● 教学重点醛、酮的结构化学性质及其制法;醛、酮的亲核加成反应历程;α,β-不饱和醛、酮的特性。
● 教学难点醛、酮的化学性质及其制法;醛、酮的亲核加成反应历程;α,β-不饱和醛、酮的特性。
● 教学时数:● 教学方法与手段1、讲授与练习相结合;2、传统教学方法与现代教学手段相结合;3、启发式教学。
● 教学内容醛、酮分子中含有官能团羰基 ,故称为羰基化合物。
羰基和两个烃基相连的化合物叫做酮,至少和一个氢原子相连的化合物叫做醛,可用通式表示为:酮:醛: 酮分子中的羰基称为酮基。
醛分子中的 称为醛基,醛基可以简写为—CHO ,但不能写成-COH 。
羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质,如甘油醛(HOCH 2CHOHCHO )和丙酮酸(HOOCCOCH 3)是细胞代谢作用的基本成分,又是有机合成的重要原料和中间体。
第一节 醛、酮的分类、同分异构和命名1.1醛、酮的分类根据羰基所连烃基的结构,可把醛、酮分为脂肪族、脂环族和芳香族醛、酮等几类。
例如:脂肪醛 脂肪酮 脂环酮 芳香醛 芳香酮根据羰基所连烃基的饱和程度,可把醛、酮分为饱和与不饱和醛、酮。
例如: O CH O C CH 3 CH 3CHO CH 3CCH 3R 1C O R 2R C O Ar C O Ar 1Ar 2(H) R Ar C C H HC O H O >C=饱和醛 不饱和醛 不饱和酮 不饱和酮根据分子中羰基的数目,可把醛、酮分为一元、二元和多元醛、酮等。
例如:二元醛 二元酮 多元酮碳原子数相同的饱和一元醛、酮互为同分异构体,具有相同的通式:C n H 2n O 。
1.2醛、酮的同分异构现象醛酮的异构现象有碳连异构和羰基的位置异构。
1.3 醛、酮的命名少数结构简单的醛、酮,可以采用普通命名法命名,即在与羰基相连的烃基名称后面加上“醛”或“酮”字。
有机化学课件--不饱和醛酮 共32页

C H 3 C H = C H C H = O
2-丁烯醛
O
C H 3 C H = C H C C H 3
3-戊烯-2-酮
O
O
C H 3C C H =C H C 6H 5
4-苯基-3-丁烯-2-酮
甲基-2-环己烯-1-酮
15.07.2019
课件
3
一 特性 体系稳定 C=C与 C=O 组成共轭体系
OH- CH3CH=CHCH=O
1,4-加成产物为主
1) RMgX,CuCl 2)H3O+
1,4-加成产物为主
1) RLi 2) H2O
1) RMgX
1,2-加成产物为主 不饱和醛(1,2-加成产物为主)
2)H2O
不饱和酮 甲基酮(1,2-加成为主)
其他酮(1,4-加成为主)
15.07.2019
课件
6
例:
KCN,HOAc
C6H5CH=CHCOC6H5
CN-
ArCHO
O-
Ar-C-H
CN
H2O
OH-
OH
Ar-C-H
CN
OH-
OH
Ar-C-
H2O
CN
ArCHOH-
H CN
OHOH OH-
Ar-C-C-Ar
H2O H CN
-CN-
OHO
Ar-C-C-Ar +CN+ Ar-C-C-Ar
H CN
H
15.07.2019
15.07.2019
课件
16
一. 反应
二. 1. 1-羟基酮的反应
(1) 银镜反应 (2)与苯肼作用生成脎(osazones)(成脎反应).
醛酮的分类和命名

第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名1.醛、酮的系统命名以包含羰基的最长碳链为主链,看作母体。
从靠近羰基的一端开始,依次标明碳原子的位次。
在醛分子中,醛基总是处于第一位,命名时可不加以标明。
酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。
α是指官能团羰基旁第一个位置,β是指第二个位置…。
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
ⅲ当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
2. 酮还有另一种命名法根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
后面是母体如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
英文羰基做取代基时用“oxo”(氧代)表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
第二节醛、酮的物理性质和光谱性质一、物理性质除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。
低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。
低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。
碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
醛酮

CH3-C-CH2CH3
⑦
⑧
-C-CH3
⑤
④
24
3、与醇的加成反应 、 ⑴、缩醛 (acetal )的生成 的生成
醛在干燥HCl或无水强酸的催化剂作用下,可与醇加 或无水强酸的催化剂作用下, 醛在干燥 或无水强酸的催化剂作用下 成生成缩醛。 成生成缩醛。
R H C= O + H OR' H+ R C H OH R'OH/H+ OR' R C H OR' OR'
⑵、缩酮的生成
CH3 CH3 1mol C= O + C2H5OH 4mol
半缩 醛
H+ 25oC CH3 C CH3 OC2H5 2% OC2H5
缩 醛
+ H 2O
平衡不利于缩酮的形成
缩酮
25
采取措施: 采取措施 使用二元醇, ①、使用二元醇,并除去反应中生成的水
O
+
CH2 OH
CH2 OH
对甲苯磺酸 苯
富电子试剂进攻缺电子的羰基碳所引起的加 成反应叫亲核加成反应 . 反应历程: 反应历程: 碱催化: 碱催化
C δ+
δ- +Nu O Oδ
O] δNu
OH +H2O Nu C Nu
[
C
C
反应物 平面三角形
过渡态 四面体氧上 四面体氧上 带部分负电荷
反应中间体 四面体 氧上带负电荷
产物 四面体
13
酸催化: 酸催化
CH3CH2CH2CHO O CH3CH2-C-CH2CH3
丁醛
3—戊酮 戊酮
4
不饱和醛酮: 不饱和醛酮:
CH2=CHCH2CHCHO CH3
药品生产技术《α,β-不饱和酮类》

利尿药α,β-不饱和酮类一、药物根本原理利用与酶中-SH 结合较强的基团,影响酶的作用而利尿,从中发现了对位不饱和酮基取代的苯氧乙酸,具有较强的利尿作用。
COOH C 2RSH O COOH Cl Cl C 2H 5S R图1,α,β-不饱和酮类机制示意图二、代表性药物依他尼酸OCOOH Cl Cl C 2H 5O图2,依他尼酸〔Ethacrynic acid ,又名:利尿酸〕1、理化性质性状:白色结晶性粉末。
溶解性:在水中不溶,溶于NaOH 。
稳定性:α、β—不饱和酮的结构,在水溶液中不稳定,尤其在碱性溶液中易分解。
2、作用利尿作用强而迅速——强效利尿药,需同服氯化钾。
3、用途临床上用于充血性心力衰竭,急性肺水肿、肾性水肿等。
肾功能衰竭者慎用。
4、区别反响溶于H2SO4→→黄色H2O→→乳白色,冷高锰酸钾→→退色加NaOH煮沸→→→甲醛浓H2SO4酸化变色酸→→深蓝色三、药理作用1、对水、电解质排泄的影响〔1〕利尿作用,尿钠、钾、氯、磷和镁等离子排泄增加,而对尿钙排泄减少。
本类药物作用机制主要抑制远端小管前段和近端小管〔作用较轻〕对氯化钠的重吸收,从而增加远端小管和集合管的Na-K交换,K分泌增多。
其作用机制尚未完全明了。
本类药物都能不同程度地抑制碳酸酐酶活性,故能解释其对近端小管的作用。
本类药还能抑制磷酸二酯酶活性,减少肾小管对脂肪酸的摄取和线粒体氧耗,从而抑制肾小管对Na、Cl-的主动重吸收。
〔2〕降压作用。
除利尿排钠作用外,可能还有肾外作用机制参与降压,可能是增加胃肠道对Na的排泄。
2、对肾血流动力学和肾小球滤过功能的影响由于肾小管对水、Na重吸收减少,肾小管内压力升高,以及流经远曲小管的水和Na增多,刺激致密斑通过管-球反射,使肾内肾素、血管紧张素分泌增加,引起肾血管收缩,肾血流量下降,肾小球入球和出球小动脉收缩,肾小球滤过率也下降。
肾血流量和肾小球滤过率下降,以及对亨氏袢无作用,是本类药物利尿作用远不如袢利尿药的主要原因。
第六节 α,β- 不饱和醛、酮

3
1, 2加 成 C C C C O + Nu 1, 4-加 成 C Nu C C C Nu C O O
H
C
C
C Nu
OH
H
C Nu
C
C
OH
C Nu
不稳定(互变) H C C O
反应为1,2-加成还是1,4-加成决定于三个方面: (1)亲核试剂的强弱 弱的亲核试剂主要进行1,4-加 成,强的主要进行1,2-加成。
X H O H–X CH2–CH–C–R CN H O CH2–CH–C–R
烯醇式重排
CN OH CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素
——羰基端基团、烯基端基团、试剂的体积
–R 1,4-(%)
H 0
Me 60
Et 71
i-Pr 100
t-Bu 100
越大越不利于1,4-加成 1,4-加成 O –CH=CH–C–R ① C2H5MgX
② H2O
OH –CH=CH–C–R C2H5 1,2-加成产物 C2H5 O –CH–CH2–C–R 1,4-加成产物
1,2-加成
越大越不利于1,2-加成
三、插烯反应(羟醛缩合)
CH 3 CHO + H-CH 2 CH=CH-CHO
CH2=C=O + R–MgX
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 O CH3–C–Cl 乙酰氯 O CH3–C–OOCCH3 乙酐 O CH3–C–OC2H5 乙酸乙酯 O CH3–C–NH2 乙酰胺 O CH3–C–R 甲基酮
_ 稀 OH
-H 2 O
CH 3 CH=CH-CH=CHCHO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH 3
O
(4)还原反应
O LiAlH
4
OH
O CH 3 H2 / Ni
CH 3
CH 3
在碱性条件下加成反应的机制
Nu
-
+
C =C
C=O
Nu
C
C =C
O
-
Nu
C
C _
C =O
H+
Nu
C
C =C
OH
互变异构
Nu
C
C
C =O
H
在酸性条件下加成反应的机制
C
+
C=C
OH
C =C
C=O
+
H
+
C =C
C
+
OH
(2)反应温度 低温进行1,2-加成,高温进行1,4加成。
(3)立体效应 羰基所连的基团大或试剂体积较大时, 有利于1,4加成。
1.亲核试剂主要进攻空间位阻小的地方;
O (H 5 C 2 ) 2 C CH CH N u: CH2 C O C C H 2C H 3
所以,醛基比酮 基更容易被进攻。
CH3
2. 强碱性亲核试剂(如RMgX、LiAlH4)主要进 攻羰基(1,2-加成) 。
O CH2 CH C CH3 L iA lH 4 H
+
OH CH2 CH C H
OH CH2 CH C CH3 CH3
H 2O
H
+
CH3
O CH2 CH C CH3 C H 3M g I
H 2O
3.弱碱性亲核试剂(如CN-或RNH2)主要进攻 碳碳双键(1,4-加成) 。
越大越不利于1,4-加成 1,4-加成 O –CH=CH–C–R ① C2H5MgX
② H2O
OH –CH=CH–C–R C2H5 1,2-加成产物 C2H5 O –CH–CH2–C–R 1,4-加成产物
1,2-加成
越大越不利于1,2-加成
三、插烯反应(羟醛缩合)
CH 3 CHO + H-CH 2 CH=CH-CHO
-
C H 3 -C H = C H -C H = C H -C H = C H -C H O C H 2 -C H = C H -C H O
-
- H 2O
OH CH 3 -CHO + C H 3 -C H = C H -C H O
- H 2O /
CH 3 -CH=CH-CH=CH-CHO
插烯规律
插烯规律:在 H3C-CHO分子的 CH3与CHO
先1,4-加成,生成烯醇重排,相当于1,2-加成。
二. 亲核加成
通常情况下,碳碳双键是不会与亲核试剂 加成的。但由于在α,β-不饱和醛、酮中,C=C 与C=O共轭,亲核试剂不仅能加到羰基上, 还能加到碳碳双键上。 以3-丁烯-2-酮与氰化氢的加成为例。
O
OH
O
3
CH 2
CH-C-CH
0
C H 2= C = O + C O 2
(3)麦克尔(Michael)反应 活泼亚甲基化合物和 α ,β –不饱和化合物 在碱催化下起1,4-加成。
B G C-H - HB - G = -N O 2 -C N -C O O G C
-
G
C
-
O G OH C - C H 2 -C H = C H
-
+ C H 2 = C H -C
_ 稀 OH
-H 2 O
CH 3 CH=CH-CH=CHCHO
-H 2 O
CH 3 CH=CHCH=O
+ H-CH 2 CH=CHCHO
稀 OH
CH 3 CH=CHCH=CHCH=CHCHO
OH 2 C H 3 -C H = C H -C H O C H 3 -C H = C H -C H O
-
- H 2O / OH
H -O R
H -X H -N H 2
(2)乙烯酮自聚
C H 2= C = O + C H 2= C = O C H 2= C O 二乙烯酮
C H 2 -C = O
C H 3 -C = O C H 2 -C = O Y O O
C H 2= C
O + H -Y
C H 2= C
OH
C H 2 -C = O
+
1) R M gX
2)H 2 O
,-不饱和醛酮发生加成反应时的选择规律 *1 卤素、HOX不发生共轭加成,只在碳碳双键上 发生1,2-亲电加成。 *2 HX, H2SO4等质子酸以及H2O、ROH在酸催化 下与,-不饱和醛酮的加成为1,4-共轭加成。 *3 HCN、NH3及NH3的衍生物等与,-不饱和醛 酮的加成也以发生1,4-共轭加成为主。 *4 醛与RLi, RMgX反应时以1,2-亲核加成为主。 与R2CuLi反应,以1,4加成为主。 *5 酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R2CuLi,主要得1,4-加成产物, 使用RMgX,如有亚铜盐如CuX做催化剂,主要得 1,4-加成产物,如无亚铜盐做催化剂,发生1,2加 成还是1,4-加成,与反应物的空间结构有关,空阻 小的地方易发生反应。
傅 -克 酰 基 化 反 应
(3)与格氏试剂反应 (羰基性质)
O C H 2 = C = O + R M gX H 2O C H 2 = C -O H R 甲基酮 C H 3 -C -R
(4)与卤素加成(碳碳双键性质)
CH 2 =C=O + X-X
CH X
2 -C=O
X
3、制 备
(1 ) 热 解 7 0 0 -8 5 0 Fe A lP O 4 700
C H 2 -C = O Y
H -O H C H 3 -C - C H 2 -C - O H 丁酮酸 O O H -O R C H 3 -C - C H 2 -C - O R 丁酮酸酯
O C H 2= C O +
OH
O
O
3
C -C H 2 -C = C H 2 AlCl
3
C-CH 2 -C-CH
C H 2 -C = O
间插入 [CH=CH] n,成为 H3C [CH=CH] n CHO,
反应仍可在共轭体系的两端进行,而共轭体系相
连的两个基团仍保持 [CH=CH] n插入前的关系,
即乙醛的CH3与CHO相互关系仍然存在,甲基上
的氢仍然活泼,称为“插烯规律”。
从结构上对比:
H H C H + CH O H H C H + CH CH + CH O
CH2=C=O + R–MgX
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 O CH3–C–Cl 乙酰氯 O CH3–C–OOCCH3 乙酐 O CH3–C–OC2H5 乙酸乙酯 O CH3–C–NH2 乙酰胺 O CH3–C–R 甲基酮
H
HB
O G C - C H 2 -C H 2 = C H
G
C - C H 2 -CC H -C H
B
-
O G C - C H 2 -C H 2 = C H
O CH 3 + C H 2 = C H -C O O B
-
O O CH 3 B
-
CH 3 O CH 2 -CH 2 -C O CH 3
0 0
C H 3C O C H 3
C
C H 2= C = O + C H 4
C H 3C O O H
(2 ) 消 除
C H 2= C = O + H 2O
C
(C H 3 ) 2 C -C = O Br Br
Zn
(C H 3 ) 2 C = C = O + Z n B r 2
( 3) 一 氧 化 碳 和 氢 气 的 反 应 ZnO 3 CO + H2 250 C 压 力
δ + CH 2 =CH-C-H
总的结果是 1,4-加成的历 程,碳-碳双 键上1,2-加成 的产物。
历 程: δ+ CH 2 =CH-C-H Oδ H
+
+ OH CH 2 =CH-C-H O CH 2 -CH 2 -C-H Cl
OH + CH 2 -CH=C-H + Cl
-
OH CH 2 -CH=C-H Cl
X H O H–X CH2–CH–C–R CN H O CH2–CH–C–R
烯醇式重排
CN OH CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素
——羰基端基团、烯基端基团、试剂的体积
–R 1,4-(%)
H 0
Me 60
Et 71
i-Pr 100
t-Bu 100
其它情况
用活泼金属还原 [Na, Li-NH3(液)]: 不还原孤立的C=C,能还原共轭的C=C, 而且是先还原C=C,再还原C=O。 用氢化金属化合物的还原:
H OH
O
H OH
H OH
H2O 97%
LiAlH4
NaBH4 C2H5OH
H2O 59%
+
41%
四、重要的醛酮 乙烯酮
CH2=C=O + H–OH CH2=C=O + H–Cl CH2=C=O + H–OOCCH3 CH2=C=O + H–OC2H5 CH2=C=O + H–NH2
实际上,共轭效应沿链传递不减弱
5.Diels-Alder反应
,不饱和醛酮是很好的亲二烯体
