不饱和醛酮
不饱和醛酮选择性加氢

不饱和醛酮选择性加氢第一部分背景介绍不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。
目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。
但是由于C=C 键比C=O 键在加氢过程中在热力学中更加有利。
所以研发新型催化剂对不饱和醛 酮选择性加氢十分重要。
这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研 究提供新的基础。
第二部分文献综述、Sn 修饰Si02负载Pt 催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn双金属催化剂0HButyraldehyde方案1. 丁烯醛加氢的还原路径丁烯醛的氢化路径,如方案1。
在负载了毗族金属催化剂中,会得到丁醛而 不产生丁烯醇,第二种金属加入到毗族金属催化剂中,来阻止C=C 键的氢化[2,3-5] 特别的,Sn 修饰负载在Si02、氧化铝或活性炭上的毗族金属,大量的被研究[2,6-10]。
我们研究了 Sn 的加入使生成不饱和醇的选择性大大增加[11,.12]。
方案2. Sn-Pt/SiO 2双金属催化剂对于丁烯醛选择性加氢。
(a )理想反应(b )实际反应方案2为我们提出的由传统浸渍法制备的 Sn-Pt/SiO 2催化丁烯醛的反应机[1]才、-Crotonaldehyde7 0HCrot/laloohol1 -Butancl理。
Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。
对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO s)上。
然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。
由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。
然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。
为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。
课堂_第十二章_醛和酮 (2)

CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
第六节_α_β-_不饱和醛、酮解读

稀-OH
CH3CH=CHCH=O +H-CH2CH=CHCHO
-H2O
OH-
2 CH3-CH=CH-CHO - H2O /
CH3-CH=CH-CHO
OH- H2O
CH3CH=CHCH=CHCH=CHCHO
CH3-CH=CH-CH=CH-CH=CH-CHO -CH2-CH=CH-CHO
OHCH3-CHO + CH3-CH=CH-CHO - H2O /
不饱和醛酮的加成反应chhcnchohcnchoh一般发生14共轭加成得34产物chcroh共轭烯醇式重排12加成14加成不饱和醛酮1214亲核加成的因素chchohchch12加成产物14加成产物羰基端基团烯基端基团试剂的体积12加成14加成100100716014tbuipretme越大越不利于12加成越大越不利于14加成chchchochchchchchchchchoohchchchoohchchchchchoohchchchochchohchchchchohchchchchochccho分子的chcho间插入chch反应仍可在共轭体系的两端进行而共轭体系相连的两个基团仍保持chch插入前的关系即乙醛的chcho相互关系仍然存在甲基上的氢仍然活泼称为插烯规律
Br
的产物。
历 程:
δ+
Oδ -
CH2=CH-C-H
H+
OH
CH2-CH=C-H Cl
+ OH CH2=CH-C-H
O CH2-CH2-C-H Cl
OH
+ CH2-CH=C-H
+
Cl-
先1,4-加成,生成烯醇重排,相当于1,2-加成。
二. 亲核加成
通常情况下,碳碳双键是不会与亲核试剂
各类化合物的紫外吸收光谱

此外,由于引入含有n电子的N原子的,这类杂环化合物还可 能产生n*吸收带。
24
苯 、萘、蒽、并四苯的吸收光谱
25
直接分析烷烃和卤代烃的紫外吸收光谱,实用价值不大,
但是它们是测定紫外(或)可见吸收光谱的良好溶剂。
1
1.3.2 简单的不饱和化合物
1、烯烃、炔烃化合物
在不饱和烃类分子中,除含有键外,还含有键,它们 可以产生*和*两种跃迁。 例如,在乙烯分子中, *跃迁最大吸收波长为180nm。
22
在气态或非极性溶剂中,
苯及其许多同系物的B谱带有
许多的精细结构,这是由于
当苯环上有取代基时,
振动跃迁在基态电子上的跃 迁上的叠加而引起的。
在极性溶剂中,这些精 细结构消失。
苯的三个特征谱带都会发生 显著的变化,其中影响较大 的是E2带和B带。
23
稠环芳烃及杂环化合物
稠环芳烃,如萘、蒽、芘等,均显示苯的三个吸收带,但是 与苯本身相比较,这三个吸收带均发生红移,且强度增加。随 着苯环数目的增多,吸收波长红移越多,吸收强度也相应增加。
0nm +6nm
10
例3
1 2
3 4
胆甾-3,5-二烯
max=214nm(基数) +3×5nm(烷基取代) +5nm(环外双键)
=234nm 观察值max=235nm
11
例4
1
CH3COO 2
34
56
该化合物在1,4,6位上有三个烷基取代;3, 4位上的双键是环外双键;2位上是酰基取代。
max=254nm(基数)+30(延长一个共轭双键) +3×5nm(烷基取代或环的剩余部分) +5nm(环外双键)
醛酮的加成反应

O O 1. CH3CHO CH3CCH2CH2MgBr + 2. H2O , H
CH3COCH 2CH2CHCH 3 OH
CH2OH 例3:从甘油合成 CHOH CH2OCR O
CH3 CH2OH CH COCH CH2O RCOCl 3 3 C CHO CH3 解: CHOH 碱 H CH2OH CH2OH
1720~1740cm-1
1695~1715cm-1
1680~1705cm-1
醛羰基约在1750~1700cm-1,醛基C-H伸缩在2820
~2720cm-1,低于脂肪烃的C-H伸缩频率。
O R C R O Ar C R O Ar C Ar O RCH CH C R
1700~1725cm-1 1680~1700cm-1
(Z)-丁酮肟
(E)-丁酮肟
(4) 与氢氰酸的加成反应
OH C=O
+ H
CN
C
CN
α -羟基腈
O OH
N aCN , H 2 SO 4
例: CH 3CCH 3
CH 3CCH 3 CN
实验:丙酮与氢氰酸作用,在3-4 h内只有一半原料起反
应,若加一滴氢氧化钾溶液,则反应可以在两分 钟内完成。加酸则使反应速度减慢。在大量的酸 存在下,放几星期也不起反应。
产率(1h,%)
89
56
36
CH 3 C= O CH 3CH 2CH 2
CH 3 C= O (CH 3)2CH
CH 3 C= O (CH 3)3C
23
12
6
加成产物在酸、碱作用下,可分解为原来的醛和酮:
R H OH C SO 3Na HCl R H C= O + NaCl + SO 2 + H 2O
第十三章 不饱和醛酮及取代醛酮

O
例:合成
O
O
O
O
O
O
O
O
O
6. 还原反应
CH3CH CHCHO CH3CH CHCHO
1. LiAlH4 2. H2O
CH2
CH C CH3
CH3CH CHCH 2OH
CH3CH2CH2CHO
19
H2 , Ni 室温
CH3CH CHCHO
O
H2 , Ni 高温
CH3CH2CH2CH2OH
O
例:
O
C6H5CHO +
C
H
O CN CH C CH3
29
例: C6H5CHO + CH2
C6H5
O C
CH2CH2
O C CH3
CN -
例:C6H5CHO
+
CH2 CH C N
O C
C6H5
CH2CH2 C N
CN -
O
C6H5CHO + CH3CH C C OC(CH3)3
CH3
C6H5 O C O
β-碳具有亲电性,容易和亲核试剂发生共轭加成。
碱催化下β,γ-不饱和醛酮的异构化: 酸催化下β,γ-不饱和醛酮的异构化:
5
反应:
O H
CH3 CH CH C
2-丁烯醛 亲电加成:亲电试剂如卤素、次卤酸等,不发
生共轭加成,只是在碳碳双键上发生亲电加成。
1.
C
C
O1
2.
CH CH C 4 3 2
共轭加成 (1, 4-加成)
N(CH3)2
POCl 3
+
H
C N(CH3)2Cl H
醛和酮 有机化学

这种加成-消除实际上可以看成由分子间脱去1分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
(六)加伯胺及氨的衍生物
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff 碱 R’
R—C = N-OH 肟
H2N—NH2 H2N—NH-
R’
R—C= N-NH2
C=O
+
d- d+
R-MgX
无水 乙—醚>
R—C—OMgX
—H3—O+>
R—C—OH
(五)与金属有机化合物加成
O (1) H—C—H +
-MgCl
1.乙醚 2.H3O+ (66%)
-CH2OH 伯醇
(2) CH3CHCH2CHO + C2H5MgCl
CH3
1.乙醚 2.H3O+ (68%)
CH3CH CH2CHC2H5 CH3 OH
醛和酮
醛和酮
羰基: C O
羰基碳与一个烃基和一个氢相连的化合物称 为醛,(甲醛中的羰基碳与两个氢相连), 羰基碳与两个烃基相连的化合物称为酮。
O
(H)R—C—H 醛 简写: R CHO
O
R—C—R’ 酮
第一节 结构、分类和命名
一、结构
O
121pm
121.7o C
H 116.6o H
平面分子
109o
例:
CH3
HO
C=O +
CH3
HO
H+ CH3 O CH3 O
R
HO CH2
第十二章醛酮不饱和-文档资料

2、共轭醛酮的特殊性质
1)特强的亲和试剂发生1,2-加成 亲核试剂进攻羰基,与饱和共轭醛酮类似。 典型试剂:烃基锂、炔化钠
H3C
O
H3C
Li
CH3
H3C
H3C
OH
CH3
H3C
O HC
CH3
C- Na+
H3C
OH
H3C
C
CH
勤读力耕,立己达人
思考:下列反应得到什么产物
O H3C Li
H3C O
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O
酸催化
H2C
CH3
H3C
O CH3
O
碱催化
H2C
CH3
H3C
O
CH3
勤读力耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O
H2C
CH3
H HO-
O-
H2C
CH3
H2C
O
CH-
CH3
H2C-
O CH3
H2O
H3C
O CH3
O
H3C
CH2 O-
H3C
CH3
O
H3C O
H3C
CH3 O-
H2O
H3C O
CH3 Li CH3 H3C
CH3
H3C
H3C O- H3C
SOCl 2 H3C H3C Cl
CH3
Li CH3 H3C
H3C
CH3
H3C
CH3 H3C
勤读力耕,立己达人
第二节 醌 quinone
醌是环状共轭二酮—芳香化合物的衍生物。
第十二章 醛酮(不饱和)

4-nitrosophenol
勤力读耕,立己达人
3)1,4-加成反应
共轭酮与HCN、 HX、 MeOH/ZnCl2发生1,4-加成, 中间体重排取代二酚,一般反应式如下:
HO HX O O OH X HO X
O
O
X=卤素、CN、甲氧基(氯化锌催化)。
HO HCl O OH Cl HO Cl
-
H3C O H3C
CH3
H3C Mg Cl Ag
+
-
H3C Cl Mg O H3C
CH3 CH3
H5C2 O C2H5 CH3
+
H3O
+
H3C H3C CH3 O
勤力读耕,立己达人
合成化合物D
H3C CH3 O
H3C O H2O
CH3
KH
H3C O
-
CH2
H3C O H3C
CH3 O
-
H3C O H3C
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O H2C CH3
酸催化
H3C
O CH3
O H2C CH3
碱催化
H3C
O CH3
勤力读耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O H2C CH3 CH
-
O H2C CH3
H HO
-
O H2C
O CH3 H2C
-
CH3
*Fries重排
苯酚在=与酰氯发生反应时先生成酚酯:
O HO
+
Cl
R
ACl 3
R
O
有机化学:第十章 醛 酮(1)
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
第13章 不饱和醛酮和取代醛酮

3-丁烯醛
OH
:
:
:
H2O +
:
CH2 CH CH CH O :
:
:
CH2 CH CH CH O :
在酸性溶液中3-丁烯醛通过烯醇转化为2-丁烯醛:
CH2 CH CH2 CH O : H+ H+
: : :
CH2 CH CH CH OH CH3 CH CH CH OH
+
: :
CH2 CH CH CH O:
CH3CH CHCH O:
2-丁烯醛
CH2 CH CH2 CH OH
+
CH2 CH CH2 CH OH
+
H+ H+
: :
: :
: :
CH3 CH CH CH OH
+
CH3 CH CH CH OH
+
:
:
CH3CH CHCH O:
13.1.1 α,β-不饱和醛酮的反应
H+
简单的烯烃与氢氰酸不起加成反应,因为生成的活性中间体——碳负离 子,非常不稳定。
R CH CH R' + CN R CH CH R' CN
:
α, β-不饱和醛酮与其他弱碱性的亲核试剂也容易起1, 4-加成反应:
O CH3 C CH CH C6H5 + HN
4-苯基-3-丁烯-2-酮 六氢吡啶
13.1.1.5 还原 α, β-不饱和醛酮用氢化铝锂还原生成α, β-不饱和醇:
CH3 CH CHCHO
2-丁烯醛
+
不饱和醛酮及取代醛酮

O CH3 C H
+
O
α
H CH2 CHO
稀碱
△
CH3CH CHCHO
α,β-不饱和醛
+ H2O
O +
2. β-羟基醛酮脱水制备 3. 烯丙位的氧化
O CH CHCCH3
OH H2O
-,
O + H2O
α,β-不饱和酮
O CrO3 / t-BuOH CH CHCCH3
O
α,β-不饱和酮
四、 化学性质
C
4
3
2C
C O C O
C
C X
C
(一) 1,2-及1,4-加成----亲电加成 α,β不饱和醛酮的亲电加成机理——1, 4-加成(共轭加成)机理
(以与HX加成为例)
H X O C C C X X O C X C H C + HCl C C OH C C X C H X OH C
H O C X C H C
基铜锂类似!!!
(一) 1,2-及1,4-加成
3. 迈克尔(Michael)反应
定义:烯醇负离子与α,β–不饱和羰基化合物 的1, 4–加成反应。
烯醇负离子
(一) 1,2-及1,4-加成----Michael加成
Michael加成机理
O C C H + C C O C O O C C C H C
41%
59%
四、 化学性质----还原反应
3. 碱金属与液氨还原
可还原与羰基共轭的碳碳双键,孤立的双键不还原,但试剂过量孤 立羰基也被还原。 常用碱金属:Li、Na、K
1) Li, NH3, -33C 2) H3O+ O O
O
醛和酮的分类

R CO
R'
RCH 2OH
R CHOH
R'
CC
LiAlH 4、NaBH 4
氢化铝锂 硼氢化钠
CH2 CH2
CO
CH OH (不还原 C C )
? 想一想
O C CH3 Zn Hg ,HCl
+ CH2CH 3 H2O
CH3CH CHCHO
① NaBH4
② H2O
CH3CH CHCH 2OH
H2 Ni CH3CH2CH2CH2OH
OH
浓H2SO4
CH3 CN
丙酮氰醇
CH3 CH2 C COOH
2-甲基-2-丙烯酸
CH 3OH
CH3
CH2 C COOCH 3
(2-)甲基(-2-)丙烯酸甲酯
2. 与亚硫酸氢钠的加成
R
HO O-Na+
C O+
S
H
O
(饱和)
常用于:
R
ONa
C
H SO3H
R OH C
H SO3Na
(白色结晶)
鉴别醛、脂肪族甲基酮和8个碳以下的环酮
互变异构 醇醛缩合 卤代反应 (碘仿反应)
O CC
氧化 还原 歧化
H
亲核加成
(与HCN 、NaHSO 3、ROH 、RMgX 、H2N-G加成)
五、醌
1. 醌的结构和命名
O
O
O
O
O
1,4-苯醌(对苯醌)
O O
O
1,2-苯醌(邻苯醌) 1,4-萘醌(α-萘醌)
O O
1,2-萘醌(β-萘醌)
O
2,6-萘醌(远萘醌)
黄
醛和酮专业知识

CH2OH C CHO CH2OH
HCHO 浓OH-
HOCH2
CH2OH C CH2OH + HCOOCH2OH
3.卤化反应及卤仿反应
醛、酮分子中旳α-氢原子轻易被卤素取代,生成α-卤代醛、酮
XO HC C R
H XO HC C R X XO XC C R X
:B-
XO
[H C- C R
:B-
XO [ -C C R
CHO
SO3H
[酮醛]
O CH2CCH2CH3
1-苯基-2-丁酮
O
O
CH2 CH C CH3 CH3CH2CCH2CHO
3-丁烯-2-酮
3-氧代戊醛 或 3-戊酮醛
sp2 羰基 :>C=O: 一种键、 一种键 R
C O 羰基碳:sp2杂化;羰基为平面型。
R'
羰基氧不杂化
CO
羰基是极性基团。
CO
C+ O-
40oC
CH3
CH3 C CHO CH2OH
CHO + CH3CHO
dil. OH-
?
CH=CHCHO
肉桂醛
O CHO +
OH-, H2O ?
O CH=
O
O
怎样利用甲醛(过量)、乙醛及必要旳试剂制备季戊四醇?
3HCHO + CH3CHO
HOCH2
CH2OH C CH2OH CH2OH
稀OH-
HOCH2
CH2=CHCH(OC2H5)2
H+ H2O
CH2=CHCHO + 2CH3CH2OH
酮也能生成半缩酮、缩酮,但反应较为困难
CH3 CH3
醛酮

CH3-C-CH2CH3
⑦
⑧
-C-CH3
⑤
④
24
3、与醇的加成反应 、 ⑴、缩醛 (acetal )的生成 的生成
醛在干燥HCl或无水强酸的催化剂作用下,可与醇加 或无水强酸的催化剂作用下, 醛在干燥 或无水强酸的催化剂作用下 成生成缩醛。 成生成缩醛。
R H C= O + H OR' H+ R C H OH R'OH/H+ OR' R C H OR' OR'
⑵、缩酮的生成
CH3 CH3 1mol C= O + C2H5OH 4mol
半缩 醛
H+ 25oC CH3 C CH3 OC2H5 2% OC2H5
缩 醛
+ H 2O
平衡不利于缩酮的形成
缩酮
25
采取措施: 采取措施 使用二元醇, ①、使用二元醇,并除去反应中生成的水
O
+
CH2 OH
CH2 OH
对甲苯磺酸 苯
富电子试剂进攻缺电子的羰基碳所引起的加 成反应叫亲核加成反应 . 反应历程: 反应历程: 碱催化: 碱催化
C δ+
δ- +Nu O Oδ
O] δNu
OH +H2O Nu C Nu
[
C
C
反应物 平面三角形
过渡态 四面体氧上 四面体氧上 带部分负电荷
反应中间体 四面体 氧上带负电荷
产物 四面体
13
酸催化: 酸催化
CH3CH2CH2CHO O CH3CH2-C-CH2CH3
丁醛
3—戊酮 戊酮
4
不饱和醛酮: 不饱和醛酮:
CH2=CHCH2CHCHO CH3
醛酮的命名和结构特点
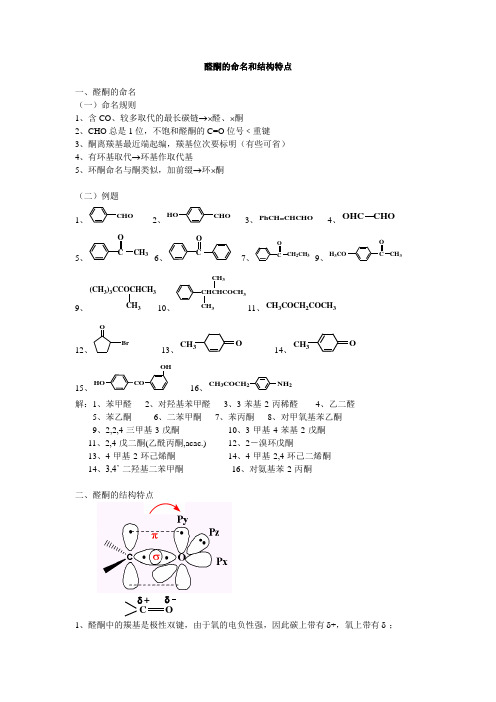
醛酮的命名和结构特点一、醛酮的命名(一)命名规则1、含CO 、较多取代的最长碳链→⨯醛、⨯酮2、CHO 总是1位,不饱和醛酮的C=O 位号﹤重键3、酮离羰基最近端起编,羰基位次要标明(有些可省)4、有环基取代→环基作取代基5、环酮命名与酮类似,加前缀→环⨯酮(二)例题1、CHO2、HO CHO3、PhCH=CHCHO4、OHC CHO5、C O CH 36、C O7、C O CH 2CH 3 9、H 3CO C OCH 39、(CH 3)3CCOCHCH 3CH 310、CH 3CHCHCOCH 3CH 311、CH 3COCH 2COCH 312、O Br 13、CH 3O 14、CH 3O15、CO HO OH 16、CH 3COCH 2NH 2解:1、苯甲醛 2、对羟基苯甲醛 3、3-苯基-2-丙稀醛 4、乙二醛5、苯乙酮6、二苯甲酮7、苯丙酮8、对甲氧基苯乙酮9、2,2,4-三甲基-3-戊酮 10、3-甲基-4-苯基-2-戊酮11、2,4-戊二酮(乙酰丙酮,acac.) 12、2-溴环戊酮13、4-甲基-2-环己烯酮 14、4-甲基-2,4-环己二烯酮14、3,4’-二羟基二苯甲酮16、对氨基苯-2-丙酮二、醛酮的结构特点C Oδδ+1、醛酮中的羰基是极性双键,由于氧的电负性强,因此碳上带有δ+,氧上带有δ-;2、δ+的碳与δ-的氧比较而言,前者更易受到试剂(亲核试剂)的进攻,因此羰基的加成属于亲核加成;3、受羰基影响,α-H具有一定的酸性,可发生卤代、羟醛缩合等反应;4、羰基的氧化度处于中间状态,可继续氧化亦可被还原;5、醛的氢直接连接羰基,较活泼,可发生醛的特性反应,如醛可被弱氧化剂养化。
由结构推知:醛酮的典型反应示意图:HC α-H 的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH=CH CH=O
2-丁烯醛
O
CH3CH=CHCCH3
3-戊烯-2-酮
O
O
CH3CCH=CHC6H5
4-苯基-3-丁烯-2-酮
甲基-2-环己烯-1-酮
一 特性 体系稳定 C=C与 C=O 组成共轭体系
如 CH2=CHCH2CH=O 3-丁 烯 醛
OH- CH3CH=CHCH=O
H+ CH3CH=CHCH=O 2-丁 烯 醛
CHO
第二节 醌 Quinone
一. 命名
O
O
1,4-苯 醌 对 苯 醌 (黄 色 )
O O
1,2-苯 醌 邻 苯 醌 (红 色 )
O CH3
H3C O
2,5-二 甲 基 -1,4-苯 醌
O
O O
O CH3
O
a萘 醌 1,4-萘 醌
b萘 醌 1,2-萘 醌
O
2-甲 基 -1,4-萘 醌
二 反应 苯醌的性质与a,b-不饱和酮相似
CH3CH=CHCOCH3
HCl(g)
CH3CH(Cl)CH2COCH3
Br2 CCl4
CH3CH(Br)CH(Br)COCH3
3. 迈克尔反应 Michael reaction
烯醇负离子与a,b-不饱和羰基化合物的确,4-加成。
产物的结构特点:1,5-二羰基化合物
用途:用于合成环状化合物,特别是稠环化合物。
练习:完成下列转变:
O KOH
+ CH2=CHCOCH3
O
O CH2CH2COCH3
O
O CH2CH2COCH3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
OH-
OH-
or
+
O
O
OO
O
O
4. 还原反应 Reduction reaction
( 4.1只 还原C=O 用LiAlH4 或 NaBH4 ( 4.2只还原C=C 用 H2/Pd-C
+ HCN
O
C6H5CH=CHCOC6H5
O
1)C6H5Li 2)H2O
1) Et2O
+ (CH3)2CuLi 2) H2O
(85%)
CN O
C6H5CH=CHC(OH)(C6H5)2 (75%)
O
(98%)
2. 亲电加成 electrophilic addition 反应速率比单烯烃及共轭二烯烃慢,为什么?
rt 30min
饱和酮
5.Diels-Alder反应
a,b不饱和醛酮是很好的亲二烯体
CHO
+
CHO
四.制备 主要由羟醛缩合反应制备
C6H5CHO + CH3COC6H5 OH- C6H5CH=CHCOC6H5
Ba(OH)2
2 CH3COCH3
O
HCHO + CH3COCH3 OH-
O
OH-
2CH3CHO
对苯醌二肟
三 制备
一般由芳香族化合物氧化制得
NH2 MnO2+H2SO4
O
如:
or K2Cr2O7+H2SO4
又如:
O
CH3 [O]
O CH3
O
第三节 羟基醛酮
Hydroxy aldehydes and ketones 如:a-羟基醛酮 HOCH2CHO 羟基乙醛; HOCH2COCH3 羟基丙酮
CHO
R-CH-OH a-羟基醛
C6H5COCH2OH + 3 C6H5NHNH2
N
H3C C
N
HC H N
C6H5
+
C6H5NH2
NHC6H5
CH=NNHC6H5
C=NNHC6H5 CH3
+ NH3
(3) HIO4氧化
CH3CH C CH3
O LiAlH4 H2O
Et2O
H OH
(97%)
O
H2/Pd-C
or 1)Li,NH3(l),-33℃
2) H3O+
O
(95%)
4.Et)CHO
O
R1
查耳酮类
R2
H2,Ni or Pt CH3(CH2)3CH(Et)CH2OH
Zn/HCOONH4/C2H5OH/H2O
1) RMgX
1,2-加 成 产 物 为 主 不 饱 和 醛 (1,2-加 成 产 物 为 主 )
2)H2O
不 饱 和 酮 甲 基 酮 (1,2-加 成 为 主 )
其 他 酮 (1,4-加 成 为 主 )
例:
KCN ,HOAc
C6H5CH=CHCOC6H5
EtOH
C6H5CH(CN)CH2COC6H5 (93-96%)
反应特点
亲核加成 亲电加成
1,2-加 成 和 1,4-加 成 ( 共 轭 加 成 )
二 反应(Reactions)
通式 C=C C=O + HNu 43 21
1,2-加 成
Nu
C=C CHOH
1,4-加成 [C-C=C-OH]
H
Nu
重排 C-C-C=O 羰基化合物
( 表 现 上 3,4-加 成 )
Nu
1. 亲核加成 Nucleophilic addition
HCN 1,4-加 成 产 物 为 主
NH
1,4-加 成 产 物 为 主
C=C-C=O
1) R2CuLi 2)H2O
1,4-加 成 产 物 为 主
1) RMgX,CuCl 2)H3O+
1,4-加 成 产 物 为 主
1) RLi 2) H2O
1. 还原 Reduction
苯醌和对苯二酚组成一个可逆的电化学氧化-还原体系
2. 亲核加成 Nucleoplilic addition
3. Diels-Alder反应
O
O
O
+
O
O
O
O
OH
+ 2H+ + 2e-
对 苯 二 酚 (氢 醌 )
O
O NH2OH
NOH
OH NH2OH
NOH
O
O
NOH
对苯醌一肟
第十一章
不饱和醛酮,取代醛酮
Unsaturated Aldelydes and KetonesSubstituted Aldehydes and Ketones UltravioletSpectra
本章提纲
第一节 α, β-不饱和醛酮 α, β -unsaturated aldehydes and ketones 第二节 醌 Quione 第三节 羟基醛酮
hydroxy aldehydes and ketones 第四节 酚醛和酚酮 henotic aldehydes and phenolic ketones
第一节 α,β-不饱和醛酮
a,β-unsaturated aldehydes and ketones
定义:碳碳双键位于α,β-碳原子间的不饱和醛酮
b羟基醛酮 CH3CH(OH)CH2CHO 3-羟基丁醛
g羟基醛酮 HO(CH2)3CHO 羟基醛酮 HO(CH2)4COCH3
一. 反应
1. 1-羟基酮的反应
(1) 银镜反应 (2)与苯肼作用生成脎(osazones)(成脎反应).
CH2OH
OH-
R-C=O
1-羟基酮
CHOH OH-
R-C-OH 烯二醇
