第六节_α_β-_不饱和醛、酮
第六节_α_β-_不饱和醛、酮.

Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
不饱和醛与酮

主讲人 钟芳锐 华中科技大学化学与化工学院
主讲内容
• 不饱和醛酮的分类与反应性 • α,β-不饱和醛酮的Michael 加成 • 醌类化合物
不饱和醛酮的分类
* 根据双键和羰基相对位置,醛酮可分为三类:
乙烯酮 ,-不饱和醛(酮 ) 非共轭烯醛(酮)
苯醌
* 乙烯酮羰基碳采取sp杂化,C=C=O呈线型结构,反应活性高; ,-不饱和醛(酮 )的C=C键与C=O处于共轭状态,热稳定性较高; * 非共轭烯醛(酮)分子内C=C键与C=O处于孤立状态,互相影响较小。 * 苯醌是一种特殊的共轭烯酮;
非共轭烯醛转化为 ,-不饱和醛
非共轭烯醛在特定条件下,发生重排反应,形成热力学稳定的共轭烯醛。
乙烯酮的反应
* 与带有活泼氢的化合物H2O、ROH、RCOOH、HX、NH3等加成形成羧酸衍生物; * 与Grignard试剂作用形成酮; * 与亚胺反应形成-内酰胺。
,-不饱和醛、酮
共轭醛酮的共振结构
与有机金属试剂共轭加成的选择性
* C2位阻很大,仅1,2-加成。
,-不饱和醛酮与烷基铜锂的共轭加成
* 有机锂试剂与卤化亚铜复合而成的有机铜锂试剂,一般仅发生1,4-加成。
* 有机铜锂试剂中铜的原子半径较大,烃基的亲核性较弱,被认为是仅发生 1,4-加成的主要影响因素。
Robinson增环(annulation)反应
醌类化合物的特征结构
对苯醌
邻苯醌
1,4-萘醌
蒽醌
* 醌是一类特殊的α,β-不饱和二酮,它们可以由芳香族化合物制备, 但醌环没有芳香族化合物的特性。
醌类化合物的1,2-加成反应
* 对苯醌一肟与对亚硝基 苯酚,已证明是互变异 构体。
α,β-不饱和醛、酮中羰基的选择性还原

α,β-不饱和醛、酮中羰基的选择性还原
王彩兰;王玉炉;王晓阳;李建平;王红
【期刊名称】《合成化学》
【年(卷),期】1998(006)004
【摘要】无
【总页数】7页(P358-364)
【作者】王彩兰;王玉炉;王晓阳;李建平;王红
【作者单位】无
【正文语种】中文
【相关文献】
1.2-(1,3-亚丙二硫)亚甲基-3-羰基丁酸作为硫醇替代试剂在缩硫醛/酮化反应中的应用 [J], 欧阳艳;于海丰;董德文;刘军;王芒;刘群
2.在羰基亲核加成反应活性中醛、酮的结构所起的作用 [J], 陈泽宇
3.NaBH4—BiCl3体系对甾体化合物中α,β—不饱和酮结构的选择性还原 [J], 史建栋;马成禹
4.关于有机化学中醛酮选择性还原教学的建议 [J], 王春艳;王建世;孙忠栋
5.α-羰基烯酮环二硫代缩醛化学(ⅩⅢ)──β,β-1,3-亚丙二硫基-α,β-不饱和酮在镁-甲醇中的还原反应 [J], 刘群;朱再明;胡玉兰;张殊佳
因版权原因,仅展示原文概要,查看原文内容请购买。
第十三章 α,β-不饱和醛酮
N-OH
+ H2N-OH
O O
H2N-OH
N-OH
对苯醌单肟
对苯醌双肟
(2)烯键的加成(卤素、卤化氢等亲电试剂)
O
O Cl
O
+ Cl2
O
Cl2
Cl O
Cl
Cl
Cl O
Cl
(3) 1,4-加成(,-不饱和羰基化合物,亲核加成 )
O
பைடு நூலகம்OH
OH
+ HCl
Cl H
O
Cl OH
O
2、还原反应(易)
第二节 一、醌的结构特点
醌
O
环状不饱和二酮,两个羰基和两个 或两个以上碳碳双键共轭。 但不是芳环类的环闭共轭体系,不 具有芳香性。具有烯烃和羰基化 合物的性质。 二、醌的分类 苯醌、萘醌、蒽醌 三、命名 p319
O O
O
邻苯醌
对苯醌
四、化学性质
1、加成
(1)羰基的加成(羰基试剂、格氏试剂等亲核试剂)
(3) UV 的检测与表示
①检测----分光光度计 ②表示
A
λ
max
图谱: A~λ , ε ~λ , T~λ , log ε ~λ
数据:
λ / nm
λ
CH3OH max
252nm (12300)
二. 常见有机化合物的UV光谱:
1. 饱和有机化合物
σ σ* n σ *
CH3Cl 172 (弱)
CH3OH 183 (150) CH3OCH3 185 (2520)
CH3NH2 215 (600)
2. 不饱和有机化合物
(1) 孤立 C=C , C≡ C, C≡ N
第十三章 不饱和醛酮及取代醛酮

O
例:合成
O
O
O
O
O
O
O
O
O
6. 还原反应
CH3CH CHCHO CH3CH CHCHO
1. LiAlH4 2. H2O
CH2
CH C CH3
CH3CH CHCH 2OH
CH3CH2CH2CHO
19
H2 , Ni 室温
CH3CH CHCHO
O
H2 , Ni 高温
CH3CH2CH2CH2OH
O
例:
O
C6H5CHO +
C
H
O CN CH C CH3
29
例: C6H5CHO + CH2
C6H5
O C
CH2CH2
O C CH3
CN -
例:C6H5CHO
+
CH2 CH C N
O C
C6H5
CH2CH2 C N
CN -
O
C6H5CHO + CH3CH C C OC(CH3)3
CH3
C6H5 O C O
β-碳具有亲电性,容易和亲核试剂发生共轭加成。
碱催化下β,γ-不饱和醛酮的异构化: 酸催化下β,γ-不饱和醛酮的异构化:
5
反应:
O H
CH3 CH CH C
2-丁烯醛 亲电加成:亲电试剂如卤素、次卤酸等,不发
生共轭加成,只是在碳碳双键上发生亲电加成。
1.
C
C
O1
2.
CH CH C 4 3 2
共轭加成 (1, 4-加成)
N(CH3)2
POCl 3
+
H
C N(CH3)2Cl H
有机波谱-习题-第二章:紫外

第二章紫外-可见光谱法一、填空1.紫外-可见光谱统称________。
这类光谱是由分子的________而产生的。
当以一定波长范围的连续光照射样品时,一定波长的光子被吸收,使透射光的强度发生变化,于是产生了以________组成的吸收光谱,以波长为横坐标,________或________为纵坐标即可得到被测化合物的吸收光谱。
2.紫外吸收光谱最大吸收值所对应的波长为________;曲线的谷所对应的波长称为________;峰旁边一个小的曲折称为________;在吸收波长最短一端,吸收相当大但不成峰形的部分为________。
整个吸收光的________、________和________是鉴定化合物的标志。
3.紫外-可见光谱研究的波长范围是________。
紫外-可见光分为三个区域:________的波长范围是10—190nm,________的波长范围是190—400nm,________的波长范围是400—800nm。
一般紫外光谱仪包括紫外光和可见光两部分。
在紫外光谱中,峰最高处的波长记为________。
4.在紫外光谱中,峰的强度遵守________,即A=lg I0/I=εcl。
理论上,该定律只适用于________,而实际上应用的入射光往往有一定的波长宽度,因此要求入射光的波长范围________。
该定律表明,在一定测试条件下,________与溶液________成正比。
5.A=εcl,符号c代表________,单位________,l代表________,单位是________,ε为________。
当c等于________,l等于________,在一定波长下测得的吸光度从数值上就等于________。
6.分子在电子基态和激发态都存在不同的振动能级,通常基态分子多处于________振动能级。
电子跃迁一定伴随能量较小的振动能级和转动能级的跃迁。
一般情况下,激发态键的强度比基态________,所以激发态的平衡核间距比基态的平衡核间距________。
第十二章醛酮不饱和-文档资料

2、共轭醛酮的特殊性质
1)特强的亲和试剂发生1,2-加成 亲核试剂进攻羰基,与饱和共轭醛酮类似。 典型试剂:烃基锂、炔化钠
H3C
O
H3C
Li
CH3
H3C
H3C
OH
CH3
H3C
O HC
CH3
C- Na+
H3C
OH
H3C
C
CH
勤读力耕,立己达人
思考:下列反应得到什么产物
O H3C Li
H3C O
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O
酸催化
H2C
CH3
H3C
O CH3
O
碱催化
H2C
CH3
H3C
O
CH3
勤读力耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O
H2C
CH3
H HO-
O-
H2C
CH3
H2C
O
CH-
CH3
H2C-
O CH3
H2O
H3C
O CH3
O
H3C
CH2 O-
H3C
CH3
O
H3C O
H3C
CH3 O-
H2O
H3C O
CH3 Li CH3 H3C
CH3
H3C
H3C O- H3C
SOCl 2 H3C H3C Cl
CH3
Li CH3 H3C
H3C
CH3
H3C
CH3 H3C
勤读力耕,立己达人
第二节 醌 quinone
醌是环状共轭二酮—芳香化合物的衍生物。
不饱和醛酮

2.β-羟基醛酮
易脱水而一般的醇在碱性溶液中是稳定的. 酸催化:通过烯醇脱水 碱催化:通过烯醇盐进行
3. γ-和δ -羟基醛酮
与环状半缩醛形成动态平衡, 既有羟基醛酮的性质,又有环状半缩醛的反应.
CH3CH(OH)CH2COCH3
H2SO4
OH-
CH3CH=CH-COCH3 (比一元醇快)
CH3CH=CHCOCH3
1) RMgX
1,2-加 成 产 物 为 主 不 饱 和 醛 (1,2-加 成 产 物 为 主 )
2)H2O
不 饱 和 酮 甲 基 酮 (1,2-加 成 为 主 )
其 他 酮 (1,4-加 成 为 主 )
例:
KCN ,HOAc
C6H5CH=CHCOC6H5
EtOH
C6H5CH(CN)CH2COC6H5 (93-96%)
反应特点
亲核加成 亲电加成
1,2-加 成 和 1,4-加 成 ( 共 轭 加 成 )
二 反应(Reactions)
通式 C=C C=O + HNu 43 21
1,2-加 成
Nu
C=C CHOH
1,4-加成 [C-C=C-OH]
H
Nu
重排 C-C-C=O 羰基化合物
( 表 现 上 3,4-加 成 )
练习:完成下列转变:
O KOH
+ CH2=CHCOCH3
O
O CH2CH2COCH3
O
O CH2CH2COCH3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
OH-
OH-
or
+
O
醛酮缩合机理

一、醛的缩合反应含有α-H的脂肪醛在碱的作用下形成它的烯醇型负离子,这个负离子有亲核性,它对另一分子的醛羰基进行亲核加成反应,结果生成了β-羟基醛。
这是醛的羟醛缩合反应(Alodlcondensation reaction)。
缩合产物受热后,脱除一分子水转变为α,β-不饱和醛。
当醛的分子增大时(>C6),反应就比较慢,需要较高的反应温度及增加所用碱浓度(5%-15%)。
例如:应当注意的是,必须是具有α-H的醛在稀碱溶液中才能进行这种羟醛缩合。
在碱性条件下羟醛缩合反应是按下面的机理进行的:如果反应的中间产物β-羟基醛中不存在α-H,则不发生进一步的脱水,就得不到α,β-不饱和醛。
如:对Perkin反应的机理,一般认为先是碱性催化剂(CH3CO2-或叔胺)夺去酸酐的α-H,生成一个酸酐负离子,后者和芳醛发生亲核加成,生成中间物β-羟基酸酐,然后再经脱水和水解生成α、β -不饱和酸:丙酸酐也可用于Perkin反应,个别的脂肪醛也会进行这种缩合反应。
五、曼尼希反应甲醛、氨(或伯、仲胺)的盐酸盐与甲基酮发生缩合生成β-酮胺(满尼赫碱Mannich Baes)盐酸盐;这是一种α-H的氨甲基化反应,称为Mannich反应。
Mannich反应一般是在水、乙醇等溶剂中于室温条件下进行的。
反应完成后,用碱中和可得到游离的-酮胺,它是有机合成的重要中间体。
例如它与KCN或NaCN水溶液加热可生成氰基化合物,后者经水解可制得-酮酸;而-酮胺的盐酸盐在受热时则发生分解生成α、β-不饱和酮。
例如:Mannich反应一般在酸性溶液中进行。
除醛、酮之外,其它的含有活泼α-H的化合物也可发生此类反应。
如酯、腈等。
六、关键词羟醛缩合、交叉缩合、α,β-不饱和醛、α,β-不饱和酮、柏琴反应、曼尼希反应、克莱森-施应特反应。
《醛酮不饱和》课件

香料合成
香料合成是另一个重要的应用领域。醛酮不饱和具有独特 的香味和香气,因此在香料合成中具有广泛的应用。它可 以作为香料合成的起始原料或中间体,通过一系列的化学 反应,制备出各丙二酸酯法是一种通过丙二酸酯得到不饱和键的方法。
详细描述
该方法通常使用丙二酸酯与醇或碱进行反应,通过消除反应引入不饱和键。该方法选择性较好,但需 要使用较昂贵的丙二酸酯作为原料。
03
醛酮不饱和的应用领域
合成高分子材料
高分子材料是现代工业和科技领域不可或缺的重要材料,而醛酮不饱和作为一类 重要的有机化合物,在合成高分子材料方面具有广泛的应用。它可以作为聚合反 应的单体,通过与其他单体进行共聚反应,制备出各种具有特殊性能的高分子材 料。
例如,利用醛酮不饱和可以合成出具有优异力学性能、耐高温性能、耐腐蚀性能 等的高分子材料,广泛应用于航空航天、汽车、电子、化工等领域。
药物合成
药物合成为醛酮不饱和提供了一个重要的应用领域。许多药 物分子中含有醛酮不饱和结构,这些结构对于药物的活性至 关重要。利用醛酮不饱和作为中间体或起始原料,可以合成 出各种具有治疗作用的药物。
循环利用
研究废弃物的循环利用技术,实现资源的 高效利用。
生物降解
研究生物降解技术,使废弃物能够自然降 解,减少对环境的污染。
谢谢您的聆听
THANKS
利用生物酶进行催化反应,实现温和条件 下的高效转化。
应用领域的拓展
药物合成
利用醛酮不饱和化合物的 特性,开发新药物或改进
现有药物。
功能性材料
开发具有特殊性能的醛酮 不饱和化合物,用于新材
合成α,β-不饱和缩酮(醛)的研究

合成α,β-不饱和缩酮(醛)的研究
沈巍巍;阳年发;杨利文;王攀登;李继超
【期刊名称】《化学试剂》
【年(卷),期】2007(29)5
【摘要】以对甲苯磺酸为催化剂,通过苄叉丙酮与-1,2-丙二醇反应合成了苄叉丙酮-1,2-丙二醇缩酮。
较系统的研究了反应溶剂、酮醇物质的量比、催化剂用量等诸因素对产品收率的影响,在n(酮)∶n(醇)=1∶3,催化剂用量为6.5 g/mol(酮),甲苯为带水剂的条件下反应一段时间,再额外加入催化量对甲苯磺酸与少量醇,继续反应,产品收率达到98%。
此条件对于其他的α,β-不饱和酮(醛)缩合反应亦适宜。
【总页数】3页(P305-306)
【关键词】α,β-不饱和酮(醛);缩醛;缩酮;对甲苯磺酸
【作者】沈巍巍;阳年发;杨利文;王攀登;李继超
【作者单位】湘潭大学化学学院
【正文语种】中文
【中图分类】O623.54
【相关文献】
1.FeCl3-漆酚树脂催化合成酯、缩醛和缩酮的研究 [J], 但悠梦;李佳凤;米远祝;段正超
2.生物质基甘油缩醛和缩酮的合成研究进展 [J], 肖泽; 常春; 白净; 陈俊英; 李攀; 韩秀丽
3.以四氢呋喃为醛基砌块合成(E)-α-羟乙基-α,β-不饱和醛 [J], 濮伟雯;史永森;刘建峰;柯德宏;吴孝兰;许胜
4.用于合成不饱和醛和/或不饱和羧酸的催化剂 [J],
5.不饱和醛和不饱和羧酸合成用催化剂、其制备方法和使用该催化剂的不饱和醛和不饱和羧酸的合成方法 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
有机化学课件--不饱和醛酮 共32页

C H 3 C H = C H C H = O
2-丁烯醛
O
C H 3 C H = C H C C H 3
3-戊烯-2-酮
O
O
C H 3C C H =C H C 6H 5
4-苯基-3-丁烯-2-酮
甲基-2-环己烯-1-酮
15.07.2019
课件
3
一 特性 体系稳定 C=C与 C=O 组成共轭体系
OH- CH3CH=CHCH=O
1,4-加成产物为主
1) RMgX,CuCl 2)H3O+
1,4-加成产物为主
1) RLi 2) H2O
1) RMgX
1,2-加成产物为主 不饱和醛(1,2-加成产物为主)
2)H2O
不饱和酮 甲基酮(1,2-加成为主)
其他酮(1,4-加成为主)
15.07.2019
课件
6
例:
KCN,HOAc
C6H5CH=CHCOC6H5
CN-
ArCHO
O-
Ar-C-H
CN
H2O
OH-
OH
Ar-C-H
CN
OH-
OH
Ar-C-
H2O
CN
ArCHOH-
H CN
OHOH OH-
Ar-C-C-Ar
H2O H CN
-CN-
OHO
Ar-C-C-Ar +CN+ Ar-C-C-Ar
H CN
H
15.07.2019
15.07.2019
课件
16
一. 反应
二. 1. 1-羟基酮的反应
(1) 银镜反应 (2)与苯肼作用生成脎(osazones)(成脎反应).
醛和酮

第十一章醛和酮课时:8课时教学目的要求:掌握醛酮与亲核试剂的加成反应及其历程,醛酮的氧化-还原反应,各类醛酮的鉴别,醛酮制法,α,β-不饱和醛酮的性质。
含羰基。
第一节醛、酮的分类,同分异构和命名一、分类烃基的类别:脂肪族醛、酮;芳香族醛、酮。
羰基的数目:一元醛、酮;二元醛、酮。
二、同分异构现象醛:碳链异构。
酮:碳链异构和羰基位置异构。
三、命名1 系统命名法选择含羰基的最长链。
编号从靠近羰基的一端开始。
CH3CHCHOCH3C6H5CHCHOCH3HC CCH2CH2CHCH2CHOCH32-甲丙醛2-苯丙醛3-甲基-6-庚炔醛CH3CO(CH2)3CH3COCH3COCH2CH32-己酮1-苯-1-乙酮1-环己基-1-丙酮碳原子的位置有时也用希腊字母表示:2酮的取代基命名法CH3CCH2CH3OCOCH3甲基乙基酮甲基苯基酮CHOOH CHOCHO3-羟基苯甲醛1,2-萘二甲醛111CHO2COOH CHOO4-甲酰苯基乙酸2,3-环氧苯甲醛COCH2CH2CH3CH2COCH31-( -萘基)-1-丁酮1-苯基-2-丙酮萘基丙基酮苄基甲基酮第二节醛、酮的结构、物理性质和光谱性质一、醛和酮的结构羰基碳原子sp2杂化。
氧原子上带部分负电荷,碳原子上带部分正电荷。
羰基是极化的,分子有偶极矩。
二、物理性质沸点比相应的烷烃和醚高(极化度大),低于相应的醇(不能形成分子间氢键)。
低级的醛、酮可溶于水(与水形成氢键),中级醛(九到十个碳)具果香味液体,用于香料工业,低级酮是液体,具有令人愉快的气味。
三、光谱性质红外光谱:碳氧双键的伸缩振动,醛在1730cm-1, 酮在1715cm-1, 形成共轭体系时,吸收的波数减小。
醛在2750cm-1处有醛氢与羰基碳之间的碳氢伸缩振动峰。
核磁共振谱:醛氢的化学位移为9-10, 与羰基相连的甲基或亚甲基的化学位移在2-2.5,紫外光谱:非共轭醛、酮在200 nm以上无强烈吸收,共轭的醛、酮则有强烈吸收。
醛酮的分类和命名

第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名1.醛、酮的系统命名以包含羰基的最长碳链为主链,看作母体。
从靠近羰基的一端开始,依次标明碳原子的位次。
在醛分子中,醛基总是处于第一位,命名时可不加以标明。
酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。
α是指官能团羰基旁第一个位置,β是指第二个位置…。
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
ⅲ当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
2. 酮还有另一种命名法根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
后面是母体如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
英文羰基做取代基时用“oxo”(氧代)表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
第二节醛、酮的物理性质和光谱性质一、物理性质除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。
低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。
低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。
碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
α,β-不饱和羰基

α,β-不饱和羰基α,β不饱和羰基在有机化学的广袤领域中,α,β不饱和羰基化合物宛如一颗璀璨的明珠,因其独特的结构和丰富的反应性而备受关注。
要理解α,β不饱和羰基,首先得从它的结构说起。
这类化合物的特征在于一个羰基(C=O)与一个碳碳双键(C=C)直接相连,形成了α,β不饱和的体系。
其中,与羰基相邻的碳原子被称为α碳,而与α碳相连的双键碳原子则被称为β碳。
这种特殊的结构赋予了α,β不饱和羰基化合物一些独特的性质。
在电子分布方面,由于羰基的强吸电子作用,使得π电子云发生极化,β碳上的电子密度相对较低,从而使其具有较高的反应活性。
α,β不饱和羰基化合物的反应类型丰富多样。
其中,亲核加成反应是其重要的一类反应。
亲核试剂可以进攻羰基碳或者β碳,这取决于反应条件和试剂的性质。
当亲核试剂的亲核性较强且反应条件较为温和时,通常优先发生 1,2-加成,即亲核试剂进攻羰基碳;而当亲核试剂的亲核性较弱或者反应条件较为剧烈时,往往发生 1,4-加成,亲核试剂进攻β碳。
例如,氢氰酸(HCN)与α,β不饱和羰基化合物反应。
在弱碱条件下,主要发生 1,2-加成,生成α氰醇;而在强碱性条件下,则以 1,4-加成为主,得到β氰醇。
除了亲核加成反应,α,β不饱和羰基化合物还能参与共轭加成反应。
共轭加成反应是指亲核试剂与共轭体系中的β碳发生加成。
这种反应在有机合成中具有重要的应用价值,可以构建各种复杂的有机分子。
在合成应用方面,α,β不饱和羰基化合物是构建许多天然产物和药物分子的关键中间体。
通过对其进行各种化学反应,可以引入不同的官能团,从而实现目标分子的合成。
比如,在药物研发中,许多具有生物活性的分子都含有α,β不饱和羰基结构。
通过对其进行化学修饰和改造,可以优化药物的活性、选择性和药代动力学性质。
此外,α,β不饱和羰基化合物在材料科学领域也有一定的应用。
由于其独特的电子结构和反应性,可以用于制备具有特定性能的高分子材料和功能性材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3-CHO + CH3-CH=CH-CHO
OH
-
- H2O /
CH3-CH=CH-CH=CH-CHO
插烯规律
插烯规律:在 H3C-CHO分子的 CH3与CHO
间插入 [CH=CH] n,成为 H3C [CH=CH] n CHO,
反应仍可在共轭体系的两端进行,而共轭体系相
连的两个基团仍保持 [CH=CH] n插入前的关系,
历 程:
+ δ+ H CH =CH-C-H CH2=CH-C-H 2 OH O
Oδ -
+ OH
OH + CH2-CH=C-H + Cl
CH2-CH=C-H Cl
CH2-CH2-C-H Cl
先1,4-加成,生成烯醇重排,相当于1,2-加成。
二. 亲核加成
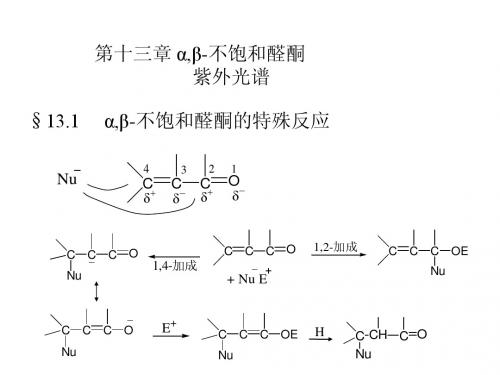
通常情况下,碳碳双键是不会与亲核试剂 加成的。但由于在α,β-不饱和醛、酮中,C=C 与C=O共轭,亲核试剂不仅能加到羰基上, 还能加到碳碳双键上。 以3-丁烯-2-酮与氰化氢的加成为例。
1,2加成 C C C O + Nu 1,4-加成
C C C O Nu C C C O Nu
H
C C C OH Nu C C C OH Nu
H
反应为1,2-加成还是1,4-加成决定于三个方面: 成,强的主要进行1,2-加成。
不稳定(互变) H C C C O Nu
(1)亲核试剂的强弱 弱的亲核试剂主要进行1,4-加
_ 稀OH -H2O
CH3CH=CH-CH=CHCHO
-H2O
CH3CH=CHCH=O +H-CH2CH=CHCHO
稀- OH
CH3CH=CHCH=CHCH=CHCHO
2 CH3-CH=CH-CHO
OH- H2O /
-
CH3-CH=CH-CH=CH-CH=CH-CHO CH2-CH=CH-CHO
OHCH3-CH=CH-CHO - H2O
(3)麦克尔(Michael)反应 活泼亚甲基化合物和 α ,β –不饱和化合物 在碱催化下起1,4-加成。
G C-H B- HB -CN -COG C-
- G = -NO2 G HB
C - + CH2=CH-C
O H OH G
OC -CH2-CH=C H O G C -CH2-CH2=C H
G
C -CH2-CH=C
1) RMgX
2)H2O
,-不饱和醛酮发生加成反应时的选择规律 *1 卤素、HOX不发生共轭加成,只在碳碳双键上 发生1,2-亲电加成。 *2 HX, H2SO4等质子酸以及H2O、ROH在酸催化 下与,-不饱和醛酮的加成为1,4-共轭加成。 *3 HCN、NH3及NH3的衍生物等与,-不饱和醛 酮的加成也以发生1,4-共轭加成为主。 *4 醛与RLi, RMgX反应时以1,2-亲核加成为主。 与R2CuLi反应,以1,4加成为主。 *5 酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R2CuLi,主要得1,4-加成产物, 使用RMgX,如有亚铜盐如CuX做催化剂,主要得 1,4-加成产物,如无亚铜盐做催化剂,发生1,2加 成还是1,4-加成,与反应物的空间结构有关,空阻 小的地方易发生反应。
,-不饱和醛酮的加成反应
一般发生1,4-共轭加成,得3,4-产物,H加在-C上。
OH CH2=CH–C–R p-共轭 +
X-
X OH CH2–CH=C–R (烯醇式)
- 1 O CH2=CH–C–R 2 4 3 + - + H–CN 1,4-加成 1,2-加成 CN O H+ CH2–CH–C–R p-共轭
C6H5 OMgBr
(1)
Ph
Ph
(3)
互变异构
COC6H5
H2O
C6H5 O-H
H
O C6H5
(4)
原料应该有一对构象异构体,例如: (1)和(2)。 所以产物应为一对光活异构体,例如: (3)和(4) 。
(2)
2 共轭不饱和醛酮的还原
情况一:只与C=O发生反应,不与C=C发生反应。
麦尔外因-彭杜尔夫还原 克莱门森还原 乌尔夫-凯惜纳-黄鸣龙还原 缩硫醇氢解
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OHNaO3S-
NaO3S-
-N=N黄色
-N(CH 3)2
-NH-N= 红色
=N+(CH 3)2
甲基橙
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
Br O Br Br O
Br2
Br O O
Br2
Br
(2)发生(Diels-Alder)反应 O
CH2
O
+
CH2
O
O + O O O
O
O
O
3、羰基与双键共同参与的反应——共轭加成
CH2=C O
CH2=C
O
CH2-C=O
CH2=C OH
二乙烯酮
CH3-C =O CH2-C=O Y O O
CH2-C=O
+ H-Y
CH2-C=O Y
H-OH
CH3-C- CH2-C- OH 丁酮酸 O O CH3-C- CH2-C- OR 丁酮酸酯
H-OR
O CH2=C O + AlCl3
OH
O
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
◎与NH2OH加成
+
H+
N
OH
互变异构
H
N
O
互变异构
NO
NH 2OH O 对苯醌单肟 O OH 对亚硝基苯酚
O
O
N-OH
N-OH
H2N-OH
O
O
H2N-OH
N-OH
(2)羰基的还原
O
H O
OH
OH
O
O
OH 氧化还原偶对
OH
O 氢醌 暗绿色
醌用作氧化脱氢剂
2、C=C双键的反应
(1)与溴加成 O
Br O
(2)反应温度 低温进行1,2-加成,高温进行1,4加成。
(3)立体效应 羰基所连的基团大或试剂体积较大时, 有利于1,4加成。
1.亲核试剂主要进攻空间位阻小的地方;
O (H5C2)2C CH CH Nu: CH2 O C C CH2CH3 CH3
所以,醛基比酮 基更容易被进攻。
2. 强碱性亲核试剂(如RMgX、LiAlH4)主要进 攻羰基(1,2-加成) 。
O
C-CH2-C=CH2
C-CH 2-C-CH 3
CH2-C=O
傅-克酰基化反应
(3)与格氏试剂反应 (羰基性质)
O CH2=C=O + RMgX H2O CH2=C-O H R CH3-C-R 甲基酮
(4)与卤素加成(碳碳双键性质)
CH2=C=O + X-X
CH 2-C=O X X
3、制 备
(1) 热 解 CH3COCH3 CH3COOH
X H O H–X CH2–CH–C–R CN H O CH2–CH–C–R
烯醇式重排
CN OH CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素
——羰基端基团、烯基端基团、试剂的体积
–R 1,4-(%)
H 0
Me 60
Et 71
i-Pr 100
t-Bu 100
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 O CH3–C–Cl 乙酰氯 O CH3–C–OOCCH3 乙酐 O CH3–C–OC2H5 乙酸乙酯 O CH3–C–NH2 乙酰胺 O CH3–C–R 甲基酮
第七节 醌类化合物
在醌型结构中存在-共轭体系,但不是闭 合的共轭体系,因此,醌没有芳香性,它是 一种特殊的不饱和二酮。一般情况下,邻苯 醌为红色,对苯醌为黄色。
即乙醛的CH3与CHO相互关系仍然存在,甲基上
的氢仍然活泼,称为“插烯规律”。
从结构上对比:
+ H C CH O H H + - + H C CH CH CH O H H
实际上,共轭效应沿链传递不减弱
5.Diels-Alder反应
,不饱和醛酮是很好的亲二烯体
+
CHO
CHO
四、乙烯酮(自学)
O
OH
O
CH2 CH-C-CH 3 + CN
- HCN
CH2 CH-C-CH 3 + CH2-CH 2-C-CH 3 CN CN
羰基上的亲 核加成产物 OH
CH2-CH C-CH 3 CN
O
CH2 CH-C-CH 3
HCN 1,4-加成
1,4-加成的历程, 碳碳双键上的加成产物 O CH2-CH 2-C-CH 3 烯醇式重排 CN
H O B-
O G C -CH2-CH2=C H
G
C-H + CH2=CH-C
H
O CH3 + CH2=CH-C O O BCH3 O O CH3 B
