不饱和醛酮选择性加氢汇编
不饱和醛酮选择性加氢

不饱和醛酮选择性加氢第一部分背景介绍不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。
目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。
但是由于C=C 键比C=O 键在加氢过程中在热力学中更加有利。
所以研发新型催化剂对不饱和醛 酮选择性加氢十分重要。
这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研 究提供新的基础。
第二部分文献综述、Sn 修饰Si02负载Pt 催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn双金属催化剂0HButyraldehyde方案1. 丁烯醛加氢的还原路径丁烯醛的氢化路径,如方案1。
在负载了毗族金属催化剂中,会得到丁醛而 不产生丁烯醇,第二种金属加入到毗族金属催化剂中,来阻止C=C 键的氢化[2,3-5] 特别的,Sn 修饰负载在Si02、氧化铝或活性炭上的毗族金属,大量的被研究[2,6-10]。
我们研究了 Sn 的加入使生成不饱和醇的选择性大大增加[11,.12]。
方案2. Sn-Pt/SiO 2双金属催化剂对于丁烯醛选择性加氢。
(a )理想反应(b )实际反应方案2为我们提出的由传统浸渍法制备的 Sn-Pt/SiO 2催化丁烯醛的反应机[1]才、-Crotonaldehyde7 0HCrot/laloohol1 -Butancl理。
Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。
对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO s)上。
然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。
由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。
然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。
为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。
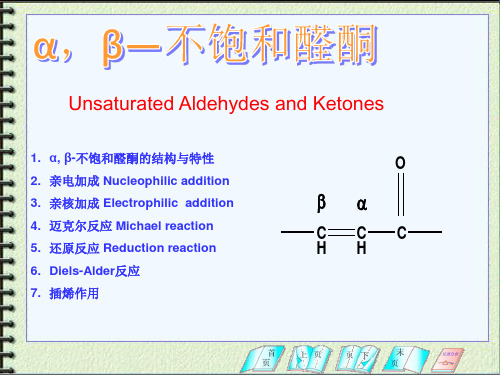
第六节_α_β-_不饱和醛、酮.

Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
αβ不饱和醛酮
+ CH2=CHCOCH3
O
O CH2CH2COCH3 O
O
KOH
CH2CH2COCH3 O
NH C6H6
O
分子内缩合
O
OH-
+ H2O
or
O
+
O
OH-
O
O
O
O
5.还原反应
Reduction reaction
(97%)
(1)只 还原C=O 用LiAlH4 或 NaBH4 H OH O H2O LiAlH4
HCN NH
1,4-加成产物为主 1,4-加成产物为主
C=C-C=O
1) R2CuLi 2)H2O
1,4-加成产物为主
1) RMgX,CuCl 1,4-加成产物为主 2)H3O+ 1) RLi 2) H2O
1,2-加成产物为主 不饱和醛(1,2-加成产物为主) 不饱和酮 甲基酮(1,2-加成为主) 其他酮(1,4-加成为主)
CH3C CH2 C CH CH CH C R 4.碱性催化剂:三乙胺,六氢吡啶,氢氧化钾,乙醇钠,氨基钠 5.该反应可逆,升温对你反应有利
O CH3 O
+CH2
O CH C CH3
KOH
O CH3
O
O
CH2 CH2
O
C CH3
KOH
O
6.反应机理: 碱夺取碳上的活泼氢,生成一个碳负离子,然后碳负离子与受体发 生1,4-共轭加成,形成加成物从溶剂中夺取一个质子形成烯醇,在互 变异构形成最终产物。 7.用途:用于合成环状化合物,通常用迈克尔反应和羟醛缩合一起合成环 状化合物
+
OH
O
Pt(111)面和Pt14团簇上肉桂醛吸附及选择性加氢机理研究

Pt(111)面和Pt14团簇上肉桂醛吸附及选择性加氢机理研究罗伟;薛继龙;孟跃;钱梦丹;方镭;夏盛杰;倪哲明【摘要】利用密度泛函理论研究了Pt(111)面及Pt14团簇对肉桂醛(CAL)的吸附作用和不完全加氢的反应机理.分析吸附能结果表明,肉桂醛分子以C=O与C=C键协同吸附在Pt(111)面上的六角密积(Hcp)位最稳定,以C=C键吸附在Pt14团簇上最稳定,且在Pt14团簇上的吸附作用较Pt(111)面更强.由过渡态搜索并计算得到的反应能垒及反应热可知,肉桂醛在Pt(111)面和Pt14团簇上均较容易对C=O键加氢得到肉桂醇(COL).其中,优先加氢O原子为最佳反应路径,即Pt无论是平板还是团簇对肉桂醛加氢均有较好的选择性.同时发现,肉桂醛分子在Pt(111)面的加氢反应能垒较Pt14团簇上更低,即Pt的催化活性及对肉桂醛加氢产物选择性与其结构密切相关,其中,Pt(111)面对生成肉桂醇更加有利.【期刊名称】《燃料化学学报》【年(卷),期】2018(046)007【总页数】8页(P818-825)【关键词】肉桂醛;吸附;加氢;铂;催化;密度泛函理论【作者】罗伟;薛继龙;孟跃;钱梦丹;方镭;夏盛杰;倪哲明【作者单位】浙江工业大学化学工程学院,浙江杭州 310014;浙江工业大学化学工程学院,浙江杭州 310014;湖州师范学院生命科学学院,浙江湖州 313000;浙江工业大学化学工程学院,浙江杭州 310014;浙江工业大学化学工程学院,浙江杭州310014;浙江工业大学化学工程学院,浙江杭州 310014;浙江工业大学化学工程学院,浙江杭州 310014【正文语种】中文【中图分类】O641肉桂醛(CAL)大量存在于肉桂等植物体中,是含有一个苯环的α,β-不饱和醛,其多种加氢产物都是重要的化工原料和中间体[1,2],具有巨大的研究价值和经济潜力。
肉桂醇(COL)是水仙香精、玫瑰香精等一系列花香香料的重要原料,也常用于心脑血管药物合成[3-5]。
单原子催化剂催化生物质衍生物选择性加氢的研究进展

单原子催化剂催化生物质衍生物选择性加氢的研究进展王璐琳;刘会贞;韩布兴
【期刊名称】《石油炼制与化工》
【年(卷),期】2024(55)1
【摘要】生物质是以碳源形式存在的可再生资源,其平台化合物及衍生物的升级利用可得到能源和精细化工产品。
多相催化剂在生物质资源的转化中起到重要作用,其中不乏纳米催化剂和单原子催化剂的参与。
由于木质纤维素的含氧量较高,不能直接作为工业应用原料,因此需要还原反应来降低其含氧量。
加氢反应是降低木质纤维素衍生分子中O C比、提高H C比的重要方法。
本研究将综合讨论单原子催化剂在呋喃类、α,β-不饱和醛酮和木质素类平台化合物选择性加氢中的应用。
【总页数】10页(P52-61)
【作者】王璐琳;刘会贞;韩布兴
【作者单位】北京分子科学国家实验室;中国科学院大学
【正文语种】中文
【中图分类】O64
【相关文献】
1.低温合成钯单原子负载的SAPO-31催化剂及其在选择性加氢中的应用
-53(Al)衍生的Rh单原子催化剂在间氯硝基苯选择性加氢制间氯苯胺反应中的应用
3.生物质基单原子催化剂制备与改性及其应用研究进展
4.镁磷物质的量比对NiW/MgAPO-5催化剂选择性催化四氢萘加氢裂化制BTEX性能的影响
因版权原因,仅展示原文概要,查看原文内容请购买。
原创——醛、酮化学反应归纳

原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
高中化学(新人教版)选择性必修三同步习题:醛 酮(同步习题)【含答案及解析】

第三节醛酮基础过关练题组一醛、酮的组成与结构1.(原创)下列物质属于酮的是( )A. B.C. D.2.(2020安徽合肥一六八中学高二下月考)下列关于醛的说法中正确的是( )A.醛的官能团是B.所有醛中都含醛基和烃基C.一元醛的通式为C n H2n OD.醛都能使溴水和酸性KMnO4溶液褪色题组二醛、酮的性质与应用3.(2020广东新会一中高二下期中)下列说法中不正确的是( )A.乙醛能发生银镜反应,表明乙醛具有氧化性B.能发生银镜反应的物质不一定是醛C.有些醇不能发生氧化反应生成对应的醛D.福尔马林是35%~40%的甲醛水溶液,可用于消毒和制作生物标本4.(2020黑龙江大庆实验中学高二下月考)下列关于常见的醛或酮的说法中正确的是( )A.常温下甲醛和乙醛都是有刺激性气味的无色液体B.丙酮是结构最简单的酮,可以发生银镜反应,也可以加氢还原C.丙酮难溶于水,但丙酮是常用的有机溶剂D.苯甲醛可由苯甲醇氧化得到5.(2019安徽铜陵一中高二下期中)不能由醛或酮加氢还原制得的醇是( )A.(CH3)2C(OH)CH2CH3B.CH3CH2CH(OH)CH3C.(CH3)3CCH2OHD.CH3CH2OH6.迄今为止科学家在星云中已发现180多种星际分子,近年来发现的星际分子乙醇醛分子模型如图所示。
有关乙醇醛说法错误的是( )A.有2种含氧官能团B.能发生银镜反应C.与乙醛互为同系物D.与乙酸互为同分异构体7.苯甲醛()在浓NaOH溶液中发生分子间的氧化还原反应,一分子苯甲醛被氧化,一分子苯甲醛被还原。
由此判断最终的反应产物是( )A.苯甲醇B.苯甲酸C.苯甲醇和苯甲酸D.苯甲醇和苯甲酸钠8.香料茉莉酮是一种人工合成的有机化合物,其结构简式为,下列关于茉莉酮的说法正确的是( )A.该有机物的化学式是C11H16OB.1mol该有机物与H2充分反应,消耗4mol H2C.该有机物属于不饱和酮类物质,能发生银镜反应D.该有机物能发生加成反应,但不能发生氧化反应9.(2020广东高二下期末)研究表明,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关。
新教材高中化学人教版选择性必修三 名师优编 第三章 第三节 醛 酮

第三章第三节醛酮测试题一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)1.下列各组物质中既不是同系物也不是同分异构体的是()A.甲醛、丁醛B.丙酮、丙醛C.乙醛、丙酮D.苯甲醛、对甲基苯甲醛2.某有机化合物的化学式为C5H10O,能发生银镜反应和加成反应。
若将它与H2加成,所得产物结构简式可能是()A.(CH3)3COH B.(CH3CH2)2CHOHC.CH3(CH2)3CH2OH D.CH3CH2C(CH3)2OH3.已知甲、乙、丙、丁四种有机化合物的转化关系如图。
其中甲、乙、丁均能发生银镜反应,则甲为()A.甲醇B.甲醛C.甲酸D.乙醛4.下列有关有机化合物的判断正确的是()A.乙醛和丙烯醛()不是同系物,它们分别与足量氢气发生加成反应后的产物也不是同系物B.对甲基苯甲醛()可使酸性高锰酸钾溶液褪色,说明它含有醛基C.1 mol HCHO发生银镜反应最多生成2 mol AgD.苯酚发生还原反应后的产物在核磁共振氢谱中应该有5组吸收峰5.A、B、C都是有机化合物,且有如下转化关系:A B C。
A的相对分子质量比B大2,C的相对分子质量比B大16,C能与氢氧化钠溶液反应,以下说法合理的是()A.A是乙炔,B是乙烯B.A是乙烯,B是乙烷C.A是乙醇,B是乙醛D.A是环己烷,B是苯6.是某有机化合物和氢气加成的产物,该有机化合物可能是() A.B.丙醛的同分异构体C.D.7.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是()A.B.C.CH3—CH CH—CHO D.8.一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又叫羰基的合成。
如由乙烯可制丙醛:CH2=CH2+CO+H2CH3CH2CHO,由丁烯进行醛化反应也可得到醛,在它的同分异构体中,属于醛的有()A.2种B.3种C.4种D.5种9.某有机物的分子式为C5H8O,能发生银镜反应,也能与Br2发生加成反应。
_不饱和醛_酮中C_C双键选择性加氢催化剂的研究进展

Pt、 Ni、 Rh、 Cu、 Ir 和 Co 等 过 渡 金属及其 化 合 物为 催 Pd 和 Ni 对 CC 双键加氢 具 有 很 高 的 化剂, 其 中, Rh 和 Ru 对 CO 和 CC 双键加氢的选择 选择性, Co 和 Pt 显示出 较 高 的 CO 双键加氢选 性不明显, 择性, 而 Os 和 Ir 被公认为是 对 CO 双键加氢选择 [8 ] 性最好的金属 组 分 。 Pd 金属 催化剂 常 用于 液 相 CC 双键的加氢反应, 且 其 对 CO 双键 显 示 出 较 低的催化 活 性, 成 为 α, β - 不饱和羰基化合物中 CC 双键选择性加氢的 首 选 催化剂。 这 不 仅 是实 验得出的结论, 也 可 从密 度 泛 函 数 理 论 的 计 算 进行 论证, 而且已在特定的金属中心优先吸附理论及 Delbecq F 等 的 理 论 研 究 中 得 到 证 实。 Liu [12 ] Ruixia 等 分别制备了 Pd、 Ru 和 Ni / 磷酸三甲苯酯 ( TPP) 三种单组 分催化剂, 应用于 超 临 界 CO2 中 柠
[ 2 ] 氢香茅醛能加强古龙水的柑橘香, 是重 要 的 香 料 。 CC 键的键 能 为 615 kJ · mol - 1 , 从热力学角 度 看,
Pd / TPP 催化剂 檬醛的选择性加氢 反 应, 结 果 表 明, Ru / TPP 催化剂上 几乎 不 产 上香茅醛 收 率 约 80% , 而 生成 70% 的 CO 双键加氢 产 物 香 叶 生香 茅 醛, 醇和橙花醇( 柠檬醛中 CC 和 CO 双键共轭体 系 CO 双键的加 的 CC 双键的加氢产物为 香 茅 醛, 而共轭 氢产物为香叶醇和 橙花 醇 两 种同 分 异构 体, 体 系 中 C C 和 C O 双 键 的 加 氢 产 物 均 为 香 茅 醇) 。而 TPP 负载的单组分催化剂 对柠檬 醛加氢 活
第十二章醛酮不饱和-文档资料

2、共轭醛酮的特殊性质
1)特强的亲和试剂发生1,2-加成 亲核试剂进攻羰基,与饱和共轭醛酮类似。 典型试剂:烃基锂、炔化钠
H3C
O
H3C
Li
CH3
H3C
H3C
OH
CH3
H3C
O HC
CH3
C- Na+
H3C
OH
H3C
C
CH
勤读力耕,立己达人
思考:下列反应得到什么产物
O H3C Li
H3C O
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O
酸催化
H2C
CH3
H3C
O CH3
O
碱催化
H2C
CH3
H3C
O
CH3
勤读力耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O
H2C
CH3
H HO-
O-
H2C
CH3
H2C
O
CH-
CH3
H2C-
O CH3
H2O
H3C
O CH3
O
H3C
CH2 O-
H3C
CH3
O
H3C O
H3C
CH3 O-
H2O
H3C O
CH3 Li CH3 H3C
CH3
H3C
H3C O- H3C
SOCl 2 H3C H3C Cl
CH3
Li CH3 H3C
H3C
CH3
H3C
CH3 H3C
勤读力耕,立己达人
第二节 醌 quinone
醌是环状共轭二酮—芳香化合物的衍生物。
第十二章 醛酮(不饱和)

4-nitrosophenol
勤力读耕,立己达人
3)1,4-加成反应
共轭酮与HCN、 HX、 MeOH/ZnCl2发生1,4-加成, 中间体重排取代二酚,一般反应式如下:
HO HX O O OH X HO X
O
O
X=卤素、CN、甲氧基(氯化锌催化)。
HO HCl O OH Cl HO Cl
-
H3C O H3C
CH3
H3C Mg Cl Ag
+
-
H3C Cl Mg O H3C
CH3 CH3
H5C2 O C2H5 CH3
+
H3O
+
H3C H3C CH3 O
勤力读耕,立己达人
合成化合物D
H3C CH3 O
H3C O H2O
CH3
KH
H3C O
-
CH2
H3C O H3C
CH3 O
-
H3C O H3C
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O H2C CH3
酸催化
H3C
O CH3
O H2C CH3
碱催化
H3C
O CH3
勤力读耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O H2C CH3 CH
-
O H2C CH3
H HO
-
O H2C
O CH3 H2C
-
CH3
*Fries重排
苯酚在=与酰氯发生反应时先生成酚酯:
O HO
+
Cl
R
ACl 3
R
O
第六节_α_β-_不饱和醛、酮解读

CH2=C=O 乙酰基化试剂
O CH3–C–OH 乙酸
O CH3–C–Cl 乙酰氯
O CH3–C–OOCCH3 乙酐
O CH3–C–OC2H5 乙酸乙酯
O CH3–C–NH2 乙酰胺
O CH3–C–R 甲基酮
第七节 醌类化合物
在醌型结构中存在-共轭体系,但不是闭 合的共轭体系,因此,醌没有芳香性,它是 一种特殊的不饱和二酮。一般情况下,邻苯 醌为红色,对苯醌为黄色。
OO C-CH2-C-CH3
(3)与格氏试剂反应 (羰基性质)
CH2=C=O + RMgX
H2O CH2=C-O H R
(4)与卤素加成(碳碳双键性质)
O CH3-C-R 甲基酮
CH2=C=O + X-X
CH 2-C=O
XX
3、制 备
(1) 热 解
CH3COCH3
700-850 0 C Fe
CH2=C=O + CH4
稀-OH
CH3CH=CHCH=O +H-CH2CH=CHCHO
-H2O
OH-
2 CH3-CH=CH-CHO - H2O /
CH3-CH=CH-CHO
OH- H2O
CH3CH=CHCH=CHCH=CHCHO
CH3-CH=CH-CH=CH-CH=CH-CHO -CH2-CH=CH-CHO
OHCH3-CHO + CH3-CH=CH-CHO - H2O /
产物。 1 O-
OH
OH
2
+
3
-
+ H—CN
4
+
O
CN
CN
O
OH
◎与HCl加成
α、β-不饱和醛酮 羰基还原成亚甲基双键不含原

α、β-不饱和醛酮的羰基还原成亚甲基双键不含原是有机化学中的一种重要反应。
本文将从该反应的基本原理、反应机理、影响因素等方面进行介绍和分析。
一、基本原理α、β-不饱和醛酮的羰基还原成亚甲基双键不含原是一种亚甲基化反应,通常通过氢化试剂进行。
在该反应中,羰基醛酮分子中的CC双键被加成,生成羟基化合物。
一般情况下,这种反应是选择性还原羰基化合物中较弱的双键,而不影响较强的双键。
二、反应机理α、β-不饱和醛酮的羰基还原成亚甲基双键不含原的反应机理主要有三种方式:催化氢化、硼氢化和金属锂还原。
其中,催化氢化是最常见的反应方式,通常使用钯、铑、铂等过渡金属催化剂。
硼氢化方式则是通过硼氢化试剂将CC双键加成成为几何异构体,最后得到相应的醇。
金属锂还原则是利用金属锂将羰基化合物中的羰基还原成亚甲基双键。
三、影响因素α、β-不饱和醛酮的羰基还原成亚甲基双键不含原的反应受到多种因素的影响,包括反应条件、催化剂种类、底物结构等。
一般来说,合适的温度、压力和溶剂选择对于反应的进行起到重要作用。
而催化剂的选择则会影响反应的速率和产物的选择性,不同的底物结构也会对反应的进行产生一定的影响。
四、应用α、β-不饱和醛酮的羰基还原成亚甲基双键不含原反应在有机合成中应用广泛,特别是在制备医药、香料、农药等方面。
通过该反应,可以有效地合成具有特定生物活性的化合物,为医药、农药等领域的研究与开发提供了重要的化学手段。
α、β-不饱和醛酮的羰基还原成亚甲基双键不含原反应是一种重要的有机合成反应,具有广泛的应用前景。
对于该反应的基本原理、反应机理和影响因素的深入了解,将有助于提高反应的效率和选择性,进一步推动有机合成领域的发展和应用。
α、β-不饱和醛酮的羰基还原成亚甲基双键不含原反应在许多领域都有重要的应用。
其中,医药领域是该反应应用最为广泛的领域之一。
由于α、β-不饱和醛酮的羰基还原为亚甲基双键反应可以合成具有生物活性的化合物,因此在药物研发和合成中具有重要的地位。
有机化学中的加氢还原反应

LiAlH4
R
C H
C H
C H
R'
O R C H C H C R'
OH
OH R' + R H2 C H2 C C H R'
NaBH4
R
C H
C H
C H
O R C H C H C R'
O
H 2/ Pd-C
R
H2 C
H2 C
C OH
R'
H2/ Pd-C
H2 C H2 C
H2 催化剂
H C C H
C
C
这种加氢方式主要得到如上图所示的顺式产物(当然也存在少量反式产物) ,不同催化剂, 溶剂还有压力对产物构型有很大影响,一般我们常用的为 PtO2 在 C2 H5 OH 溶剂中,主要得 到顺式产物。 1.2 炔烃的加氢还原反应 和烯烃类似,炔烃也可以被还原成烷烃:
H2 催化剂
有机化学中的加氢还原反应
李博阳子(200231040004) 2002 级化学基地班,化学与分子科学学院,武汉大学,430072 摘要:在学习有机化学的过程中,我们经常会遇到将不饱和化合物(包括-C=C-,-C=O,-C ≡N 等) 加氢还原为饱和化合物的情况。 本文就这一部分对基本的有机化学反应进行小结并 就常用的一些还原试剂进行比较。 关键词: 有机化学,加氢还原 在学习有机化学的过程中,我们经常会遇到将双键(包括-C=C-,-C=O,-C≡N 等)加氢还 原为饱和化合物的情况。这一类反应牵涉到的物质种类繁多,反应的机理和条件,反应得到 的产物和各种产物的构型也比较复杂。 本文就根据这一情况对基本的加氢还原反应进行小结 并就常用的一些还原试剂进行比较。
α,β—不饱和醛酮的反应

α,β—不饱和醛酮的反应
不饱和醛酮是一类含有碳碳双键和醛基或酮基的有机化合物。
它们可以参与多种反应,下面列举了其中一些常见的反应。
1. 加成反应:不饱和醛酮可以与亲核试剂发生加成反应。
例如,它们可以与碱性溶液中的亲核试剂如水、胺或醇反应,生成相应的加成产物。
2. Michael加成:不饱和醛酮可以参与Michael加成反应,与
含有可负电荷的亲核试剂(如醇、胺、硫醇等)反应,形成
1,4-加成产物。
3. 氧化反应:不饱和醛酮可以被氧化剂如氧气、过氧化氢等氧化,形成相应的醛酸或酮酸。
4. 还原反应:不饱和醛酮可以通过还原反应还原为相应的醇。
还原剂包括金属铝、钠、锂等还原剂,还有氢气与催化剂(如铂或钯)反应。
5. 缩合反应:不饱和醛酮可以与胺反应形成亲缘结构的胺缩合产物。
6. 羟基化反应:不饱和醛酮可以与水或醇反应,羰基碳上的氢可以被羟基取代。
需要注意的是,不同的不饱和醛酮结构对应的反应也会有所不
同。
因此,具体的反应条件和产物取决于具体的不饱和醛酮结构和试剂条件。
吴英(1972.4~),电子信息工程学院教师、自动控制教研室主任,概要(精选多篇)

吴英(1972.4~),电子信息工程学院教师、自动控制教研室主任,概要(精选多篇)第一篇:吴英(1972.4~ ),电子信息工程学院教师、自动控制教研室主任,概要吴英(1972.4~),电子信息工程学院教师、自动控制教研室主任,2002年于重庆大学光电工程学院获仪器科学与技术学科工学博士学位、清华大学博士后,教授,日本东北大学访问学者。
中国仪器仪表学会微纳器件与系统分会理事、中国仪器仪表学会高级会员、重庆科技学院学报编委。
在教学方面,主要负责《自动化概论》、《专业英语》、《新型传感器技术》等课程的教学,曾指导学生获全国大学生电子竞赛重庆市二等奖,入选重庆市优秀中青年骨干教师资助计划。
在科研方面,承担中国博士后基金1项、承担重庆市科技攻关项目1项、承担重庆市科委自然基金项目2项、承担清华横向项目1项(“973”子项目)、承担四川石油管理局横向项目1项、西南油气田分公司重庆气矿横向项目1项、参与了国防预研项目1项、参与国家863国际合作重点项目1项、参与国家自然科学基金3项等。
在国内外学术刊物和国际学术会议发表论文30余篇,其中被SCI、EI、ISTP 三大检索收录论文20余篇。
目前感兴趣的研究方向有:MEMS技术、微纳器件与系统、检测技术。
联系方式:*********************.cn彭军(1970.7~),电子信息工程学院教师,2003年于重庆大学获计算机软件与理论学科工学博士学位,教授。
曾任电子信息工程学院副院长,香港城市大学和日本筑波大学密码学与信息安全实验室访问学者,现正在美国加州州立大学计算机科学系作访问学者。
IEEE会员,IEEE Trans.CAS-II, IEEE Trans.SMC-B, Journal of South China University of Technology(Natural Science Edition)等国际学术期刊特约审稿人,曾任SEA’08(USA), SEKE’08(USA), ICCIT’08(Korea), WCICA’08(China)等国际学术会议的国际程序委员会委员。
13不饱和醛酮及取代醛酮

13--不饱和醛酮及取代醛酮§1.α,β-不饱和醛酮不饱和醛酮分子中,C=C 位于α-和β-碳原子间的称谓α,β-不饱和醛酮;位于β-和γ-碳原子间的,则称为β,γ-不饱和醛酮,由于前者和羰基组成共轭体系,所以比后者更稳定。
例如:H 2C CHCH 2CH OH 3CHC CHCH O△H =-25kJ/mol 放热 反 应在酸或碱催化下,3-丁烯醛容易转变成2-丁烯醛: ①在碱催化下:H 2C CHCH 2CH O H 3CHC CHCH O+OH H 2O +CH 2=CHCHCH=OCH 2=CHCH=CH OCH 2CH=CHCH=O②在酸催化下:H 2C CHCH 2CH O2C CH CH 2CH OHH 2C C HCH 2HC OHH +H 2C C H C H C H OH3CH C H CHOHCH 3CH=CHCH OHH 3CHC CH CH=OH- H +CH 3CH=CHCH=O1.α,β-不饱和醛酮 的反应 (1) 亲核加成:①与HCN 加成α,β不饱和酮与HCN 反应,主要生成1,4加成产物:α,β不饱和醛与HCN反应,主要生成1,2加成产物。
②与格氏试剂加成羰基上的取代基大小对1,2 和 1,4 加成有一定影响。
下列反应中的数据也说明了羰基上取代基大小对1,2和1,4 加成的影响:C6H5HC CHCOR(1)C H MgBr3C6H5HC CH COHRC2H5+C6H5CHCH2COR2H5 1,2-加成产物1,4-加成产物R=H CH3 C2H5 CH(CH3)2 C(CH3)3 C6H5 1,4-加成产物% 0 60 71 100 100 99③与烃基锂加成主要发生在1,2加成:④与二烃基酮锂加成以1,4 加成为主H OO(2)、亲电加成αβ不饱和醛酮与亲电试剂,一般都发生1,4加成OHBr(g)OBr (3)还原①使羰基还原②使双键还原③使羰基,双键同时被还原(催化加氢)H 3CH 2CH 2CHC CCHOCH 2CH 3H 2CH 3CH 2CH 2CH 2CHCH 2OH2CH 3(4)氧化αβ不饱和醛在温和条件下,可氧化为αβ不饱和羧酸(5)狄尔斯-阿尔德反应(Diels-Alder )反应2. α,β-不饱和醛酮的制备 有醛酮的缩合反应制备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不饱和醛酮选择性加氢第一部分背景介绍不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。
目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。
但是由于C=C键比C=O键在加氢过程中在热力学中更加有利。
所以研发新型催化剂对不饱和醛酮选择性加氢十分重要。
这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研究提供新的基础。
第二部分文献综述一、Sn修饰SiO2负载Pt催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn双金属催化剂[1]方案1. 丁烯醛加氢的还原路径丁烯醛的氢化路径,如方案1。
在负载了Ⅷ族金属催化剂中,会得到丁醛而不产生丁烯醇,第二种金属加入到Ⅷ族金属催化剂中,来阻止C=C键的氢化[2,3-5]。
特别的,Sn修饰负载在SiO2、氧化铝或活性炭上的Ⅷ族金属,大量的被研究[2,6-10]。
我们研究了Sn的加入使生成不饱和醇的选择性大大增加[11,.12]。
方案2. Sn-Pt/SiO2双金属催化剂对于丁烯醛选择性加氢。
(a)理想反应(b)实际反应方案2为我们提出的由传统浸渍法制备的Sn-Pt/SiO2催化丁烯醛的反应机理。
Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。
对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO2)上。
然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。
由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。
然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。
为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。
一个不饱和醛的是C=C键不直接与Pt表面接触,来抑制C=C氢化。
另一个是H分子在Pt表面上被活化。
有两个策略来避免Pt区域和不饱和醛的直接接触。
一个是形成足够均匀的SnPt合金。
正如之前提到的,金属Sn形成SnPt 可以抑制C=C键和Pt的相互作用。
因此,为了制备足够均匀的SnPt合金,C=C 键的氢化被抑制。
另一个是通过SnO2层来避免Pt和C=C键的相互作用,活化C=O基团的SnO x存在在Pt金属附近,尽管SnO x通过SiO2层与Pt完全分离。
根据前面的方案,我们尝试制备SiO2包裹在SnPt内部的纳米粒子[14]。
这种纳米粒子(摩尔比Sn/Pt=1.0)用多元醇工艺来制备。
在这种方法,形成均一的SnPt合金纳米粒子。
这些催化剂具有高选择性(66.7%,转化率为41.1%),由于SnPt合金中心和反应物方向的控制的协同效应。
方案3. Sn/SP催化丁烯醛加氢对于后者策略,这种催化剂是Pt纳米粒子覆盖到多孔的SiO2层,Sn在SiO2层的外表面。
目前,包裹在SiO2壳内部的金属或金属氧化物纳米粒子,在很多领域进行了研究[15-23]。
很多研究报道了Ni[16,17],Pt[18,19],FePt[20]和Rh[21-23]纳米粒子包裹到介孔SiO2壳中。
报道了SP催化剂通过金属醇盐在反相胶束溶液中水解作用来合成,SiO2层是微孔和介孔。
把Sn加入到SP催化剂中,控制孔的尺寸使H2可以进入Pt孔,然而不饱和醛不能进入Pt孔,我们提出了新的概念如方案3。
由于不饱和醛不能进入Pt纳米粒子孔,C=C键的氢化被抑制,在SiO2外表面Sn位点的C=O键被活化。
由中心Pt粒子活化的溢流氢通过Sn的吸附攻击C=O键形成不饱和醇。
目前,SiO2负载Pt催化剂用微乳液制备,SP催化剂用浸渍法和Sn制备Sn 修饰SiO2负载Pt(Sn/SP)催化剂。
为了证实Pt和Sn的分离,SP和Sn/SP催化剂的形态和物理性能通过TEM,EXAFS,H2和CO的化学吸附。
Sn/SP的氢化丁烯醛的性能与传统的催化剂作对比。
除此之外,我们提出了新的概念在Sn/SP 催化剂上选择性加氢。
2.实验2.1.催化剂的制备2.1.1 SiO2负载Pt(SP)SiO2负载Pt纳米粒子根据文献用油包水微乳液制备[19]。
为了形成微乳液,十六烷基聚乙二醇(15),一种非离子型表面活性剂,环己烷作为溶剂。
表面活性剂在溶剂中的浓度是0.5mol/L。
H2PtCl6的水溶液在323K注射入溶液中。
为了稳定Pt纳米粒子,包含CTABr和1-己醇的溶液加入到微乳液中,CTABr在1-己醇中的浓度是0.3mol/L。
TEOS(0.86mol/L),作为SiO2的来源加入到微乳液中,然后加入稀释的氨水溶液(28%)。
TEOS的水解反应在323K下进行1h。
为了终止水解作用,通过加入2-丙醇来破坏SiO2覆盖Pt纳米粒子溶液的胶束结构。
溶液离心来与沉淀分离,然后得到的沉淀用2-丙醇完全洗涤,在353K下过夜干燥,在623-823K的空气流中煅烧2h来移除表面活性剂。
在空气中煅烧后,样品浸入王水溶液24h来移除未覆盖在SiO2上的Pt纳米粒子。
最后,样品在393K 下干燥过夜,在相同的温度下煅烧2h,在573K的H2流下还原2h。
通过XRF 分析,Pt的负载量约4%。
2.1.2 Sn修饰SiO2负载Pt(Sn/SP)Sn修饰SiO2负载Pt催化剂通过浸渍法SP和SnCl2•2H2O的乙醇溶液来制备,用王水处理并干燥。
Sn/Pt的摩尔比一致。
浸渍后,样品在393K下干燥过夜并在相同的温度下在空气流中煅烧2h,来除去表面活性剂。
最后,在573-773K的H2气流下还原2h得到样品。
2.1.3 负载型Pt或Sn单金属催化剂这里使用的SiO2载体在制备催化剂之前在773K空气下煅烧5h。
Pt/SiO2和Sn/SiO2通过将SiO2载体和H2PtCl6的水溶液或SnCl2•2H2O(15mL)的乙醇溶液来制备。
Pt和Sn在载体上的负载量是4wt%和2.5-5.1wt%。
然后,样品在393K 下干燥过夜,在823K的空气流中煅烧2h。
然后,Pt/SiO2在573K的H2下还原2h。
在Sn/SiO2情况下,为了XRD测试,样品在573-773K下还原2h。
2.1.4 负载Sn/Pt双金属催化剂负载Sn/Pt双金属催化剂继续用浸渍法来制备。
煅烧后的Pt/SiO2,在SnCl2•2H2O的乙醇溶液中浸渍,393K下干燥过夜,在823K的空气中煅烧2h,573K的H2下还原2h。
Sn/Pt的摩尔比为1.0-1.5。
3. 结果与讨论3.1 SP和Sn/SP催化剂的形态和物理性能图1. (a)SP (b)Sn/SP催化剂XRD图。
823K空气焙烧并且573K氢气还原图1为SP和Sn/SP催化剂的XRD图,823K空气下煅烧、573K氢气下还原。
在两个催化剂中,观察到2θ=39°和47°有明显的衍射线,分别表示Pt(111)和(200)的衍射峰[24]。
证实了SP和Sn/SP催化剂上的Pt的存在。
对于Sn/SP 催化剂,出现了27°、34°和52°的2θ峰,是SnO2的存在[25]。
图2. (a)SP和(b)Sn/SP催化剂TEM图。
823K空气焙烧并且573K氢气还原图2为SP和Sn/SP的催化剂的TEM图,823K空气下煅烧、573K氢气下还原。
在SP中(图2a),发现Pt粒子负载在球形SiO2粒子的中心,Pt和SiO2粒子的尺寸均一。
Pt在SP催化剂的负载量通过XRF测试为3.9wt%。
Pt粒子和整个SiO2负载Pt的尺寸约为5nm和50nm。
SiO2层厚度为20-25nm。
在Sn/SP 中(图2b),Sn氧化物粒子继续通过浸渍出现在SiO2的外表面。
此外,在Sn/SP 中,没有观察到SP催化剂的核壳结构的坍塌。
表明了核壳结构在Sn的浸渍过程中稳定存在。
图3. k3-加权Sn K-吸收边EXAFS傅里叶变换图。
(a)SnO2,(b)Sn/SiO2,(c)Sn/SP,(d)Sn/Pt/SiO2(Sn/Pt=1.5)EXAFS数据如图3。
SnO2作为参考,1.6Å的峰是氧原子(Sn-O)配位层位于距离Sn2.06 Å。
2.9和3.5Å的峰分别是位于距离3.18Å和3.72Å的第一和第二近的Sn的贡献[26,27]。
对于Sn/Pt/SiO2催化剂,图3d中观察到2.5Å的峰。
这在SnO2和Sn/SiO2中未观察到。
此外,由于次最近Sn(Sn-O-Sn)的贡献3.5Å的峰没有在Sn/Pt/SiO2(Sn/Pt=1.5)中观察到。
因此,2.5Å的峰是与Pt配位的Sn原子。
在Sn-Pt双金属催化剂中,例如,Sn/Pt/SiO2通过继续浸渍法制备,Sn前躯体可以容易的吸附在Pt表面,并发生Sn和Pt的相互作用,形成SnPt合金[28,29]。
此外,Sn-Pt距离为2.72Å符合文献的报道(2.5-2.8Å)[30,31]。
因此,Sn-Pt这个峰存在与SnPt合金中。
Sn/SP在823K煅烧和在573K氢气还原,显示了与SnO2和Sn/SiO2相同的结构函数,如图3c。
在这种情况下,没有观察到Sn-Pt在2.5Å处的峰,表明Sn 和Pt没有相互作用。
这一结果表明了Sn和Pt在一个催化剂粒子上达到完全分离。
表1. Sn K-吸收边EXAFS振荡曲线分析数据为了评价Sn在每个样品的结构参数,进行了EXAFS振荡拟合曲线,具体参数如表1。
在Sn/SiO2和Sn/SP中,Sn-O和Sn-Sn的配位数和原子间距离与标准样品SnO2基本一致。
结果也表明了Sn元素作为SnO2存在于Sn/SiO2和Sn/SP 催化剂中。
对于Sn/Pt/SiO2催化剂,配位数比SnO2小。
这一结果表明一部分Sn 与Pt之间无相互作用,它们在Sn/Pt/SiO2中形成SnO2小颗粒。
图4. H2和CO在SP和Sn/SP的化学吸附能力H2和CO在SP和Sn/SP的化学吸附能力如图4。
H2和CO的不可逆吸附可以在所有情况下观察到。
在这些催化剂中,H2和CO的化学吸附只发生在Pt上,这一结果证明了H2和CO通过带孔的SiO2层到达Pt纳米粒子。
在SP催化剂中,H2化学吸附的数量在任何煅烧温度下均保持一致。
另一方面,CO的化学吸附具有不同的倾向。
CO化学吸附的数量随着煅烧温度直到823K 增加而减小,CO在823K几乎不在SP吸附。
这可能是因为CO与Pt中心的相互作用通过SiO2层来阻止。
这些结果表明了,由于不饱和醛比CO分子大很多,SiO2层阻止不饱和醛与Pt的相互作用。
823K时的H2和CO对于SP和Sn/SP吸附作用几乎没有观察到不同。
在Sn-Rh 和Sn-Pt[32,33]双金属催化剂中,相对于CO,H2不可逆的化学吸附量随着Sn负载量的增加而大大减少。
