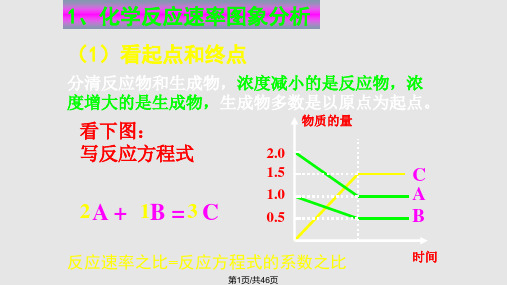
化学平衡图像 PPT
合集下载
高三一轮复习-化学平衡ppt课件.ppt

行到t1时刻达到平衡状态的是
bd
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
判断:
(1)当条件改变时,平衡一定会发生移动
(2)当速率发生变化时,平衡一定发生移动
√ (3)当平衡发生移动时,速率一定发生变化
(4)当平衡正向移动时,反应物的转化率一定 增大
(二)化学平衡的移动: 病原体侵入机体,消弱机体防御机能,破坏机体内环境的相对稳定性,且在一定部位生长繁殖,引起不同程度的病理生理过程
增大N2或H2的浓度
升高温度
减小压强
使用催化剂
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 பைடு நூலகம்长繁 殖,引 起不同 程度的 病理生 理过程
2.2HI(g) H2(g)+I2(g),平衡后再充入HI, HI转化率_不__变_
3.A(s)+ B(g)
C(g)+D(g)平衡后再充入B,
B的转化率__减__小
例1:向密闭容器中加入NO2,一段时间后形成平 病原体侵入机体,消弱机体防御机能,破坏机体内环境的相对稳定性,且在一定部位生长繁殖,引起不同程度的病理生理过程
衡2NO2
N2O4; △H<0.
(1)恒温恒容充入少量Ne,气体颜色_不__变__
(2)恒温恒压充入少量Ne ,气体颜色先__变__浅__后__变_深_
(3) 恒温恒压充入少量NO2,在新的平衡状态混合 气体的颜色_不__变_,NO2的平衡转化率_不_变__ , NO2的体积分数__不__变___。 (4)恒温恒容再充入少量NO2,新的平衡状态混合气 体的颜色_加_深__,NO2的平衡转化率_增__大_ NO2的体积分数___减__小_____.
人教版高中化学选修4第二章第三节 化学平衡 课件(共16张PPT)

反应平衡时 ——v(正)=v(逆),c(反应物)、c(生成物)均 _不__再__改__变____,但不一定相等或等于化学 计量数之比
—以上过程中v-t图像表示如下:
2、化学平衡状态
在一定条件下的可逆反应里,当正、逆 两个方向的反应速率相__等__时,反应体系 中所有参加反应的物质的质量或浓度保 持_恒_定__的状态。
4、化学平衡状态的判定标志
化学反应mA(g)+nB(g) pC(g)+qD(g)平衡状态的判定:
1)、正逆反应速率相等 ①在单位时间内消耗了m mol A,同时也生成了 m mol A,即v正=v逆 ②在单位时间内消耗了n mol B的同时也消耗了 p mol C,即v正=v逆 2)、温度 任何化学反应都伴随着能量变化,当体系温度 一定时(其他不变) 3)、颜色
①当m+n≠p+q时,Mr一定 ②当m+n=p+q时,Mr一定
一定平衡 不一定平衡
7、一定条件下,将NO2与SO2以体积比1∶2置于 密闭容器中发生反应:NO2(g)+SO2(g)——SO3(g) +NO(g) ΔH=-41.8 kJ/mol, 下列能说明反应达到平衡状态的是( ) A.体系压强保持不变 B.混合气体颜色保持不变 C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
• 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观 察是思考和识记之母。”2021年11月9日星期二3时48分48秒15:48:489 November 2021
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午3时48 分48秒下午3时48分15:48:4821.11.9
化学平衡图像PPT课件
(D)
D%
1 增大 B 的浓度
2 升高反应温度 3 缩小反应容器的体积 4 加入催化剂
a
b
时间 t
A. 1 2 B. 1 3
C. 2 3 D. 3 4
第31页/共46页
五.基本题型
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g)
的图象是( B )
C%
700oC v V正
v
Z%
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
b
a
0
t
第17页/共46页
反应X(g)+Y(g) 2Z(g); △H<0,在 一定条件下,反应物Y的转化率与反 应时间(t)的关系如右下图所示。若 使曲线a变为曲线b可采取的措施是 A 加催化剂 B 降低温度 C 增大压强 D 增大Y的浓度
第18页/共46页
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
第37页/共46页
3 .在容积固定为2L的密闭容器中充入X、Y各2mol,发生反应:
X( g) + 2Y(g)
2Z(g)
达到平衡时,以Y的浓度改变表示的关系如下图所示:
回答下列问题:
(1)用S表示面积,如 Obd 的面积 意可义表是示:为表_S_(示_O_bd反_),_应__则正__S向_(a_bd进_O_)行_表__时示__减的__少_
___的__Y__的__物__质__的__量__浓__度________。
v(Y)
a V(正) b
(2)平衡时 Y 的物质的量浓度可
表示为:__1_-__S__( a_O__b_) __mol/L。
新人教版选择性必修1第2章第2节化学平衡第4课时课件(25张)

课堂评价
1.判断正误(正确的打“√”,错误的打“×”)。
在密闭容器中,反应2X(g)+Y2(g) ⇌2XY(g) ΔH<0达到甲平衡状态。在仅改变 某一条件后,达到乙平衡状态:
(1)图Ⅰ中t时刻改变的反应条件可能是降低反应
的温度。 ( ×)
(2)图Ⅰ中平衡正向移动,化学平衡常数K一定增大。
( ×)
大小关系为T2 > T1。 ②T1→T2时改变温度的方式是 升高温度 ,生成物 图2-2-10 百分含量C%变小,说明 升高温度 平衡向 逆反应方向 移动,故知该反应的 正反应是 放热 反应。
新课探究
Ⅱ.据B图可知
①因“先拐先平”,p1时反应达到平衡所用时间短,则p1时反应速率大,故p1与p2
表示的压强大小关系为p1 > p2。 ②p1→p2时压强改变方式是 减小压强 , 反应物转化率α变大,说明 减小压强 平衡
则a+b < c。 Ⅱ.在压强一定时(如p3),温度升高,C% 增大 , 化学平衡 正向 移动,正反应是 吸热 反应。
图2-2-11
新课探究
2.化学平衡图像题的解题流程 一看面(纵、横坐标的意义) 二看线(线的走向和变化趋势)
看图像 三看点(起点、拐点、终点) 四看辅助线(如等温线、等压线、平衡线) 五看量的变化(如浓度变化、温度变化)
(√)
图2-2-14
(5)图Ⅱ中,平衡状态甲与乙相比,甲的反应物转化率低。 × ( )
课堂评价
2.分别在V L密闭容器中加入等物质的量的A和B 气体,发生2A(g)+B(g) ⇌2C(g),测得不同温度下,A 的转化率随时间变化关系如图2-2-15。下列判定 正确的是( A )
A.T2>T1 ΔH<0 B.T2<T1 ΔH<0 C.T2>T1 ΔH>0 D.T2<T1 ΔH>0
化学平衡移动图像_图文

C、缩小体积,使体系压强增大
D、升高了反应温度
解题指导:①水平线代表平衡 状态②各物质的Δc呈反应系数 比③达到平衡前,一般反应物 浓度减小,产物浓度增大。
二、速度-时间图:可用于:
1、已知引起平衡移动的因素,判断反应是吸热或放
热,反应前后气体体积的变化。
v 2、(已知反应)判断引起平衡移动的因素。
化学平衡移动图像_图文.ppt
•有关图象问题,可按以下的方法进行分析 :
①认清坐标系,搞清纵、横坐标所代表的意义,并 与勒夏特列原理挂钩。
②紧扣可逆反应的特征,搞清正反应方向是吸还是 放热,体积增大还是减小、不变,有无固体、纯液体 物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化 之间搭桥。
④看清起点、拐点、终点,看清曲线的变化趋势。 ⑤先拐先平。例如,在转化率-时间图上,先出现拐 点的曲线先达到平衡,此时逆向推理可得该变化的温 度高、浓度大、压强高。 ⑥定一议二。当图象中有三个量时,先确定一个量不 变再讨论另外两个量的关系。
一、浓度 - 时间图:
例:
1)写出化学反应方程式:
c
A+2B 3C
•对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2
•m+n<p+q
T1P2 T1P1
t
•正反应吸热
四、某物质的转化率(或百分含量)-温度(或压强)图:
•对于反应mA(g)+nB(g)
pC(g)+qD(g)
A的
A%
500℃
转化
200℃
率
1.01*107Pa
1.01,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关 系曲线。图中坐标有A、B、C、D、E 5点,其中表
D、升高了反应温度
解题指导:①水平线代表平衡 状态②各物质的Δc呈反应系数 比③达到平衡前,一般反应物 浓度减小,产物浓度增大。
二、速度-时间图:可用于:
1、已知引起平衡移动的因素,判断反应是吸热或放
热,反应前后气体体积的变化。
v 2、(已知反应)判断引起平衡移动的因素。
化学平衡移动图像_图文.ppt
•有关图象问题,可按以下的方法进行分析 :
①认清坐标系,搞清纵、横坐标所代表的意义,并 与勒夏特列原理挂钩。
②紧扣可逆反应的特征,搞清正反应方向是吸还是 放热,体积增大还是减小、不变,有无固体、纯液体 物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化 之间搭桥。
④看清起点、拐点、终点,看清曲线的变化趋势。 ⑤先拐先平。例如,在转化率-时间图上,先出现拐 点的曲线先达到平衡,此时逆向推理可得该变化的温 度高、浓度大、压强高。 ⑥定一议二。当图象中有三个量时,先确定一个量不 变再讨论另外两个量的关系。
一、浓度 - 时间图:
例:
1)写出化学反应方程式:
c
A+2B 3C
•对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2
•m+n<p+q
T1P2 T1P1
t
•正反应吸热
四、某物质的转化率(或百分含量)-温度(或压强)图:
•对于反应mA(g)+nB(g)
pC(g)+qD(g)
A的
A%
500℃
转化
200℃
率
1.01*107Pa
1.01,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关 系曲线。图中坐标有A、B、C、D、E 5点,其中表
化学课件《化学平衡——化学平衡图像》优秀ppt 人教课标版

A. Z、W均为气态,X、Y中有一种为气体 B. Z、W中有一种为气体,X、Y均为气体 C. X、Y、Z均为非气体,W 为气体 D. X、Y均为气体,Z、W 皆为非气体
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
练习6:
已知反应: 3A( g ) + B( g )
C( s ) + 4D( g )
下图中a、b 表示一定条件下,D的体积分数随时间t的
0.4
(2)反应的化学方程式是:
0.3
______2_A_____2_B__+_C_______
0.2 0.1
(3)8min后,若将容器的体
积缩小一半,c(A)将___增_大____
c(B)将___增_大____c(C)将__增__大___ 0
(填增大、减小、不变);
B A
C 时间(min)
平衡将向___逆_____反应方向移动;达到新的平衡时混 合气体的相对平均分子质量是_____增__大____ , A的转化率 ____减_小____。
A. N2(g) + 3H2(g)
2NH3(g) △H < 0
B. H2(g) + I2(g)
2HI(g) △H < 0
C. 2SO3(g)
2SO2(g) + O2(g) △H > 0
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H < 0
练习5:
对于达到平衡的可逆反应: X + Y W + Z 增大压 强则反应速率的变化图象如图所示。据此分析 X、Y、 W、Z的聚集状态是
谢谢
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
练习6:
已知反应: 3A( g ) + B( g )
C( s ) + 4D( g )
下图中a、b 表示一定条件下,D的体积分数随时间t的
0.4
(2)反应的化学方程式是:
0.3
______2_A_____2_B__+_C_______
0.2 0.1
(3)8min后,若将容器的体
积缩小一半,c(A)将___增_大____
c(B)将___增_大____c(C)将__增__大___ 0
(填增大、减小、不变);
B A
C 时间(min)
平衡将向___逆_____反应方向移动;达到新的平衡时混 合气体的相对平均分子质量是_____增__大____ , A的转化率 ____减_小____。
A. N2(g) + 3H2(g)
2NH3(g) △H < 0
B. H2(g) + I2(g)
2HI(g) △H < 0
C. 2SO3(g)
2SO2(g) + O2(g) △H > 0
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H < 0
练习5:
对于达到平衡的可逆反应: X + Y W + Z 增大压 强则反应速率的变化图象如图所示。据此分析 X、Y、 W、Z的聚集状态是
谢谢
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
化学平衡移动原理及图像分析_图文

D.达到平衡后,增加A的质量有利于化学平衡向正反应方向 移动
真题集训把脉高考
题组1 化学反应进行的方向
B
2.(2011·高考海南卷)氯气在298 K、100 kPa时,在1 L水中可 溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。 请回答下列问题: (1)该反应的离子方程式为 ____________________________________________________; (2)估算该反应的平衡常数 __________________________________________(列式计算); (3)在上述平衡体系中加入少量NaOH固体,平衡将向________ 移动; (4)如果增大氯气的压强,氯气在水中的溶解度将________(填 “增大”、“减小”或“不变”),平衡将向________移动。
A
B
3.可逆反应mA(s)+nB(g)
eC(g)+fD(g),反应过程中保持
其他条件不变,C的体积分数在温度(T)和压强(P)的条件下
随时间(t)变化如下图所示,下列叙述正确的是( B )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>e+f
化学平衡移动原理及图像分析_图文.ppt
教材回顾夯实双基
构建双基
反应方向
正
体积缩小 体积扩大
放热反应
吸热反应
减弱
体验高考
B
思考感悟 某一可逆反应,一定条件下达到平衡状态,若化学反应速率改 变了,平衡一定发生移动吗?相反,若平衡发生移动了,化学 反应速率一定改变吗? 【提示】 化学平衡移动的本质是由v(正)=v(逆)改变为v(正) ≠v(逆),此时平衡就会发生移动。因此速率改变,平衡不一定 移动,如加催化剂会同等程度地改变正逆反应速率,对于反应 前后气体分子数不变的可逆反应,改变压强会同等程度改变正 逆反应速率等,这些条件的改变只能改变反应速率大小,但不 能使平衡发生移动;相反,平衡移动,说明反应速率一定改变了。
《化学平衡状态》课件

总结词
详细描述
反应速率受温度、浓度、压力和催化剂等 因素影响。
温度越高,反应速率越快;浓度越高,反 应速率越快;压力越大,反应速率越快; 适当使用催化剂可以加快反应速率。
化学反应的方向
总结词
反应方向决定了化学平衡的移 动方向。
详细描述
根据勒夏特列原理,如果改变 影响平衡的条件,平衡就会向 着减弱这种改变的方向移动。
在制药工业中,化学平衡状态对于药物的合成和分离过程至关重要,通过调节平衡 条件可以获得高纯度的药物。
环境保护中的应用
化学平衡状态在环境保护中也有着重 要的应用,例如在大气污染控制中, 通过化学反应原理来降低大气中的污 染物浓度。
在土壤污染修复中,通过调节土壤中 的化学平衡来降低重金属等有害物质 的活性,从而减少对生态环境的危害 。
用率。
促进环境保护
通过研究化学平衡状态,可以减少 有害物质的排放,促进环境保护。
推动科学研究
化学平衡状态是化学反应动力学和 热力学研究的重要内容,有助于深 入了解化学反应的本质和规律。
02
化学平衡状态的建立
化学反应的速率
总结词
详细描述
反应速率是化学平衡状态建立的关键因素 。
化学反应速率决定了反应进行的快慢,对 于可逆反应,正逆反应速率相等是平衡状 态的特征之一。
《化学平衡状态》ppt课件
目录
• 化学平衡状态的定义 • 化学平衡状态的建立 • 化学平衡状态的移动 • 化学平衡状态的应用 • 化学平衡状态的实验验证
01
化学平衡状态的定义
什么是化学平衡状态
01
化学平衡状态是指在一定条件下 ,可逆反应进行到正、逆反应速 率相等且不再改变的状态。
02
《化学平衡》PPT全文课件【人教版】

b.当m+n=p+q时增大压 强(即△n=0的体系)。
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
三、某物质的转化率(或百分含量)-时间-温度(或 《化学平衡》PPT全文课件【人教版】优秀课件(实用教材) 压强)图(先拐先平,温度、压强均更高)
对于反应mA(g)+nB(g) pC(g)+qD(g)
对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2 T1P2 T1P1
t •首先判断压强高低:P1<P2 则:m+n<应吸热
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
AB3%
温度
A.
1×105Pa
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
四、某物质的转化率(或百分含量)-温度(或压强)图: 对于反应mA(g)+nB(g) pC(g)+qD(g)
A%
200℃
300℃
P
吸 >
•正反应 热 吸 m+n p+=q
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
化学平衡
常见化学平衡图像问题的处理
由下列图象能分析得出什么结论?
A%
A%
0
T
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
三、某物质的转化率(或百分含量)-时间-温度(或 《化学平衡》PPT全文课件【人教版】优秀课件(实用教材) 压强)图(先拐先平,温度、压强均更高)
对于反应mA(g)+nB(g) pC(g)+qD(g)
对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2 T1P2 T1P1
t •首先判断压强高低:P1<P2 则:m+n<应吸热
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
AB3%
温度
A.
1×105Pa
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
四、某物质的转化率(或百分含量)-温度(或压强)图: 对于反应mA(g)+nB(g) pC(g)+qD(g)
A%
200℃
300℃
P
吸 >
•正反应 热 吸 m+n p+=q
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
化学平衡
常见化学平衡图像问题的处理
由下列图象能分析得出什么结论?
A%
A%
0
T
化学平衡图像专题ppt课件

⑴确定t1、t2、t3时刻的操作:
A、浓度减小
B、加压
C、降温
⑵该反应正向是 放 (吸、放)热反应; ⑶气体物质的量增大 (增大、减少)的反应。
v
V(正) V(逆)
V(正) V(逆)
V(逆) V(正)
V(正) V(逆)
t1 t2
t3
7
t
看图技巧:
1、改变条件使平衡移动的瞬间曲线是连 续的,则是物质浓度发生改变 2、改变条件使平衡移动的瞬间曲线出现 断点,则是温度改变或是压强改变 3、改变条件反应速率变化但是平衡不移 动,则是使用催化剂或是反应前后气体 系数不变的反应中压强改变
C%
答问 11、、TT11与>TT22的高低
案题 2、2是、放放热热反反应应还是吸热反应
T2C
T1C
看图技巧:
先拐先平数值大
0 t1 t2 时间
12
物质产率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
产 率
问答题:1、T2>T1
1、T1与T2的相对大小
2案、该2反、应吸是热放反热反应应还是吸热反应
5、五看量的变化如浓度、温度、转化率、物 质的量斜率的变化等。
4
二、想规律:依据图像信息,利用平衡 移动原理,分析可逆反应的特征
三、先拐先平,温高压大 四、定一议二
5
一、速率—时间图像 1.计算平衡浓度
例:在容积固定为2L的密闭容器中,充入X、Y气体各2mol,
发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,
第二章 化学反应速率与化学平衡
第三节化学平衡 第三课时
平衡图像
1
复习回顾
高中化学选修人教版化学平衡图像ppt--PPT导学课件

PART 1
1、 v—t图像
四、化学平衡图像
1、v—t图像
①“渐变”类v — t图 浓度对平衡的影响
同增同减是温压,你升我升最听话。 一个断点是浓度,藕断丝连到天涯。 催化来了赶紧跑,一条直线画到老。 一增一减最奇葩,恒压来个大劈叉。
②“断点”类v — t图
温度(或压强)对平衡的影响
③“平台”类v-t图——催化剂(或压强)对平衡的影响
升温右移 T2
高,这个反应 是向左进行的。
T2>T1 ΔH>0 t
先找出谁先拐,谁的温度就高,然后看平衡向哪移动进
而判断ΔH
。
②确定左右气体系数 mA(g)+nB(g) ⇌ pC(g)+qD(g)
A 的 转
A
P1
的
加压左移 转
P1 加压右移
先 拐
化 率
P2
化 率
P2
先
平
P2>P1 m+n<p+q t
平衡图像
目录
CONTENTS
1、 v—t图像 2、c—t、n—t图像 3、ɑ-t-T图像和ɑ-t-P图像 4、恒温线、恒压线 5、其它图像
(1)、 看懂图像 面:图像形状,横、纵坐标的含义 线:走向,变化趋势 点:起点、终点、交点、拐点 是否需作辅助线(等温线、等压线) 定量图像中有关量的多少
(2)、联想规律,作出判断
例47,根据以上规律 判断,下列结论正确
的是( C )
A. 反应Ⅰ: ΔH>0,p2>p1
B. 反应Ⅱ: ΔH>0,T1>T2
C.反应Ⅲ: ΔH>0 T2>T1; 或ΔH<0 T2<T1
D. 反应Ⅳ: ΔH<0,T2>T1
化学平衡ppt课件

知识精讲
定
等
动
变
动态平衡
条件改变,原平衡状态被破坏,在新的条件下建立新的平衡
υ(正)= υ(逆)
改变影响化学反应速率的因素,如浓度、压强、温度,就有可能改变化学平衡
研究的对象是可逆反应
逆
υ(正)= υ(逆)≠0
各组分的含量保持一定,各组分的浓度保持一定。
3.化学平衡状态的特征:
二、化学平衡状态
0.7
0.7
......
从反应开始起,B、C的体积分数均为1/2,始终没有改变,不是变量,不能作为判断平衡状态的依据。
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
9.733×10-4
1.486×10-2
49.54
0
0
1.520×10-2
1.696×10-3
1.696×10-3
1.181×10-2
48.49
0
0
1.287×10-2
1.433×10-3
1.433×10-3
1.000×10-2
48.70
0
0
3.777×10-2
4.213×10-3
4.213×10-3
c (HI)
c (H2)
c(I2)
c (HI)
1.135×10-2
9.04×10-3
0
4.56×10-3
1.95×10-3
8.59×10-3
8.298
0
0
1.655×10-2
3.39×10-3
3.39×10-3
9.77×10-3
8.306
定
等
动
变
动态平衡
条件改变,原平衡状态被破坏,在新的条件下建立新的平衡
υ(正)= υ(逆)
改变影响化学反应速率的因素,如浓度、压强、温度,就有可能改变化学平衡
研究的对象是可逆反应
逆
υ(正)= υ(逆)≠0
各组分的含量保持一定,各组分的浓度保持一定。
3.化学平衡状态的特征:
二、化学平衡状态
0.7
0.7
......
从反应开始起,B、C的体积分数均为1/2,始终没有改变,不是变量,不能作为判断平衡状态的依据。
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
9.733×10-4
1.486×10-2
49.54
0
0
1.520×10-2
1.696×10-3
1.696×10-3
1.181×10-2
48.49
0
0
1.287×10-2
1.433×10-3
1.433×10-3
1.000×10-2
48.70
0
0
3.777×10-2
4.213×10-3
4.213×10-3
c (HI)
c (H2)
c(I2)
c (HI)
1.135×10-2
9.04×10-3
0
4.56×10-3
1.95×10-3
8.59×10-3
8.298
0
0
1.655×10-2
3.39×10-3
3.39×10-3
9.77×10-3
8.306
化学反应速率、化学平衡的图像分析(共21张PPT)

化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析
结束
二、解答化学反应速率、化学平衡图像题的一般原则方法 (1)看图像:一看轴,即纵、横坐标的意义;二看点:即起
点、拐点、交点、终点;三看线,即线的走向和变化趋势;四看 辅助线,即等温线、等压线、平衡线等;五看量的变化,如浓度 变化、温度变化、转化率变化、物质的量的变化等。
结束
[解析]
无论是升高温度还是增大压强,v(正)、v(逆)均应
增大。B项中v(逆)减小,D项中v(正)和v(逆)均减小,故B、D项 均错误;该反应的正反应是一个气体分子数增大的吸热反应, 升高温度,平衡向正反应方向移动,则v(正)>v(逆),A项错 误;增加压强,平衡向逆反应方向移动,则v(逆)>v(正),C项 正确。
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析
结束
3.从曲线的变化趋势着手
对于速率-温度(或压强)图像, 由于随着温度逐渐升高或压强逐 渐增大,反应速率会逐渐增大,因此图像上出现的是平滑的递增曲 线。
根据温度或压强对化学反应速率的影响,可以判断速率曲线的 变化趋势。需要注意的是:(1)温度或压强的改变对正、逆反应速率 的影响是一致的,即要增大都增大,要减小都减小,反映到图像 上,就是v(正)、v(逆)两条曲线的走势大致相同;(2)分析外界条件 对反应速率的影响时,只能分析达到平衡之后化学反应速率的变化 情况。
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析
结束
4.含量——时间——温度(压强)图
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5、五看量的变化如浓度、温度、转化率、物 质的量斜率的变化等。
二、想规律:依据图像信息,利用平衡 移动原理,分析可逆反应的特征
三、先拐先平,温高压大
四、定一议二
作业:
• 根据今天所学内容自己编制习题(要求:每 一种图像都要涉及到)
(2) X(<、=、>)_____Y,其理由是:A%
(1) 达平衡前的情况
(2) <;达到平衡点P后加压,
A%增加,说明平衡向左移动了
P·
0 压强
看图技巧:可逆反应的最大程度即化学平衡状态
练习:
对于可逆反应 2AB3(g)
A2(g) + 3B2(g) (正
反应吸热),下列图像正确的是(BD )
υ
υ逆
练习:根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、浓度减小
B、热反应;
⑶气体物质的量 增大(增大、减少)的反应。
v
V(逆)
V(正) V(逆)
V(正) V(逆)
V(正)
V(正) V(逆)
t1 t2
t3
t
看图技巧:
1、改变条件使平衡移动的瞬间曲线是连 续的,则是物质浓度发生改变 2、改变条件使平衡移动的瞬间曲线出现 断点,则是温度改变或是压强改变 3、改变条件反应速率变化但是平衡不移 动,则是使用催化剂或是反应前后气体 系数不变的反应中压强改变
二、物质的量(浓度)——时间图像
例:一定温度下,在2L的密闭容器中,X、Y、Z三 种气体的物质的量随时间变化的曲线如下图所示,
1)写出化学反应方程式: 2)求反应物的转化率:
二、浓度——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
此图在t2时,如果是改变温度,那
浓 度
么正反应是放热还是吸热?如果是 改变压强,那么m+n与p的关系如何? 平衡常数怎样改变?
A.B物质的转化率 Y
B.正反应的速率 C.平衡体系中的A%
300℃ 200℃
100℃
P
D.平衡体系中的C%
五.其它图像 由速率-压强(温度)图像
[例]对于反应 xA(g)+B(s)
yC(g)+ D(s)
A的百分含量与外压强有如下图的关系, (温度不变)则:
(1) P点左面曲线表示为_________
C%
问 1、T1与T2的高低 题 2、是放热反应还是吸热反应
T2C
T1C
看图技巧:
先拐先平数值大
0 t1 t2 时间
练习
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A的 转化率
B的
T1
转 化
T2
率
P1 P2
•正反应吸热 t
•m+n<p+q t
A%
C%
T1
T2
•正反应放热 t
P1
P2
•m+n=p+q t
四.百分含量(转化率或产率)—压强—温度曲线 m A(g)+nB(g) pC(g)+qD(g) ΔH=Q
A
转
m+n > p+q
化
1.01107Pa ΔH <0
率
1.01106Pa
1.01105Pa
看图技巧:图象中有三
0
T
温度 个量时,“定一议二”
练习:对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可能 表示(AD )
C
0
A或B
t1 t2 t3
时间
看图技巧:
1、物质的量(浓度)减少的是反应物,增加 的是生成物
2、转化量之比=化学计量数之比,可求知反 应方程式的化学计量数
3、反应一段时间后各物质的量保持不变且都 大于零,则是可逆反应
三、转化率(或产率、百分含量等)-时间图象
MA(g)+nB(g) pC(g)+qD(g) ΔH=Q
第二章 化学反应速率与化学平衡
第三节化学平衡 (第三课时)
平衡图像
一、速率-时间图:
1已知对某一平衡改变温度时有如下图变化,则温度的
变化是 升高 (升高或降低),平衡向正 反应方向移动,
正反应是 吸热反应。
v
v正
v
v逆
t1
t2 t
v逆
v正
t1
t2 t
•若对一正反应吸热的可逆反应平衡后降低 温度,画出平衡移动过程中的 v - t 图。
AB3%
100℃
υ正
500℃
AB3%
温度
A.
1×105Pa
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
化学平衡图像题的解题方法
一、看图像
1、一看轴,即横坐标和纵坐标的意义。 2、二看点,即一些特殊点如起点、拐点、交 点、终点、最高点的意义。 3、三看线即弄清图像中线的走向和变化趋势。 4、四看辅助线弄清图像斜率的大小。
二、想规律:依据图像信息,利用平衡 移动原理,分析可逆反应的特征
三、先拐先平,温高压大
四、定一议二
作业:
• 根据今天所学内容自己编制习题(要求:每 一种图像都要涉及到)
(2) X(<、=、>)_____Y,其理由是:A%
(1) 达平衡前的情况
(2) <;达到平衡点P后加压,
A%增加,说明平衡向左移动了
P·
0 压强
看图技巧:可逆反应的最大程度即化学平衡状态
练习:
对于可逆反应 2AB3(g)
A2(g) + 3B2(g) (正
反应吸热),下列图像正确的是(BD )
υ
υ逆
练习:根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、浓度减小
B、热反应;
⑶气体物质的量 增大(增大、减少)的反应。
v
V(逆)
V(正) V(逆)
V(正) V(逆)
V(正)
V(正) V(逆)
t1 t2
t3
t
看图技巧:
1、改变条件使平衡移动的瞬间曲线是连 续的,则是物质浓度发生改变 2、改变条件使平衡移动的瞬间曲线出现 断点,则是温度改变或是压强改变 3、改变条件反应速率变化但是平衡不移 动,则是使用催化剂或是反应前后气体 系数不变的反应中压强改变
二、物质的量(浓度)——时间图像
例:一定温度下,在2L的密闭容器中,X、Y、Z三 种气体的物质的量随时间变化的曲线如下图所示,
1)写出化学反应方程式: 2)求反应物的转化率:
二、浓度——时间曲线
mA(g)+nB(g) pC(g)+qD(s)
此图在t2时,如果是改变温度,那
浓 度
么正反应是放热还是吸热?如果是 改变压强,那么m+n与p的关系如何? 平衡常数怎样改变?
A.B物质的转化率 Y
B.正反应的速率 C.平衡体系中的A%
300℃ 200℃
100℃
P
D.平衡体系中的C%
五.其它图像 由速率-压强(温度)图像
[例]对于反应 xA(g)+B(s)
yC(g)+ D(s)
A的百分含量与外压强有如下图的关系, (温度不变)则:
(1) P点左面曲线表示为_________
C%
问 1、T1与T2的高低 题 2、是放热反应还是吸热反应
T2C
T1C
看图技巧:
先拐先平数值大
0 t1 t2 时间
练习
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A的 转化率
B的
T1
转 化
T2
率
P1 P2
•正反应吸热 t
•m+n<p+q t
A%
C%
T1
T2
•正反应放热 t
P1
P2
•m+n=p+q t
四.百分含量(转化率或产率)—压强—温度曲线 m A(g)+nB(g) pC(g)+qD(g) ΔH=Q
A
转
m+n > p+q
化
1.01107Pa ΔH <0
率
1.01106Pa
1.01105Pa
看图技巧:图象中有三
0
T
温度 个量时,“定一议二”
练习:对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可能 表示(AD )
C
0
A或B
t1 t2 t3
时间
看图技巧:
1、物质的量(浓度)减少的是反应物,增加 的是生成物
2、转化量之比=化学计量数之比,可求知反 应方程式的化学计量数
3、反应一段时间后各物质的量保持不变且都 大于零,则是可逆反应
三、转化率(或产率、百分含量等)-时间图象
MA(g)+nB(g) pC(g)+qD(g) ΔH=Q
第二章 化学反应速率与化学平衡
第三节化学平衡 (第三课时)
平衡图像
一、速率-时间图:
1已知对某一平衡改变温度时有如下图变化,则温度的
变化是 升高 (升高或降低),平衡向正 反应方向移动,
正反应是 吸热反应。
v
v正
v
v逆
t1
t2 t
v逆
v正
t1
t2 t
•若对一正反应吸热的可逆反应平衡后降低 温度,画出平衡移动过程中的 v - t 图。
AB3%
100℃
υ正
500℃
AB3%
温度
A.
1×105Pa
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
化学平衡图像题的解题方法
一、看图像
1、一看轴,即横坐标和纵坐标的意义。 2、二看点,即一些特殊点如起点、拐点、交 点、终点、最高点的意义。 3、三看线即弄清图像中线的走向和变化趋势。 4、四看辅助线弄清图像斜率的大小。
