肌红蛋白测定试剂盒(化学发光免疫分析法)产品技术要求万孚
肌红蛋白(MYO)测定试剂盒(免疫比浊法)产品技术要求利德曼

肌红蛋白(MYO)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人体血清或血浆中肌红蛋白的含量。
1.1包装规格试剂1(R1):4×60mL、试剂2(R2):3×60mL;试剂1(R1):1×60mL、试剂2(R2):1×45mL;试剂1(R1):1×45mL、试剂2(R2):1×15mL;试剂1(R1):2×45mL、试剂2(R2):2×15mL;试剂1(R1):1×15mL、试剂2(R2):1×5mL;试剂1(R1):2×75mL、试剂2(R2):2×25mL;试剂1(R1):1×75mL、试剂2(R2):1×25mL;试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):1×60mL、试剂2(R2):1×20mL;试剂1(R1):2×61mL、试剂2(R2):2×21mL;试剂1(R1):1×46mL、试剂2(R2):1×16mL;840测试/盒:【试剂1(R1):2×61mL、试剂2(R2):2×20mL】;校准品(选配):4×1mL;质控品(选配):高、低值两个水平1×3mL、1×1mL。
1.2主要组成成分1.2.1试剂组成试剂1(R1):氨基乙酸缓冲液试剂2(R2):MYO胶乳试剂:被抗人肌红蛋白抗体包裹的聚苯乙烯橡胶等大小颗粒0.12%悬浊液。
1.2.2 校准品的组成四个水平的液体校准品,在50mmol/L pH=7.0 的Capso(3-(环己烷)-1-丙磺酸)缓冲液中添加肌红蛋白纯品,定值范围:(50~150)ng/mL、(150~250)ng/mL、(350~450)ng/mL、(700~900)ng/mL。
肌红蛋白(Myo)测定试剂(荧光免疫层析法)产品技术要求万孚

肌红蛋白(Myo)测定试剂(荧光免疫层析法)
性能指标
1 外观检查
外观应平整,材料附着应牢固,各组份应齐全,卡固定紧密。
2 物理检查
膜条宽应不小于2.0mm;液体移行速度应不低于10mm/min。
3 线性范围
取同一批号的试剂分别对五个浓度的肌红蛋白参考品进行检测,其检测范围为2.0ng/mL~400.0ng/mL,每份参考品重复检测3次,计算相关系数r,其中r值应≥0.9900。
4 精密度
4.1 批内精密度
随机抽取同一批号的试剂10份,分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
4.2 批间精密度
随机抽取连续三个批号的试剂,每个批号取3份分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
5 准确度
用同一批号试剂分别测定三个水平浓度的肌红蛋白参考品,计算样本测定结果均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
6 最低检出限
取同一批号的试剂10份,对配制参考品基质进行检测,计算样本测定结果均值X和标准偏差SD,其中(X+2SD)≤2.0ng/mL。
7 分析特异性
选择同一浓度的肌红蛋白参考品分别加入胆固醇、甘油三酯、胆红素,使干扰物最终浓度胆固醇60mg/mL、甘油三酯40mg/mL、胆红素2mg/mL,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
肌红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求jiuqiang
肌红蛋白测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清或血浆中肌红蛋白的含量。
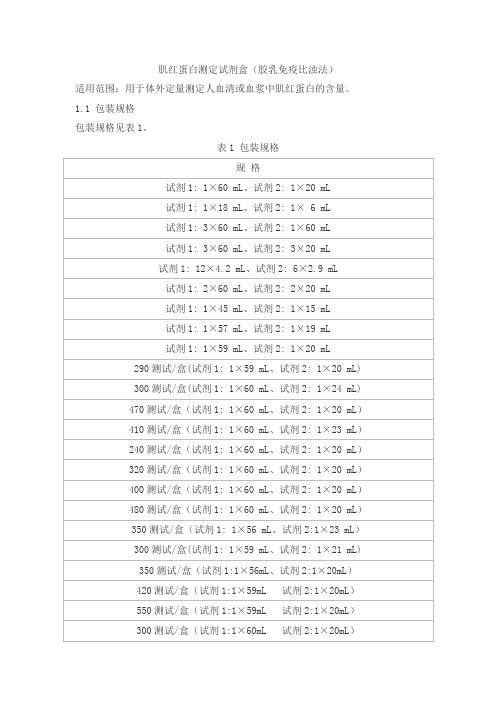
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分表2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为乳白色液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3试剂空白吸光度A570nm下测定空白吸光度应≤1.8000。
2.4 准确度与已上市产品进行比对试验:在[10,800 ]ng/mL区间内,相关系数r≥0.975,在[10,100 ]ng/mL区间内测定的绝对偏差应不超过±10 ng/mL,在(100,800]ng/mL区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为200 ng/ml时,其吸光度变化在0.0300~0.2000之间。
2.6 线性区间在[10,800]ng/mL区间内,线性相关系数r≥0.99,在(10,100]ng/mL 区间内绝对偏差应不超过±10 ng/mL,在(100,800]ng/mL区间内相对偏差应不超过±10%。
2.7 测量精密度2.7.1重复性对高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于7%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应≤10%。
2.8 质控品赋值有效性使用质控品进行测定,所得结果应在靶值范围内。
2.9 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
取到效期后试剂盒进行检测,检测结果应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.10校准品溯源性按GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准品溯源至企业工作校准品,与北京利德曼公司试剂盒比对赋值。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)产品技术要求深圳市锦瑞生物科技

医疗器械产品技术要求编号:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)2 性能指标2.1 外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状组分外观性状Ra 应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
校准品应为冻干粉,呈疏松状,加入纯水后在15min内溶解,无沉淀或絮状物。
质控品应为冻干粉,呈疏松状,加入纯水后在15min内溶解,无沉淀或絮状物。
2.2 装量试剂盒内各组分装量应不少于标示值。
2.3 准确度回收率应在(90%~110%)区间内。
2.4 空白限应不大于5 ng/mL。
2.5 线性试剂盒在21 ng/mL~3000 ng/mL区间范围内,其线性相关系数r≥0.9900。
2.6 重复性用试剂盒质控品L和质控品H作为样本,重复检测10次,其变异系数(CV)应不大于7%。
2.7 批间差用3个批号试剂盒分别检测同一瓶质控品L和质控品H,3个批号试剂盒之间的批间变异系数(CV)应不大于10%。
2.8 质控品测定值用试剂盒配套的校准品校准测量系统后,以试剂盒配套的质控品作为样本进行检测,其测定结果应在标示范围内。
2.9 质控品均一性瓶间变异系数(CV)应不大于10%。
2.10 校准品测量准确度用工作校准品校准测量系统后,以试剂盒配套的校准品作为样本进行检测,C1、C2测定结果与标示值的相对偏差应在±10%范围内;C0测定结果的绝对偏差应不大于5ng/mL。
2.11 校准品均一性C1,C2瓶间变异系数(CV)应不大于10%;C0瓶间标准差(SD)应不大于5ng/mL。
心肌三项I(cTnI CK—MB Myo)质控品产品技术要求万孚

2. 性能指标
2.1外观检查
质控品复溶前为白色或类白色疏松饼状结构,复溶后为澄清、透明液体,无沉淀、悬浮物和絮状物。
2.2 包装
包装瓶为棕色玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.3 均一性
2.3.1 瓶内均一性
瓶内CV≤15%。
2.3.2 瓶间均一性
瓶间CV≤15%。
2.4 靶值及靶值范围
2.4.1 赋值程序
每批质控品均应提供本批产品的靶值单,并应提供赋值方法程序文件。
2.4.2 赋值的准确性
用校准后的测量程序测定该质控品,检测结果应在其靶值范围内。
1。
肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)产品技术要求lideman

肌红蛋白(MYO)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人体血清或血浆中的肌红蛋白(MYO)含量。
1.1规格100测试/盒。
1.2组成试剂盒由校准品、试剂1号、试剂2号、磁分离试剂和质控品组成。
试剂1号(5mL/瓶×2瓶):内容物含荧光素标记肌红蛋白单克隆抗体试剂2号(5mL/瓶×2瓶):内容物含碱性磷酸酶标记肌红蛋白单克隆抗体。
缓冲液:含1%羊血清蛋白、2%马血清蛋白、1%牛血清蛋白等的缓冲溶液。
磁分离试剂(2.5mL/瓶×2瓶):含有0.1%磁性微粒(共价包被抗荧光素抗体)和1%牛血清白蛋白的0.1mol/L Tris缓冲液,含0.2%w/v的NaN。
3校准品(0.5mL/瓶×6瓶):校准品分别含有0、25、100、300、500和1000ng/mL 的肌红蛋白,以含有的0.1mol/L Tris和0.2%w/v NaN的缓冲液配制而成。
3质控品(1.0mL/瓶×2瓶):2个水平,含一定量的肌红蛋白,以含有0.1mol/L Tris 的缓冲液配制而成。
质控范围详见质控单。
和0.2%w/v NaN32.1 试验条件以下所有试验,均要求环境温度为:18℃~25℃。
2.2 外观2.2.1试剂盒各组分应齐全、完整、液体无渗漏;2.2.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.2.3液体组分应澄清,无沉淀或絮状物;2.2.4包装标签应清晰,易识别。
2.3 特异性(交叉反应)试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应表1 交叉反应2.4 准确度回收试验:应在85-115%范围内。
2.5 最低检测限应不大于2ng/mL。
2.6 线性在[2,1000]ng/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.7 重复性用(60±12)ng/mL和(300±60)ng/mL 的样本各重复检测10次,其变异系数(CV)应不大于10%。
肌红蛋白测定试剂盒(免疫比浊法)产品技术要求北京北检

肌红蛋白测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中肌红蛋白的含量。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成试剂1:甘氨酸缓冲液 150mmol/L20mmol/LEDTA-Na2氯化钠 95mmol/L试剂2:甘氨酸缓冲液 150mmol/L羊抗人肌红蛋白抗体胶乳颗粒≥0.5g/L氯化钠95mmol/L1.2.2 校准品的组成(选配)在牛血清白蛋白中添加肌红蛋白水平1:肌红蛋白 (0~40) μg/L水平2:肌红蛋白 (40~80) μg/L 水平3:肌红蛋白 (80~160) μg/L 水平4:肌红蛋白 (160~320) μg/L水平5:肌红蛋白 (320~550) μg/L1.2.3 质控品的组成(选配)水平1:肌红蛋白 (22~80) μg/L 该质控品为血清基质质控品水平2:肌红蛋白 (81~500) μg/L 该质控品为血清基质质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明无杂质液体;2.1.3 试剂2:乳白色悬浊无絮状物液体;2.1.4 校准品:无色或淡黄色澄清透明无杂质液体;2.1.5 质控品:无色或淡黄色澄清透明无杂质液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在波长500nm、37℃条件下,试剂空白吸光度不大于1.5;2.3.2 试剂空白吸光度变化率在波长500nm、37℃条件下,试剂空白吸光度变化率不大于0.008。
2.4 线性2.4.1 线性范围[22,500]µg/L,相关系数r≥0.990。
2.4.2 线性偏差[100,500]µg/L线性范围内,相对偏差不超过±10%;[22,100)µg/L线性范围内,绝对偏差不超过±10µg/L。
2.5 分析灵敏度检测浓度为100µg/L的样本时,吸光度变化率不小于0.01。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)产品技术要求tongxin

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中肌红蛋白(MYO)的含量。
1.1 包装规格
96人份/盒
1.2 主要组成成分
表1主要组成成分
注:校准品采用贝克曼MYO检测试剂盒(磁颗粒化学发光法)比对赋值,校准品(A~F)目标浓度为0、20、200、1000、2000、3000ng/ml。
2.1 外观
组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量
液体装量应不少于标示值。
2.3 准确度
在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在
85~115%范围内。
2.4 线性
在线性范围 [10,3000]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限
应不大于10ng/ml。
2.6 重复性
变异系数(CV)应不大于10.0%。
2.7 批间差
批间变异系数(CV)应不大于15.0%。
2.8 分析特异性
测定浓度为5mg/ml血红蛋白,交叉反应率小于0.002%。
2.9 稳定性
产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语
4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析
4.2 MYO:Myoglobin肌红蛋白
4.3 RLU:Relative Light Unit相对光单位。
肌红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求wtdr

肌红蛋白测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中肌红蛋白的含量。
1.1 包装规格1) 试剂1:45mL×1、试剂2:15mL×1;2) 试剂1:45mL×3、试剂2:15mL×3;3) 试剂1:48mL×1、试剂2:12mL×1;4) 试剂1:48mL×3、试剂2:12mL×3;校准品:0.5mL×5(选配);质控品水平1:0.5mL×1(选配);质控品水平2:0.5mL×1(选配)。
1.2 组成成分试剂1:甘氨酸缓冲液 50mmol/L聚乙二醇6000 3%吐温-20 0.10%试剂2:甘氨酸缓冲液50mmol/L聚乙二醇6000 3%抗人肌红蛋白抗体结合胶乳按效价确定校准品:甘氨酸缓冲液,人血清(≥5%),肌红蛋白;肌红蛋白校准品目标浓度:水平1:0.0μg/L,水平2:100.0μg/L,水平3:200.0μg/L,水平4:400.0μg/L,水平5:800.0μg/L,批特异,具体浓度见瓶签;质控品:甘氨酸缓冲液,人血清(≥5%),肌红蛋白;肌红蛋白质控品靶值范围:水平1:100.0μg/L~140.0μg/L,水平2:290.0μg/L~410.0μg/L,批特异,具体浓度见瓶签。
2.1 装量试剂盒内液体装量应不低于瓶签标示装量。
2.2 外观试剂1:无色澄清液体;试剂2:白色乳浊液体;校准品:淡黄色液体;质控品水平1:淡黄色液体;质控品水平2:淡黄色液体。
2.3 试剂空白吸光度测定温度:37℃;测定波长:570nm;比色杯光径:1.0cm;其空白吸光度应不大于1.5。
2.4分析灵敏度100μg/L 肌红蛋白样品吸光度差值为:0.01≤△A≤0.2。
2.5 准确度用已上市试剂盒和本公司试剂盒同时测试至少40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990,斜率应在[0.9,1.1]内;[15,80]μg/L浓度线性绝对偏差不超过±8μg/L,(80,800]μg/L浓度线性相对偏差应不超过±10%。
肌红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求huayuyikang

肌红蛋白测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中肌红蛋白的含量。
1.1 产品型号/规格试剂1:1×30 ml,试剂2:1×10 ml;试剂1:2×30 ml,试剂2:2×10 ml;试剂1:4×30 ml,试剂2:4×10 ml;试剂1:8×30 ml,试剂2:8×10 ml;试剂1:1×45 ml,试剂2:1×15 ml;试剂1:2×45 ml,试剂2:2×15 ml;试剂1:3×50 ml,试剂2:2×25 ml;试剂1:1×60 ml,试剂2:1×20 ml;试剂1:2×60 ml,试剂2:2×20 ml;试剂1:2×90 ml,试剂2:2×30 ml;试剂1:2×90 ml,试剂2:3×20 ml;试剂1:4×90 ml,试剂2:4×30 ml;试剂1:2×15 ml,试剂2:2×5 ml ;试剂1:4×15 ml,试剂2:4×5 ml ;试剂1:8×15 ml,试剂2:8×5 ml ;试剂1:16×15 ml,试剂2:16×5 ml。
校准品:0.5 ml/瓶×5瓶(选配)1.2 主要组成成分试剂1:磷酸盐缓冲液50mmo l/L聚乙二醇(PEG)6000 3% Proclin-3000.1%试剂2:磷酸盐缓冲液50mmo l/LTween-200.10%抗人肌红蛋白(Mb)抗体包裹的聚苯乙烯颗粒0.1g/LProclin-3000.1%校准品(选配):Tris缓冲液10 0mmol/LProclin-3000.5‰肌红蛋白目标浓度分别为:水平1:0.00ng/mL;水平2:100.00ng/mL;水平3:200.00ng/mL;水平4:400.00ng/mL;水平5:800.00ng/mL。
高敏肌钙蛋白I测定试剂盒(化学发光免疫分析法)产品技术要求万孚

2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;样本处理液R3应为无色液体;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
将具有溯源性的两个正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.3空白限
空白限不大于0.006ng/mL;
2.4线性
试剂盒在0.01ng/mL~50 ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
2.5重复性
变异系数CV≤8%。
2.6批间差
变异系数CV≤10%.
2.7分析特异性
测定浓度均为1000ng/mL 的心肌肌钙蛋白C、心肌肌钙蛋白T、骨骼肌肌钙蛋白I,交叉反应率应≤0.1%。
2.8校准品
2.8.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内,C0 测定结果的绝对偏差的绝对值不高于0.006ng/mL。
2.8.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%,C0 的SD≤0.006ng/mL。
2.8.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%,C0 的SD≤0.006ng/mL。
肌红蛋白(Myo)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求北京中航赛维

肌红蛋白(Myo)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中的肌红蛋白(Myo)的含量。
1.1产品规格
50测试/盒,100测试/盒,200测试/盒
1.2主要组成成分
注:校准品和质控品浓度具有批特异性,具体浓度详见每批的校准品和质控品标签。
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应澄清,无沉淀或絮状物;
2.1.4包装标签应清晰,易识别;
2.2溯源性
应根据GB/T21415-2008及有关规定提供校准品的来源、溯源的赋值方法和相应指标、以及不确定度等内容。
本试剂盒校准品可溯源至企业工作校准品,并与已上市产品比对赋值。
2.3准确度
回收率应在85%-115%范围内。
2.4分析特异性
测定浓度为10mg/mL的血红蛋白,其测定结果应不高于1ng/mL。
2.5空白限
应不大于1ng/mL。
2.6线性
在[3,2000]ng/mL的测量范围内,相关系数r应≥0.9900。
2.7重复性
变异系数(CV)应不大于8%。
2.8质控品的赋值有效性
质控品的测量值应在质控范围内。
2.9批间差
变异系数(CV)应不大于15.0%。
2.10稳定性
试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.3、2.4、2.5、2.6、2.7和2.8的要求。
肌红蛋白测定试剂盒说明书

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载肌红蛋白测定试剂盒说明书地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30 人份/盒、2×50 人份/盒、2×100 人份/盒【预期用途】用于体外定量测定人体血清或(和)血浆中肌红蛋白的含量。
肌红蛋白(MYO)分子量为 17.8 kD,由一个多肽链和一个亚铁血红素辅基组成,由人体骨骼肌和心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌和心肌来源的两种肌红蛋白无免疫学上的差异。
肌红蛋白的主要生理功能为携带氧气供细胞呼吸。
肌红蛋白是检测急性心肌梗死(AMI) 的早期指标,具有极高的灵敏度但是特异性较差,在 AMI 早期心肌细胞受损,由于 MYO 的分子量小,可以很快从破损的细胞中释放出来,在 AMI 发病 1~3 小时后血中浓度迅速上升,6~7 小时达峰值,12 小时内几乎所有 AMI 患者 MYO 都有升高,升高幅度大于各心肌酶,因此可以作为 AMI 的早期诊断标志物。
由于 MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重的充血性心力衰竭、长时间休克及各种原因引起的肌病患者、肌内注射、剧烈的锻炼、某种毒素和药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断 AMI 的早期指标,仅限于没有上述相关疾病的患者。
在有急性症状的患者中,4 小时内 MYO 水平不升高,AMI 的可能性极低。
由于在AMI 后血中 MYO 很快从肾脏清除,发病 l8~30 小时内可完全恢复到正常水平。
肌红蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

肌红蛋白测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清或血浆中肌红蛋白的含量。
1.1包装规格液体双剂型试剂1(R1):60mL×1,试剂2(R2):20mL×1;试剂1(R1):45mL×1,试剂2(R2):15mL×1;试剂1(R1):75mL×1,试剂2(R2):25mL×1。
1.2主要组成成分1.2.1 试剂1(R1)(液体)甘氨酸100mmol/L1.2.2 试剂2(R2)(液体)Mb抗体包被乳胶颗粒3mg/mL2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.2试剂2(R2)应为白色乳浊液,无杂质,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长570nm(550nm~600nm)处(光径1cm),试剂空白吸光度(A)应≤1.300。
2.4 准确度用中生试剂和已上市同类试剂分别测定40个在线性范围内不同浓度的样本,在[10,800]ng/mL范围内,比对两组数据的相关系数(r)及测值的偏差,要求r≥0.975;在(50,800]ng/mL区间内,相对偏差应不超过±10%;在[10,50]ng/mL区间内,绝对偏差应不超过±5ng/mL。
2.5 分析灵敏度对应于浓度为为400ng/mL的Mb所引起的吸光度差值(△A)的绝对值应在0.080~0.200的范围内。
2.6 重复性重复测定高、低浓度样本,变异系数(CV)应≤ 7%。
2.7 批间差测定同一样本,批间差(R)应≤ 10%。
2.8 线性范围在[10,800]ng/mL范围内,线性相关系数(r)应≥0.990;在(50,800]ng/mL范围内,线性相对偏差应不超过±10%;在[10,50]ng/mL范围内,线性绝对偏差应不超过±5ng/mL。
肌钙蛋白T测定试剂盒产品技术要求万孚

肌钙蛋白T测定试剂盒产品技术要求万孚1.产品简介:肌钙蛋白T测定试剂盒是一种高灵敏度、高特异性的试剂盒,用于检测肌钙蛋白T水平。
该试剂盒通过化学发光免疫分析法,利用特异性的抗体与肌钙蛋白T结合,生成免疫复合物,进而产生化学发光信号,通过光度计测量信号强度,从而确定样本中肌钙蛋白T的浓度。
2.抗体:该试剂盒中所使用的抗体应为高亲和力、高特异性的肌钙蛋白T抗体。
抗体应经过充分的验证,并能与肌钙蛋白T特异性结合,不与其他相关物质发生非特异性反应。
3.校准品:试剂盒应包含不同浓度的校准品,用于构建标准曲线。
校准品应经过准确测定其肌钙蛋白T浓度,并保证稳定性。
4.灵敏度:试剂盒应具有足够的灵敏度,能够检测出低至0.01 ng/mL的肌钙蛋白T浓度。
5.线性范围:试剂盒应具有宽广的线性范围,能够涵盖生理范围内的肌钙蛋白T浓度变化。
6.重复性:试剂盒应具有良好的重复性,同一样本的重复测定结果应具有较小的变异性。
7.特异性:试剂盒应具有良好的特异性,不受其他相关物质的干扰。
8.稳定性:试剂盒的试剂和材料应具有良好的稳定性,能够保持在规定的储存条件下长期保存。
9.操作简便性:试剂盒的操作步骤应简单明了,能够被普通实验室人员快速掌握并使用。
10.结果解读:试剂盒的结果应能够准确、直接地反映样本中肌钙蛋白T的浓度,并能够被普通实验室人员快速解读。
以上是对肌钙蛋白T测定试剂盒产品技术要求的详细描述,通过满足这些要求,可以确保该产品可以准确、可靠地测定肌钙蛋白T水平,从而在临床诊断和研究中发挥重要作用。
肌红蛋白测定试剂盒(直接化学发光法)产品技术要求ja
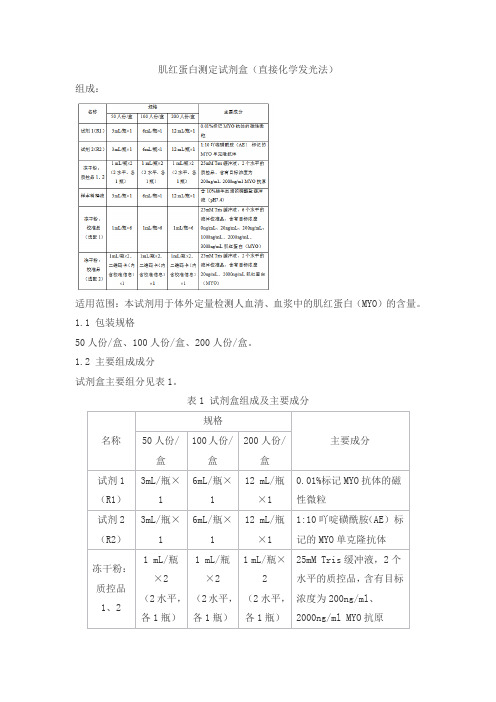
肌红蛋白测定试剂盒(直接化学发光法)组成:适用范围:本试剂用于体外定量检测人血清、血浆中的肌红蛋白(MYO)的含量。
批特异性:每批校准品的值、质控品的质控范围具有特异性,详见瓶签。
以上校准品(选配1)、校准品(选配2)须选择一项获取校准信息。
2.1 物理性状2.1.1外观本试剂盒中的组分齐全、完整,液体试剂澄清,无异物、沉淀物、絮状物和无渗漏。
各组分标签字迹清晰、无破损。
质控品、校准品为淡黄色冻干品,用蒸馏水复溶后应为淡黄色液体。
2.1.2 装量液体装量不少于标示值。
2.2线性在[2,3000]ng/mL范围内,用线性拟合公式拟合,相关系数应不低于0.9900。
2.3准确度将已知浓度的肌红蛋白(MYO)加入到低值样本中,其回收率应在85%-115%。
2.4空白限本试剂盒的空白限不大于2ng/mL。
2.5重复性分别用高、低2个浓度的样本,各重复检测10次,其变异系数(CV)不大于8.0%。
2.6 批间差用3个批号试剂盒分别检测高、低2个浓度的样本,则3个批号试剂盒之间的批间变异系数(CV)不大于15%。
2.7 质控品、校准品批内瓶间差质控品、校准品批内瓶间差CV(%)应不高于10%。
2.8特异性检测表2中相应浓度的交叉反应物,检测结果应小于2ng/mL。
表2 被测物常见的交叉反应物2.9 质控品赋值有效性质控品测定结果应在本试剂盒规定的范围内。
2.10 校准品溯源性应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准信息可溯源至本公司工作校准品,工作校准品与已上市肌红蛋白检测系统比对赋值。
2.11 稳定性2.11.1效期稳定性将试剂盒在2℃~8℃的环境中放置12个月后,分别检测2.1、2.2、2.3、2.4、2.5、2.9项,结果应符合各项目的要求。
2.11.2复溶稳定性质控品复溶后在2℃~8℃条件下储存28天后,产品性能应符合2.7、2.9规定的要求。
肌红蛋白测定试剂盒说明书

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30人份/盒、2×50 人份/盒、2×100人份/盒【预期用途】用于体外定量测定人体血清或(与)血浆中肌红蛋白得含量。
肌红蛋白(MYO)分子量为17、8 kD,由一个多肽链与一个亚铁血红素辅基组成,由人体骨骼肌与心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌与心肌来源得两种肌红蛋白无免疫学上得差异。
肌红蛋白得主要生理功能为携带氧气供细胞呼吸。
肌红蛋白就是检测急性心肌梗死(AMI) 得早期指标,具有极高得灵敏度但就是特异性较差,在AMI 早期心肌细胞受损,由于MYO得分子量小,可以很快从破损得细胞中释放出来,在AMI发病1~3小时后血中浓度迅速上升,6~7小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 得早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重得充血性心力衰竭、长时间休克及各种原因引起得肌病患者、肌内注射、剧烈得锻炼、某种毒素与药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI得早期指标,仅限于没有上述相关疾病得患者。
在有急性症状得患者中,4小时内MYO 水平不升高,AMI 得可能性极低.由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平.故MYO 测定有助于在AMI病程中观察有无再梗塞或者梗塞再扩展。
MYO频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩与多肌炎时血清MYO水平亦升高。
心脏外科手术患者血清MY O升高,可以作为判断心肌损伤程度及愈合情况得一项客观指标。
【检验原理】肌红蛋白测定采用双位点夹心化学发光免疫分析法,其检测原理如下:第一步:将样本与包被着抗肌红蛋白抗体得超顺磁性微粒(磁珠)以及抗肌红蛋白抗体—碱性磷酸酶标记物添加到反应管中,经过孵育,样本中得肌红蛋白与包被在磁珠上得抗肌红蛋白抗体结合,同时抗肌红蛋白抗体-碱性磷酸酶标记物与样本中肌红蛋白另一位点结合。
肌红蛋白(Myo)质控品产品技术要求万孚

2.性能指标
2.1外观检查
质控品复溶前为白色或类白色疏松饼状结构,复溶后为澄清、透明液体,无沉淀、悬浮物和絮状物。
2.2包装
包装瓶为棕色玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.3均一性
2.3.1瓶内均一性
瓶内CV≤15%。
2.3.2瓶间均一性
瓶间CV≤15%。
2.4靶值及靶值范围
2.4.1赋值程序
每批质控品均应提供本批产品的靶值和靶值范围表,并应提供赋值方法程序文件。
2.4.2赋值的准确性
用校准后的测量程序测定该质控物,检测结果应在其靶值范围内。
肌红蛋白(MYO)质控品产品技术要求同生时代
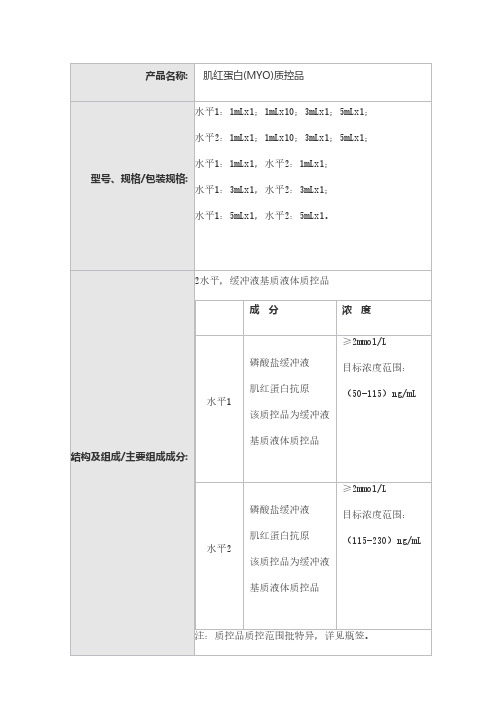
水平1:1mLx1;1mLx10;3mLx1;5mLx1;水平2:1mLx1;1mLx10;3mLx1;5mLx1;水平1:1mLx1,水平2:1mLx1;
水平1:3mLx1,水平2:3mLx1;
水平1:5mLx1,水平2:5mLx1。
1.2主要组成成分
2水平,缓冲液基质液体质控品
2.1性状
质控品为无色至淡黄色液体。
2.2装量
液体质控品的装量不少于标示值。
2.3可接受区间
质控品测定值应在靶值范围内。
2.4瓶间均匀性
赋值结果的瓶间均匀性变异系数(CV)≤5%。
2.5稳定性
2.5.1效期稳定性
质控品原包装在2℃~8℃避光保存,有效期为18个月,在稳定期内赋值结果的变化趋势不显著。
2.5.2开瓶稳定性
质控品开瓶后,在2℃~8℃下避光密封保存,可稳定14天,在稳定期内赋值结果的变化趋势不显著。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.3空白限
不大于21ng/mL。
2.4线性
试剂盒在21ng/mL~3000ng/mL 区间内,其相关系数(r)绝对值不低于0.9900。
2.5重复性
变异系数CV≤8%。
2.6批间差
变异系数CV≤10%。
2.7校准品
2.7.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内,C0 测定结果的绝对偏差的绝对值不高于21ng/mL。
2.7.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%,C0 的SD≤21ng/mL。
2.7.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%,C0 的SD≤21ng/mL。
1。
