TaqMan实时荧光定量RT
实时荧光定量PCR技术

千里之行,始于足下。
Real-time PCR for mRNA quantitation一、原理实时荧光定量PCR技术是通过检测PCR产物中荧光讯号强度来达到定量PCR产物的目的,目前该技术已在动植物基因工程,微生物和医学领域中得到广泛应用。
实时定量PCR 包括探针法和染料法两种,探针法是利用与靶序列特异杂交的探针来指示扩增产物的增强,特异性高,如Taq Man TM技术;染料法则是利用染料来指示扩增的增强,特异性相对较低,但简便易行。
染料法的原理是在PCR 反应体系中,参加过量荧光染料,荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的染料分子不会发射任何荧光信号,从而保证荧光信号的增强与PCR产物的增强彻低同步。
荧光染料发射出的荧光讯号强度与DNA 产量成正比,检测PCR 过程中的荧光讯号便可得知靶序列初始浓度,从而达到定量目的。
目前染料法实时荧光定量PCR主要使用的是美国Molecular Probes 公司的SYBR Green 1 和SYBR Gold 染料。
二、实验步骤一)、单链cDNA 摸板的合成(参照相关资料)二)、Real-time PCR操作主意(TIANGEN 公司RealMasterMix(SYBR Green) PCR Kit)1、20×SYBR Green solution 在室温下平衡并彻底混匀。
2、将125μL 20×SYBR Green solution 参加至1.0 ml 2.5×ReaMasterMix 中并轻轻混匀。
3、照表1决定多个PCR反应混合物并分装到各个PCR管中。
4、将PCR管放入热循环仪并启动循环程序(表2)。
三、计算在定量PCR中,需要经过数个循环后荧光信号才干够被检测到。
荧光域值的缺省设置是3-15 个循环的荧光信号的标准偏差的10 倍。
在实际操作中普通以前15个循环的荧光信号作为荧光本底信号。
荧光定量PCR中一个关键的数据是“Ct(threshold cycle)值”,其中“t”是Threshold ,即PCR管内荧光超过本底(达到可检测水平)时的临界数值;第 1 页/共 3 页朽木易折,金石可镂。
流感病毒RNA荧光RT(PCR检测技术)-

流感病毒RNA荧光RT(PCR检测技术)-流感病毒核糖核酸荧光逆转录聚合酶链反应检测技术实时荧光定量聚合酶链反应是在常规聚合酶链反应基础上发展起来的定量聚合酶链反应技术。
通过在聚合酶链式反应体系中加入荧光基团,利用荧光信号的积累,对整个聚合酶链式反应过程进行实时监控。
最后,根据ct值和标准曲线对未知模板进行定量分析。
常用的实时荧光定量PCR可分为非特异性荧光标记的SYBR Green法、特异性荧光标记的TaqMan法和分子信标法。
1。
实时荧光定量聚合酶链反应原理:1。
SYBR Green方法:SYBR Green是一种双链DNA结合染料,在自由状态下不发光,当无意中掺入双链DNA时会发出荧光信号。
它的强度与双链DNA 的数量有关。
随着扩增产物数量的增加,检测到的荧光信号增加。
2,TaqMan方法:在扩增反应液中加入特异性探针,探针的5’端和3’端分别标记有荧光报告基团和荧光淬灭基团,当探针完成时,两个基团的位置接近,5’端报告基团的荧光能量被3’端淬灭基团吸收,此时未检测到荧光信号,在扩增过程中,探针与模板结合形成5’→3’切除活性底物当Taq酶沿着模板向前延伸到探针连接处时,发生链置换。
Taq酶的5’→3’切除活性切割从探针上切割连接到探针5’端的报道基团。
5’末端报道基团的荧光能量与3’末端荧光淬灭基团的吸收分离,并且可以检测荧光信号。
在每个聚合酶链反应循环之后,荧光信号也有一个同步生长过程,就像扩增产物一样3.分子信标法:将探针设计成发夹形的茎环。
环的核苷酸序列与扩增产物的序列互补。
两端的核苷酸序列互补形成茎。
一端用报道基团标记,另一端用淬灭基团标记。
当探针不与模板结合时,报道基团和淬灭基团在空间上彼此靠近,报道基团的荧光能量被淬灭基团吸收。
此时,无法检测到荧光信号。
与模板结合后,探针的构象由发夹状变为链状,报道基团和淬灭基团分离,并呈荧光核酸检测是鉴定流感病毒基因组的一种强有力的方法,即使基因组含量很低或可以检测到死病毒。
taqman荧光定量pcr基本原理

taqman荧光定量pcr基本原理
TaqMan荧光定量PCR是指采用荧光标记的PCR技术,它可以实现对特定序列DNA的定量分析,即可以直接测量所检测序列在模板文库中的相对浓度。
TaqMan荧光定量PCR可以说是一种双通道的实时PCR技术,最初由PE Applied Biosystems(PE)推出。
它是通过特定的标记技术,开发了FRET和TaqMan技术,结合PCR技术,以达到定量分析和监测某一特定序列DNA的目的,这种技术比以往的技术有很大的优势,更易于完成。
TaqMan荧光定量PCR的基本原理比较简单,大致可以分为以下四步:
(1)样本处理:检测序列DNA及其作为模板的原始样品将在定量PCR试剂盒中经过一系列处理,得到模板文库。
(2)探针标记:样品处理完成后,将开发出一对对应该特殊序列的5'荧光探针—特殊碱基对相对应的序列和3'分子耦合(MolecularBeacon)。
探针内部具有双螺旋结构,当处于开放状态时,荧光物质才能折射发射自己特有的颜色荧光。
(3)反应物添加:在模板文库中添加进Taq DNA 聚合酶、核酸类型的合成引物,以及缓冲液,用水调节总体浓度。
(4)加热-冷却:完成上述步骤,将反应液放入定量PCR仪,按照一定的条件,经由一系列的加热、冷却过程,Taq DNA聚合酶将碱基对引物合成,产生复制模板文库。
同时在复制过程中,反应液中复制数量也不断增加,一旦达到一定温度,则表明文库复制到足够多,荧光探针能够在反应液中爆炸,产生光谱,得以直接测定检测序列DNA的定量。
此外,TaqMan荧光定量PCR技术能够检测DNA的扩增曲线,并由此提供准确的定量结果,同时也不受PCR技术的一些影响,更易于操作。
microRNA实时定量茎环RT-PCR的技术

microRNA的实时定量茎环RT-PCR技术摘要:已开发出一种新型的microRNA(miRNA)的定量方法,即利用茎环反转录,Taqman PCR 分析。
茎环RT引物在RT 效率和特异性方面比传统的更好。
TaqMan miRNA的检测是很具体的,可以检测成熟miRNA和区分相关的甚至低至一个核苷酸的miRNAs。
此外,他们不会受到基因组DNA污染的影响。
精确量化可以从低至25皮克的总RNA中提取大多数miRNA。
事实上,这种方法灵敏度高,特异性强和精密度高,允许无需核酸纯化,直接分析单个细胞。
如标准TaqMan基因表达分析,TaqMan miRNA的检测显示出了7个数量级的动态范围。
七个小鼠组织中五个miRNA定量显示,在每个细胞中,有低至10到超过30000个拷贝数。
这种方法可以确保快速,准确,灵敏miRNA表达谱,并能识别和监控特定组织或疾病的潜在生物标志物。
茎环RT-PCR可用于其他小RNA分子,如短干扰RNA(siRNAs)的量化。
此外,为更好的特异性和效率,茎环RT引物设计的概念可以应用在小分子RNA 克隆和多重检测。
引言:miRNA是自然发生的,高度保守的转录家庭,来源于较大的发夹前体。
miRNA是在动物和植物的基因组上发现的。
到目前为止,有1000个独特的转录产物,其中,在桑格中心miRNA的注册表中包括326人类miRNA。
miRNA是通过催化mRNA的分裂或抑制mRNA的翻译来调节基因表达。
他们被认为在细胞发育,分化和传导中发挥着重要作用。
具体职责包括调节细胞增殖和新陈代谢,发育时间,细胞死亡,造血,神经发育,人类肿瘤形成与DNA甲基化和染色质修饰。
虽然miRNA的相对丰富的转录产物类别,其表达水平在物种和组织之间相差很大。
低丰度的miRNA经常逃避检测技术,如克隆,Northern杂交和基因芯片分析。
这里,我们提出一种新型实时定量方法,能够准确灵敏地检测miRNA与其他小分子RNA。
EHP、SHIV 双重TaqMan 实时荧光定量PCR 检测方法的构建及应用

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:本研究根据GenBank 中已有的虾肝肠胞虫(EHP )和虾血细胞虹彩病毒(SHIV )基因的保守序列,设计特异的引物和探针。
建立了快速诊断EHP 和SHIV 的双重TaqMan 实时荧光定量PCR 检测方法,并对其特异性、敏感性和稳定性进行检测。
结果表明:该方法检测限可达10 copies/μL ,其敏感性是SYBR Green real-time PCR 的10倍,普通PCR 法的100倍;对白斑综合征病毒、传染性皮下及造血组织坏死病毒、高致病性副溶血弧菌,以及桃拉综合征病毒的检测结果均为阴性,表明无交叉反应,具有良好特异性;重复性试验结果表明,该方法Ct 值的变异系数小于4%,具有良好的稳定性。
对37份已知检测结果的样品进行检测,结果符合率为100%。
本研究建立的EHP 和SHIV 检测方法具有快速、特异性强、灵敏度高等优点,适用于对虾隐性感染的早期监测。
关键词:虾肝肠胞虫;虾血细胞虹彩病毒;TaqMan 荧光定量PCR 中图分类号: S852.723文献标志码:A 文章编号:1674-6422(2022)01-0112-08Development of a Duplex TaqMan Real-time PCR Assay for Detection of EnterocyTozoon Hepatopenaei and Shrimp Hemocyte IridovirusHOUYuee 1, ZENG Junxia 1, LAN Jianyuan 1, XU Zaozhu 1, LIAO Xiuyun 2, LUO Baozheng 2(1. Zhuhai Kerric T esting T echnolongy Co. Ltd., Zhuhai 519000, China; 2. Gongbei Customs district technology center, Zhuhai 519015, China)收稿日期:2019-09-04基金项目:珠海市公共技术服务平台产学研协同创新计划项目(IETP201901011)作者简介:侯月娥,女,硕士,主要从事畜禽和水产疾病及免疫防治通信作者:罗宝正,E-mail:*************EHP 、SHIV 双重TaqMan 实时荧光定量PCR检测方法的构建及应用侯月娥1,曾俊霞1,蓝间媛1,许枣珠1,廖秀云2,罗宝正2(1.珠海科艺普检测科技有限公司,珠海51900;2.拱北海关技术中心,珠海519015)2022,30(1): 112-119Abstract: In this study, specific probes and primers were designed according to Enterocy Tozoon Hepatopenaei (EHP) and Shrimp Hemocyte Iridovirus (SHIV) gene sequences in GenBank. A d uplex TaqMan-based real-time quantitative PCR assay was then developed by optimizing the reaction conditions. The results demonstrated that this PCR assay was more sensitive for EHP and SHIV with the detection limit of 1×10 copies/μL, which was 10-fold higher than SYBR Green real-time PCR and 100-fold higher than conventional PCR. Specifi city tests showed no cross reactions with White spot syndrome virus, Infectious hypodermal and hematopoietic necrosis virus, High pathogenicity ibrio parahaemolyticus and Taura syndrome virus. Repeatability tests demonstrated that the threshold cycle of the method gave a good stability with the coeffi cient of variations were less than 4%. Then 37 samples were tested by using a duplex TaqMan real-time PCR and conventional PCR and the results reached 100% agreement. In conclusion, the duplex TaqMan-based real-time quantitative PCR assay developed here were specifi c and sensitive for rapid detection of EHP and SHIV . Therefore, it could be suitable for early duplex TaqMan-based real-time quantitative PCR assay of latent infection of shrimp.Key words: Enterocy tozoon hepatopenaei; shrimp hemocyte iridovirus; TaqMan real-time PCR; detection· 113 ·侯月娥等:EHP、SHIV 双重TaqMan 实时荧光定量PCR 检测方法的构建及应用第30卷第1期虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是2009年于泰国养殖池塘生长迟缓的斑节对虾(Penaeus monodon)中发现的专门寄生于细胞内的原生生物[1-2]。
实时荧光定量PCR(RT-qPCR)完全手册

实时荧光定量PCR(RT-qPCR)完全手册所谓的实时荧光定量PCR就是通过对PCR 扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板定量及定性的分析。
RT-qPCR是由三个步骤组成 RT-qRCR影响分析可靠性关键点(Key porint)关键词:荧光实时实时荧光定量PCRRT-qPCRRT-PCR反转录定量PCRQRT-PCR方法简介所谓的实时荧光定量PCR就是通过对PCR 扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板定量及定性的分析。
在实时荧光定量PCR反应中,引入了一种荧光化学物质,随着PCR 反应的进行,PCR 反应产物不断累计,荧光信号强度也等比例增加。
每经过一个循环,收集一个荧光强度信号,这样我们就可以通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线。
RT-qPCR是由三个步骤组成:1.反转录:依赖反转录酶将RNA反转录成cDNDA;2. 扩增:用PCR的方法扩增cDNA;3.检测:实时检测和定量扩增的产物.RT-qRCR影响分析可靠性关键点(Key porint):1.分析结果依赖于模板的数量、质量以及合理的检测方法设计2.反转录反应的非标准化影响试验的稳定性3.数据分析应该高度客观,如果不合理的分析,从分析结果中会得到混淆的错误结果,因此通过对RT-qPCR的每一组分进行质量评价以达到最小化变异性,最大化可重复性,而且还需要沿用一个通用的数据分析的指南。
对基因表达分析的标准化的需要是与人类临床诊断分析相适应的。
存在的问题由于各个学术团体和科研机构使用不同的操作流程,必然导致大家使用不同定量的来源物以及数据分析:1.新鲜、冰冻、甲醛固定的样品2.整个组织样本,显微切割样本,单个细胞,组培细胞3.总RNA或者mRNA4.RNA反转录成cDNA的不同的引发策略5.不同的酶以及酶的不同组合6.变异系数、灵敏度7. 多类型的检测化学方法,反应的条件,热循环仪的分析以及汇报方式。
TaqMan实时荧光定量RT-PCR检测甲型肝炎减毒活疫苗病毒含量的研究

Ab s t r a c t : O b j e c t i v e T o e s t a b l i s h a s p e c i i f c T a q Ma n — b a s e d R e a l — t i m e R T — P C R a s s a y f o r t h e r a p i d d e t e c t i o n o f h e p a t i t i s A
配制 。
灵敏 、 特异 、 重复性好等优点 , 可应 用于 甲型肝 炎减 毒活疫 苗 生产 过程 中病 毒 含量 滴度 测定 及指 导疫 苗 成 品的 关键词 : 甲肝病毒 ; 实时荧光定量 R T — P C R; T a q Ma n 探针 中图分类号 : Q 9 3 9 . 4 文献标 志码 :A 文章编号 : 1 0 0 5— 5 6 7 3 ( 2 0 1 3 ) 0 5— 0 0 1 4— 0 4
・
1 4・
微生物学免疫学进展
2 0 1 3年 l O月第 4 1 卷第 5期
ห้องสมุดไป่ตู้
P r o g i n Mi c r o b i o l I mm u n o l , O c t 2 0 1 3 ,V o 1 . 4 1 N o . 5
.
U 菩 } .
T a q M a n实 时荧 光 定 量 R T — P C R检 测 甲型肝 炎 减 毒 活疫 苗 病 毒 含 量 的研 究
猪捷申病毒TaqMan实时荧光定量RT-PCR检测方法的建立和初步应用

Chinese Journai of Veterinaa Medicine中国兽医杂志2020年(第56卷)第11期37猪捷申病毒TaqMan定量RT-PCR 检测方法的建立和初步应用秦毅斌1,苏乾莲1,赵硕2,卢冰霞1,何颖1,周展宏1,2,李斌1,1,2,赵武1(1.兽医研究所广西兽医生物重验室,530001;2.广西大学动物科学技术学院,广西南宁530005)摘要:为建立猪捷申病毒(PTV)的TaqMan实时荧光定量RT-CR(RT-qPCR)检测方法,在PTV基因组序列保守区设计引物和TaqMan,重组为阳性标准品,通过优化反应,了PTV的RT-qPCR方法,并进行特异性、感性和重复性试验。
结果表明,该方法仅对PTV出现特异性扩增反应,与猪流行性腹泻、猪状、猪传染性胃肠炎病毒、A群猪轮状病毒等常见猪病毒均无交叉反应。
该方法的标准曲线Ct值与4.6x108~4.6x102拷贝/$L的质粒浓度范围具有良好线性关系,标准曲线方程为C=-3.201xlog?+40.527,线性相关系数(*)为0.996,检测下为4.6x 101拷贝多L对不同浓度的pMD18-PTV进行组内与组间重复检测,每个浓度重复试验的C值的变异系数均小于4.0%,好的重现性。
应所的方法对235份临床猪腹泻进行,PTV阳性32份,性为13.62%$本试验的RT-qPCR方法为PTV实验及研究分析提供了可靠的$关键词:猪捷申病毒;荧光定量RT-PCR;TaqMan探针中图分类号:S852.65T文献标志码:A文章编号:0529-6005(2020)11—0037—06Development and Preliminary Application of a Real-time TaqMan Fluorescent Quantitative RTPCR Assay for Detection of Porcine TeschovirucQU Yi-bin1,SU Qian-lian1,ZHAO Shuv2,LU Bing-xia1,HE Ying1,ZHOU Zhan-hong1,YUAN Ting-ting2,LI Bin1,DUAN Qun-peng1,OUYANG Kang2,ZHAO Wu1(1.Guangpi Veterinaa Research N s/NN,Guangxi Key Laboatoa of Veterinary Biotechnology,Nanning530001,China;2.Colleae of Anival Science and Technolog,Guangxi Universith,Nanning530005,China)Abstract:To establish a real-time TaqMan fuorescent quantitative RT-PCR(RT-qPCR)assay for the detection of porcine te-schovRus(PTV),p/mem and TaqMan fluorescent probe were desianed according tr the conserved reaion of PTV genome sequence.A recombinant plasmid was constructed as the positive standard sample,and RT-qPCR was developed by optimization of reacting conditions./urthermoro,the specificity,sensitivity and repeatabilith of the established RT-qPCR were tested.Results showed that there was no cross-reaction with conventionai porcine viruses,such as porcine epidemic diarrhea virus,porcine tansmissible gastroenteritis,porcine deeacoanavRus,porcine rotavirus group A,and et ai.The assay was lineas for the template plasmin pMD18-TTV in the range from4.6x108copies/$L te4.6x102copies/$L,the standard equation was C=-3.201x log?+40.527,coeelation coefficient was*=0.996,and detection limit was low te4.6x101copies/$L.Also,the assay showed the good reproducibility with the coefficient of variation(CV)less than4%both in intra-5ssay and inter-5ssay.ThRty-two of the235clinicai fecai samples collected from dVferent areas in Guangi were positive for PTV tested by the developed assay.In conclusion,the development of this assay provides a convenient,specific and sensitive diagnostic method for the PTV detection and epidemiologicai investigation.Key words:porcine teschovRus;real-Cme TaqMan Iuorescent quantitative PCR;TaqMan Iuorescenco probeCorressonding author:ZHAO Wu,E-maii:zhaowul68866@收稿日期:2020—05—10基金项目:广西创新驱动发展专项资金项目(桂科AA17204057);广西基本科研业务费专项(桂科专项202/19-2);广西自然科学基金项目(2017GXNSFBA198092);广西兽医生物技术重点实雌开放基金课题(16A?0A5氨A/17A59A6氨A);广西柳州市科技计划(2018BH20501)作者简介:秦毅斌(1983-),男,高级兽医师,硕士,研究方向为动物传染病病原与分子生物学,E-mel:qmymm51??@163•com通讯作者:赵武,E-maii:zhaowu168866@163-com38中国兽医杂志2020年(第56卷)第11期Chinese Journai of Veterinao Medicine猪捷申病(Porcina teschen disease,PTD),又称塔尔凡病或脑脊髓炎,是由猪捷申病毒(Porcine tv-schovirus,PTV)感染引起的一种猪病毒性传染病$该病首次于1929年在捷克斯洛伐克的捷申地区发现,故命名为“捷申病”,随后传播至北美%非洲、澳大利亚和日本等国家,目前已散布于世界各养猪国家(1猪群感染PTV后,主要表现为腹泻、脑脊髓灰质炎⑵、肺炎、心包炎、心肌炎、皮肤损坏等症状,母猪还可导致繁殖障碍[3],感染发病猪具有较高的病死率,给养猪业带来了较大经济损失$PTV属于小RNA病毒科(PRomavibdae)捷申病毒属(Teschovirus)成员,病毒粒子呈球形,外层包裹衣壳,无脂蛋白,病毒基因组为单股正链RNA,长约7.2kb,仅含有1个完整的编码1个多聚蛋白的开放阅读框!0RF),该多聚蛋白被蛋白水解酶裂解为非结构蛋白2A、2B、2C、3A、3B、3C、3D和结构蛋白L、VP1、VP2、VP3%VP4(45)$PTV至少有11个血清型[6],并且还不断出现新的血清型PTV12(7)、PTV13[8]$研究表明,我国猪群PTV感染较为普遍。
实时荧光定量PCR具体实验步骤

实时荧光定量PCR具体实验步骤1.提取样本RNA/DNA:首先,从研究对象中提取出所需的RNA或DNA样本。
可以使用商业化的提取试剂盒来完成这一步骤。
2. 反转录酶链反应(RT):如果提取的样本为RNA,则需要先进行反转录酶链反应,将RNA转录成cDNA(即DNA拷贝),反转录酶具有多样性(M-MLV逆转录酶)和过程性(RTase)。
3.准备PCR反应体系:根据实验所需的扩增模板和引物,将PCR反应体系按照厂家提供的信息制备,通常需要包括PCR反应缓冲液、dNTPs、引物、酶、模板DNA/cDNA和稀释水。
4. 调整荧光探针的浓度:如果实验中使用到了荧光探针(如TaqMan探针、MGB探针等),需要根据实验要求对荧光探针的浓度进行调整。
5.放置PCR板:将所需的PCR试管或板放置在适当的位置,以便加载反应体系。
6.反应体系加载:按照实验所需的样品数量和模板浓度,依次向PCR反应管或板中加入反应体系。
注意,需要设置相应的阳性对照和阴性对照。
7.封闭PCR反应管/板:闭合PCR反应管或板,以防止反应体系的挥发和样品的交叉污染。
8.准备PCR仪:根据PCR仪的要求,调整PCR仪的温度和时间参数。
9.PCR扩增:将已封闭的PCR反应管或板放置在预热的PCR仪中,开始PCR扩增。
根据实验需要,设置不同的PCR程序(如热启动PCR、两步PCR和三步PCR等)。
10. 实时监测PCR过程:在PCR反应过程中,实时监测PCR反应管或板中产生的荧光信号,并记录下每个周期(cycle)的荧光值。
11. 数据分析:根据荧光信号的变化,结合标准曲线法或相对表达量法,对PCR反应中目标序列的数量进行定量分析。
常见的分析软件包括Stratagene MxPro QPCR软件和Applied Biosystems SDS软件等。
12.结果分析和解释:根据数据分析的结果,对实验结果进行解释和讨论,并在图表中呈现。
13. 结果验证:可以使用其他方法验证RT-qPCR的结果,如Western blotting、细胞免疫化学分析等。
流感病毒RNA荧光RT-PCR检测技术

流感病毒RNA荧光RT-PCR检测技术实时荧光定量PCR是在常规PCR基础上发展起来的定量PCR技术,通过在PCR反应体系中加入荧光基团,利用荧光信号累积,实时监测整个PCR进程,最后根据ct值和标准曲线,对未知模版进行定量分析。
常用的实时荧光定量PCR又分为非特异性荧光标记的SYBR Green 法和特异性荧光标记的TaqMan法和分子信标法。
一、实时荧光定量PCR原理:1、SYBR Green法:SYBR Green是一种双链DNA结合染料,游离状态下不发光,非特意地掺入到双链DNA中后发出荧光信号,其强度与双链DNA的数量相关,随着扩增产物量的增加,检测到的荧光信号增强。
2、TaqMan法:在扩增反应液中,加入一特异性探针,该探针5‘端和3’端分别标记一个荧光报告基团和一个荧光淬灭基团,探针完整时,两基团位置靠近,5‘端报告基团的荧光能量被3’端淬灭基团吸收,此时检测不到荧光信号,在扩增过程中,探针与模板结合形成Taq 酶的5‘→3’外切活性底物,当Taq酶沿模板向前延伸到探针结合处时,发生链的置换,Taq酶的5’→3’外切活切将探针5‘端连接的报告基团从探针上切割下来,5’端报告基团的荧光能量脱离3’端荧光淬灭基团的吸收,可检测到荧光信号,每经过一个PCR循环,荧光信号也和扩增产物一样,有一个同步增长的过程。
3、分子信标法:探针设计成茎环结构的发夹状,环部核苷酸序列与扩增产物序列互补,两端核苷酸序列互补形成茎部,且一端标记有报告基团,另一端标记有淬灭基团,探针未与模板结合时,报告基团和淬灭基团空间位置靠近,报告基团的荧光能量被淬灭基团吸收,此时,检测不到荧光信号,与模板结合后,探针的构象由发夹状改变为链状,报告基团和淬灭基团分离,可检测到荧光信号。
核酸检测是一种鉴定流感病毒基因组的有力方法,即使基因组含量很低或死病毒也可以检测到。
本章将介绍检测流感病毒的聚合酶链式反应(PCR)。
流感病毒的基因组是负链RNA,在进行PCR扩增前必须合成与病毒RNA 互补的DNA,即为cDNA。
实时荧光定量PCR
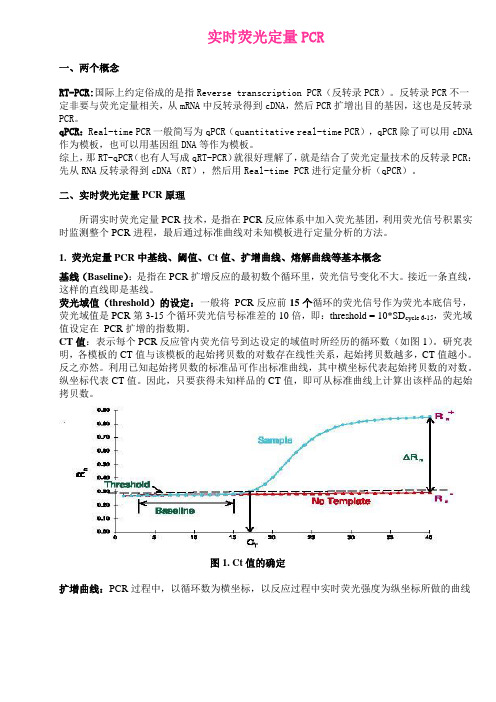
实时荧光定量PCR一、两个概念RT-PCR:国际上约定俗成的是指Reverse transcription PCR(反转录PCR)。
反转录PCR不一定非要与荧光定量相关,从mRNA中反转录得到cDNA,然后PCR扩增出目的基因,这也是反转录PCR。
qPCR:Real-time PCR一般简写为qPCR(quantitative real-time PCR),qPCR除了可以用cDNA 作为模板,也可以用基因组DNA等作为模板。
综上,那RT-qPCR(也有人写成qRT-PCR)就很好理解了,就是结合了荧光定量技术的反转录PCR:先从RNA反转录得到cDNA(RT),然后用Real-time PCR进行定量分析(qPCR)。
二、实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
1. 荧光定量PCR中基线、阈值、Ct值、扩增曲线、熔解曲线等基本概念基线(Baseline):是指在PCR扩增反应的最初数个循环里,荧光信号变化不大。
接近一条直线,这样的直线即是基线。
荧光域值(threshold)的设定:一般将PCR反应前15个循环的荧光信号作为荧光本底信号,荧光域值是PCR第3-15个循环荧光信号标准差的10倍,即:threshold = 10*SD cycle 6-15,荧光域值设定在PCR扩增的指数期。
CT值:表示每个PCR反应管内荧光信号到达设定的域值时所经历的循环数(如图1)。
研究表明,各模板的CT值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,CT值越小。
反之亦然。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数。
纵坐标代表CT值。
因此,只要获得未知样品的CT值,即可从标准曲线上计算出该样品的起始拷贝数。
图1. Ct值的确定扩增曲线:PCR过程中,以循环数为横坐标,以反应过程中实时荧光强度为纵坐标所做的曲线判断扩增曲线是否良好的指标主要有几个方面:①曲线拐点清楚,特别是低浓度样本指数期明显,扩增曲线整体平行性好,基线平而无上扬现象,低浓度样本扩增曲线指数期明显。
实时荧光定量PCR技术的两种方法原理简述

实时荧光定量PCR技术的两种方法原理简述依据所使用的技术不同,实时荧光定量PCR可以分为:荧光探针和荧光染料两种方法。
现将其原理简述如下:1. TaqMan荧光探针TaqMan探针法是高度特异的定量PCR技术,其核心是利用Taq酶的3'5'外切核酸酶活性,切断探针,产生荧光信号。
PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸取;PCR扩增时,Taq酶的3'5'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分别,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成wan全同步。
而新型TaqMan—MGB探针使该技术既可进行基因定量分析,又可分析基因突变(SNP),有望成为基因诊断和个体化用药分析的shou选技术平台2. SYBR荧光染料在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料非特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的加添与PCR 产物的加添wan全同步。
SYBR仅与双链DNA进行结合,因此可以通过溶解曲线,确定PCR反应是否特异。
SYBR荧光染料法定量PCR的基本过程是:① 开始反应,当SYBR染料与DNA双链结合时发出荧光;② DNA变性时,SYBR染料释放出来,荧光急剧削减;③ 在聚合延长过程中,引物退火并形成PCR引物;④ 聚合完成后,SYBR染料与双链产物结合,定量PCR系统检测到荧光的净增量加大。
实时荧光定量PCR技术依据化学原理可以分为探针类和非探针类。
探针类实时荧光定量 PCR 技术紧要是利用与靶序列特异杂交的探针来指示扩增产物的加添;非探针类实时荧光定量 PCR 技术紧要通过荧光染料来指示产物的加添。
RT-qPCR(实时荧光定量PCR)

• 2、Molecular Beacon 分子信标。标记荧光的发夹
探针,环与目标序列互补,茎由互补配对序列组成 。变性过程:产生非特异性荧光;延伸过程:不产 生荧光;退火过程:产生特异性荧光,检测荧光信 号。
• 3、Amplisensor 双链信号引物,进行半巢式扩增
;随着PCR循环的重复进行,信号引物的双链结构 被破坏,其中一条链参与到产物的合成中,荧光消 失,产物量与荧光成反比。
4. 反应Buffer体系的优化
5. 反应温度和时间参数:由酶和引物决定
6. 其他与常规PCR相同
优 点
对DNA模板没有选择性 ----适用于任何DNA 使用方便 -----不必设计复杂探针 非常灵敏 便宜
缺 点
容易与非特异性双链DNA结合,产 生假阳性,但可以通过融解曲线的分
1
RT-qPCR 原理----绝对定量
R2为相关系数:R2>0.99时,认为 两数值之间相关性好。 E为扩增效率:一般认为在90%110%之间数据可用。 Logo
1
2.相对定量
RT-qPCR 原理----相对定量
病人内参 基因 Ct a
病人目的 基因 b
对照内参 基因 c
对Байду номын сангаас目的 基因 d
������−∆∆������������ = ������−(∆������������������−∆������������������) = ������−[
������−������ −(������−������)]
结果表示病人的目的基因的表达是对照组目的基因表达的多少倍。
Logo
RT-qPCR 原理----融解曲线
荧光强度
呼吸道合胞病毒TaqMan探针实时定量RT-PCR检测方法的建立及应用

[ b ta t 0bet e o d vl p c c a i,sniv T q n b sd e -ie q a tai P R asy A s c] r jci :T ee p a sei ,rpd e sie aMa ae ra t uni t e C sa v o i f t l m tv
c n e l b l d p o e e e d sg e a c r i g o t e o s r ai e e e e u n e f R V.Ab o u e i l o y wa e c - a e e r b w r e i n d c o d n t h c n e v t g n s q e c o S v s l t vr c p s a
京 10 5 002
[ 要 】 目的 : 立 呼 吸道 合胞 病 毒 ( S 核 酸 特 异 、 速 、 感 的 T q a 针 实 时 荧 光定 量 P R检 测 方 法 , 摘 建 R V) 快 敏 a M n探 C 并对 临 床 样本进行检 测。方法 : 比对 编 码 R V非 编 码 蛋 白的 基 因序 列 , 取 其保 守 片 段 设 计 引 物 和 探 针 , 立 实 时荧 光 定 S 选 建
应 , 具 有 良好 的特 异 性 和 重 复 性 。 从 1 9 临 床 呼 吸道 标 本 中检 出 R V 阳 性 4 例 , 于 普 通 P R方 法 ( 119 。 且 6份 S 0 高 C 3/6 )
rt pcr原理

Real-time PCR(实时荧光定量PCR)原理解析1. 什么是PCR?PCR(Polymerase Chain Reaction,聚合酶链反应)是一种在体外扩增DNA片段的技术。
PCR的发明者是美国生物化学家基里尔·米隆尼斯(Kary Mullis),于1983年提出了这一方法。
PCR通过不断重复三个步骤来扩增目标DNA片段:变性(Denaturation)、退火(Annealing)和延伸(Elongation)。
这些步骤在PCR仪中由多个温度循环来控制,因此PCR也被称为“温度循环扩增”。
PCR技术为科学家提供了一种快速、敏感、特异性极高的扩增目标DNA的方法。
然而,传统的PCR只能在反应结束后进行结果的检测,无法实时监测反应的过程。
为了解决这个问题,Real-time PCR技术应运而生。
2. 实时PCR概述实时PCR是在PCR扩增过程中,使用荧光信号实时监测反应的进行。
与传统PCR相比,实时PCR能够提供实时的、连续的照片剖析PCR的进展。
实时PCR有两种常用的检测方法:荧光染料法和探针法。
其中,探针法又分为TaqMan探针法和Molecular Beacon探针法。
这些探针和染料能够与PCR反应中的产物结合,并产生荧光信号,根据信号的增长情况可以推断目标DNA的含量。
实时PCR广泛应用于分子生物学、医学诊断、检测病原体等领域。
接下来,我们将重点介绍实时PCR的基本原理以及常用的探针法和荧光染料法。
3. 实时PCR基本原理实时PCR的基本原理和传统PCR类似,也是通过变性、退火和延伸三个步骤来扩增DNA片段。
然而,在实时PCR中,PCR反应是在热循环PCR仪中进行,并且扩增过程中的结果可以实时检测。
实时PCR一般需要使用一种独特的仪器,称为实时荧光PCR仪或荧光定量PCR仪。
这种仪器能够在不破坏试管密封的情况下,通过荧光信号实时检测PCR反应体系中的增长程度。
在实时PCR中,荧光信号通过专门的探测器(Detector)收集,并且荧光信号的强度会随着PCR反应进行的次数递增。
RT-PCR与realtime pcr

Real-time PCR中文译作“实时聚合酶链反应”,是一种最新发展的定量PCR技术。
该技术借助于荧光信号来检测PCR产物,一方面提高了灵敏度,另一方面还可以做到PCR每循环一次就收集一个数据,建立实时扩增曲线,准确地确定CT值,从而根据CT值确定起始DNA拷贝数,做到了真正意义上的DNA定量,较以往常用的终点定量的方法更加准确。
根据所使用的技术不同,荧光定量PCR 又可以分为TaqMan探针和SYBR Green I荧光染料两种方法。
Real-time PCR 所采用的专用PCR仪能够自动在每个循环的特定阶段对反应体系的荧光强度进行检测,实时的记录荧光强度的改变,从而对样品的浓度进行精确的定量。
RT-PCR是Reverse transcription PCR的简称,中文译作“逆转录聚合酶链反应”,是将RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术。
首先经反转录酶的作用从RNA合成cDNA,再以cDNA为模板,扩增合成目的片段。
RT-PCR技术灵敏而且用途广泛,可用于检测细胞中基因表达水平,细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列。
作为模板的RNA可以是总RNA、mRNA或体外转录的RNA产物。
无论使用何种RNA,关键是确保RNA中无RNA酶和基因组DNA的污染。
用于反转录的引物可视实验的具体情况选择随机引物、Oligo dT及基因特异性引物中的一种。
对于短的不具有发卡结构的真核细胞mRNA,三种都可。
Real time RT-PCR是将Real time-PCR的方法用于RT-PCR中,目的也是为了对样品浓度进行精确控制。
RT-PCR和Real time-PCR是没有必然联系的,两种技术可以一起使用,就是Real time RT-PCR;也可以单独使用。
就是名称有点绕,逆转录PCR先出现,所以占用了RT-PCR这个简写,等Real time-PCR技术出现后,本来按照惯例,简写也是RT-PCR,但为了与逆转录PCR相区别,还是写成Real time-PCR。
实时荧光定量PCR-TaqMan探针法及设计原则

03
Taqman探针的合成与制备
探针的合成方法
化学合成法
通过化学反应将荧光基团和淬灭基团分别连接到DNA或RNA的5'和3'末端,形成 Taqman探针。
酶促合成法
利用DNA聚合酶将荧光基团和淬灭基团分别添加到DNA或RNA的特定位置,形成 Taqman探针。
探针的质量检测与纯化
质量检测
通过电泳、质谱和光谱分析等方法检测探针 的长度、荧光基团和淬灭基团的数量和位置 ,以及探针的纯度。
定义与原理
定义
实时荧光定量PCR-Taqman探针法是 一种基于荧光信号的实时监测技术, 用于定量分析DNA或RNA的拷贝数。
原理
通过在Taq酶催化下,利用荧光染料 标记的特异性探针与待测核酸进行特 异性结合,在PCR循环过程中实时监 测荧光信号的增强,从而实现对核酸 的定量分析。
发展历程与现状
02
Taqman探针的设计原则
探针的长度与结构
长度
通常为20-30bp,确保特异性并减少非特异性扩增。
结构
由报告基团、淬灭基团和连接臂组成,连接臂长度一般为5-6个脱氧核糖核苷酸。
探针的特异性
针对目标序列
确保探针与目标序列完全匹配,避免 交叉反应。
序列选择
选择基因特异性区域,避免基因组中 的高变区。
04
Taqman探针在实时荧光定量 PCR中的应用
样本处理与PCR反应体系建立
样本处理
确保样本质量,去除杂质和抑制剂,提 取高质量的DNA或RNA。
Taqman探针设计
根据目标基因序列设计Taqman探针, 确保探针的特异性和荧光信号的稳定
性。
引物设计
根据目标基因序列设计特异性引物, 确保引物与模板的结合效率和特异性。
实时荧光定量PCR(qPCR,RT-PCR)的原理及应用

病原体检测 转基因食品检测 基因表达研究 •相对定量(Relative Quantification,RQ) 基因在不同组织中的表达差异 药物疗效考核 耐药性研究
RT-PCR技术的数据分析 相对定量通过内标定量
内标(Endogenous Control) 通常是18S、28S、β-actin、GAPDH基因等看家基因
2、用试验样本的ΔCT值减校准样本的ΔCT值:
ΔΔCT= ΔCT(test/control) - ΔCT(calibrator)
3、计算表达水平比率: 相对表达量RQ= 2 –ΔΔCT
RT-PCR技术的数据分析
SYBR Green 熔解曲线分析
RT-PCR技术的应用
• 临床疾病诊断:各型肝炎、艾滋病、禽流感等传染病诊断 和疗效评价;肿瘤标志物及瘤基因检测实现肿瘤病诊断; 遗传基因检测实现遗传病诊断。 • 动物疾病检测:禽流感、猪瘟、沙门菌、大肠埃希菌、胸 膜肺炎放线杆菌、寄生虫病等。 • 食品安全:食源微生物、食品过敏源、转基因、乳品企业 阪崎肠杆菌等检测。 • 科学研究:医学、农牧、生物相关分子生物学定量研究。 • 应用行业:各级各类医疗机构、大学及研究所、检验检疫 局、兽医站、食品企业及乳品厂等。
RT-PCR技术的数据分析
扣 除 背 景 荧 光 后 的 相 对 荧 光 量
如何定量?-ΔΔCt
PCR扩增循环数
3. Ct值与起始模板的关系 研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存 在线性关系,起始拷贝数越多,Ct值越小。利用已知起始拷贝 数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对 数,纵坐标代Ct值。因此,只要获得未知样品的Ct值,即可从 标准曲线上计算出该样品的起始拷贝数。
taqman探针实时荧光定量rt-pcr法检测siv2fshiv病毒rna拷贝数方法的建立及..

第三节结果1.TaqMan探针real.timeRT-PCR方法及SYBRGreenIreal.timeRT-PCR方法测定定量曲线各个稀释度RS标准品在第一个循环结束后测到一个基础吸光值,图1-a中一直到第15个循环结束时都没有明显变化,从第15个循环开始lX107copies/pLRS标准品的吸光值增大,定量曲线开始抬头,18个循环(Ct值)后,曲线迅速上扬,至第28个循环前后达到峰值,随后进入平台期,一直到反应结束,此后的标准品的Ct值依次延迟约3个循环,但除10个拷贝Rs标准品外,各扩增曲线的斜率相同,间距相等,相互平行,阴性对照PCR级水的扩增曲线稍有起伏。
而图l-b中从第11个循环开始lX107copies/pLRS标准品的吸光值增大,15个循环后,曲线迅速上扬,至第30个循环前后达到峰值,随后同样进入平台期,至反应结束,102和10个拷贝RS标准品几乎同时在33个循环左右出现曲线,但斜率不同,阴性对照PCR级水也出现了扩增曲线,但吸光值不高(见图1)。
图1-aTaqMan探针real—timeRT-PCR测得10倍系列稀释RNA标准品的荧光定量曲线。
由左至右分别是1×107copies/I_tL、l×106copies/pL、1×l05copies//aL、l×104eopies/I.tL、1×103copies/I.tL、l×102copies/pL、1×101copies/BL,最下面一条线是PCR级水做的阴性对照。
横坐标显示的是循环数,纵坐标是荧光值。
Fig.1-aAmplificationcurveobtainedwith10一foldserialdilutionsoftheRNAstandards(RS)byreal-timeRT-PCRmethodwithTaqManprobe.Fromlefttorightarestandardsfroml×107copies/lJLto1×101copies/lxL.Asanegativecontr01.thetemplateRNAwasreplacedwithPCR-gradewater.Thex-axisshowsthenumberofPCRcyclesandthey-axisshowsthenormalizedfluorescenceintensity.b图1.bSYBRGreenIreal—timeRT-PCR测得10倍系列稀释RNA标准品的荧光定量曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
TaqMan实时荧光定量RT-PCR检测ERCC1变异剪接体检测平台的建立前言对一个基因的各个变异剪接体分别进行精确定检测是深入研究变异剪接的基础。
在TaqMan实时荧光定量RT-PCR技术( TaqMan real-time quantity RT-PCR)出现前,传统的检测方法有4种[1, 2]:(1)Northern blot; (2)核酶保护分析;(3)相对定量RT-PCR,(4)竞争定量RT-PCR这些方法都有其内在的局限性。
Northern blot耗时,随时面临RNA降解的困扰,而且灵敏度不高,需要相对大量的RNA 才能检测出来,仅仅适合相对定量分析[3]。
核酶保护分析比Northern blot相对灵敏,但是仍然耗时而且需要相对大量的RNA才方便检测[4-8]。
相对定量RT-PCR 则需要在每个反应的指数扩增期停止反应后进行凝胶电泳分析,由于每个样本的起始拷贝数不一致,很难确保每个样本均处于相同的指数扩增期。
而且此方法需要将PCR产物进行琼脂糖或聚丙烯酰胺凝胶电泳分析,增加了步骤,而且增加了污染的可能性[9]。
竞争定量RT-PCR则需要根据不同的目的基因片断构建相应的竞争子,然后需要确定每个反应体系中竞争子和目的基因的不同比例,不仅仅耗时而且繁琐,更重要的是竞争子的构建不仅仅需要很大的技巧性,而是是一件极其艰难的工作[10, 11]。
这些传统技术不仅繁琐耗时,而且对mRNA的质量要求较高,结果不稳定。
而且,这些传统的方法由于方法学上的差异性,导致研究结果不十分可靠,各研究机构之间的结果差异较大。
应用TaqMan实时荧光定量RT-PCR技术则可以分别精确检测各个变异剪接体的表达量,结果稳定,可重复性高,方便快捷,程序简单,无需后续处理,几无污染[1, 12-14]。
本研究拟建立对切除修复交叉互补基因1即ERCC1(excision repair cross-complementation group 1)变异剪接体的TaqMan实时荧光定量RT-PCR检测平台,为深入研究ERCC1的变异剪接奠定基础[15]。
TaqMan实时荧光定量RT-PCR技术的基本原理是通过设计与目的序列互补的一段寡核苷酸作为TaqMan探针,在此探针的5’端标记报告基团(如FAM),在3’端标记淬灭基团(如TAMRA)。
当探针完整时,报告基团所发射的荧光通过荧光共振能量传递(FRET)被淬灭基团所吸收,从而不能检测到其荧光。
Taq 酶则具有5’外切酶活性,在PCR的延伸阶段,可以从探针的5’端将报告基团水解掉,并将整个探针完全水解,使得报告基团和淬灭基团的原有空间结构被打散,荧光共振能量传递不复存在,从而可以探测到反应体系中报告基团所发射的荧光。
随着PCR循环的增加,荧光也不断的累加,从而反映产物的生成情况[16-18]。
在研究变异剪接时,只需要将TaqMan探针设计在发生了变异剪接的外显子的前后邻近两个外显子处,即跨在前一个外显子的末端和后一个外显子的前端,便可检测到目的变异剪接体的表达量。
在不同的探针上标记不同的荧光物质,便可以在同一个反应体系中同时检测各个变异剪接体的表达量[12, 19-21]。
变异剪接(alternative splicing)是真核生物中广泛存在的一个现象[22-27],可以调节基因的表达水平[28],增加蛋白质的多样性[29, 30],并对肿瘤的生物学行为有很大的影响[22, 27, 31-34],和肺癌[13]、乳腺癌[35-37]、卵巢癌等的发生发展存在一定的关系。
ERCC1是核酸切除修复系统NER(nucleotide excision repair)的一个关键基因,在以铂类为基础的化疗中扮演着重要角色。
铂类药物通过与细胞DNA形成加合物(Pt-DNA adducts)从而杀伤肿瘤细胞,NER则可以通过切除加合物并修复被损伤的DNA,从而降低化疗的效果。
研究表明ERCC1的mRNA表达量与肿瘤患者的化疗敏感性和生存时间具有一定的相关性[38]。
ERCC1基因共10个外显子,细胞中存在不同比例的两种形式的剪接体,为含10个外显子的全长剪接体mRNA (full length, FL),和缺失第VIII外显子(长72bp),仅含9个外显子的变异剪接体mRNA( alternative splicing, AS)[39-41]。
1 ERCC1基因结构特征分析(文章写作不规范,[ERCC1基因结构特征分析]一节是属于材料方法,还是前言部分?我认为这部分ERCC1在GenBank的背景,可以放在综述里)根据GenBank数据库提供的信息,ERCC1基因ID为GeneID: 2067,位于19号染色体长臂,处于19q13.2-q13.3位置。
ERCC1在染色体的位置:chromosome: 19; Location: 19q13.2-q13.3Official Symbol ERCC1 and Name: excision repair cross-complementing rodent repair deficiency, complementation group 1 (includes overlapping antisense sequence) [Homo sapiens]Other Aliases: COFS4, UV20Other Designations: excision repair cross-complementing 1; excision repair protein Chromosome: 19; Location: 19q13.2-q13.3Annotation: Chromosome 19, NC_000019.8 (50604712..50619017, complement) MIM: 126380GeneID: 2067ERCC1是研究比较多的基因,ERCC1在染色体的位置图可以在文章中不列出,而且ERCC1基因的染色体位置,与其外显子剪切无关。
基因组全长14306 bp,转录为含有10个外显子的mRNA全长为1101bp,编码氨基酸的mRNA序列从147开始至1040结束,共计894bp是编码氨基酸的序列,以ATG作为起始密码子,以TGA作为终止密码子(任何一个蛋白质都是与ATG 为起始密码子,以TGA作为终止密码子,这句多余)。
产物ERCC1蛋白含297个氨基酸。
编码核酸序列占基因组核酸的6.25%。
每个外显子的长度在100bp左右,最长外显子是第III外显子,长216bp,最短外显子是第IX外显子,长69bp,平均外显子长度是110bp。
ERCC1基因内含子与外显子的序列Exons and Intron of ERCC1 Gene成熟的全长ERCC1 mRNA含有10个外显子,全长1101bp,从1至146bp是3’非编码区3’UTR (3’ untranslated region),从1041到1101是5’非编码区5’UTR (5’untranslated region)The structure of ERCC1 mRNA使用BLAST在人基因组和转录子库里面比对ERCC1的mRNA序列,可以发现ERCC1的mRNA序列是非常特异的。
(在人基因组和转录子库里比对,应用的是贪婪比对法则,而且只与人的基因组比对,当然只有ERCC1可比对,这些与外显子检测无关,可删除)ERCC1基因的BLASTA同源性比对Homology of ERCC1 gene using BLASTA software(删除)第八外显子72bp序列GTGACTGAATGTCTGACCACCGTGAAGTCAGTCAACAAAACGGACAGTCA GACCCTCCTGACCACATTTGGA2. ERCC1全长及缺失第VIII外显子变异剪接体TA质粒的构建(这一节属方法部份,放到方法里)试验流程如下:TRIZol 提取RNA PCR 产物克隆至pMD18-T 载体Oligo (dT)18逆转录cDNA转化入感受态大肠埃希氏菌并筛选扩增TaqMan 实时荧光定量PCR 新鲜卵巢癌组织PCR 扩增ERCC1的CDS 序列,beta-actin目的片断抽提质粒,稀释成不同浓度作为标准品2.1 材料与试剂2.1.1 标本标本组织来源来自正常卵巢组织(标本来源单位,时间,何种病人,正常人是不可能被切卵巢的),标本切下后迅速置于液氮中保存直至提取RNA 时取出。
质粒与菌株大肠埃希菌(DH-5à) Escherichia Coli ,E.Coli 为本实验室保存留种。
pMD18-T TA 克隆质粒够自日本Takara 公司[42, 43]。
其结构如下:pMD18-T质粒结构和酶切位点示意图The structure and enzyme site of pMD18-T Vector2.1.2 主要仪器超速低温离心机德国西门子公司(本实验室没有该品牌)TGL-16C台式高速离心机上海安亭科学仪器厂Gel doc 2000凝胶成像分析系统美国Bio-Rad公司(本实验室没有该品牌)紫外可见分光光度计北京普析通用仪器有限责任公司PCR扩增仪美国热电公司Thermo electron corporation电动玻璃匀浆机宁波玻璃仪器厂OLYMPUS光学显微镜日本OLYMPUS公司恒温水浴箱国产冰浴加样盒国产桥式水平电泳仪槽北京崇文东方仪器厂DYY-型稳压稳流电泳仪北京六一仪器厂Eppendorf管国产微量移液器美国Gilson公司超低温冰箱中国海尔公司荧光定量PCR管0.2ml--------------薄壁美国Cepheid 公司Smartcycler ???/ 2.1.3试剂(1) TRizol 试剂购自Invitrogen公司(2)First Strand cDNA Synthesis Kit 逆转录试剂盒购自MBI Fermentas 公司,内含:M-Mulv 反转录酶Oligo(dT)18 (0.5μg/μl)高浓度dNTP 10mM dNTPRNA酶抑制剂Rnasin inhibitor5×reaction buffer(3) Taq PCR Master Mix 购自TIANGEN生物有限公司(4)DNA片段纯化回收试剂盒购自日本宝生物TaKaRa公司(5)氨苄青霉素贮存液(100μg/ml) -20℃保存备用(6)LB培养基:NaCl 10g; Yeast extract 5g; Tryptone 10g; 加蒸馏水溶解,用5M NaOH调至7.0,定容至1000ml,高压灭菌消毒20min。
