氨基末端脑钠肽前体测定试剂盒(荧光免疫法)产品技术要求yuepu
氨基末端脑利钠肽前体测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求华大吉比爱

氨基末端脑利钠肽前体测定试剂盒(磁微粒化学发光免疫分析法)
适用范围:用于体外定量测定人血清、血浆或全血中氨基末端脑利钠肽前体(NT-proBNP)的含量。
1.1 包装规格
24人份/盒、48人份/盒。
1.2 主要组成成分
注:定标液浓度具有批特异性,具体浓度见标签。
2.1 外观
外观应符合如下要求:
a)试剂盒各组分应齐全、完整,液体无渗漏;
b)包装标签应清晰,无破损。
2.2 溯源性
根据GB/T21415-2008的要求提供定标液的来源、赋值过程以及测量不确定度等内容,溯源至企业工作校准品。
2.3 准确度
对企业准确度质控品进行检测,其测量结果的相对偏差应不超过±10%。
2.4 检出限
检出限应小于28pg/mL。
2.5 线性
在[30,30000]pg/mL线性范围内,相关系数r应≥0.9900。
2.6 重复性
分别用高、中、低3个浓度的样本,各重复检测10次,其变异系数(CV)应不大于10%。
2.7 批间差
用3个批号试剂盒分别检测高、中、低3个浓度的样本,则3个批号试剂盒之间的批间变异系数(CV)应不大于15%。
2.8 分析特异性
检测浓度为3.5μg/mL BNP,检测结果<30pg/mL。
2.9 稳定性
2℃~8℃保存12个月,取效期末的试剂盒进行检测,应符合2.3、2.4、2.5、2.6、2.8的要求。
N末端心房利钠肽前体(NT-proBNP)测定试剂盒(免疫荧光层析法)说明书 新健康成

N末端心房利钠肽前体(NT-proBNP)测定试剂盒(免疫荧光层析法)说明书1. 产品概述本产品是一种针对人体内N末端心房利钠肽前体(NT-proBNP)的测定试剂盒,采用免疫荧光层析法进行测定。
该试剂盒适用于临床医学实验室分析仪器的使用,用于定量测定人体血清或血浆中NT-proBNP的浓度,以协助临床诊断与治疗。
2. 产品原理本试剂盒采用免疫荧光层析法进行测定,利用特定的抗体与目标物NT-proBNP结合形成复合物,通过荧光信号的检测和定量分析,确定样本中目标物的浓度。
3. 试剂组成本试剂盒包含以下组分:•试剂盒盖板(1个)•试剂盒外盒(1个)•标准品(包含不同浓度的NT-proBNP,1套)•样本稀释液(1瓶)•封闭液A(1瓶)•封闭液B(1瓶)•洗涤缓冲液(1瓶)•底物A(1瓶)•底物B(1瓶)•停止液(1瓶)•离心管(适量)•微孔板(96孔)4. 操作步骤步骤1:准备工作1.首先将待测样本,标准品和试剂从冰箱中取出,并使其回至室温。
2.打开试剂盒外盒,检查试剂的完整性和有效期。
3.预热分析仪器至指定温度。
步骤2:标准曲线的制备1.将标准品稀释为不同浓度的工作液。
依次取出标准品管的适量体积,加入稀释液中,充分混合。
2.取出微孔板中的一行作为空白对照,加入适量的稀释液。
3.将制备好的工作液分别加入微孔板中,每个孔加入相同体积的工作液。
4.注意用标签标记好每行的标准品浓度。
步骤3:样本测定1.取出样本离心管,将待测样本加入管中。
2.取出微孔板中的一行作为样本孔,将样本离心管中的样本加入样本孔中。
3.热封微孔板,确保样本充分与试剂反应。
4.将微孔板放入分析仪器中,按照仪器操作说明进行测定。
步骤4:结果分析1.仪器完成测定后,读取测定结果。
2.通过标准曲线,根据测定结果计算出样本中NT-proBNP的浓度。
5. 结果解读对于NT-proBNP的浓度结果,根据临床实验室的参考值范围进行判断和解读。
6. 注意事项•本试剂盒仅适用于专业实验室内使用,禁止非专业人员操作。
氨基末端脑利钠肽前体(NT-proBNP)化学发光免疫冻干微球定量检测试剂研究

氨基末端脑利钠肽前体(NT-proBNP)化学发光免疫冻干微球定量检测试剂研究陈珠金【期刊名称】《生物化工》【年(卷),期】2022(8)1【摘要】目的:研制可定量检测人血清中氨基末端脑利钠肽前体(NT-proBNP)的化学发光免疫冻干微球。
方法:采用直接化学发光免疫分析法,混合预先添加好试剂储存液的磁微粒包被原料和吖啶酯标记原料,利用液氮点样仪器点样,形成冷冻微球并转入冻干机,最后真空冷冻干燥后用保护气体进行分装保存。
检测时,加入纯化水与待测样本,等到待测物中的NT-proBNP抗原与试剂混合,形成双抗体夹心复合物结合在磁珠上后,清洗分离。
结果:试剂性能分析显示,最低检出限≤20 pmol/mL;批内变异系数(CV)≤5%;线性范围20~35000 pmol/mL,线性相关系数R2≥0.999;试剂45℃储存90 d稳定性变化幅度≤10%;试剂可常温(25℃±5℃)储存5个月,稳定性变化幅度≤10%;平均加样回收率95.7%;应用本实验中获得的试剂对100例样本进行检测并与罗氏NT-proBNP检测试剂盒检测过的标本进行比较,结果表明相关性系数R2为0.9764。
结论:该试剂具有灵敏度高,线性范围广,准确度高,稳定性好可常温储存,可实现单人份包装等特点,为临床人血清NT-proBNP定量检测提供坚实的基础。
【总页数】4页(P44-47)【作者】陈珠金【作者单位】安邦(厦门)生物科技有限公司【正文语种】中文【中图分类】R541.6;R446.6【相关文献】1.Getein1600荧光免疫定量分析仪及N-端脑利钠肽前体检测试剂盒性能分析2.氨基末端脑利钠肽前体水平对非HIV免疫损害患者肺炎的预后价值3.氨基末端脑利钠肽前体水平对非HIV免疫损害患者肺炎的预后价值4.N末端脑利钠肽前体电化学发光检测方法的建立5.脑利钠肽和氨基末端脑利钠肽前体在儿童川崎病中的临床意义因版权原因,仅展示原文概要,查看原文内容请购买。
N末端脑利钠肽前体(NT-proBNP)测定试剂盒(电化学发光免疫分析法)产品技术要求lianzhongtaike
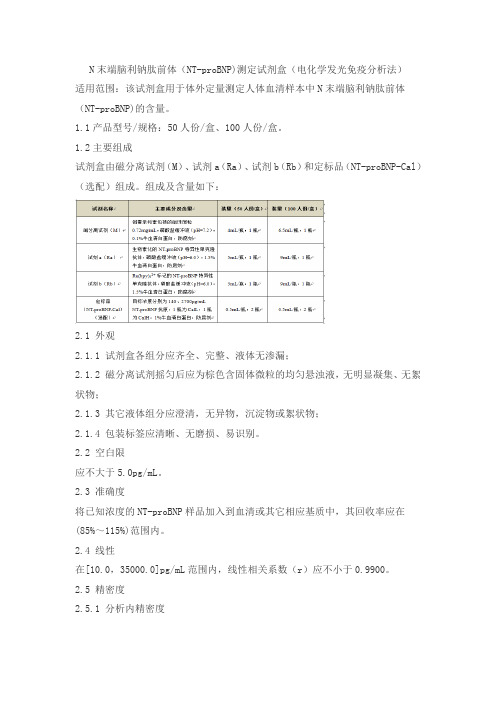
N末端脑利钠肽前体(NT-proBNP)测定试剂盒(电化学发光免疫分析法)适用范围:该试剂盒用于体外定量测定人体血清样本中N末端脑利钠肽前体(NT-proBNP)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(NT-proBNP-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于5.0pg/mL。
2.3 准确度将已知浓度的NT-proBNP样品加入到血清或其它相应基质中,其回收率应在(85%~115%)范围内。
2.4 线性在[10.0,35000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(500.0±100.0pg/mL)、(1000.0±200.0pg/mL)和(5000.0±1000.0pg/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(500.0±100.0pg/mL)、(1000.0±200.0pg/mL)和(5000.0±1000.0pg/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到罗氏的NT-proBNP定标液。
POCT即时检验(新项目学习资料)

POCT(即时检测)新项目的临床意义一、降钙素原(PCT)二、氨基末端脑钠肽前体(NT-proBNP)三、胸痛三联卡或称心肺功能三联卡(CTnI/NT-proBNP/DD)1、降钙素原PCT1.1 概念PCT是降钙素的前肽,一种无激素活性的糖蛋白。
由116氨基酸组成,分子量为13KD 的糖蛋白,半衰期为25~30h,在体内外稳定性很好。
生理情况下,甲状腺C细胞可产生极少量的PCT,健康人的血清PCT水平通常测不到,但在细菌感染时,除甲状腺外,肝脏的巨噬细胞和单核细胞,肺、肠道组织的淋巴细胞及内分泌细胞都能合成分泌PCT,此时血清PCT 水平会明显升高,且随感染进展或控制而持续在高水平或逐渐下降。
1.2 临床意义:A、当严重的细菌、真菌、寄生虫感染和脓毒症以及多个脏功能衰竭时,它在血浆中的水平升高,然而自身免疫,过敏和病毒感染时PCT不会升高。
B、PCT用来鉴别细菌和病毒感染。
局部有限的细菌感染、轻微的感染和慢性炎症都不会导致其明显升高,所以PCT反映了全身炎症反应的程度,并且PCT升高程度与炎症程度成正比。
影响PCT水平的因素包括被感染器官的大小和类型、细菌的种类、炎症的程度和免疫反应的状况。
C、PCT水平的升高出现在严重休克、全身性炎症反应综合征(SIRS)和多个器官功能紊乱综合征(MODS)。
1.3 优势与特点:1)疾病的早期诊断: PCT通常在疾病发生的2-6小时内就升高, 并可以检测到。
2)与病情发展呈正相关:随着病情严重程度增加,血浆PCT浓度明显增高。
PCT对严重脓毒症和脓毒性休克的诊断特异性明显高于CRP、WBC等等指标,特异性高达100%。
这说明血浆PCT 含量测定是多器官功能衰竭综合症(MODS)发生的预警指标。
3)疗效观察与疾病预后:PCT水平下降表明炎性反应的降低及感染灶的清除,提示良好的预后。
注:详细可查阅附件附带的降钙素原PCT的标准与指南(临床应用的专家共识)。
2、氨基末端脑钠肽前NT-proBNP氨基末端脑钠肽前体(N-terminal pro-brain natriuretic peptide)检测试剂盒(荧光免疫层析法),用于定量测定血清中氨基末端脑钠肽前体(简称:NT-proBNP),N末端脑钠肽前体的检测可用于急性呼吸困难的鉴别诊断、早期发现心力衰竭病人、心衰患者的危险度分级、心源性猝死的预测、急性冠脉综合症的评估、心衰患者的治疗疗效监测及预后评估,因此NT-proBNP 的检测试剂盒的开发将具有广泛的市场。
N端脑钠肽前体测定试剂盒(胶体金免疫层析法)产品技术要求yuepu

N端脑钠肽前体测定试剂盒(胶体金免疫层析法)适用范围:本试剂盒配合北京x普医疗科技有限责任公司生产的免疫定量分析仪,用于临床样本(全血/血清/血浆)中N端脑钠肽前体的定量检测。
1.1 规格卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含1/10/20/50人份检测卡和1份说明书、批号卡和样品缓冲液。
每人份检测卡包括1份N端脑钠肽前体检测卡、1支滴管和1包干燥剂,选配件为医用酒精棉、无菌采血针(注:选配件均为外购已获得医疗器械注册证的产品)。
N端脑钠肽前体检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗人NT-proBNP单克隆抗体;C线包被抗鼠抗体)、金标垫(包被胶体金标记的鼠抗人NT-proBNP单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2 膜条宽度检测卡的膜条宽度≥2.5mm。
2.1.3 液体移行速度液体移行速度应不低于10 mm/min。
2.2 空白检出限空白检出限应不高于100pg/mL。
2.3 精密度2.3.1批内精密度批内精密度CV(%)应不高于15.0%。
2.3.2 批间精密度批间精密度CV(%)应不高于15.0%。
2.4 剂量-反应曲线的线性在100pg/ml~6000pg/ml的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.975。
2.5 准确度2.5.1型式检验项目:检测N端脑钠肽前体纯品,样本回收率应高于85%。
2.5.2出厂检验项目:检测已知浓度的N端脑钠肽前体测定样品液,实测值与标示值的偏差范围应不高于15%。
2.6稳定性将试剂盒在4℃~30℃的环境中放置18个月后,取样分别检测2.1、2.2、2.3.1、2.4、2.5.2项,结果应符合各项目的要求。
N末端脑钠肽前体(NT—proBNP)测定试剂盒(化学发光免疫分析法)产品技术要求深圳锦瑞

N末端脑钠肽前体(NT-proBNP)测定试剂盒(化学发光免疫分析法)2性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;外观和性状应符合表2 要求。
表 2 试剂盒内各组分的外观性状2.2装量试剂盒内各组分装量应不少于标示值。
2.3准确度对工作校准品进行检测,其测量结果的相对偏差应不超过±10%。
2.4检出限应不高于15 pg/mL。
2.5线性试剂盒在15 pg/mL~30000 pg/mL 区间范围内,其线性相关系数r≥0.9900。
2.6重复性分别用(125±25) pg/mL、(1200±240) pg/mL、(15000±3000) pg/mL 浓度范围内的3 个样本,各重复检测10 次,其变异系数(CV)应不大于8%。
2.7批间差用3 个批号试剂盒分别检测(125±25) pg/mL、(1200±240) pg/mL、(15000±3000)pg/mL 浓度范围内的3 个样本,3 个批号试剂盒之间的批间变异系数(CV)应不大于10%。
2.8质控品测定值用试剂盒配套的校准品校准测量系统后,以试剂盒配套的质控品作为样本进行检测,其测定结果应在标示浓度范围内。
2.9质控品均一性瓶间变异系数(CV)应不大于10%。
2.10校准品测量准确度用工作校准品校准测量系统后,以试剂盒配套的校准品作为样本进行检测,其测定结果与标示值的相对偏差应在±10%范围内。
2.11校准品均一性瓶间变异系数(CV)应不大于10%。
氨基末端脑利钠肽前体测定试剂盒(荧光免疫层析法)产品技术要求北京协和洛克
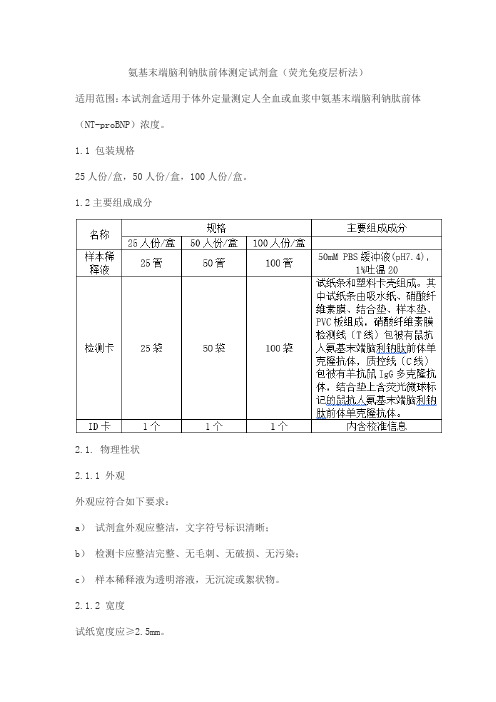
氨基末端脑利钠肽前体测定试剂盒(荧光免疫层析法)适用范围:本试剂盒适用于体外定量测定人全血或血浆中氨基末端脑利钠肽前体(NT-proBNP)浓度。
1.1 包装规格25人份/盒,50人份/盒,100人份/盒。
1.2主要组成成分2.1. 物理性状2.1.1 外观外观应符合如下要求:a)试剂盒外观应整洁,文字符号标识清晰;b)检测卡应整洁完整、无毛刺、无破损、无污染;c)样本稀释液为透明溶液,无沉淀或絮状物。
2.1.2 宽度试纸宽度应≥2.5mm。
2.1.3 移行速度液体移行速度应不低于10mm/min。
2.1.4 样本稀释液装量液体体积为180μL±3.6μL。
2.2 准确度对高、低浓度质控品进行检测,其测量结果的相对偏差应不超过±15%。
2.3 检出限不高于20pg/mL。
2.4 线性试剂盒的线性范围为[30,30000]pg/mL,相关系数r不小于0.990。
2.5重复性分别用高、中、低3个浓度的质控品,各重复检测10次,其变异系数(CV)应不大于13%。
2.6 批间差用3个批号试剂盒分别检测高、中、低3个浓度的质控品,3个批号试剂盒之间的批间变异系数(CV)应不大于15%。
2.7 特异性分别将浓度为1ng/mL肾上腺素、1ng/mL NT-proANP、2μg/mL C型钠肽CNP、0.6ng/mL血管紧张素作为样本进行特异性反应,交叉反应率应小于5%。
2.8效期稳定性试剂盒在2℃~30℃储存有效期为18个月,取到效期后产品进行检测,检测结果应符合2.1~2.5,2.7项要求。
2.9溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供所用校准品的来源、赋值过程以及不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
氨基末端脑利钠肽前体测定试剂盒(荧光免疫层析法)产品技术要求乐普

氨基末端脑利钠肽前体测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血浆、血清和全血中人氨基末端脑利钠肽前体的含量。
1.1 规格
10人份/盒、20人份/盒、50人份/盒。
1.2 组成
每盒含10/20/50人份试剂、10/20/50人份缓冲液和1张二维码卡片:
2. 性能指标
2.1 物理性状
2.1.1 外观
检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2膜条宽度
检测卡的宽度≥2.5 mm。
2.1.3液体移行速度
液体移行速度应不低于10 mm/min。
2.2 空白检测限
空白检出限应不高于0.1ng/mL。
2.3精密度
2.3.1 批内精密度
批内精密度CV(%)应不高于15.0%。
2.3.2批间精密度
批间精密度CV(%)应不高于15.0%。
2.4 线性
在 0ng/mL~10ng/mL的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.975。
测试浓度0~1.25ng/mL的氨基末端脑利钠肽前体测定样品液,绝对偏差不超过±0.25ng/mL;测试浓度>1.25ng/mL的氨基末端脑利钠肽前体测定样品液,相对偏差不超过±20%。
2.5准确度
检测已知浓度的人氨基末端脑利钠肽前体Hytest标准品(编号:8NT2),实测值与标识值的偏差范围应不高于20%。
2.6稳定性
将检测卡在2℃~30℃的环境中放置18个月后,取到期后3个月内的产品进行检测,结果应符合2.1,2.2,2.3.1,2.5的要求。
N末端脑钠肽前体(NT—proBNP)测定试剂盒(磁微粒化学发光法)产品技术要求国赛生物

N末端脑钠肽前体(NT-proBNP)测定试剂盒
(磁微粒化学发光法)性能指标
1.性能指标
1.1 试剂条性能指标
1.1.1 外观
试剂条中第7孔内组分为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;其余皆为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.1.2 装量
液体试剂的装量应不少于标示值。
1.1.3 空白限
应不大于5pg/mL。
1.1.4 检出限
应不大于20pg/mL。
1.1.5 准确度
检测结果与标定浓度的相对偏差应在±10%以内。
1.1.6 线性范围
在20pg/mL~30000pg/mL区间内,线性相关系数(r)应不小于0.9900。
1.1.7 精密度
1.1.7.1 批内精密度
用同一批号的试剂条检测高、中、低3个浓度的质控品,测量结果的变异系数(CV)应不大于10%。
1.1.7.2 批间精密度
用3个不同批号的试剂条分别检测高、中、低3个浓度的质控品,3个批号试剂条之间的批间变异系数(CV)应不大于15%。
1.2 校准品性能指标
1.2.1 外观
校准品CAL2为白色冻干块。
1.2.2 准确度和赋值程序检测
测量结果与标定浓度的相对偏差应在±10%以内。
校准品的溯源及赋值程序
文件见附录1。
1.2.3 批内瓶间差
对一瓶校准品重复检测10次,对同一批号的10瓶校准品分别检测1次,批内瓶间差CV应≤15%。
氨基末端脑钠肽前体检测试剂盒

目前唯一可以用于评价心脏舒张功能的生化指标
普通人群NT-proBNP 125pg/mL为界时,对心衰的 阴性预测值100%,敏感性100%,阳性预测值70%
心衰患者出院前NT-proBNP水平对与出院后死亡、
心衰复发有预测价值
NT-proBNP的临床意义 -心功能变化疾病的最佳指标
心肌梗死
冠脉血栓形成 心肌缺血 冠状动脉病变 神经内分泌活化 心室 重构 猝死
天宝诊断NT-proBNP 专业技术诊断,实验数据共 享 生物荧光免疫终点法,结果准确、 可靠 快速、准确、可靠的全定量检测全 血、血清血浆NT-proBNP 三步操作简单快捷,无需专业培训 检测线性50-45000pg/ml 10min检测结果,10-30min无限次 重复检测
谢谢观看
无特异性 缺乏标准化 对结果的阐述具有主观性 临床表现和预后间的联系不明确 客观,但不便于用于监测心衰的
预后和治疗 心衰诊断的“金标准” 不同中心检查结果没有可比性
主题内容
NT-proBNP的定义及其生理特点? 什么是心衰? NT-proBNP的临床应用? NT-proBNP的检测?
什么是NT-proBNP?
NT-proBNP是一个含76个氨基酸的多肽,主要来源于 心室。 它的含量与心室压力、呼吸困难程度、神经激素调节系 统状态相关。 心室的体积和压力增高可导致血浆内NT-proBNP值的 升高,升到的程度与心室扩张和压力超负荷成正比。
Pre-Pro-BNP1-134
心力衰竭又称心肌衰竭,是指心脏不能搏出同静脉回流及身 体组织代谢所需相称的血液供应。往往由各种疾病引起心肌 收缩能力减弱,从而使心脏的血液输出量减少,不足以满足 机体的需要,并由此产生一系列症状和体征。根据临床症状 可分为左心、右心和全心衰竭。 心衰最典型的症状是程度不同的呼吸困难,活动时加重,严 重者端坐呼吸、咳嗽 并伴大量白色绒粉红色泡沫痰、食欲降 低、双下肢浮肿等。
N-末端脑钠肽前体(NT-proBNP)测定试剂盒(胶体金免疫层析法)产品技术要求贝尔

N-末端脑钠肽前体(NT-proBNP)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量测定人血清或血浆中的N-末端脑钠肽前体(NT-ProBNP)含量。
1.1 包装规格20人份/盒1.2主要组成成分本试剂盒由NT-ProBNP检测卡、干燥剂和滴管组成。
NT-ProBNP检测卡由试纸条外壳与试纸条构成,试纸条由样品垫、胶体金垫(喷有由胶体金标记的NT-ProBNP 单克隆抗体)、层析膜(T线包被有NT-ProBNP单克隆抗体,C线包被有羊抗鼠IgG抗体)、吸水纸、衬垫构成。
检测卡为20人份/盒,干燥剂为1个/袋,滴管为20个/盒。
2.1 物理性状2.1.1 外观试剂盒各组分齐全、完整;包装袋应密封性好无破损;标签清晰;材料附着牢固,条宽应适应于卡壳且装配紧密。
2.1.2 膜条宽度膜条宽度应不低于4.0mm。
2.1.3 液体移行速度液体移行速度应不低于10mm/min。
2.2 空白检测限应小于200pg/ml。
2.3 分析特异性与5ng/ml cTnI、250ng/ml Myoglobin和50ng/ml CK-MB分析特异性参考品进行交叉反应测定,测定结果应均小于200pg/ml。
2.4 重复性用500pg/ml N-末端脑钠肽前体(NT-proBNP)参考品和6000pg/ml N-末端脑钠肽前体(NT-proBNP)参考品各重复检测10次,其变异系数(CV)应不大于15%。
2.5 准确度将12000pg/ml N-末端脑钠肽前体(NT-proBNP)血清参考品加入到N-末端脑钠肽前体(NT-proBNP)含量为200pg/ml正常人血清参考品中,按照体积比1:9混合,对混合后样本进行检测,回收率应在85%~115%范围内。
2.6 线性线性范围为[200,12000]pg/ml,试剂盒的相关系数r应≥0.99。
2.7 批间差用3个批号试剂盒对500pg/ml N-末端脑钠肽前体(NT-proBNP)参考品和6000pg/ml N-末端脑钠肽前体(NT-proBNP)参考品各重复检测10次,则3个批号试剂盒之间的批间相对偏差(R)应不大于15%。
N末端脑钠肽(NT—proBNP)检测试剂盒(免疫层析法)产品技术要求模板

医疗器械产品技术要求编号:
N末端脑钠肽(NT—proBNP)检测试剂盒
(免疫层析法)
1.产品型号/规格及划分说明
1.1产品型号/规格
20人份/盒。
1.2结构组成
由检测卡、干燥剂和说明书组成;检测卡由鼠抗NT-proBNP单抗、胶体金鼠抗NT-proBNP单抗,羊抗鼠IgG和硝酸纤维素膜等支持物组成。
1.3 适用范围
用于体外定性检测血清中的N末端脑钠肽(NT-proBNP)。
2.性能指标
2.1外观
2.1.1检测卡应无明显划痕、气泡、外观平整,材料附着牢固。
2.1.2检测卡的文字和标记应清晰、准确。
2.2膜条宽度
检测条的宽度应≥2.5mm。
2.3液体移行速度
液体移行速度应不低于 10mm/分钟
2.4灵敏度(最低检出限)
本试剂盒对 NT-proBNP 最低检出限为 200 pg/mL。
2.5检测范围
本试剂盒 NT-proBNP 检测范围为 200 pg/mL~15,000 pg/mL。
2.6特异性
试剂盒与心肌钙蛋白-I(cTn-I)、肌酸激酶同工酶(CK-MB)、肌红蛋白(Myoglobin) 均不发生交叉反应。
2.7精密度
2.7.1批内精密度
取同一批号试剂对精密度参考品(NT-proBNP 1000 pg/mL)分别进行 10 次测定,反应结果应一致,且显色度应均一。
2.7.2批间精密度
分别取连续三个批号试剂对精密度参考品(NT-proBNP 1000 pg/mL)分别进行 10 次测定,反应结果应一致,且显色度应均一。
人N—末端脑钠肽前体(NT—proBNP)测定试剂盒(酶联免疫法) 产品技术要求海格德生物

人N-末端脑钠肽前体(NT-proBNP)测定试剂盒
1.性能指标
1.1外观和性状
试剂盒各组分应齐全、完整,液体无渗漏;中文包装标签应清晰、明确、牢
固,无划破或缺失部分。
1.2各组份净含量
各组份应不低于装量瓶标签标示的装量要求。
1.3试剂盒校准品均一性
瓶间重复性CV 值应≤10%。
1.4准确度
检测浓度与理论浓度的偏差应在±10%范围内。
1.5试剂盒最低检测限
应不大于50 pg/ml。
1.6线性范围及线性要求
试剂盒线性范围在100 pg/ml~2500 pg/ml 之间,在该范围内试剂盒的相
关系数r 值应≥0.9900 。
1.7精密度
试剂盒批内变异系数应≤10%,批间变异系数应≤15%。
1.8分析特异性:血红蛋白5 mg/ml、甘油三酯10 mg/ml、胆红素0.2 mg/ml,
用于本试剂盒的干扰实验检测,均无非特异性反应,干扰样本检测浓度
与对照样本检测浓度的相对偏差应在±15%范围内。
N-末端脑钠肽前体测定试剂盒(荧光免疫层析法)产品技术要求zhongjianantai

N-末端脑钠肽前体测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量检测人体血清、血浆或全血样本中N-末端脑钠肽前体(NT-proBNP)的含量。
1.1包装规格:20人份/盒,40人份/盒。
1.2主要组成:表1 试剂盒产品组成表2.1 物理检查2.1.1 外观外观平整,材料附着牢固,内容齐全,试剂无杂质,外包装完整无破损,标签清晰可辨。
2.1.2 膜条宽度膜条宽度应满足4.0mm±0.2mm。
2.1.3 液体移行速度液体移行速度应不低于10mm/min。
2.1.4 样本稀释液样本稀释液的净含量应不少于标示值,且其pH值为7.0±0.2。
2.2准确度准确度应符合以下要求之一。
a). 回收率:将已知浓度的高浓度质控品加入到低浓度血清中测定回收率,要求在85%~115%范围内。
b). 比对试验采用与罗氏诊断产品(上海)有限公司的脑利钠肽前体检测试剂盒(电化学发光法)检测的样本进行对比试验,相关系数(r)应不小于0.950,斜率应在[0.9,1.1]内。
2.3线性范围在[56,35000]pg/ml范围内,相关系数(r)应不低于0.990。
2.4 重复性分别检测高、中、低三个浓度的样本,变异系数(CV)应不高于10.0%。
2.5批间差用三个批号试剂盒分别检测高、中、低三个浓度的样本,三个批号试剂盒之间的批间变异系数(CV)应不高于15.0%。
2.6 检出限检出限低于30pg/mL。
2.7校准信息溯源性校准信息所用工作校准品根据GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的规定,溯源至企业工作校准品,工作校准品通过已上市产品进行赋值。
2.8稳定性试剂盒在规定的条件下保存至有效期末,取到效期后两个月内试剂盒,检测2.2、2.3、2.4、2.6项,结果应符合要求。
脑自然肽N端前体蛋白测定试剂盒(化学发光法)产品技术要求新产业

2.性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰、准确、牢固;试剂盒内组分(磁性微球溶液除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表 1
2.3重复性
分别用高、中、低 3 个浓度的样本,各重复检测10 次,其变异系数(CV)应不大于8%。
2.4批间精密度
用3个批号试剂盒分别检测高、中、低3个浓度的样本,3个批号试剂盒之间的变异系数(CV)应不大于15%。
2.5准确度
相对偏差应在±10% 范围内。
2.6空白限
试剂盒的空白限应小于 2.0 pg/mL。
2.7检出限
试剂盒的检出限应≤5.0 pg/mL
2.8线性
在(5.0~35000.0)pg/mL 浓度范围内,线性相关系数(r)绝对值应大于0.9900。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨基末端脑钠肽前体测定试剂盒(荧光免疫法)
组成:
每盒包含相应规格检测卡和1份产品二维码(内含校准信息)。
每人份检测卡包括1份氨基末端脑钠肽前体检测卡和1包干燥剂。
氨基末端脑钠肽前体检测卡由PMMA镀膜、反应室(T线包被鼠抗人NT-proBNP单克隆抗体;C线包被羊抗鼠抗体)、荧光微球室(储存荧光微球标记的鼠抗人NT-proBNP单克隆抗体)、回收池、塑料结构支撑层组成。
适用范围:本产品用于体外定量检测人全血、血清、血浆中氨基末端脑钠肽前体含量。
1.1规格
卡型1人份/盒、10人份/盒、20人份/盒、50人份/盒。
1.2组成
每盒包含相应规格检测卡和1份产品二维码(内含校准信息)。
每人份检测卡包括1份氨基末端脑钠肽前体检测卡和1包干燥剂。
氨基末端脑钠肽前体检测卡由PMMA镀膜、反应室(T线包被鼠抗人NT-proBNP单克隆抗体;C线包被羊抗鼠抗体)、荧光微球室(储存荧光微球标记的鼠抗人NT-proBNP单克隆抗体)、回收池、塑料结构支撑层组成。
2.1物理性状
2.1.1外观
应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2液体移行速度
液体移行速度应不低于10 mm/min(到达Test区应低于2min)。
2.2检出限
检出限应不高于30pg/mL。
2.3重复性
分别用低、中、高3个浓度的氨基末端脑钠肽前体样本液,测定变异系数(CV)应不大于15%。
2.4批间差
用3个批号试剂卡分别检测低、中、高3个浓度的氨基末端脑钠肽前体样本液,变异系数(CV)应不大于15%。
2.5线性
在[30,30000]pg/mL线性范围内,相关系数应不低于0.990。
2.6准确度
以指定的已上市试剂盒作为比对方法,进行比对试验,相关系数(r)应不小于0.950,斜率应在[0.9,1.1]内。
2.7校准信息溯源性
应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准信息可溯源至本公司工作校准品,工作校准品由罗氏试剂盒比对赋值。
2.8稳定性
将检测试剂盒在4℃~30℃的环境中放置至有效期18个月后,分别检测2.1、2.2、2.3、2.5、2.6项,结果应符合各项目的要求。
