芳烃的性质
芳烃的性质实验报告

芳烃的性质实验报告
芳烃是一类含有苯环结构的碳氢化合物,具有特殊的化学性质。
本实验旨在通
过对芳烃的性质进行实验研究,以期深入了解其化学特性及应用价值。
首先,我们进行了对芳烃的物理性质的实验研究。
实验结果显示,芳烃具有较
高的沸点和熔点,这与其分子结构紧密相关。
此外,我们还测试了芳烃的溶解性,发现芳烃在非极性溶剂中溶解度较高,而在极性溶剂中溶解度较低,这与芳烃的分子极性有关。
接着,我们对芳烃的化学性质展开了实验研究。
在实验中,我们发现芳烃具有
较高的稳定性,不易发生化学反应。
但在适当的条件下,芳烃可以发生亲电取代反应和求核取代反应,这为芳烃的合成和改性提供了重要的理论基础。
此外,我们还对芳烃的燃烧性质进行了实验研究。
实验结果表明,芳烃在氧气
条件下可以发生完全燃烧,生成二氧化碳和水,释放大量的能量。
这为芳烃作为燃料的应用提供了重要的参考依据。
最后,我们对芳烃的环境影响进行了实验研究。
实验结果显示,芳烃在大气中
易发生光化学反应,产生有害的光化学污染物,对环境造成一定的影响。
因此,在芳烃的生产和使用过程中,需要采取相应的环保措施,减少对环境的影响。
综上所述,通过对芳烃的性质进行实验研究,我们深入了解了芳烃的物理性质、化学性质、燃烧性质以及环境影响等方面的特点。
这对于进一步的芳烃的应用和环境保护具有重要的理论和实践意义。
希望本实验能为相关领域的研究和应用提供一定的参考价值。
大学芳烃知识点总结

大学芳烃知识点总结一、芳烃的结构芳烃是一类含有苯环结构的碳氢化合物,其分子结构可以使用分子式(CnH2n-6)表示。
若n=6,则为苯,苯是最简单的芳香烃。
芳烃的分子结构稳定,具有特殊的共振结构。
在芳烃分子中,每个碳原子都与邻近的碳原子形成σ键,同时其中的3个sp2杂化碳原子上还存在一个与此共面的π键,形成单独的共轭环结构。
二、芳烃的性质1. 燃烧性能:芳烃在空气中燃烧时,产生的热量非常大,燃烧完全时生成的气体中只有水和二氧化碳。
因此具有高热值和热稳定性。
2. 溶解性:芳烃在非极性溶剂中溶解度较高,但在极性溶剂中溶解度较低。
这是因为芳烃分子中存在苯环结构,是由于共轭结构形成了大量的π键,因此芳烃分子呈现非极性特性。
3. 化学反应:芳烃具有很强的亲电性,与强亲电试剂发生亲电取代反应。
在苯环中存在的共轭结构会进一步增强芳烃的亲电性。
除此之外,芳烃还可以发生加成反应、氢化、氧化、取代、芳香核聚合等化学反应。
三、芳烃的制备1. 从石油中提炼:芳烃是石油加工过程中的重要产品之一。
石油中含有大量的芳烃类物质,通过裂化、裂解、加氢处理等工艺流程,可以从石油中提取得到芳烃。
2. 有机合成:芳烃可以通过有机合成的方法进行制备。
常见的合成方法包括芳基烷基化、芳基取代反应、芳基硝化和还原等。
3. 光照反应:一些有机化合物在光照条件下会发生光敏反应,而芳烃类物质对光敏反应具有一定的敏感性,通过光照反应也可以制备芳烃。
四、芳烃的应用1. 化工生产:芳烃在化工生产中有着广泛的应用。
如苯乙烯,苯甲酸,邻苯二甲酸二丁酯,对苯二甲酸等都是重要的芳烃类化合物。
这些物质广泛用于制备高分子材料、染料、颜料等。
2. 燃料与能源:芳烃具有高燃烧热值和热稳定性,因此在燃料和能源领域有着广泛的应用。
如苯、甲苯等可用于制备合成油、燃油、航空燃料等。
3. 医药领域:芳烃类化合物在医药领域也有着重要的应用。
许多药物的合成过程中都要用到芳烃类原料。
例如,水杨酸、草酸、间苯二酚等。
芳烃的性质_实验报告

一、实验目的1. 了解芳烃的物理性质,如沸点、熔点、密度、溶解性等。
2. 掌握芳烃的化学性质,如氧化反应、取代反应等。
3. 熟悉实验操作技能,提高实验操作能力。
二、实验原理芳烃是一类具有特殊结构的有机化合物,其分子中含有苯环。
苯环具有特殊的共轭π电子体系,使其具有独特的化学性质。
本实验主要研究苯及其同系物的物理性质和化学性质。
三、实验材料1. 苯、甲苯、二甲苯、苯酚等芳烃化合物。
2. 氧化剂(如酸性高锰酸钾、氯水等)。
3. 催化剂(如铁粉、氯化铝等)。
4. 实验仪器:蒸馏装置、分液漏斗、试管、烧杯、酒精灯、滴管等。
四、实验步骤1. 物理性质测定- 沸点测定:将苯、甲苯、二甲苯分别置于蒸馏装置中,测定其沸点。
- 熔点测定:将苯、甲苯、二甲苯分别置于试管中,用酒精灯加热,观察其熔点。
- 密度测定:将苯、甲苯、二甲苯分别置于烧杯中,加入一定量的水,观察其密度。
- 溶解性测定:将苯、甲苯、二甲苯分别加入水中,观察其溶解性。
2. 化学性质研究- 氧化反应:将苯、甲苯、二甲苯分别加入酸性高锰酸钾溶液中,观察其反应现象。
- 取代反应:将苯、甲苯、二甲苯分别加入氯水中,观察其反应现象;或将苯、甲苯、二甲苯分别加入氯化铝溶液中,观察其反应现象。
五、实验结果与分析1. 物理性质- 沸点:苯的沸点为80.1℃,甲苯的沸点为110.6℃,二甲苯的沸点为138.5℃。
- 熔点:苯的熔点为5.5℃,甲苯的熔点为-95℃,二甲苯的熔点为-48.6℃。
- 密度:苯的密度为0.879 g/cm³,甲苯的密度为0.87 g/cm³,二甲苯的密度为0.87 g/cm³。
- 溶解性:苯、甲苯、二甲苯均不溶于水。
2. 化学性质- 氧化反应:苯在酸性高锰酸钾溶液中不发生反应,甲苯和二甲苯在酸性高锰酸钾溶液中会发生氧化反应,使溶液褪色。
- 取代反应:苯在氯化铝催化下与氯水反应,生成氯苯;甲苯在氯化铝催化下与氯水反应,生成氯甲苯;二甲苯在氯化铝催化下与氯水反应,生成氯化二甲苯。
3.1芳香烃
磺化反应可逆,调节温度得到不同产物
CH3 CH3 CH3 SO3H
+ H2SO4
+
SO3H
反应温度不同 产物比例不同
0℃ 25℃ 100℃
邻甲基苯磺酸 43% 32% 13%
对甲基苯磺酸 53% 62% 79%
30
•
利用磺化的可逆性保护苯环上的某些位置
OH
H2SO4
OH
2molBr2
OH Br Br
•六氯化苯简称六六六, 杀虫剂,已经禁止使用。
44
3.3.2.3 氧化反应
45
46
CH 3
均有,直接 氧化到苯甲酸
CH 2CH 2CH 3
COOH
MnO4-/H2O
47
3.4苯环上亲电取代反应的定位效应
3.4.1 定位基概念
定位基:在进行亲电取代反应时,苯环上原有取代基, 不仅影响着苯环的取代反应活性,同时决定着第二个取代基 进入苯环的位置,即决定取代反应的位置。原有取代基称做 定位基。
54
2.间位定位基定位能力由强到弱的顺序: -NR3 > -NO2 > -CN > -SO3H > -CHO > -COR > -COOH > -COOR > -CONH2
+
55
3.4.3 定位规律的理论解释 (1) 第一类定位基对苯环的影响及其定位效应
3.3.2.1 亲电取代反应—SE
O R
F-C acylation Halogenation
Cl
Br
I
al ky la tio n
na lf o Su
C
(4) b酰基 化反应
第六章芳烃的性质-精品文档

+ H
+
势 能
Eact 1
H SO3
Eact1接近Eact2
Eact 2
+
SO3
SO3
+ + H
反应进程
磺化反应及苯磺酸衍生物的重要性
合成苯磺酸衍生物
H S O 浓 ) 2 4( C H 1 2 2 5 C H 1 2 2 5 S O H 3 N a O H C H 1 2 2 5 S O N a 3
§6-3苯及其同系物的物理性质
1、状态: 一般为无色有芳香味的液体。 2、相对密度:在0.86-0.93g.ml-3。 3、熔、沸点:沸点随相对分子质量增大而升高, 熔点 与相对分子质量和分子形状有关。分子对称性高,熔点 也高。如:苯的熔点大大高于甲苯的熔点,二元取代苯 中,对位的熔点高于其它两个异构体的熔点。熔点高, 溶解度小,易结晶。利用此性质,通过重结晶,分离邻 、间、对异构体。 4、溶解性:不溶于水,可溶于乙醚等有机溶剂,是良好的 溶剂,有毒性。
X + 2
机理
X2 + Fe FeX3
亲电中心
X2
+
FeX3
X
X
FeX3
XXFຫໍສະໝຸດ X3H X-H+
X -FeX4
②硝化反应 苯环上的氢被硝基取代的反应叫硝化反应,通 常用混酸(浓硝酸与浓硫酸的1:1混合物)
+ 浓 HNO 3 浓H 2SO 4 。 50~60 C NO 2
例 :
NO 2 + 浓 HNO 3 浓H 2SO 4 。 100~110 C
+
6 5 6 9 %
C H C H C H 3 3 C H C H = C H + 3 2
芳烃的总结

芳烃的总结概述芳烃是一类化学化合物,特点是分子中含有一个或多个苯环结构。
它们具有结构简单、稳定性高、物理化学性质独特等特点,广泛应用于化工、医药、染料、涂料等领域。
本文将对芳烃的结构特点、制备方法以及应用进行总结。
结构特点芳烃的分子结构主要由苯环构成,苯环由6个碳原子构成,其中每个碳原子与相邻两个碳原子通过π键连接。
芳烃的一些重要特性源于共轭π电子结构。
具有这种结构的化合物在化学反应中表现出独特的稳定性和活泼性。
芳烃分为单环芳烃和多环芳烃两类。
单环芳烃如苯、甲苯等,是由一个苯环构成的化合物。
多环芳烃如萘、菲等含有多个苯环结构。
多环芳烃通常比单环芳烃具有更高的熔点和沸点,且具有更强的芳香性。
制备方法1. 芳烃的烷基化烷基化是一种将烷烃(如甲烷、乙烷)转化为芳烃的方法。
常用的烷基化试剂有氯化铝和氯化锌等。
这些试剂可以将烷烃通过取代反应转化为烷基苯或烷基苯类化合物。
烷基化反应一般在惰性溶剂中进行,通常需要加热才能进行。
2. 芳烃的酰基化酰基化是一种将芳烃转化为酰化产物的方法。
常用的酰基化试剂有酸酐和酰氯等。
酰基化反应常在惰性溶剂中进行,通常需要加热和催化剂的存在。
其中,苯甲酸酐和苯甲酰氯是常用的酰基化试剂。
3. 芳烃的氢化氢化是将烯烃或芳烃转化为饱和化合物的方法。
对于芳烃而言,可以通过加氢反应将芳烃转化为烷烃。
常用的氢化试剂有氢气和催化剂,如铂、钯、铑等。
氢化反应可在常温下进行,但通常需要提高反应温度和压力才能获得更好的转化率。
应用领域芳烃在化工、医药、染料、涂料等领域有广泛的应用。
以下是芳烃在一些领域的具体应用:1. 化工领域芳烃是许多重要化学品的基础,如基础有机合成原料、溶剂和催化剂。
另外,芳烃也是制备聚合物和合成纤维的重要原料。
2. 医药领域很多药物分子中含有苯环结构,芳烃是药物合成的重要中间体。
芳烃还可以作为配体参与到药物与受体的相互作用中。
3. 染料和涂料领域芳烃具有良好的稳定性和颜色可调性,因此在染料和涂料领域有广泛的应用。
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
芳烃知识点总结

芳烃知识点总结一、基本概念芳烃是一类化学结构中含有苯环或其取代物的有机化合物。
在芳烃中,苯环或其取代物被称为芳香环,其特点是环上所有碳原子都是sp2杂化的,各碳原子间的键角为120°,具有很高的稳定性。
芳香环上的每一个碳原子上都有一个π电子,这些π电子是由碳原子的p轨道形成的,这些π电子在芳烃的化学性质中起着重要作用。
芳烃通常可分为单环芳烃和多环芳烃两类。
单环芳烃的代表是苯、甲苯、二甲苯等,它们的分子结构简单,化学性质稳定。
多环芳烃则是由两个以上的苯环简单结合而成,其代表物是萘、菲、芘等。
二、结构特点1. 芳香环结构芳香环是芳烃的结构基础,具有六个碳原子组成的六元环。
芳香环上的每个碳原子都与相邻的两个碳原子形成σ键,同时与另外一个碳原子形成一个π键。
芳香环上所有的碳原子都处于sp2杂化状态,形成了120°的键角。
由于π键的范德华半径远大于σ键的范德华半径,因此芳香环具有很高的稳定性。
2. 取代基取代的位置芳烃可以通过取代基进行取代反应,取代基取代的位置是有一定规律的。
对取代基而言,芳烃的芳香环上三个相对邻近的碳原子被标记为1、2、3号碳原子,另外三个相对邻近的碳原子被标记为4、5、6号碳原子。
与取代基连接的碳原子称为取代基所连接的碳原子,芳烃中取代基取代位置的规律可以总结出为:(1)取代基偏向于连接到相对邻近的位置上;(2)取代基偏向于连接到离键极等电子密度较大的位置上;(3)取代基偏向于连接到离相对邻近位置电子密度较大的位置上;(4)取代基偏向于连接到使取代基离得远的位置上。
三、物理化学性质1. 沸点和熔点芳烃的沸点和熔点通常较低,易挥发。
这是因为芳烃分子间的相互作用力较弱,使得芳烃具有较低的沸点和熔点,便于在常温下从固态和液态向气态转化。
2. 溶解性芳烃在水中不溶解,但它们可以与有机溶剂如醚、醇、酮等溶解生成适当的溶液。
这是因为芳烃分子中含有较为稳定的π键,呈现较为规则的空间结构,使得与水分子之间的相互作用力不足以克服芳烃分子内部的相互作用力,从而导致芳烃不溶于水。
芳香烃的性质

芳⾹烃的性质芳⾹烃的性质物理性质芳⾹烃不溶于⽔,但溶于,如、、等。
⼀般芳⾹烃均⽐⽔轻;沸点随升⾼⽽升⾼;熔点除与相对分⼦质量有关外,还与其结构有关,通常对位异构体由于分⼦对称,熔点较低。
⼀些常见芳⾹烃的物理性质列于下表中:⼀些常见的芳⾹烃的名称及物理性质化学性质加成反应1.苯的加成反应具有特殊的稳定性,⼀般不易发⽣加成反应。
但在特殊情况下,芳烃也能发⽣加成反应,⽽且总是三个双键同时发⽣反应,形成⼀个体系。
如苯和氯在阳光下反应,⽣成六氯代环⼰烷。
只在个别情况下,⼀个双键或两个双键可以单独发⽣反应。
2.萘、蒽和菲的加成反应萘⽐苯容易发⽣加成反应,例如:在不受光的作⽤下,萘和⼀分⼦氯⽓加成得1,4⼆氯化萘,后者可继续加得,反应在这⼀步即停⽌,因为四氯化后的分⼦剩下⼀个完整的苯环,须在催化剂作⽤下才能进⼀步和氯⽓反应。
1,4-⼆氯化萘和1,2,3,4-四氯化萘加热可以失去氯化氢⽽分别得1-氯代萘和1,4-⼆氯代萘。
由于稠环化合物的环⼗分活泼,因此⼀般不发⽣侧链的卤化。
蒽和菲的9、10位化学活性较⾼,与卤素的加成反应优先在9、10位发⽣。
还原反应还原反应(钠、钾或锂)在液氨与醇(⼄醇、异丙醇或⼆级丁醇)的混合液中,与芳⾹化合物反应,苯环可被还原成1,4-环⼰⼆烯类化合物,这种反应叫做Birch(伯奇)还原。
例如,苯可被还原成。
Birch还原反应与苯环的催化氢化不同,它可使芳环部分还原⽣成环⼰⼆烯类化合物,因此Birch还原有它的独到之处,在合成上⼗分有⽤。
萘同样可以进⾏Birch还原。
萘发⽣Birch还原时,可以得到1,4⼆氢化萘和1,4,5,8-四氢化萘。
2.催化氢化反应苯在催化氢化( catalytic hydrogenation)反应中⼀步⽣成环⼰烷体系。
萘在发⽣催化加氢反应时,使⽤不同的催化剂和不同的反应条件,可分别得到不同的加氢产物。
蒽和菲的9、10位化学活性较⾼,与氢⽓加成反应优先在9、10位发⽣。
有机化学 第五章 芳烃

Ⅰ 贡献大
Ⅱ
Ⅲ
Ⅳ 贡献小 键长、键角不等 的不等价结构
Ⅴ
键长,键角完全 相等的等价结构
H
H
H
H
H
H
苯的结构小结
(1)苯是一个正六边形的平面分子,键长、键角平均化; )苯是一个正六边形的平面分子,键长、键角平均化; (2)电子云分布在苯环的上方和下方; )电子云分布在苯环的上方和下方; 电子高度离域, 个 电子在基态下都在成键轨道 (3)π电子高度离域,6个π电子在基态下都在成键轨道 ) 电子高度离域 内,故体系的能量降低,而使苯环稳定。 故体系的能量降低,而使苯环稳定。
(3)具有平面和接近平面的环状结构。 (3)具有平面和接近平面的环状结构。 具有平面和接近平面的环状结构 (4) 易发生亲电取代反应 不易发生加成反应。 易发生亲电取代反应,不易发生加成反应 不易发生加成反应。
单环芳烃 联苯和联多苯 苯系芳烃 如:
联苯
芳烃
多环芳烃
本文由duan490513584贡献
ppt文档可能在WAP端浏览体验不佳。建议您优先选择TXT,或下载源文件到本机查看。
第五章
芳烃—— 芳香族碳氢化合物 芳烃
(1)碳氢比高 如: C:H=1:1 C : H = 10 : 8
特点
碳碳键长介于C—C与C=C之间 (2) 碳碳键长介于C—C与C=C之间 如: 0.139nm C— C 0.154nm C=C 0.133nm
三苯甲烷 2,3-二甲基 苯基己烷 二甲基-1-苯基己烷 二甲基
苯基: 苯基: -Ph 、 芳基: -Ar 芳基: R CH2H3C-CH3
m-二甲苯 二甲苯 1,3-二甲苯 二甲苯
芳烃的性质实验报告

芳烃的性质实验报告芳烃的性质实验报告引言:芳烃是一类具有苯环结构的有机化合物,其分子结构稳定,具有一系列独特的性质。
本实验旨在通过一系列实验方法,研究芳烃的性质,探索其在化学反应中的特殊行为。
实验一:芳烃的燃烧性质实验步骤:1. 取一小块苯并点燃,观察燃烧现象。
2. 重复以上步骤,分别使用甲苯和二甲苯进行燃烧实验。
实验结果与讨论:在实验过程中,我们观察到苯、甲苯和二甲苯都能够燃烧,产生明亮的火焰。
这表明芳烃具有良好的燃烧性质。
与脂肪烃相比,芳烃的燃烧热较高,燃烧过程更加剧烈。
这是因为芳烃分子中的苯环结构使得其分子间的相互作用更加紧密,燃烧时释放的能量更多。
实验二:芳烃的溶解性质实验步骤:1. 取苯、甲苯和二甲苯各一小部分,分别加入不同的溶剂中(如水、乙醇、石油醚等),观察其溶解情况。
2. 重复以上步骤,将溶剂温度分别升高和降低,观察溶解性的变化。
实验结果与讨论:在实验中,我们发现苯、甲苯和二甲苯均不溶于水,但能够溶于有机溶剂如乙醇和石油醚。
这是因为芳烃分子中的苯环结构使得其分子间的相互作用较强,难以与水分子形成氢键。
而与有机溶剂相比,芳烃分子间的相互作用较弱,易于与有机溶剂形成溶解。
实验三:芳烃的亲电取代反应实验步骤:1. 取苯为反应物,加入溴水,搅拌一段时间。
2. 观察反应过程中的变化,如颜色变化、沉淀形成等。
实验结果与讨论:在实验中,我们发现苯与溴水发生反应后,溶液的颜色由无色逐渐变为橙黄色,同时观察到溶液中出现沉淀。
这是由于苯分子中的π电子云具有高度稳定性,难以被亲电试剂攻击。
然而,通过加入溴水作为亲电试剂,溴离子能够与苯环发生取代反应,形成溴代芳烃产物。
实验四:芳烃的亲核取代反应实验步骤:1. 取苯为反应物,加入浓硫酸和浓硝酸的混合液,搅拌一段时间。
2. 观察反应过程中的变化,如颜色变化、气体产生等。
实验结果与讨论:在实验中,我们发现苯与浓硫酸和浓硝酸的混合液发生反应后,溶液的颜色由无色逐渐变为深红色,同时观察到气体的产生。
第七讲 芳烃
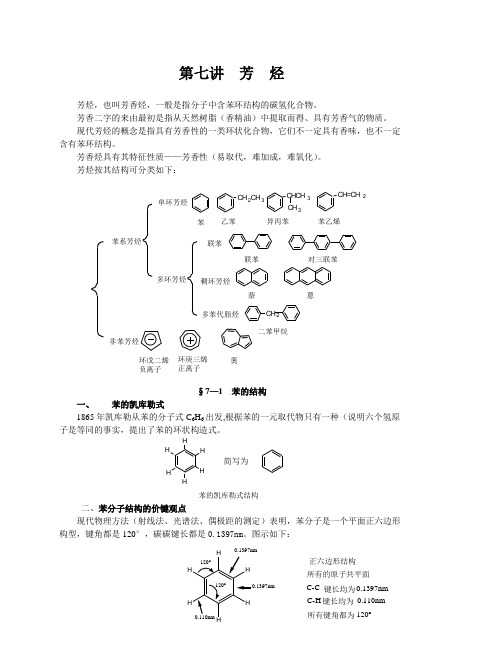
第七讲 芳 烃芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。
芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含有苯环结构。
芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。
芳烃按其结构可分类如下:§7—1 苯的结构一、 苯的凯库勒式1865年凯库勒从苯的分子式C 6H 6出发,根据苯的一元取代物只有一种(说明六个氢原子是等同的事实,提出了苯的环状构造式。
苯的凯库勒式结构 二、苯分子结构的价键观点现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是一个平面正六边形构型,键角都是120°,碳碳键长都是0.1397nm 。
图示如下:2CH 3CHCH 32CH 3CH 2苯系芳烃非苯芳烃单环芳烃多环芳烃联苯稠环芳烃多苯代脂烃苯乙苯异丙苯苯乙烯联苯对三联苯萘 蒽二苯甲烷环戊二烯负离子环庚三烯正离子薁简写为所有的原子共平面键长均为键长均为所有键角都为C-C C-H 0.1397nm0.110nm 120°0.1397nm正六边形结构理论解释:1. 杂化轨道理论解释苯分子中的碳原子都是以sp 2杂化轨道成键的,故键角均为120°,所有原子均在同一平面上。
未参与杂化的P 轨道都垂直与碳环平面,彼此侧面重叠,形成一个封闭的共轭体系,由于共轭效应使π电子高度离域,电子云完全平均化,故无单双键之分。
2. 分子轨道理论解释分子轨道理论认为,分子中六个P 轨道线形组合成六个π分子轨道,其中三个成键规定,三个反键轨道。
在基态时,苯分子的六个π电子成对填入三个成键轨道,其能量比原子轨道低,所以苯分子稳定,体系能量 较低 。
苯分子的大π键是三个成键轨道叠加的结果,由于π电子都是离域的,所以碳碳键长完全相同。
二、 从氢化热看苯的稳定性苯中的P 轨道P轨道的重叠E 原子轨道反键轨道成键 轨道苯的分子轨道能级示意图H 22H 23H 2H=_120KJ / mol H=_232KJ / molH=_208KJ / mol H 苯实=208 KJ / molH 苯理=3x120=360KJ / molE ψψ351三个节面苯的π电子分子轨道重叠情况苯的稳定化能(离域能或共振能)=360-208=152KJ/mol三、苯的共振式和共振论的简介 (自学)§7—2 单环芳烃的异构和命名一、 异构现象1.烃基苯有烃基的异构例如:2.二烃基苯有三中位置异构例如: 3. 三取代苯有三中位置异构 例如:二、 命名 1.基的概念芳烃分子去掉一个氢原子所剩下的基团称为芳基(Aryl )用Ar 表示。
芳 烃

44芳烃内容提要芳烃是一类重要的化合物,芳烃结构的特殊性导致其不一般的物理、化学性质。
掌握这些物质的结构极其性质,其中亲电取代反应极其理论,亲电取代反应中的定位效应是本章的重点和难点。
了解芳烃化合物在有机化学和有机化工,特别是石油化工中的应用。
芳香族碳氢化合物(又名芳烃)是一类在结构上具有单、双键相间的环状化合物。
因这类化合物具有芳香气味而得名。
芳烃虽然含有单键、双键和碳环,但它们的化学性质与烷烃、烯烃、炔烃以及脂环烃都有很大区别。
这种特殊性曾经被作为芳香性的标志。
芳香族碳氢化合物及其衍生物在有机化学中占有非常重要的地位。
最常见的芳烃是含苯环的化合物,而不含苯环的芳烃称为非苯芳烃。
4.1 芳烃的分类、命名和结构4.1.1 芳烃的分类根据是否有苯环以及所含苯环的数目和连结方式的不同,芳烃可以分为三类:单环芳烃、多环芳烃及非苯芳烃(见表4.1)。
4.1.2 芳香族化合物的命名4.1.2.1 单环芳烃和多苯代脂肪烃的命名单烷基苯以苯为母体,烷基作为取代基来命名。
多烷基苯的命名要标出取代基在苯环上的位置,取代基的位置用阿拉伯数字表示,或用邻(ortho-,简写作o-)、间(meta-,简写作m-)、对(para-,简写作p-)等字表示。
但苯环上烃基较复杂或有不饱和烃基时,可以把苯环作为取代基来命名。
邻二甲苯间二甲苯对二甲苯(1,2-二甲苯)(1,3-二甲苯)(1,4-二甲苯)CH 3CH 3CH 3CH 3CH 3CH 3异丙基苯 苯乙烯或乙烯基苯 1,2-二苯乙烯CH(CH 3)2CH CH 2CH CH4.1.2.2 取代单环芳烃的命名取代芳烃的命名遵循下列原则:1、某些取代基,如硝基(-NO 2),亚硝基(-NO),卤素(-X)等取代的芳烃, 母体总是苯。
读作“某(基)苯”。
NO 2BrCH 3NO 2硝基苯溴苯 间硝基甲苯2、当苯环上取代基为氨基(-NH 2)、羟基(-OH)、醛基(-CHO)和羧基(-COOH)等时,常把它们与苯环一起作为母体来命名,其它较简单的取代基作为取代基来命名。
有机化学第六章芳烃

第六章芳烃芳烃是芳香族碳氢化合物的简称。
一般情况下,把苯及其衍生物称为芳香族化合物。
其中分子中只含一个苯环的芳烃叫做单环芳烃。
芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含有苯环结构。
芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。
第一节单环芳烃的结构、异构和命名一、单环芳烃的结构苯是单环芳烃中最简单最重要的化合物,也是所有芳香族化合物的母体。
1. 凯库勒构造式根据元素分析得知苯的分子式为C6H6。
仅从苯的分子式判断,苯应具有很高的不饱和度,显示不饱和烃的典型反应—加成、氧化、聚合,然而苯却是一个十分稳定的化合物。
通常情况下,苯很难发生加成反应,也难被氧化,在一定条件下,能发生取代反应,称为“芳香性”。
1865年凯库勒从苯的分子式出发,根据苯的一元取代物只有一种,说明六个氢原子是等同的事实,提出了苯的环状结构。
这个式子虽然可以说明苯分子的组成以及原子间连接的次序,但这个式子仍存在着缺点,它不能说明苯既然含有三个双键,为什么苯不起类似烯烃的加成反应?环己烯的氢化热为119.6kJ/mol,如果苯的构造式用凯库勒式表示的话,苯的氢化热为环己烯氢化热的三倍。
119.6×3=358.8KJ/mol 。
实际上苯的氢化热是208.4KJ/mol,比预计的数值低150.4KJ/mol。
2.闭合共轭体系根据现代物理方法(如X射线法,光谱法等)证明了苯分子是一个平面正六边形构型,键角都是120℃ ,碳碳键的键长都是0.1397nm。
按照轨道杂化理论,苯分子中六个碳原子都以sp2杂化轨道互相沿对称轴的方向重叠形成六个C-C σ键,组成一个正六边形。
每个碳原子各以一个sp2杂化轨道分别与氢原子1s轨道沿对称轴方向重叠形成六个C-H σ键。
由于是sp2杂化,所以键角都是120℃,所有碳原子和氢原子都在同一平面上。
芳 烃

下,与酰卤(RC0-X)作用,生成芳酮。这个 反应是制备芳酮的重要方法之一。
注意:
a.酰基化反应不发生重排,可用克莱门
森法将 -CO- 还原成 -CH2- ,是由苯间
接合成烷基苯的方法。 b.苯环上引入酰基活性下降,不易生成 多酰基化产物。 c.苯环上有吸电子基时,不发生酰基化 反应。
* 加成反应
② 间位定位基(第二类定位基)
这类定位基可使第二个取代基进入它的间 位,常见的有: -N+(CH3)、 -NO2 –CN、 -COOH 、-SO3H 、 -CHO、 -COR 等。 特点:a.与苯环相连的原子,一般都是不饱和的 (-CCI3 除外)。 b.钝化苯环,难发生取代反应 c.为吸电子基,具有很强的吸电子能力
第六章 芳 烃(aromatic
hydrocarbon)
第一节 芳烃的定义及分类 第二节 苯的结构 第三节 单环芳烃 第四节 稠环芳烃 小结
第一节 芳烃的定义及分类
芳烃的是芳香族化合物的母体,主要是指 分子中含有苯环结构的烃。少数非苯芳烃,虽
不含苯环,但却含有结构、性质与苯环相似的
-O-、-NH2、-NHR、-NR2、-OH、-OCH3、 -NHCOCH3、-OCOR、-C6H5、-CH3、-X 等,定位能 力先强后弱。 特点: a.与苯环相连的原子一般都是饱和的(-CH=CH2
除外)
b.可活化苯环,比苯易进行亲电取代反应(卤 素除外) c.大部分是给电子基(具有给电子性能)
正离子在二氧化硫溶液中作用得到。
环庚三烯正离子的6个π电子
离域分布在7个碳原子上,因此是 稳定的,具有芳香性。
●
环辛四烯负离子 环辛四烯的π电子数为8,不符合休克尔规
16种常见多环芳烃的物理性质

萘【1】英文名称NAP Naphthalene分子量 128.18物理性质;密度1.162 熔点80.5℃,沸点217.9℃,凝固点,80.5℃,闪点78.89℃,折射率1.58212(100℃)恒压燃烧热:40264.1J/g(标准大气压,298.15K)恒压燃烧热:40205J/g(标准大气压,298.15K)。
不溶于水,溶于乙醇和乙醚等。
易挥发,易升华溶于乙醇后,将其滴入水中,会出现白色浑浊。
化学性质(1)萘的氧化温和氧化剂得醌,强烈氧化剂得酸酐。
萘环比侧链更易氧化,所以不能用侧链氧化法制萘甲酸。
电子云密度高的环易被氧化。
(2)萘的还原(3)萘的加成(4)萘的亲电取代反应萘的a-位比b-位更易发生亲电取代反应。
a-位取代两个共振式都有完整的苯环。
b-位取代只有一个共振式有完整的苯环。
在萘环上主要发生亲电取代,同苯环一样,但活性比苯环强从中间对称的两个C旁边的C 开始标,其中1,4,5,8号碳活性完全一样(称为阿尔法碳),2,3,6,7号碳性质完全一样(称为贝塔碳)。
一般情况下,阿尔法碳活性大于贝塔碳,取代基在阿尔法位上,这是由动力学控制,温度较高时,阿尔法碳[1]上取代基会转移到贝塔碳上。
但在萘的弗瑞德-克来福特酰基化反应,不加热却生成了阿尔法位和贝塔位的混合物。
如用硝基甲烷为溶剂,则主要生成贝塔酰化产物。
苊烯ANY Acenaphthylene 分子量:152.200性质:黄色棱柱状或板状结晶。
熔点92-93℃,沸点265-275℃(部分分解),156-160℃(3.73千帕),相对密度0.8988(16/2℃),易溶于乙醇、甲醇、丙醇、乙醚、石油醚、苯,不溶于水。
能在强酸中聚合。
苊ANA Acenaphthene 英文别名:1,8-Ethylenenaphthalene 分子量:154.21性状描述:白色或略带黄色斜方针状结晶。
物理参数:密度:1.0242(99/4°C) 熔点:96.2°C 沸点:279°C 闪点:125°C 折射率:1.6048(95°C)芴FLU Fluorene分子量:166.22性状描述:白色叶状至小片状结晶物理参数:密度:1.202 g/mL 熔点:116-117°C 沸点:295°C 闪点:151°C菲PHE Phenanthrene 分子量:178.23性状描述:类白色粉状结晶体。
实验15 芳烃的性质

实验15 芳烃的性质一、实验目的1. 掌握芳烃的品质鉴定方法,确定某些未知物质是否为芳烃。
2. 通过芳烃的性质实验,了解芳烃的燃烧性、溶解度、氧化还原性和取代反应等基本特性。
二、实验原理1. 芳烃的品质鉴定方法物质是芳烃有以下特点:(1)有苯环,即C6H5结构为母体结构。
(2)具有芳香味。
(3)较难与其他有机物发生反应。
(4)加热容易发生热解或裂解,产生芳烃或芳香烃。
(5)在硫酸、硝酸等强酸剂中不容易被铜或铁还原,但容易被氢氧化钠或氢氧化钾还原。
(6)芳烃的热稳定性较高,即能承受较高的温度而不分解。
(1)芳烃的燃烧性:芳烃燃烧时释放出大量的热能,并产生CO2和H2O,因此燃烧产生的热值较高。
(2)芳烃的溶解度:芳烃具有不良的溶解度,与水的溶解度很小,而与有机溶剂的溶解度较大。
(3)芳烃的氧化还原性:芳烃中的苯环与其他原子发生反应时,多数发生电子云共享的碳碳键加成反应。
(4)芳烃的取代反应:由于苯环的稳定性较高,是很难发生加成反应的,但是芳烃中的氢原子与一些取代试剂反应,可以发生取代反应。
三、实验操作将待鉴定物质溶解在水中,加入过量的氢氧化钾,观察是否有悬浮在溶液中的黄色物质出现,若出现,则为芳香酮或芳香烃。
2. 燃烧性实验将几滴苯加入蒸馏水中,并用玻璃杯盖住,将其倒置,用火机将水中的苯点燃,观察燃烧现象。
3. 溶解度实验取一定量的苯和甲醇,分别倒入两个试管中,观察两者是否能充分混合。
4. 氧化还原性实验将几滴溶有铁离子的盐酸滴入苯溶液中,观察反应现象。
5. 取代反应实验向苯溶液中加入利什曼试剂,观察反应现象。
四、实验结果及分析实验时发现苯能够燃烧,并产生明亮的火焰,燃烧结束后产生CO2和H2O。
经实验可知,苯与甲醇不能充分混合。
实验时,在苯溶液中加入少量的铁离子溶液,发现溶液颜色由无色变为了深紫色,说明芳烃具有较高的电子云稳定性,难于发生氧化还原反应。
实验时,将貌似白色结晶的利什曼试剂溶解在苯溶液中,观察到溶液由无色变为棕色,说明在利什曼试剂的作用下,苯中的氢原子被取代。
芳香烃的性质及应用

芳香烃的性质及应用芳香烃是由苯环或含有苯环结构的有机化合物,具有特殊的化学性质和应用。
以下是关于芳香烃性质及应用的详细介绍。
一、芳香烃的性质:1. 强烈的香气:芳香烃因为其结构中带有苯环,使其具有强烈的香气,常用于香水、香精等产品的制造。
2. 不溶于水:芳香烃的分子结构使其分子间只具有弱的范德华力,不具有极性,因此不溶于水,但可以溶于非极性溶剂如苯、氯仿等。
3. 高燃点和不稳定性:芳香烃具有较高的燃点和不稳定性,易燃且不易水解,容易聚合。
4. 具有麻醉作用:大部分芳香烃对人体有一定的麻醉作用,可以用于麻醉药物的合成。
二、芳香烃的应用:1. 化学品的合成:由于芳香烃具有多样的反应性,可以用于合成各种化学品。
例如,苯可用作甲苯、硝基苯等有机溶剂和合成材料的原料,具有重要的工业应用。
2. 香料和香水的制造:由于芳香烃具有较浓郁的香气,许多芳香烃被用作香料和香水的制造原料。
例如,香脂醛、苯乙烯等可用于制造香水。
3. 聚合物的制备:由芳香烃聚合而成的聚合物具有较高的熔点和强度,可用于制造高温材料、纤维、电子材料等。
例如,苯乙烯可以聚合为聚苯乙烯,用于制造塑料制品。
4. 医药领域:芳香烃在医药领域有广泛的应用。
例如,苯胺类化合物可作为抗菌药物,对抗真菌、细菌等有较好的效果。
此外,芳香烃也可用于合成药物的中间体。
5. 染料的合成:芳香烃作为染料的原料可以产生多种颜色,用于纺织工业、染料工业等。
例如,二苯甲酮类化合物可用于合成偶氮染料。
6. 有机金属化合物的合成:芳香烃可以通过和金属反应生成金属有机化合物,这些金属有机化合物广泛应用于有机合成、催化反应等领域。
总结起来,芳香烃具有强烈的香气、不溶于水、不稳定、具有麻醉作用等性质,广泛应用于化学品合成、香料和香水制造、聚合物制备、医药领域、染料合成、有机金属化合物合成等领域。
在未来,随着科技的不断发展,芳香烃的应用也将不断拓展和创新。
实验八芳烃的性质

实验八芳烃的性质一、实验目的1.掌握芳烃的化学性质,重点掌握取代反应的条件。
2.了解游离基的存在及化学检验方法。
3.掌握芳烃的鉴别方法。
二、实验仪器与药品苯、甲苯、二甲苯、环己烯、KMnO4、10%H2SO4、20%Br2/CCl4、10%NaOH、氨水、萘、浓HNO3、甲醛、CCl4、AlCl3三、实验步骤1.高锰酸钾溶液氧化在3支试管中分别加入苯、甲苯、环己烯各0.5mL,再分别加入0.5mL10% H2SO4溶液和1滴0.5% KMnO4溶液,水浴60-700C 加热15min,观察现象。
2.芳烃的取代反应(1)溴代①光对溴代反应的影响在3支小试管中分别加入等体积的苯、甲苯、二甲苯,液柱高度约3~4cm,把每只试管套上约1.5 cm高的黑纸筒。
在每只试管中各加入3~4滴Br2/CCl4溶液,振荡摇匀后,把试管放在离灯源2~3cm处,使每只试管上光照强度基本相等。
观察试管褪色情况。
②催化剂对溴代反应的影响在试管中加入3mL苯,0.5mL20%Br2/CCl4,再加入少量Fe粉,三个烧杯中分别加入10%NaOH,无离子水,氨水各10mL。
水浴加热整个试管,使之微沸,然后分别用上述3个小烧杯的液体吸收,观察现象反应毕,将反应液到入盛有10mL 水的小烧杯中,观察现象?(2)磺化4支试管分别加入苯,甲苯,二甲苯各1.5mL及萘0.5g,分别加入浓硫酸2mL,在水浴中加热到750C,振荡,观察比较各样品反应活性差异,把反应物分成两份,一份到入10mL水小烧杯,另一份到入10mL饱和NaCl中,观察现象?(3)硝化①一硝基化物的制取在干燥的大试管中加3ml浓HNO3,在冷却下逐滴加入4ml浓H2SO4,冷却振荡,然后将混酸分成两份,分别在冷却下滴加1mL苯、甲苯,充分振荡,在600C以下水浴数分钟,再分别倾入10mL冷水中,搅拌、静置、观察现象。
②二硝基化合物的制取在干燥的大试管中加入2mL浓HNO3,在冷却下逐滴加入4mL浓H2SO4,冷却,逐滴加1.5mL苯,在沸水中加热10min,冷却后,到入40mL冷水烧杯中,观察现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验15 芳烃的性质
一、实验目的
1. 1.掌握芳烃的化学性质,重点掌握取代反应的条件。
2. 2.了解游离基的存在及化学检验方法。
3. 3.掌握芳烃的鉴别方法。
二、实验仪器与药品
苯、甲苯、二甲苯、KMnO4、10%H2SO4、20%Br/CCl4、10%NaOH、氨水、萘、浓HNO3、甲醛、CCl4、AlCl3
三、实验步骤
1.高锰酸钾溶液氧化
①①苯、甲苯各0.5ml ③0.5ml10% H2SO4
②1滴0.5% KMnO4 ④水浴60-700C △
观察现象?
2.芳烃的取代反应
(1)(1)溴代
①光对溴代反应的影响
光照
a.2ml(苯、甲苯、二甲苯)
b. Br/CCl4
避光
观察现象?
②催化剂对溴代反应的影响
在试管中加入3ml苯,0.5ml20%Br/CCl4,再加入少量Fe粉,三个烧杯中分别加入10%NaOH,无离子水,氨水水浴加热整个试管,使之微沸,观察现象?反应毕,将反应液到入盛有10ml水的小烧杯中,观察现象?
(2)磺化
四支试管分别加入苯、甲苯、二甲苯各1.5ml及萘0.5g,分别加入浓硫酸溜2ml,水浴750C △,振荡,反应物分成两份,一份到入10ml水小烧杯,另一份到入10ml饱和NaCl中,观察现象?
(3)硝化
a.一硝基化物
3ml浓HNO3在冷却下逐滴加入4ml浓H2SO4冷却振荡,然后见混酸分成两份,分别在冷
却下滴加1ml苯、甲苯充分振荡,水浴数分钟,再分别倾入10ml冷水中,观察现象?
b.二硝基化合物
加入2ml浓HNO3,在冷却下逐滴加入4ml浓H2SO4,冷却,逐滴加1.5ml苯,在沸水中加热10min,冷却,到入40ml冷水烧杯中,观察现象?
3.芳烃的显色反应
a.甲醛—硫酸试验
将30mg固体试样(液体试样则用1-2滴)溶于1ml非芳烃溶剂,取此溶液1-2滴加到滴板上,再加一滴试剂,观察现象?
b.无水AlCl3-CHCl3试验
取1支干燥的试管,加入0.1-0.2g无水AlCl3,试管口放少许棉花,加热使AlCl3升华,并结晶在棉花上,取升华的AlCl3粉末少许置于点滴板孔内,滴加2-3滴样品(用氯仿溶解)即可观察到特征颜色的产生。
