氨基酸测定方法
氨基酸测定

食物中氨基酸的测定方法测定食物中的胱氨酸使用过甲酸氧化-氨基酸自动分析仪法,测定色氨酸使用荧光分光光度法,测定其它氨基酸使用氨基酸自动分析仪法。
一、氨基酸自动分析仪法1.原理食物蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
一份水解液可同时测定天冬,苏,丝,谷,脯,甘,丙,缬,蛋,异亮,亮,酪,苯丙,组,赖和精氨酸等16种氨基酸,其最低检出限为10pmol。
2.适用范围GB/T14965-1994食物中氨基酸的测定方法。
本法适用于食物中的16种氨基酸的测定。
其最低检出限为10pmol。
本方法不适用于蛋白质含量低的水果、蔬菜、饮料和淀粉类食物的测定3.仪器和设备3.1真空泵3.2恒温干燥箱3.3水解管:耐压螺盖玻璃管或硬质玻璃管,体积20~30ml。
用去离子水冲洗干净并烘干。
3.4真空干燥器(温度可调节)3.5氨基酸自动分析仪。
4.试剂全部试剂除注明外均为分析纯,实验用水为去离子水。
4.1浓盐酸:优级纯4.26mol/L盐酸:浓盐酸与水1:1混合而成。
4.3苯酚:需重蒸馏。
4.4混合氨基酸标准液(仪器制造公司出售):0.0025mol/L4.5缓冲液:4.5.1 pH2.2的柠檬酸钠缓冲液:称取19.6g柠檬酸钠(Na3C6H5O7.2H2O)和16.5ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至2.24.5.2 pH3.3的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和12ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节至pH至3.3。
4.5.3 pH4.0的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和9ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至4.0。
4.5.4 pH6.4的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和46.8g氯化钠(优级纯)加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至6.4。
8第六章 氨基酸定量测定

1.原理: 强离子交换树脂-二乙烯苯树脂: 交联度大,8-12%。 树脂的结构紧密,孔隙度小,适用于分子较小的氨 基酸的分离。选用Na型的树脂。
吸附:一般在pH2.2溶解样品,由于pH比较低,氨 基酸的H+解离被抑制,氨基酸带正电荷,可以与阳 离子交换树脂发生交换。
样品 液
分离 柱
M
Na+
pK1
COOCH2(CH2)4+NH3
+NH 3
pK2 9.0
COO CH2(CH2)4+NH3 NNH2 NH2
赖氨酸的等当电=( pK1+pK2)/ 2 = 9.75
洗脱:当pH2.2,3.3,4.9等缓冲液相继流经树脂时, 随着pH逐渐升高,氨基酸失去正电荷,与树脂结合 减弱,从树脂上脱落下来。由于氨基酸的氨基不同, 因此与柱子的结合能力不同。 酸性氨基酸带的正电荷少,等电点比较低,碱性氨 基酸带的正电荷多,被置换下来的pH比较高。
吹数分钟(或置于70~80℃烘
箱中烘干)即可观察到紫红色
的氨基酸斑点,脯氨酸例外,
为黄色斑点。
用铅笔圈出氨基酸斑点,量出溶剂前沿的距离及 各斑点中心与起点之间的距离,并计算各氨基酸 的Rf值。
原点到层析点中心的距离
Rf= 原点到溶剂前沿的距离
标准氨基酸薄层层析色谱
氨基酸的性质与Rf之间的关系
层析的分离是基于氨基酸的非极性性质。 物质的极性越小(即非极性越大),在有机溶剂中分 配就越多,迁移率Rf就越大;
混合样
加样
洗脱剂
分离结果
影响电离的基团:氨基、羧基、胍基、咪唑基、酚基。
洗脱顺序: 酸性氨基酸,中性氨基酸,芳香族氨基 酸,碱性氨基酸 日立832型氨基酸分析仪的洗脱顺序: 天门冬,苏,丝,谷,脯,甘,丙,半胱,缬,蛋, 异亮,亮,酪,苯丙,赖,氨,组,精
检测蛋白质中氨基酸的含量的各种方法及优劣讨论

蛋白质中氨基酸的含量测定组成蛋白质的基本单位是氨基酸,氨基酸通过脱水缩合形成肽链。
蛋白质是由一条或多条多肽链组成的生物大分子,其含量测定是生化药品研究中最常用、最基本的分析方法之一。
目前其常用的测定方法有凯氏定氮法、福林酚法、双缩脲法、BcA法、考马斯亮蓝法、紫外分光光度法及荧光法。
1凯氏定氮法1.1方法本法系依据蛋白质为含氮的有机化合物,当与硫酸和硫酸铜、硫酸钾一同加热消化时使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。
然后碱化蒸馏使氨游离,用硼酸液吸收后以硫酸滴定液滴定,根据酸的消耗量乘以氮转化为蛋白质的换算系数,即为蛋白质的含量。
本法各国药典收载的方法一致。
故参照《中国药典》2005年版三部[41附录方法,按纯蛋白类供试品及添加无机含氮物质及有机非蛋白质含氮物质的供试品分别拟定各测定方法。
1.2讨论1.2.1凯氏定氮法虽耗时较长,但它是蛋白质测定方法中最经典的测定方法,本法所测的结果为蛋白质绝对浓度而非相对浓度,可用于标准蛋白质含量的准确测定。
1.2.2本法灵敏度较低,适用于O.2~2.o mg氮的测定,干扰少。
1.2.3蛋白质是复杂的含氮有机化合物,一般蛋白质的含氮量为16%,故含氮量转化为蛋白质的系数为6.25。
但由于不同蛋白质的结构差异,其换算系数会稍有区别,如乳制品为6.38,动物胶为5。
65等,因此一些特殊蛋白质应在各论中相应说吩其转化系数。
1.2.4在本法附注中起草了非蛋白氮供试品溶液制备的两种常用方法用于非氮的测定,一般采用钨酸沉淀法,但当供试品中含有氨基酸(精氨酸)时,由于其会影响蛋白质的沉淀,故建议采用三氯醋酸沉淀法方法(1)与方法(3)的线性相关系数均能达到0.999以上,较理想;方法(1)试剂配制繁琐且整个实验费时长,而方法(3)操作更简便快速。
氨基酸的测定方法

食物中氨基酸的测定方法测定食物中的胱氨酸使用过甲酸氧化-氨基酸自动分析仪法,测定色氨酸使用荧光分光光度法,测定其它氨基酸使用氨基酸自动分析仪法。
一、氨基酸自动分析仪法1.原理食物蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
一份水解液可同时测定天冬,苏,丝,谷,脯,甘,丙,缬,蛋,异亮,亮,酪,苯丙,组,赖和精氨酸等16种氨基酸,其最低检出限为10pmol。
2.适用范围GB/T14965-1994食物中氨基酸的测定方法。
本法适用于食物中的16种氨基酸的测定。
其最低检出限为10pmol。
本方法不适用于蛋白质含量低的水果、蔬菜、饮料和淀粉类食物的测定3.仪器和设备3.1真空泵3.2恒温干燥箱3.3水解管:耐压螺盖玻璃管或硬质玻璃管,体积20~30ml。
用去离子水冲洗干净并烘干。
3.4真空干燥器(温度可调节)3.5氨基酸自动分析仪。
4.试剂全部试剂除注明外均为分析纯,实验用水为去离子水。
4.1浓盐酸:优级纯4.26mol/L盐酸:浓盐酸与水1:1混合而成。
4.3苯酚:需重蒸馏。
4.4混合氨基酸标准液(仪器制造公司出售):0.0025mol/L4.5缓冲液:4.5.1 pH2.2的柠檬酸钠缓冲液:称取19.6g柠檬酸钠(Na3C6H5O7.2H2O)和16.5ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至2.24.5.2 pH3.3的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和12ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节至pH至3.3。
4.5.3 pH4.0的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和9ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至4.0。
4.5.4 pH6.4的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和46.8g氯化钠(优级纯)加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至6.4。
氨基酸的分析方法

氨基酸的分析方法
氨基酸的分析方法主要有以下几种:
1. 比色法:利用氨基酸中的吸收光谱特性进行定量分析。
对于有色氨基酸,可以直接用此方法进行分析,如色氨酸、酪氨酸等。
对于无色氨基酸,需事先进行衍生化反应,如二羧基二氨基联苯胺(DTNB)法,测定半胱氨酸含量。
2. 氨基酸自动分析仪:常用的分析方法是自动氨基酸分析仪,其原理是利用离子交换色谱技术对氨基酸进行分离和检测。
该方法操作简便,自动化程度高,可同时分析多种氨基酸,用于生化实验和质量检测。
3. 氨基酸序列测定法:利用氨基酸测定仪测定氨基酸的相对分子质量,进而测定氨基酸的分子序列,通常用于蛋白质结构分析和生物活性研究。
4. 纸层析法:利用氨基酸的亲水性和疏水性差异进行分离,通常用于初步鉴定氨基酸的含量和组成。
该方法简便易行,但准确性较低,仅可作为定性或半定量分析方法。
5. 高效液相色谱法:利用高效液相色谱技术对氨基酸进行分离和检测。
该方法灵敏度高、重复性好、分辨率高,可用于生化分析和质量检测。
氨基酸测定方法

氨基酸测定方法一、引言氨基酸是构成蛋白质的基本单位,因此对于蛋白质的研究和分析,氨基酸的测定是非常重要的。
目前,常用的氨基酸测定方法主要有色氨酸法、二硫化物法、硫酸铜法、乙醇胺法、二甲基乙二胺法等。
本文将从样品处理、试剂配制、实验步骤和数据处理等方面详细介绍氨基酸测定方法。
二、样品处理1. 样品收集:选择适当的组织或液体样品进行采集,如血清、尿液等。
2. 样品预处理:根据不同样品特点进行预处理,如尿液中可加入少量硝酸使其变为无色透明状态。
3. 样品保存:在低温条件下保存样品以避免其蛋白质降解。
三、试剂配制1. 氢氧化钠溶液:取固体氢氧化钠加入去离子水中搅拌至完全溶解。
2. 硫代乙酰胺溶液:取固体硫代乙酰胺加入去离子水中搅拌至完全溶解。
3. 氨基酸标准溶液:将各种氨基酸按照一定比例加入去离子水中,调节pH值至7.0左右。
4. 还原剂:取固体羟肟酸钠加入去离子水中搅拌至完全溶解。
四、实验步骤1. 样品处理:取适量的样品加入硫代乙酰胺溶液中,混合均匀后放置于60℃恒温水浴中反应20分钟。
2. 加入还原剂:将还原剂加入反应体系中,混合均匀后再次放置于60℃恒温水浴中反应20分钟。
3. 加入氢氧化钠溶液:将氢氧化钠溶液加入反应体系中,混合均匀后放置于60℃恒温水浴中反应30分钟。
4. 加入试剂:取适量的氨基酸标准溶液和待测样品分别加入反应体系中,混合均匀后放置于室温下静置10分钟。
5. 测定吸光度:使用分光光度计在570nm波长下测定反应体系的吸光度值。
五、数据处理1. 绘制标准曲线:将不同浓度的氨基酸标准溶液分别测定吸光度值,绘制标准曲线。
2. 计算待测样品中氨基酸含量:根据待测样品的吸光度值和标准曲线计算其中氨基酸含量。
3. 数据统计分析:对实验数据进行统计分析,如平均值、方差等。
六、注意事项1. 实验过程中要注意卫生和安全,避免试剂进入眼睛和口腔。
2. 样品处理时要避免过度稀释或过度浓缩,以保证实验结果的准确性。
测定氨基酸,磺基水杨酸的方法

测定氨基酸,磺基水杨酸的方法
测定氨基酸的方法主要有以下几种:
1. 布鲁斯试剂法:使用布鲁斯试剂与氨基酸发生反应,生成紫色或蓝色络合物,通过比色法或光度法来测定氨基酸的含量。
2. 紫外光谱法:氨基酸在紫外光下有特征性的吸收峰,通过测量吸收峰的强度来确定氨基酸的浓度。
3. 核磁共振法:使用核磁共振仪器对氨基酸样品进行分析,通过观察氨基酸在不同磁场下的共振信号来确定其结构和浓度。
磺基水杨酸的测定方法主要有以下几种:
1. UV-Vis光谱法:磺基水杨酸在紫外光下有特征性的吸收峰,通过测量吸收峰的强度来确定其浓度。
2. 氯化亚砜法:磺基水杨酸与氯化亚砜反应生成产物,通过测量产物浓度来确定磺基水杨酸的浓度。
3. 离子色谱法:使用离子色谱仪对磺基水杨酸进行分析,通过观察峰的面积或高度来确定其浓度。
请注意,以上方法仅为常用的测定方法之一,具体使用哪种方法还要根据实际情况来确定。
n端氨基酸和c端氨基酸的测定

n端氨基酸和c端氨基酸的测定引言:氨基酸是构成蛋白质的基本单元,对于研究蛋白质的结构和功能具有重要意义。
而氨基酸的n端和c端是蛋白质的两个重要端点,其测定对于研究蛋白质的合成、分解和修饰过程具有重要意义。
本文将介绍n端氨基酸和c端氨基酸的测定方法和应用。
一、n端氨基酸的测定方法n端氨基酸是蛋白质的起始氨基酸,其测定可以揭示蛋白质的合成起始位点,帮助我们理解蛋白质的合成机制和调控过程。
1. N-末端测定方法常用的n端氨基酸测定方法包括Edman降解法和质谱法。
Edman降解法是一种经典的测定n端氨基酸的方法。
该方法通过将蛋白质与Edman试剂反应,将n端氨基酸转化为可检测的衍生物,再通过高效液相色谱等技术进行分离和检测。
这种方法适用于含有少量氨基酸的蛋白质,但对于大分子蛋白质或富含脂肪酸的蛋白质不适用。
质谱法是一种快速准确测定n端氨基酸的方法。
通过将蛋白质进行酶解,生成n端氨基酸段和肽段,然后利用质谱仪对其进行分析和鉴定。
质谱法具有高灵敏度、高分辨率和高通量的优点,适用于复杂样品的分析。
2. 应用和意义n端氨基酸的测定可以帮助我们揭示蛋白质的合成机制和调控过程。
例如,在研究蛋白质的转录后修饰时,可以通过测定n端氨基酸的变化来判断修饰酶的活性和底物特异性。
此外,n端氨基酸的测定在蛋白质工程和药物研发中也具有重要应用价值。
二、c端氨基酸的测定方法c端氨基酸是蛋白质的终止氨基酸,其测定可以揭示蛋白质的合成终止位点,帮助我们理解蛋白质的翻译终止机制和调控过程。
1. C-末端测定方法常用的c端氨基酸测定方法包括质谱法和抗体检测法。
质谱法是一种常用的测定c端氨基酸的方法。
通过将蛋白质进行酶解,生成c端氨基酸段和肽段,然后利用质谱仪对其进行分析和鉴定。
质谱法具有高灵敏度和高分辨率的优点,适用于复杂样品的分析。
抗体检测法是一种特异性较高的测定c端氨基酸的方法。
通过将蛋白质与特异性抗体结合,再利用酶标记的二抗和底物进行信号放大和检测。
氨基酸测定方法
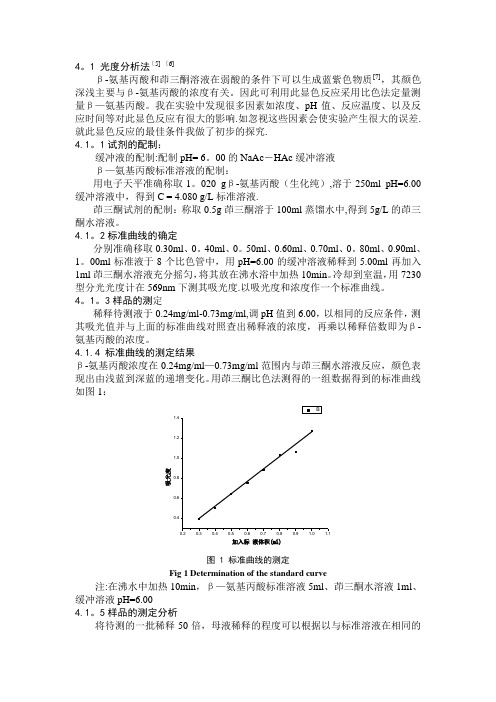
4。
1 光度分析法[5] [6]β-氨基丙酸和茚三酮溶液在弱酸的条件下可以生成蓝紫色物质[7],其颜色深浅主要与β-氨基丙酸的浓度有关。
因此可利用此显色反应采用比色法定量测量β—氨基丙酸。
我在实验中发现很多因素如浓度、pH 值、反应温度、以及反应时间等对此显色反应有很大的影响.如忽视这些因素会使实验产生很大的误差.就此显色反应的最佳条件我做了初步的探究.4.1。
1试剂的配制:缓冲液的配制:配制pH= 6。
00的NaAc -HAc 缓冲溶液β—氨基丙酸标准溶液的配制:用电子天平准确称取1。
020 g β-氨基丙酸(生化纯),溶于250ml pH=6.00缓冲溶液中,得到C = 4.080 g/L 标准溶液.茚三酮试剂的配制:称取0.5g 茚三酮溶于100ml 蒸馏水中,得到5g/L 的茚三酮水溶液。
4.1。
2标准曲线的确定分别准确移取0.30ml 、0。
40ml 、0。
50ml 、0.60ml 、0.70ml 、0。
80ml 、0.90ml 、1。
00ml 标准液于8个比色管中,用pH=6.00的缓冲溶液稀释到5.00ml 再加入1ml 茚三酮水溶液充分摇匀,将其放在沸水浴中加热10min 。
冷却到室温,用7230型分光光度计在569nm 下测其吸光度.以吸光度和浓度作一个标准曲线。
4。
1。
3样品的测定稀释待测液于0.24mg/ml-0.73mg/ml,调pH 值到6.00,以相同的反应条件,测其吸光值并与上面的标准曲线对照查出稀释液的浓度,再乘以稀释倍数即为β-氨基丙酸的浓度。
4.1.4 标准曲线的测定结果β-氨基丙酸浓度在0.24mg/ml —0.73mg/ml 范围内与茚三酮水溶液反应,颜色表现出由浅蓝到深蓝的递增变化。
用茚三酮比色法测得的一组数据得到的标准曲线如图1:吸光度加入标液体积(ml)图 1 标准曲线的测定Fig 1 Determination of the standard curve注:在沸水中加热10min ,β—氨基丙酸标准溶液5ml 、茚三酮水溶液1ml 、缓冲溶液pH=6.004.1。
氨基酸测定

茚三酮显色法测定氨基酸的含量一.原理:凡含有自由氨基的化合物,如蛋白质、多肽、氨基酸的溶液与水合茚三酮共热时,能产生紫色化合物,可用比色法进行测定。
氨基酸与茚三酮的反应分两个步骤。
第一步是氨基酸被氧化形成CO2、NH3和醛、茚三酮被还原成还原型茚三酮;第二步是所形成的还原型茚三酮与另一个茚三酮分子和NH3缩合生成有色物质。
二.仪器:721型分光光度计台天平减压蒸馏器干燥容量瓶移液枪烧杯试管架试管水浴锅。
三.药品:(1)标准氨基酸溶液:配制成0.3 mmol/L 溶液(2)pH5.4,2mol/L 醋酸缓冲液:量取86mL 2mol/L 醋酸钠溶液,加入14mL 2mol/L 乙酸混合而成。
用pH 检查校正。
(3)茚三酮显色液:称取170mg 茚三酮和30mg 还原茚三酮,用20mL 乙二醇甲醚溶解(4)60%乙醇。
(5)样品液:每毫升含0.5~50μg 氨基酸。
茚三酮若变为微红色,则需按下法重结晶:称取5g 茚三酮溶于15~25mL 热蒸馏水中,加入0.25g 活性炭,轻轻搅拌。
加热30min 后趁热过滤,滤液放入冰箱过夜。
次日析出黄白色结晶,抽滤,用1mL 冷水洗涤结晶,置干燥器干燥后,装入棕色玻璃瓶保存。
还原型茚三酮按下法制备:称取0.5g 茚三酮,用12.5mL 沸蒸馏水溶解,得黄色溶液。
将0.5g 维生素C 用25mL 温蒸馏水溶解,一边搅拌一边将维生素C 溶液滴加到茚三酮溶液中,不断出现沉淀。
滴定后继续搅拌15min,然后在冰箱内冷却到4℃,过滤、沉淀用冷水洗涤3 次,置五氧化二磷真空干燥器中干燥保存,备用。
乙二醇甲醚若放置太久,需用下法除去过氧化物:在500mL 乙二醇甲醚中加入5g 硫酸亚铁,振荡1~2h,过滤除去硫酸亚铁,再经蒸馏,收集沸点为121~125℃的馏分,为无色透明的乙二醇甲醚。
四、操作步骤1.标准曲线的制作分别取0.3mmol/L 的标准氨基酸溶液0,0.2,0.4,0.6,0.8,1.0mL 于试管中,用水补足至1mL。
氨基酸的定量测定

6、三硝基苯磺酸法
原理: 三硝基苯磺酸(TNBS)是定量测定氨基酸的重要试剂之一。 TNBS 在偏碱性的条件下与氨基酸反应,先形成中间络合物。 中间络合物在光谱上有2个吸收值相近的高峰,分别位于355nm 和420nm 附近。然而溶液一旦酸化,中间络合物转化成三硝基苯 -氨 基酸(TNP-氨基酸),420nm 处的吸收值显著下降,而350nm 附近 的吸收峰则移至340nm 处。 利用 TNBS 与氨基酸反应的这一特性,可在420nm 处(偏碱性 溶液中)或在340nm(偏酸性溶液中)对氨基酸进行定量测定。在 340nm 处,各氨基酸的吸收度大致相近,而在420nm 处的吸光度因 2 氨基酸种类而异;在加入适量 SO3 时,吸收值升高。 本法允许的测定范围是 0.05~0.4μmol 氨基酸。
1、甲醛滴定法
计算结果:
氨基酸态氮含量=
(V2 V1 ) c 0.014 100 % m
式中:c——氢氧化钠标准溶液的浓度,mol/L V1——用中性红作指示剂滴定时消耗氢氧化钠标准溶液体积,mL V2——用百里酚酞作指示剂滴定时消耗氢氧化钠标准溶液体积, mL m——测定用样品溶液相当于样品的质量,g 1 0.014—— N2毫摩尔质量,g/mmol
100%
式中:VHClO ——所消耗的高氯酸标准溶液的体积 cHClO ——所消耗的高氯酸标准溶液的浓度 M——被测氨基酸的摩尔质量 m——被测氨基酸的质量
4
4、非水溶液滴定法
②回滴法(适用于不易溶解于冰醋酸而能溶解于高氯酸的氨基酸):精确称取氨 基酸样品30~40mg 左右,溶解于5mL高氯酸标准溶液中,加2滴甲基紫指示剂,剩 余的酸以醋酸钠溶液滴定,颜色变化由黄,经过绿、蓝至初次出现不褪的紫色为 终点。 氨基酸含量=
氨基酸常用的检测方法和原理

氨基酸常用的检测方法和原理氨基酸是构成蛋白质的基本组成单元,对于研究蛋白质结构和功能具有重要意义。
因此,准确、快速地检测氨基酸的方法和原理是科学研究和实际应用中的关键问题之一。
本文将介绍几种常用的氨基酸检测方法及其原理。
一、纸层析法纸层析法是一种简单、快速的氨基酸检测方法。
其原理是根据氨基酸在纸上的迁移速度差异来分离和检测氨基酸。
首先,将待测样品与色谱溶剂混合,然后将混合液滴在纸上,待溶剂上升至一定高度后,根据不同氨基酸的迁移距离和颜色变化,可以判断样品中是否含有特定的氨基酸。
二、高效液相色谱法(HPLC)高效液相色谱法是一种精确、灵敏的氨基酸检测方法。
其原理是利用氨基酸在液相中的分配系数差异来实现分离和检测。
首先,将待测样品通过色谱柱进行分离,然后通过检测器检测样品中各种氨基酸的浓度。
由于不同氨基酸的分配系数不同,它们在色谱柱中的停留时间也不同,从而实现了氨基酸的分离和检测。
三、毛细管电泳法毛细管电泳法是一种高效、快速的氨基酸检测方法。
其原理是利用氨基酸在电场作用下在毛细管中的迁移速度差异来实现分离和检测。
首先,将待测样品注入毛细管中,然后施加电场,通过检测器检测样品中各种氨基酸的浓度。
由于不同氨基酸的电荷性质和大小不同,它们在电场作用下的迁移速度也不同,从而实现了氨基酸的分离和检测。
四、质谱法质谱法是一种高精确度、高灵敏度的氨基酸检测方法。
其原理是利用氨基酸分子在质谱仪中的质量-电荷比差异来实现分离和检测。
首先,将待测样品通过质谱仪进行分离,然后通过检测器检测样品中各种氨基酸的质量-电荷比。
由于不同氨基酸的分子量不同,它们在质谱仪中的质量-电荷比也不同,从而实现了氨基酸的分离和检测。
纸层析法、高效液相色谱法、毛细管电泳法和质谱法是常用的氨基酸检测方法。
每种方法都有其独特的原理和优势,可以根据实际需要选择合适的方法进行氨基酸的检测。
这些方法的应用不仅在科学研究中具有重要意义,也在食品、医药等领域有着广泛的应用前景。
氨基酸总量测定方法

氨基酸总量测定方法咱今儿就来讲讲氨基酸总量测定方法,这可是个很有意思的事儿呢!你想想啊,氨基酸就像是我们身体里的小宝贝,它们的数量和状态对我们可重要啦!要说测定氨基酸总量,那方法可不少呢。
就好像我们要去一个地方,有好多条路可以走。
比如说茚三酮比色法,这就像是走一条大家都比较熟悉的大道,可靠又实用。
把样品和茚三酮试剂一混合,经过一系列反应,就能通过颜色的变化来大致知道氨基酸的量啦。
这多神奇呀!还有甲醛滴定法,这就好比是找到了一个特别的窍门。
利用甲醛和氨基酸的反应,然后通过滴定来确定数量。
是不是感觉很有意思呢?就像解开一个小小的谜题。
再说说电位滴定法吧,这就像是有个特别精准的仪器在帮我们把关,能非常准确地测量出氨基酸的量呢。
那我们在实际操作的时候可得注意一些小细节哦!就像做饭要掌握好火候一样,不能马虎。
比如试剂的选择,一定要挑质量好的呀,不然怎么能得出准确的结果呢?还有操作步骤,一步都不能错哦,不然就像走在路上迷路了一样。
你说,要是我们不认真对待这些方法,那不是就像闭着眼睛走路吗?能走到目的地才怪呢!所以呀,我们得好好琢磨这些方法,就像对待宝贝一样。
在测定的过程中,每一个环节都很关键呢。
从样品的处理到最后的数据分析,都需要我们细心再细心。
这可不是闹着玩的事儿呀!而且呀,不同的样品可能需要不同的方法来测定氨基酸总量呢。
这就好像不同的人穿不同的衣服才合适一样。
你总不能给一个大人穿小孩的衣服吧?总之呢,氨基酸总量测定方法是个很有学问的事儿,我们可得好好研究研究。
只有这样,我们才能真正了解氨基酸的奥秘,才能更好地为我们的健康服务呀!这可不是开玩笑的哦!。
氨基酸测定方法

氨基酸测定方法一、引言氨基酸是构成蛋白质的基本组成单位,对于生命体的生长和发育起着重要的作用。
因此,准确测定氨基酸的含量和组成对于研究蛋白质结构和功能具有重要意义。
本文将介绍一些常用的氨基酸测定方法,包括色谱法、光谱法和化学法等。
二、色谱法测定氨基酸2.1 气相色谱法气相色谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品转化为易挥发的衍生物,然后使用气相色谱仪进行分析。
气相色谱法具有分离效果好、灵敏度高和操作简便等优点。
2.1.1 衍生化反应在气相色谱法中,常用的氨基酸衍生化反应包括酯化、酰化和取代反应等。
这些反应能够将氨基酸转化为易挥发的衍生物,便于后续的气相色谱分析。
2.1.2 气相色谱仪气相色谱仪是进行气相色谱分析的关键设备。
它由进样系统、色谱柱和检测器等部分组成。
进样系统用于将样品引入色谱柱,色谱柱用于分离氨基酸衍生物,检测器用于检测分离后的化合物。
2.2 液相色谱法液相色谱法也是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品溶解在溶剂中,然后使用液相色谱仪进行分析。
液相色谱法具有分离效果好、灵敏度高和选择性强等优点。
2.2.1 色谱柱选择在液相色谱法中,选择合适的色谱柱对于分离氨基酸非常重要。
常用的色谱柱包括离子交换柱、反相柱和手性柱等。
不同的色谱柱具有不同的分离机理和选择性,可以根据需要选择合适的色谱柱。
2.2.2 梯度洗脱条件在液相色谱法中,通过调整洗脱溶剂的组成和流速等参数,可以实现对氨基酸的有效分离。
梯度洗脱条件可以根据氨基酸的亲水性和极性等特性进行优化。
三、光谱法测定氨基酸3.1 紫外-可见光谱法紫外-可见光谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过测量氨基酸在紫外-可见光波段的吸收特性,来推断其含量和组成。
紫外-可见光谱法具有操作简便、灵敏度高和选择性强等优点。
3.1.1 吸收峰特征不同氨基酸在紫外-可见光谱中具有不同的吸收峰特征。
通过测量氨基酸的吸收峰强度和位置,可以推断其含量和组成。
氨基酸的测定方法比较分析

食物中氨基酸的测定方法一、氨基酸自动分析仪法1. 原理食物蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
一份水解液可同时测定天冬,苏,丝,谷,脯,甘,丙,缬,蛋,异亮,亮,酪,苯丙,组,赖和精氨酸等16种氨基酸,其最低检出限为10pmol。
2. 适用范围GB/T14965-1994食物中氨基酸的测定方法。
本法适用于食物中的16种氨基酸的测定。
其最低检出限为10pmol。
本方法不适用于蛋白质含量低的水果、蔬菜、饮料和淀粉类食物的测定3. 仪器和设备3.1 真空泵3.2 恒温干燥箱3.3 水解管:耐压螺盖玻璃管或硬质玻璃管,体积20~30ml。
用去离子水冲洗干净并烘干。
3.4 真空干燥器(温度可调节)3.5 氨基酸自动分析仪。
4. 试剂全部试剂除注明外均为分析纯,实验用水为去离子水。
4.1 浓盐酸:优级纯4.2 6mol/L盐酸:浓盐酸与水1:1混合而成。
4.3 苯酚:需重蒸馏。
4.4 混合氨基酸标准液(仪器制造公司出售):0.0025mol/L4.5 缓冲液:4.5.1 pH2.2的柠檬酸钠缓冲液:称取19.6g柠檬酸钠(Na3C6H5O7.2H2O)和16.5ml浓盐酸加水稀释到1 000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至2.24.5.2 pH3.3的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和12ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节至pH至3.3。
4.5.3 pH4.0的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和9ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至4.0。
4.5.4 pH6.4的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和46.8g氯化钠(优级纯)加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至6.4。
4.6 茚三酮溶液4.6.1 pH5.2的乙酸锂溶液:称取氢氧化锂(LiOH.H2O)168g,加入冰乙酸(优级纯)279ml,加水稀释到1000ml,用浓盐酸或50%的氢氧化钠调节pH至5.2。
氨基酸的含量测定方法

氨基酸的含量测定方法
氨基酸的含量可以用不同的方法进行测定,以下是其中几种常用的方法:
1. 紫外吸收法(UV法):氨基酸分子中存在芳香族环和烯烃键,可以吸收紫外光,根据吸收的强度来确定氨基酸的浓度。
2. 高效液相色谱法(HPLC法):这是一种常用的测定氨基酸含量的方法,通过将样品中的氨基酸溶解后注入液相色谱仪中,利用氨基酸在不同条件下的保留时间和峰面积来测定其含量。
3. 伯里特法:伯里特试剂能与氨基酸发生比色反应,该方法适用于测定含有酪蛋白、皮质素等色泽较重的氨基酸的含量。
4. 显色法:该方法将氨基酸和特定试剂反应,生成显色产物,根据产物的颜色深浅来测定氨基酸含量。
常用的显色试剂有二。
蛋白质与氨基酸的测定

蛋白质与氨基酸的测定
蛋白质测定可以采用以下方法:
1. 比色法:常用的比色剂有布鲁姆甘蓝G、伯胺蓝、硫酸铜-法明斯试剂等。
比色法的原理是蛋白质与比色剂形成复合物,复合物的颜色与蛋白质的含量成正比。
2. 生物学方法:通过测定蛋白质在生物体中所起的生物学作用,如酶活性、免疫反应等来定量测定蛋白质的含量。
3. 尿素-二元酸法:通过加入细胞膜清洗液中的尿素和二元酸,并利用这两种化合物对蛋白质的溶解性,然后根据其溶解度定量测定蛋白质的含量。
氨基酸的测定可以采用以下方法:
1. 比色法:在酸性条件下,氨基酸与2,4-二硝基苯肼、2,4-二硝基苯胺等发生磺酰化反应,形成淡棕色的产物,比色法根据产物的吸光度来定量测定氨基酸的含量。
2. 二级结构破坏法:通过加热和高浓度酸的处理,使蛋白质的二级结构破坏,进而测定其中的氨基酸含量。
3. 比重法:在油水分离流程中,用比重法分离出有机相,然后加入酸性溶液,
氨基酸与酸反应,形成有颜色的产物,根据产物的吸光度来定量测定氨基酸的含量。
氨基酸含量的测定

五、计算
标准甘氨酸氨基氮的回收率=
VNaoH*0.0500mol/L *14.008 理论计算值
理论计算值:取用氨基酸的体积乘以浓度,再乘以14.008 VNaoH 两次测定所用氨基酸的体积的平均值
每毫升氨基酸溶液中含氨基氮的毫克数为
式中:V1为滴定样品消耗氢氧化钠的体积(ml); V2为滴空白消耗氢氧化钠的体积(ml);
氨基酸的定量分析 —甲醛滴定法
一、目的:
初步掌握甲醛滴定法测定氨基酸含量的原理和操作要点
二、实验原理
水溶液中的氨基酸为兼性离子,因而不能直接用碱 滴定氨基酸的羧基。甲醛可与氨基酸上的—N+H3结合, 形成 — NH—CH2OH、—N(CH2—OH)2 等羟甲基衍生物 ,使 N+H3 上的 H+ 游离出来,这样就可以用碱滴定 N+H3 放出H+,测出氨基氮,从而计算氨基酸的按下表加入试剂。
锥形瓶编号 试剂
1
2
3
4
5
0.1mol/L甘氨酸溶液 /mL
中性甲醛溶液/mL 水/mL 0.5%酚酞酒精溶液 (滴) 未知浓度的 氨基酸混合溶液/mL
0
1 4 4 0
1
1 3 4 0
1
1 3 4 0
0
1 3 4 1
0
1 3 4 1
2、用0.0500mol/L NaOH溶液滴定至溶液变微红色 注意:滴定管中溶液的初始位置和滴定结束时的位置; 滴定管的使用方法 3、用0.0500mol/L NaOH溶液滴定至溶液变微红色 4、记录每次滴定所用的0.0500mol/L NaOH溶液的 体积
若样品中只含有单一的已知氨基酸,则可由此法滴 定的结果算出氨基酸的含量。若样品中含有多种氨 基酸(如蛋白质水解液),测不能由此法算出氨基 酸的含量。 脯氨酸与甲醛作用后,生成的化合物不稳定,导致 滴定后结果偏低;酪氨酸含酚基结构,导致滴定结 果偏高。
中国药典氨基酸测定方法

中国药典氨基酸测定方法
嘿,你知道中国药典的氨基酸测定方法吗?那可是相当厉害呢!先说说步骤吧,就像搭积木一样,一步一步来。
首先得准备好样品,这就好比做饭前要准备食材一样。
然后进行一系列的操作,比如提取、纯化啥的。
注意事项也不少呢!比如操作过程中要小心,别弄洒了样品,这就像端着宝贝瓷器,可得小心轻放。
测定过程中的安全性那是杠杠的!就像有个坚固的盾牌保护着你。
只要按照规范操作,基本不会有啥危险。
稳定性也没得说,就像一座稳稳的大山。
那应用场景可多了去了!制药、食品行业都能用得上。
优势也很明显呀,准确、可靠,就像一个靠谱的小伙伴。
咱再来看看实际案例。
有个制药厂,用这个方法测定氨基酸,效果那叫一个好!产品质量有了保障,市场竞争力也大大提升。
这难道不是很厉害吗?
中国药典的氨基酸测定方法真的超棒!它就像一个魔法棒,能为各个行业带来准确的结果,让我们的生活更有保障。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光度分析法[5] [6]β-氨基丙酸和茚三酮溶液在弱酸的条件下可以生成蓝紫色物质[7],其颜色深浅主要与β-氨基丙酸的浓度有关。
因此可利用此显色反应采用比色法定量测量β-氨基丙酸。
我在实验中发现很多因素如浓度、pH 值、反应温度、以及反应时间等对此显色反应有很大的影响。
如忽视这些因素会使实验产生很大的误差。
就此显色反应的最佳条件我做了初步的探究。
试剂的配制:缓冲液的配制:配制pH= 的NaAc -HAc 缓冲溶液β-氨基丙酸标准溶液的配制:用电子天平准确称取 g β-氨基丙酸(生化纯),溶于250ml pH=缓冲溶液中,得到C = g/L 标准溶液。
茚三酮试剂的配制:称取茚三酮溶于100ml 蒸馏水中,得到5g/L 的茚三酮水溶液。
标准曲线的确定分别准确移取、、、、、、、标准液于8个比色管中,用pH=的缓冲溶液稀释到再加入1ml 茚三酮水溶液充分摇匀,将其放在沸水浴中加热10min 。
冷却到室温,用7230型分光光度计在569nm 下测其吸光度。
以吸光度和浓度作一个标准曲线。
样品的测定稀释待测液于ml —ml,调pH 值到,以相同的反应条件,测其吸光值并与上面的标准曲线对照查出稀释液的浓度,再乘以稀释倍数即为β-氨基丙酸的浓度。
标准曲线的测定结果β-氨基丙酸浓度在ml —ml 范围内与茚三酮水溶液反应,颜色表现出由浅蓝到深蓝的递增变化。
用茚三酮比色法测得的一组数据得到的标准曲线如图1:吸光度加入标液体积(ml)图 1 标准曲线的测定Fig 1 Determination of the standard curve 注:在沸水中加热10min ,β-氨基丙酸标准溶液5ml 、茚三酮水溶液1ml 、缓冲溶液pH=样品的测定分析将待测的一批稀释50倍,母液稀释的程度可以根据以与标准溶液在相同的反应条件下反应,再观察样品的显色程度而确定。
取稀释后的产物液1ml,用pH=的缓冲液稀释到5ml再加入1ml茚三酮水溶液,在沸水中加热10min,测得如下数据如表3:表3 样品的测定Table 3 Determination of sample吸光度A待测液序号待测液所对应的反应时间110h220h322h浓度对显色反应的影响:实验表明,β-氨基丙酸与茚三酮水溶液在表3所注的条件反应的最低浓度为ml,随着β-氨基丙酸的浓度变大显色逐渐变深。
当浓度大于ml时,所显颜色过深或生成紫色化合物影响其吸光度。
当β-氨基丙酸的浓度在m—ml时,颜色变化明显而且稳定,因此,我选定此浓度范围作为测定范围。
得到的数据如表4:表4 浓度对显色反应的影响Table 4 Concentration on the colorpH值对显色反应的影响[8]以ml的标准溶液5ml,加入1ml茚三酮水溶液在沸水中加热10min,观察到的颜色变化如表5:表 5 pH值对显色反应的影响Table 5 The influence of pH on the color缓冲溶液Ph=显色反应随着pH值得不同,颜色有着明显的变化。
当pH值小于时几乎无色,而在pH值在—时颜色变化明显。
pH值为,加热不到二分钟即显色;pH值为,加入茚三酮溶液后不加热30s左右即显红棕色;茚三酮水溶液在强碱的条件下带有明显的淡黄色。
因此pH值为左右最好。
故我选定pH值为。
此时显色明显无干扰且稳定。
温度和反应时间的影响:实验表明:温度和反应时间对此显色反应的影响很大。
温度太低,反应太慢导致显色时间长,而且显色效果不好。
而温度过高,反应时间长对此反应影响也很大,会生成紫色化合物影响其吸光度。
在显色反应中,反应时间主要根据具体的颜色变化而定。
一般来说,β-氨基丙酸浓度在ml—ml时,在沸水中加热10min即可,时间太短,反映不完全颜色梯度不明显。
时间过长,溶液挥发严重也影响其吸光度。
故我把反应时间定在10min左右。
其他因素的影响不同溶剂的茚三酮溶液对显色反应也有一些影响。
为了区别它们对显色反应的影响,我做了如下实验:分别称取茚三酮三份,分别溶于乙醇、水、丙酮各100ml中,可以观察到:丙酮溶解茚三酮的速度最快,乙醇次之。
移取β-氨基丙酸标准溶液l)1ml三份,用pH值为的NaAc-HAc缓冲溶液稀释到5ml再依次加入1ml茚三酮水溶液、乙醇溶液以及丙酮溶液,在沸水中加热。
实验表明:在加热2min时,乙醇溶液开始显色;丙酮溶液的显红棕色;水溶液无色。
在加热6min时,丙酮溶液的颜色加深;水溶液显浅蓝色;乙醇溶液的所显颜色最深。
乙醇易挥发,在加热的条件下挥发更严重。
基于这一点的考虑,我采用茚三酮水溶液。
而茚三酮的用量对此显色反应的影响不大,可以选择5ml的被测液与1ml(5g/l)的茚三酮水溶液反应。
测定时,最好选择标样与待测液在同一水浴。
这样可以减少误差提高测定的准确度。
另外,当被测液中含有其他的氨基酸或是含氨基的化合物也可以与茚三酮发生显色反应,影响测定结果。
总之,茚三酮比色法作为一种β-氨基丙酸的定量检测方法具有操作简单、成本低的优点。
只要控制好反应条件就能得到较好的测量结果。
三.茚三酮比色法:1原理:氨基酸在一定pH范围内,能与茚三酮生成兰紫色化合物。
可以用比色法定量测定。
2试剂:(1)磷酸缓冲液()制备方法如下:称磷酸二氢钾。
定容500ml称NAH2PO4·12H2O 分别溶解定容500ml取磷酸二氢钾10ml与磷酸氢二钠190ml混合即为的缓冲液(2)2%茚三酮溶液:称茚三酮1g→溶于35ml热水→加入40mg氯化亚锡(SnCl2·H2O)搅拌过滤(作防腐剂)→于冷暗处过夜→定容50ml①氨基酸标液称干燥氨基酸(如异亮氨酸)→溶解定容100ml→摇匀→吸10ml于另外100ml 容量瓶定容100ml,即得200Ug/ml标液3操作方法:(1)绘制标准曲线:取7个25ml容量瓶,吸取标液0 于7个25ml容量瓶,加水补充至容积为4ml,然后加茚三酮和缓冲液各1ml,于水浴加热15分钟,冷却后定容25ml,静置15分钟,在570nm下测消光值,绘制标准曲线。
(2)样品测定:取样品~(液体样5-10ml)→于烧杯中→加50ml水和活性碳约5g→加热过滤→用30—40ml热水洗涤活性炭→吸澄清样液1~4ml→加茚三酮和缓冲液各1ml水浴加热15分钟,冷却定容,静置15分钟于570nm下测定消光值,按下式计算氨基酸含量。
氨基酸含量(毫克/100克)=C/(W×1000)×100C——从标准曲线上查得得氨基酸的量(Ug)W——测定得样品溶液相当于样品的量(g)注意事项:茚三酮受阳光、温度、湿度、空气等影响易被氧化呈淡红或深红色,使用前要进行纯化,方法如下:取10g茚三酮容于40ml热水中,加一克活性炭,摇匀静置30分钟,过滤,将滤液放入冰箱中过滤,即出现兰色结晶,过滤,用2ml冷水洗涤结晶,置干燥皿中干燥,装瓶备用。
茚三酮显色法测定氨基酸含量一、目的学习茚三酮显色法测定氨基酸含量的方法二、原理茚三酮溶液与氨基酸共热,生成氨。
氨与茚三酮和还原性茚三酮反应,生成紫色化合物。
该化合物颜色的深浅与氨基酸的含量成正比,可通过测定570n m处的光密度,测定氨基酸的含量。
三、试剂与材料(1)标准氨基酸溶液:配制成L溶液。
(2),2mol/L醋酸缓冲液:量取86mL 2mol/L醋酸钠溶液,加入14mL 2 mol/L乙酸混合而成。
用pH检查校正。
(3)茚三酮显色液:称取85mg茚三酮和15mg还原茚三酮,用10mL乙二醇甲醚溶解。
茚三酮若变为微红色,则需按下法重结晶:称取5g茚三酮溶于15~25mL 热蒸馏水中,加入活性炭,轻轻搅拌。
加热30min后趁热过滤,滤液放入冰箱过夜。
次日析出黄白色结晶,抽滤,用1mL冷水洗涤结晶,置干燥器干燥后,装入棕色玻璃瓶保存。
还原型茚三酮按下法制备:称取5g茚三酮,用125mL沸蒸馏水溶解,得黄色溶液。
将5g维生素C用250mL温蒸馏水溶解,一边搅拌一边将维生素C溶液滴加到茚三酮溶液中,不断出现沉淀。
滴定后继续搅拌15min,然后在冰箱内冷却到4℃,过滤、沉淀用冷水洗涤3次,置五氧化二磷真空干燥器中干燥保存,备用。
乙二醇甲醚若放置太久,需用下法除去过氧化物:在500mL乙二醇甲醚中加入5g硫酸亚铁,振荡1~2h,过滤除去硫酸亚铁,再经蒸馏,收集沸点为12 1~125℃的馏分,为无色透明的乙二醇甲醚。
(4)60%乙醇。
(5)样品液:每毫升含~50μg氨基酸。
(6)分光光度计。
(7)水浴锅。
四、操作步骤1.标准曲线的制作分别取L的标准氨基酸溶液0,,,,,于试管中,用水补足至1mL。
各加入1mL ,2mol/L醋酸缓冲液;再加入1mL茚三酮显色液,充分混匀后,盖住试管口,在100℃水浴中加热15min,用自来水冷却。
放置5min后,加入3mL 60%乙醇稀释,充分摇匀,用分光光度计测定OD570nm。
(脯氨酸和羟脯氨酸与茚三酮反应呈黄色,应测定OD440nm)。
以OD570nm为纵坐标,氨基酸含量为横坐标,绘制标准曲线。
2.氨基酸样品的测定取样品液1mL,加入,2mol/L醋酸缓冲液1mL和茚三酮显色液1mL,混匀后于100℃沸水浴中加热15min,自来水冷却。
放置5min后,加3mL 60%乙醇稀释,摇匀后测定OD570nm(生成的颜色在60min内稳定)。
将样品测定的OD570nm与标准曲线对照,可确定样品中氨基酸含量。
五、结果计算氨基酸含量(mmol/L)=OD570nm对应标准曲线查得值1 000。
