溶解度曲线图像题
溶解度图像题
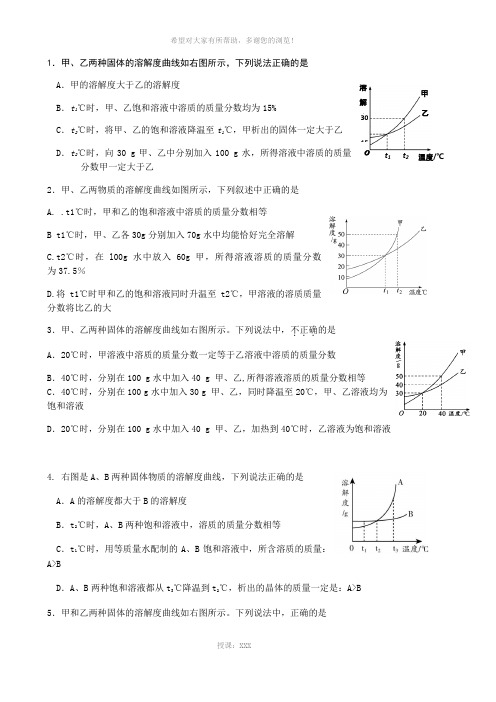
1.甲、乙两种固体的溶解度曲线如右图所示,下列说法正确的是 A .甲的溶解度大于乙的溶解度B .t 1℃时,甲、乙饱和溶液中溶质的质量分数均为15%C .t 2℃时,将甲、乙的饱和溶液降温至t 1℃,甲析出的固体一定大于乙D .t 2℃时,向30 g 甲、乙中分别加入100 g 水,所得溶液中溶质的质量分数甲一定大于乙2.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是 A. .t1℃时,甲和乙的饱和溶液中溶质的质量分数相等 B t1℃时,甲、乙各30g 分别加入70g 水中均能恰好完全溶解C.t2℃时,在l00g 水中放入60g 甲,所得溶液溶质的质量分数 为37.5%D.将t1℃时甲和乙的饱和溶液同时升温至t2℃,甲溶液的溶质质量分数将比乙的大3.甲、乙两种固体的溶解度曲线如右图所示。
下列说法中,不正确...的是 A .20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数 B .40℃时,分别在100 g 水中加入40 g 甲、乙,所得溶液溶质的质量分数相等C .40℃时,分别在100 g 水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液D .20℃时,分别在100 g 水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液4. 右图是A 、B 两种固体物质的溶解度曲线,下列说法正确的是 A .A 的溶解度都大于B 的溶解度B .t 2℃时,A 、B 两种饱和溶液中,溶质的质量分数相等C .t 1℃时,用等质量水配制的A 、B 饱和溶液中,所含溶质的质量:A>BD .A 、B 两种饱和溶液都从t 3℃降温到t 2℃,析出的晶体的质量一定是:A>B 5.甲和乙两种固体的溶解度曲线如右图所示。
下列说法中,正确的是3015 溶 解 度 t 1 t 2 温度/℃甲乙A.10℃时,甲的溶解度大于乙的溶解度B.通过降温可以将甲的饱和溶液变为不饱和溶液C.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数D.30℃时,分别在100 g水中加入40 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液6.甲和乙两种固体的溶解度曲线如右图所示。
正确理解溶解度曲线图中的点、线、面

正确理解溶解度曲线图中的点、线、⾯正确理解溶解度曲线图中的点、线、⾯王敏溶解度曲线是《溶液》⼀章的重要知识点,溶解度曲线试题也是中考中常见的题型,更是同学们在学习过程中易出错的题型。
现以2006年各地市的中考试题为例,将易错解的溶解度曲线试题作以下归类解析。
⼀. 理解溶解度曲线图中点的含义例1. 下图为A、B两种固体物质的溶解度曲线。
请回答:曲线上Q点表⽰_____________。
解析:溶解度曲线图中不同位置的点代表的意义各不相同。
曲线下⽅的任意⼀点对应的溶液是⼀定温度下的不饱和溶液;曲线上的任意点对应的溶液是⼀定温度下的该溶质的饱和溶液;曲线上⽅的任意⼀点代表该温度下的饱和溶液和未溶晶体(溶质)的共存。
两条溶解度曲线的交点则表⽰在该温度下,这两种溶质的溶解度相同。
答案:20℃时,A、B两物质的溶解度相等⼆. 掌握结晶⽅法的使⽤范围例2. 下图是甲、⼄两种物质在⽔中的溶解度曲线。
(1)在_____________,可配制溶质的质量分数相等的甲、⼄两种物质的饱和溶液。
(2)我国西北部有许多盐碱湖,湖⽔中有⼤量的NaCl、,那⾥的⼈们冬天捞碱,夏天晒盐。
据此,你认为图中(填“甲”或“⼄”)_____________的溶解度曲线与纯碱的溶解度曲线相似,其理由是_____________。
解析:对于第(2)问,⾸先要考虑的是温度对物质的溶解度影响的⼤⼩。
蒸发溶剂是从溶液中得到溶解度受温度影响不⼤的物质,冷却热饱和溶液是从溶液中得到溶解度受温度影响较⼤的物质。
由题意可知,NaCl的溶解度受温度影响不⼤,所以可通过蒸发溶剂(夏天晒盐)使其结晶,⽽的溶解度受温度影响较⼤,所以可通过降温(冬天捞碱)使其结晶。
因⽽图中甲的溶解度曲线与纯碱的溶解度曲线相似。
答案:(1)(2)甲纯碱的溶解度受温度影响较⼤三. 认清溶液的状态例3. 下图是M、N两种物质的溶解度曲线。
在t2℃时,往盛有100g⽔的烧杯中先后加⼊agM和agN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。
溶解度曲线练习题.doc

溶解度曲线练习题溶解度曲线的应用例1:右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。
据图答复:〔1〕P点的含义是。
〔2〕t2℃时30g a物质参加到50g水中不断搅拌,形成的溶液是〔饱和或不饱和〕溶液,溶液质量是g。
〔3〕t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是__________〔填写物质序号〕。
〔4〕在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是,所得溶液中溶质质量分数〔浓度〕由大到小的顺序是。
〔5〕把t1℃a、b、c三种物质的饱和溶液升温到t2℃时,所得a、b、c三种物质的溶液中溶质质量分数〔浓度〕大小关系。
〔6〕假设把混在a中的少量b除去,应采用___________方法;假设要使b从饱和溶液中结晶出去,最好采用___________。
假设要使C从饱和溶液中结晶出去,最好采用___________。
稳固练习1、图2是硝酸钾和氯化钠的溶液度曲线,以下表达中不正确的选项是〔〕A. t1℃时,120gKNO3饱和溶液中含有20gKNO320B. t2℃时,KNO3和NaCl的饱和溶液中溶质的质量分数一样C. KNO3的溶解度大于NaCl的溶解度D. 当KNO3中含有少量的NaCl时,可以用结晶方法提纯KNO32、右图为A物质的溶解度曲线。
M、N两点分别表示A物质的两种溶液。
以下做法不能实现M、N间的相互转化的是〔〕A.从N→M:先向N中参加适量固体A再降温B.从N→M:先将N降温再参加适量固体A甲 乙溶解度 g 0 t 1 t 2 温度/℃3050 20 40 10 C .从M→N :先将M 降温,过滤后再将其升温D .从M→N :先将M 升温再将其蒸发掉局部水3、图1是a 、b 两种物质的溶解度曲线。
室温时,将盛有a 、b 饱和溶液的试管分别放入烧杯内的水中,均无晶体析出。
当向烧杯内的水中参加硝酸铵固体或浓硫酸后,图2试管内所示现象正确的选项是〔 〕(A) (B) (C) (D)图24、t ℃时,某物质的溶液220g ,蒸发去15g 水后,析出晶体6g ,又蒸发去10g 水,析出6g 晶体,再蒸去10g 水又析出晶体的质量为〔 〕A .4gB .6gC .10gD .15g5.20℃时,甲、乙两烧杯内依次放入A 物质的饱和溶液100g 、200g ,假设各蒸发5g 水,再恢复到20℃后,两杯中析出晶体质量为〔 〕A .甲>乙B .甲<乙C .甲=乙D .无法判断6、如图3是A 、B 、C 三种物质的溶解度曲线,以下说法中不正确的选项是〔 〕〔A 〕A 的饱和溶液从t 2℃降温到t 1℃时变为不饱和溶液〔B 〕C 的溶解度随温度的升高而减小 〔C 〕在t 1℃时,A 的溶解度等于C 的溶解度〔D 〕当A 中含有少量B 时,可以用降温结晶的方法提纯A7. 25℃时向一定量不饱和KNO3溶液中逐渐参加KNO3固体,那么以下图像中能正确表示此过程溶质质量变化规律的是〔 〕1.甲、乙两物质的溶解度曲线如右图所示。
人教版2023中考化学备考精讲题型:微专题8 溶解度曲线及其应用

图1
图2
微专题8 溶解度曲线及其应用
返回目录
考查点3 溶解度概念的理解和大小比较(省卷5年3考,兰州5年2考) (4)50 ℃时,KNO3的溶解度为_8_5_._5_g_;20 ℃时,100 g水中最多溶解 NaCl的质量为_3_6__g。 (5)温度小于t ℃时,NaCl的溶解度_>__(填“>”或“<”)KNO3。
考查点5 溶液相关量的计算与比较(省卷5年2考,兰
州5年3考)
(13)20 ℃时,将35 g KNO3固体加入到100 g水中, 充分溶解,所得溶液的质量为_1_3_1_.6_g,溶质质量分 数约为_2_4_._0_%__(结果保留至0.1%),溶质和溶剂的 质量比为_7_9_∶__2_5_0_(填最简整数比);50 ℃时,137g NaCl的饱和溶液中溶质的质量为__3_7_g。 (14)10 ℃时,图示三种物质饱和溶液的溶质质量分 数大小关系为_N_a_C__l>__K__N_O__3_>__C_a_(_O_H__)2_。
微专题8 溶解度曲线及其应用
1 典例串讲 2 跟踪训练
微专题8 溶解度曲线及其应用
返回目录
典例串讲
考向1 溶解度曲线(省卷仅2022年未考查,兰州近5年连续考查)
例1
根据如图所示溶解度曲线,回答下列问题。
考查点1 交含义(省卷、兰州均5年3考)
(1)图1中P点表示_t_℃__时__,__硝__酸__钾__和__氯__化__钠__
微专题8 溶解度曲线及其应用
返回目录
3.
(2021省卷)如图是甲、乙、丙三种固体物质(均不含
结晶水)的溶解度曲线。下列说法正确的是( D ) A. 三种物质的溶解度大小关系为甲>乙>丙
江西省2021年中考化学考前精选专题《图像题》(含答案)

江西省中考化学精选真题含答案专题一图像题题型训练类型1 溶解度曲线及溶质的质量分数1.25 ℃时,向一定量饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是( )图T1-92.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图T1-10所示,下列说法中正确的是( )图T1-10A.t2℃时,将50 g甲物质放入50 g水中,充分搅拌后得到100 g甲溶液B.t2℃时,配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲=丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多,丙溶液中无晶体析出3.【连云港改编】如图T1-11是甲、乙固体的溶解度曲线。
下列说法正确的是( )图T1-11A.图中P点所表示的溶液是t3℃时甲的饱和溶液B.可用t1℃时20%的甲溶液配制10%的甲溶液C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,形成的溶液质量甲____(填“>”“<”或“=”)乙类型2 金属与酸(盐)反应4.向一定量的稀硫酸中加入足量的锌粒,下列图像中正确的是( )图T1-125.将稀盐酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余。
产生H2的质量随时间变化的趋势如图T1-13。
下列说法正确的是( )图T1-13A.甲的活动性比乙强B.甲的相对原子质量一定比乙小C.甲的相对原子质量可能比乙大D.反应消耗等质量的盐酸6.【遂宁改编】向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图T1-14所示。
下列说法正确的是( )图T1-14A.t1时,向溶液中滴加氯化钠溶液,没有白色沉淀产生B.t3和t5时,溶质种类不同,金属单质种类也不同C.若t时刻向溶液中插入铝丝,铝丝表面有红色固体析出,则时间t的取值范围是:t2<t<t4D.t2时,溶液中的金属离子有Zn2+、Cu2+,固体中的金属单质是Ag类型3 pH变化7.【北京改编】实验小组用传感器探究稀氢氧化钠溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图T1-15所示。
2021届高考化学复习:专题三 溶解度曲线问题

专题三溶解度曲线问题1、以废旧铅蓄电池的含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯PbO,实现铅的再生利用。
其主要流程如下:PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。
结合图示溶解度曲线,简述由粗品PbO得到高纯PbO的操作_____________。
答案在35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体解析根据图像可知35%NaOH溶液的溶解度受温度影响较大,超过110℃随温度升高而降低,因此由粗品PbO得到高纯PbO的操作为将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
2、Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法:已知:①卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)的变化曲线如上图。
(1)加入BaCl2的目的是除________,如何判断该离子已除尽:___________________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3===Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③______;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
答案(1)SO2-4静置,取上层清液加入BaCl2,若无白色沉淀,则SO2-4已沉淀完全(2)趁热过滤解析(1)加入BaCl2的目的是除去SO2-4,钡离子与硫酸根离子结合生成硫酸钡沉淀,过滤除去;检验SO2-4是否除尽的方法是静置,取上层清液加入BaCl2,若无白色沉淀,则SO2-4已沉淀完全。
初三中考重点考点之溶解度图像题(有答案)

溶解度图像题〔重点〕1. 〔2021安徽〕甲、乙两种物质的溶解度曲线如图。
t1℃时,在两支试管中分别参加等质量的两种物质,再分别参加等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。
再将两支试管升温到t2℃〔不考虑溶剂质量变化〕。
由t1℃到t2℃的过程中,以下说法正确的选项是〔〕A.甲溶液中溶质的质量分数减小B.装有乙物质的试管中剩余的固体增多C.甲、乙两种物质的溶解度都增大D.两支试管里剩余的固体质量一样2.〔201玉林〕右图是A、B、C三种物质的溶解度曲线,以下说法错误的选项是〔〕A.t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>AB.当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯AC.升高温度可使接近饱和的C溶液变为饱和D.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>A3.〔2021北京〕a、b 两种物质的溶解度曲线如下图.以下说法不正确的选项是〔〕A.15℃时,a、b 的溶解度均为20gB.加水或升温均可使b的饱和溶液变为不饱和溶液C.将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变D.分别向100g 水中参加20ga和b,升温至30℃,所得溶液均为饱和溶液4.〔2021龙岩〕右图为硫酸钠和氯化钠的溶解度曲线。
以下说法正确的选项是〔〕A.温度升高,两种物质的溶解度都增大B.50℃的Na2SO4饱和溶液降到40℃时有晶体析出C.40℃时,75g饱和Na2SO4溶液中含25g Na2SO4D.可用降温结晶的方法提纯含少量Na2SO4的NaCl5.〔2021泉州〕甲、乙两种固体物质的溶解度曲线如右图所示。
以下说法正确的选项是〔〕A.甲的溶解度大于乙的溶解度B.降低温度可使甲的饱和溶液变为不饱和溶液C.t1℃时,甲、乙两种饱和溶液的溶质质量分数相等D.t2℃时,50g乙参加100g水中得到乙的不饱和溶液6、〔2021毕节〕如下图,甲、乙是两种物质的溶解度曲线,以下表达正确的选项是〔〕A.60℃时,在100g水中参加100g甲,充分溶解后溶液的质量是200gB.40℃时,甲、乙两种物质的溶解度相等C.20℃时甲的溶解度大于乙的溶解度D.采用降温的方法可将乙的不饱和溶液转化为饱和溶液7.〔2021厦门〕如图是三种固体物质的溶解度曲线,以下说法正确的选项是〔〕A.物质c的溶解度随温度的升高而增大B.物质a的溶解度大于物质c的溶解度C.t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160gD.将t1℃b,c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液8.〔2021武威〕如图为甲、乙两种固体物质在水中的溶解度曲线.以下说法错误的选项是〔〕A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g9.〔2021河南〕如图是甲、乙两种固体的溶解度曲线.以下说法中不正确的选项是〔〕A.t1℃时,甲和乙的溶解度相等B.t1℃时,30g乙加到100g水中形成饱和溶液C.t2℃时,各100g饱和溶液降温至t1℃析出固体甲多于乙D.t2℃时,75g甲的饱和溶液中加100g水得到20%的溶液10. 〔2021哈尔滨〕右图为甲、乙两物质〔均不含结晶水)的溶解度曲线,以下说法错误的选项是〔〕A. 20℃时,100g甲溶液中含甲物质的质量小于25gB. 20℃时,等质量甲、乙饱和溶液中含溶质的质量相等C. 30℃时,甲物质的溶解度大于乙物质的溶解度D. 50℃时,将甲、乙两种物质的饱和溶液分别降温至20℃析出晶体的质量甲大于乙11.〔2021大庆〕图中a、b、c分别表示KNO3、NaCl、Ca〔OH〕2溶解度曲线,以下说法错误的选项是〔〕A.T1时,KNO3和NaCl的饱和溶液溶质的质量分数相等B.T2时,A点表示KNO3的不饱和溶液,降温至T1时有晶体析出,且变为T1时KNO3的饱和溶液C.T1时,将Ca〔OH〕2饱和溶液升温至T2变为饱和溶液D.温度高于T1时,KNO3溶解度大于NaCl溶解度,温度低于T1时,KNO3溶解度小于NaCl溶解度12.〔2021鄂州〕甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如下图,以下说法中正确的选项是〔〕A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲=丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多,丙溶液中无晶体析出13.〔2021黄冈〕以下图是a 、b 、c 三种物质的溶解度曲线,以下分析不正确的选项是〔 〕A .t 2 ℃时a 、b 、c 三种物质的溶解度由大到小的顺序是a>b>cB .t 2 ℃时,将50g a 物质放入100g 水中充分溶解得到a 的饱和溶液〔a 物质不含结晶水〕C .将t 2 ℃时a 、b 、c 三种物质的饱和溶液降温至t 1 ℃时,所得溶液的溶质质量分数关系是b > a=cD .将c 的饱和溶液变为不饱和溶液,可采用降温的方法14.〔2021咸宁〕右图是甲、乙两种固体物质的溶解度曲线,以下说法中正确的选项是〔 〕A .将等质量的甲、乙的饱和溶液分别由t 2℃降温至t 1℃,析出甲多B .t 2℃时,甲、乙两溶液中溶质的质量分数相等C .将甲溶液从t 2℃降温到t 1℃时,一定有晶体析出D .将t 2℃时乙的饱和溶液变为不饱和溶液,可采取降温的方法15.〔2021孝感〕右图是A 、B 、C 三种固体物质的溶解度曲线。
3.2.3溶解度曲线

3.2.3溶解度溶解度曲线一溶解度影响固体溶解性的影响因素:溶质的种类,溶剂的种类,温度1、溶解度定义:在一定温度下,某物质在100g溶剂(通常是水)里达到饱和状态时,所溶解得最大克数。
符号:S,单位:g/100g水2、溶解度的含义:20℃时,S NaCl = 36g/100g水含义:20℃,食盐在100g水里达到饱和状态时最多溶解36克。
举例:20℃时,S AgNO3 = 222g/100g水影响固体溶质溶解度的唯一因素是对于气体溶质影响溶解度的因素有和二绘制溶解度曲线图(1)请根据下表列出硝酸钾、氢氧化钙在不同温度下的溶解度,在坐标系中作出温度(℃)0 20 40 60 80 溶解度(g/100g水)13.3 31.6 63.9 110 169 KNO3温度(℃)0 20 40 100 溶解度(g/100g水)0.173 0.165 0.121 0.076Ca(OH)2(2)溶解度曲线的运用溶解度曲线上表示溶液的点的位置所表示的含义及点的移动操作诀窍例1:右图是A、B、C三种物质的溶解度曲线,看图回答:(1)60℃时,B物质的溶解度是。
(2)10℃时,B物质的溶解度(填<、=或>)A物质的溶解度。
(3)℃时,A、B两物质的溶解度相同。
例2:.右图是X、Y、Z三种物质的溶解度曲线(1)A点所表示的意义(2)若X、Y、Z三种物质中,有一种是气态物质,该物是。
判断的依据是。
(3)20℃时,N处物质X的溶液呈(填饱和或不饱和)状态、要使该溶液从N状态变为M状态.应采取的措施有或三有关溶解度的计算公式:S 100 =m(溶质)m(溶剂)SS+100=((+(mm m溶质)溶质)溶剂)=m(m溶质)(溶液)例1、在T℃时,向80克水中加入硝酸钾固体20克,恰好达到饱和,求该温度下的溶解度例2、在20℃时,氯化钠的溶解度是36g/100g水,则在此温度下,30克水中最多能溶解氯化钠多少克?T℃,硝酸钾饱和溶液200克,蒸发20克水后析出晶体12克,则该温度时,硝酸钾的溶解度为_____________当堂训练1.下列说法正确与否,为什么?(1)20℃时,把10克食盐溶解在100克水里,所以20℃时食盐的溶解度是10 (2)20℃时,100克食盐饱和溶液里含有26.4克食盐,所以20℃时食盐的溶解度是26.4克/100克水(3)20℃时,食盐的溶解度是36克/100克水。
初中化学化学图像题汇编试题(有答案和解析)

3.下列关系不正确的是
A. t2摄氏度时等质量的甲乙饱和溶液中含有溶剂的质量甲<乙
B. 加热氯酸钾和二氧化锰制取氧气
C. 向澄清的石灰水中通入过量二氧化碳
D. 向与稀硫酸溶质质量分数相同的氢氧化钡溶液中加入稀硫酸
【答案】D
【解析】
【分析】
【详解】
下列关系不正确的是
A、根据溶解度曲线可知,t2℃时,甲的溶解度大于乙,等质量的甲、乙饱和溶液中含有溶剂的质量甲<乙,图像与事实相符,故A正确;
故选D。
7.下列所示的图像能反映相对应实验的是
A.甲图可表示向pH=10的氢氧化钙溶液不断加水稀释,溶液pH的变化
B.乙图可表示向碳酸钙固体中逐滴加入稀盐酸至过量时,产生气体质量的变化
C.丙图可表示在40 ℃,将饱和硝酸钾溶液恒温蒸发至有白色晶体析出,溶质质量分数的变化
D.丁图可表示将等质量的镁与锌分别和足量稀硫酸混合时,产生气体质量的变化
初中化学化学图像题汇编试题(有答案和解析)
一、中考化学图像题汇编
1.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法正确的是()
A.20°C时,甲和丙的溶解度相等
B.50 °C时,将30 g甲物质加入到50 g水中不断搅拌,可形成80 g溶液
C.甲中混有少量丙时,可用蒸发结晶的方法提纯甲
D.将三种物质的饱和溶液从50 °C降温至20 °C,所得溶液溶质质量分数的大小关系是:乙>甲=丙
【详解】
A、由图可知t1时,产生气体的质量:X>Y,A正确;
B、等质量X、Y两种金属分别和足量的同体积、同浓度的盐酸反应,X在t2时间先反应完,Y在t3时间后反应完,说明X活动性强于Y,X和Y可能分别是镁和铁,正确;
例谈溶解度曲线图像题的解析

例谈溶解度曲线图像题的解析作者:于兆明来源:《新教育时代·学生版》2019年第37期摘要:初中化学《义务教育课程标准》对溶解度曲线这一知识点的教学要求不是很高。
但溶解度曲线是学生初步认识利用图像来处理数据的形式。
这种方式可以把抽象的问题简单化,非常的便捷和高效。
因此,溶解度曲线图像题几乎是各省市中考题的常考题型。
下面我以2017年和2018年黑龙江省龙东地区中考题溶解度曲线图像题为例,来详细剖析这种专题的解题思路。
关键词:溶解度曲线图像解析一、命题的立意及考点例题一:甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:(1)三种物质中 ; ; ;的溶解度随温度变化趋势与气体溶解度的变化相似(填甲或乙或丙)。
(2)将t2摄氏度时,将甲、乙两物质饱和溶液分别蒸发等质量的水,析出固体的质量甲 ; ; ;乙。
(填>本题考查的知识点及命题立意如下。
第(1)题旨在培养学生分析概括知识的能力,培养学生能够利用所学知识点之间的内在联系来类比和归类,从而构建具有相同特征的一类知识体系。
第(2)题考查的是:理解溶解度曲线上的各点的含义,试题考查的角度很新颖,一改以往直接对比某温度下溶解度的大小,而是将溶解度概念的具体含义和比较溶解度曲线上的点以及读图能力有机结合起来一起考查,可谓“简单一问,意味深长”。
第(3)小题以解决生产实践中遇到的实际问题为出发点,考查了混合物的分离方法。
第(4)小题试题的考查难度加大,需要学生运用抽象思维联系溶液的特点,全面细致剖析和解决问题。
二、解题思路和讲解分析第(1)小题,先观察三条溶解度曲线的走势,甲物质为陡升型,乙物质为缓升型,只有丙物质属于“不走寻常路”的下降型,然后回顾气体溶解度的特点:是随温度的升高反而减小。
从而确定物质丙和气体性质一致。
解题后要提醒学生快速逆向检查,联系生活中喝汽水打嗝的例子,倒推气体溶解度的特点,然后再比对丙物质曲线,从而判断此题解题正确无误。
专题4-10 沉淀溶解平衡的图像分析与解题思路(原卷版)

沉淀溶解平衡的图像分析与解题思路【常见图像与解题思路】 1、溶解度曲线图 溶解度随温度变化曲线曲线可知信息①曲线上各点的意义:曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液 ②曲线的变化趋势:A 曲线表示溶解度随温度升高而增大;B 曲线表示溶解度随温度升高而减小;C 曲线表示溶解度随温度升高变化不大 ③分离提纯:A(C):蒸发浓缩、冷却结晶、过滤、洗涤、干燥 C(A):蒸发结晶、趁热过滤 ④计算K sp :对于难溶电解质来说,若知道溶解度的值S g ,可求出难溶电解质饱和溶液时的浓度c =MS 10mol·L -1,进而求出K sp 【对点训练1】1、溴酸银(AgBrO 3)溶解度随温度变化曲线如下图所示。
下列说法错误..的是( )A .溴酸银的溶解是放热过程B .温度升高时溴酸银溶解速度加快C .60 ℃时溴酸银的K sp 约等于6×10-4D .若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 2、双曲线(1)阳离子~阴离子单曲线图:横、纵坐标分别为阳离子或阴离子以“BaSO 4(s)Ba 2+(aq)+SO 2-4(aq)”为例图像展示曲线可知①曲线上任意一点(a 点、c 点)都达到了沉淀溶解平衡状态,此时Q c =K sp 。
在温度不变时,信息无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外②曲线上方区域的点(b点)均为过饱和溶液,此时Q c>K sp,表示有沉淀生成③曲线下方区域的点(d点)均为不饱和溶液,此时Q c<K sp,表示无沉淀生成④计算K sp:由c点可以计算出K sp点的变化a→c曲线上变化,增大c(SO2-4)b→c加入1×10-5 mol·L-1 Na2SO4溶液(加水不可以) d→c加入BaCl2固体(忽略溶液的体积变化)c→a曲线上变化,增大c(Ba2+)溶液蒸发时,离子浓度的变化原溶液不饱和时,离子浓度都增大;原溶液饱和时,离子浓度都不变溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同【对点训练2】1、某温度下,难溶物FeR的水溶液中存在平衡:FeR(s)Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。
中考化学化学溶解度(大题培优)及答案解析

【解析】
【分析】
甲乙的溶解度随温度的升高而增大,丙的溶解度随温度升高而减小,甲的溶解度比乙的溶解度受温度影响大;t1℃时,甲、乙溶解度相等,t2℃时,乙丙溶解度相等。
【详解】
A、t2℃时,甲的溶解度最大,乙丙相等,三种物质的溶解度:甲>乙=丙,说法正确,不符合题意;
B、t1℃时,等质量的甲乙饱和溶液中溶质的质量才相等,说法错误,符合题意;
C、向烧杯中加入NH4NO3固体后,温度降低,若降到20℃以下,才有晶体析出,高于此温度,则无晶体析出;所以向烧杯中加入NH4NO3固体后,试管2中不一定有晶体析出,故C错误;
D、将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,甲乙溶解度减小,均析出晶体,溶质的质量减小,溶质的质量分数减小,丙溶解度增大,溶液中溶质、溶剂的质量不变,溶质的质量分数与降温前相等;饱和溶液中溶质质量分数= ×100%,即溶解度越大质量分数也就越大,20℃时乙的溶解度大于甲的溶解度大于30℃时丙的溶解度,故所得溶液中溶质的质量分数的大小关系是乙>甲>丙,故D正确。
【答案】B
【解析】
【详解】
A项,固体物质的溶解度只受一个外界因素的影响——温度,因此没有说明温度,溶解度也就没有意义,错误;
B项,由两物质的溶解度曲线不难看出,甲的溶解度受温度的影响大,正确;
C项,由于在t2℃时,乙的溶解度是50 g,即在100 g水中最多溶解50 g乙,错误;
D项,由于甲的溶解度受温度的影响大,因此相同质量的甲、乙的饱和溶液由t2℃降至t1℃,甲析出的晶体多,错误。故选B。
6.如图是A、B、C三种物质的溶解度曲线.下列叙述正确的是
A.三种物质溶解度大小顺序为A>B>C
B.t1℃时,110gA的溶液中含有溶质A的质量是10g
初中化学溶解度图像题含答案
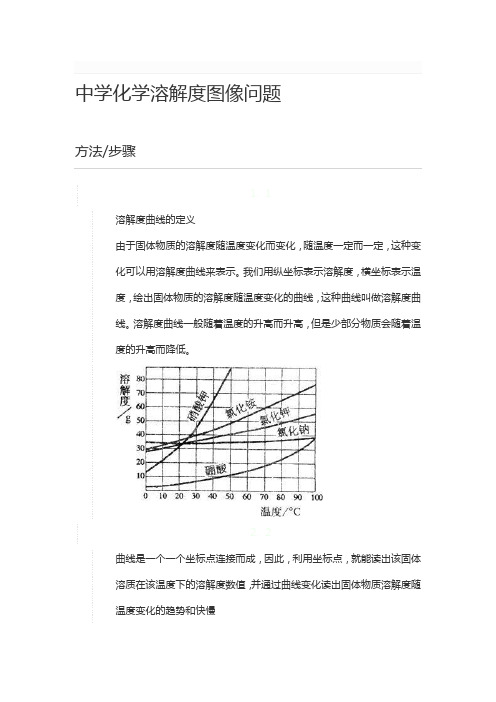
中学化学溶解度图像问题
1. 1
溶解度曲线的定义
由于固体物质的溶解度随温度变化而变化,随温度一定而一定,这种变
化可以用溶解度曲线来表示。
我们用纵坐标表示溶解度,横坐标表示温
度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲
线。
溶解度曲线一般随着温度的升高而升高,但是少部分物质会随着温
度的升高而降低。
2. 2
曲线是一个一个坐标点连接而成,因此,利用坐标点,就能读出该固体
溶质在该温度下的溶解度数值,并通过曲线变化读出固体物质溶解度随
温度变化的趋势和快慢
3. 3
例题
如图a、b是两种物质的溶解度曲线图:
(1)a物质的溶解度的变化趋势是
(2)M点表示
(3)当℃时a物质的溶解度大于b物质的溶解度,当℃时a物质的溶解度小于b物质的溶解度。
(3)37℃时a物质的溶解度为 g,80℃时40g a物质溶于50g水中所形成的溶液是溶液(选填“饱和”或“不饱和”)。
4. 4
(1)通过图像趋势,能看出来a物质的溶解度随温度升高而增大(2)M点是曲线a和曲线b的交点,说明在该温度下a和b的溶解度相等
(3)通过曲线比较溶解度大小时,只需看曲线的上下位置,60℃以后,a曲线高于b曲线,因此物质a的溶解度大于物质b的溶解度,同理可得另外的结论
(4)读图,37℃时物质a对应的纵坐标是30,则物质a在该温度下的溶解度是30g(溶解度的单位是g 切忌不能遗忘)
而80℃时a物质溶解度为85g,通过溶解度定义可知,100g水中最多溶解85g物质a就恰好形成饱和溶液,则50g水中只能溶解42.5g 物质a,因此,40g a物质加入到50g水中,不能形成饱和溶液。
备战中考化学化学溶解度(大题培优)含答案

备战中考化学化学溶解度(大题培优)含答案一、初中化学溶解度1.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是A.t2℃时a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.P点表示t1℃时,a、c两种物质的溶解度相等C.将c的饱和溶液变为不饱和溶液,可采用降温的方法D.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的饱和溶液【答案】D【解析】试题分析:依据图形,A、B、C正确; t2℃时,a的溶解度为50g,则t2℃时,将30g a物质加入到50g水中充分搅拌时只能溶解25ga物质,则75ga的饱和溶液,D错误。
考点:溶解度曲线。
2.如图为甲、乙两种固体物质(不含结晶水)的溶解度曲线。
下列说法错误的是A.t2℃时,甲的溶解度大于乙B.t1℃时,甲、乙各25g加到50g水中,均得70g溶液C.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等D.t2℃时,将溶剂均为100g的甲、乙的饱和溶液分别降温到t1℃时,析出晶体的质量甲>乙【答案】C【解析】【分析】【详解】A.由图像可知,t2℃时,甲的溶解度大于乙,正确;B、t1℃时,甲、乙两种物质的溶解度是40g,所以各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g,故B正确;C、t1℃时,溶液的饱和状态不确定,所以甲溶液的溶质质量分数不一定等于乙溶液的溶质质量分数,故C错误;D. t2℃时,甲的溶解度大于乙,将溶剂均为100g的甲、乙的饱和溶液分别降温到t1℃时,析出晶体的质量甲>乙,正确;故选C。
3.如图是A、B、C三种固体物质的溶解度曲线。
下列分析正确的是()A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3 C.将t2℃时A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系是B=C>AD.将t1℃时C的饱和溶液变为不饱和溶液,可采用的方法是升高温度【答案】B【解析】【详解】A、t1℃时,A、C两种物质的溶解度相等,但是饱和溶液的质量不能确定,所以饱和溶液中溶质的质量也不能确定,选项错误;B、t2℃时,A物质的溶解度是50g,所以把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为25g:75g=1:3,选项正确;C、t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,降低温度,A、B物质的溶解度减小,C物质的溶解度增大,应该按照t2℃时的溶解度计算,所以将t2℃时A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系是B>A>C,选项错误;D、C物质的溶解度随温度的升高而减小,所以将t1℃时C的饱和溶液变为不饱和溶液,可采用的方法是降低温度,选项错误,故选B。
2021年中考复习溶解度曲线图像问题
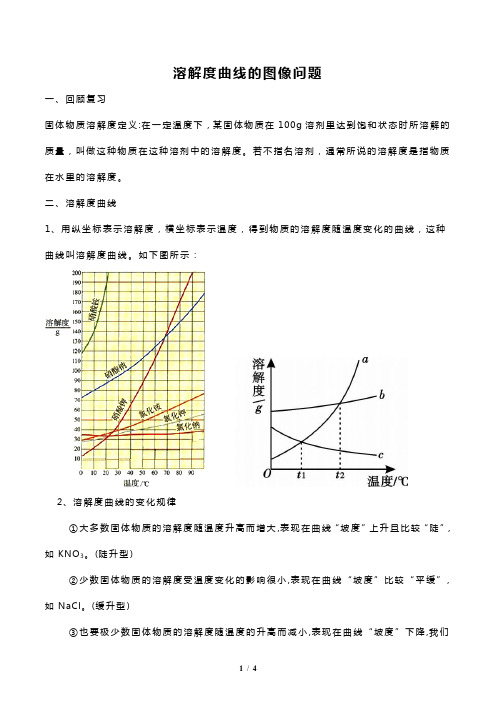
溶解度曲线的图像问题一、回顾复习固体物质溶解度定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
若不指名溶剂,通常所说的溶解度是指物质在水里的溶解度。
二、溶解度曲线1、用纵坐标表示溶解度,横坐标表示温度,得到物质的溶解度随温度变化的曲线,这种曲线叫溶解度曲线。
如下图所示:2、溶解度曲线的变化规律①大多数固体物质的溶解度随温度升高而增大,表现在曲线“坡度”上升且比较“陡”,如KNO3。
(陡升型)②少数固体物质的溶解度受温度变化的影响很小,表现在曲线“坡度”比较“平缓”,如NaCl。
(缓升型)③也要极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,我们需要特殊记忆如Ca(OH)2。
(下降型)3、溶解度曲线的意义内容意义举例(以上图为例)点曲线上的点表示该物质在对应温度时的溶解度如a点表示物质A在t1℃时的溶解度为40g或者a点表示t1℃时物质A在100g水中最多能溶解40g两曲线的交点表示两物质在对应温度时的溶解度相等如d点表示物质A、物质C在t1℃和t2℃间某一温度下的溶解度相等,溶解度为交点的纵坐标所对应数值线(1)表示物质在不同温度下的溶解度(2)表示物质的溶解度随温度变化的趋势如物质A的溶解度随温度的升高而增大,物质C 的溶解度随温度的升高而减小面曲线下面的点表示溶液是对应温度下该物质的不饱和溶液b点表示t2℃时物质A的不饱和溶液曲线上面的点表示溶液饱和且有未溶解的固体按此配成的溶液中固体物质有剩余4、溶解度曲线的应用①查出某种物质在某温度时的溶解度。
②可以看出物质的溶解度随温度变化的规律。
③比较不同物质在同一温度时的溶解度大小。
④可以比较不同物质的溶解度受温度变化影响的大小。
⑤根据溶解度曲线确定如何制得某温度时的该物质的饱和溶液⑥由溶解度曲线可确定从溶液中析出晶体的方法。
三、例题1、如图是甲、乙两种固体的溶解度曲线,下列说法正确的是()A.甲的溶解度等于乙的溶解度B.升高温度可将甲的不饱和溶液变为饱和溶液C.20℃时,100g乙的饱和溶液中溶质质量是30gD.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量2、如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。
化学│中考化学溶液 溶解度(有难度)经典

化学│中考化学溶液 溶解度(有难度)经典一、溶液选择题1.图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t 2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )A .t 2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为甲>乙B .将甲、乙两种物质的饱和溶液都从t 2℃将至t 1℃时,两种溶液中溶质的质量分数相等C .向烧杯的水中加NaOH 固体后,只有乙溶液中溶质的质量分数变小D .向烧杯的水中加NH 4NO 3固体后,只有盛放甲溶液的试管中有晶体析出【答案】B【解析】【分析】【详解】A 、图2中两试管底部溶液中都有固体溶质未溶解,因此试管中的溶液均为t 2℃时的饱和溶液,图1显示,t 2℃时甲的溶解度大于乙的溶解度,而饱和溶液中溶质的质量分数=100%+100g溶解度溶解度 ,因此两物质的饱和溶液溶解度大的其饱和溶液的溶质质量分数大,故甲的溶质质量分数大于乙的溶质质量分数,选项A 正确;B 、甲的溶解度随温度的降低而减小,乙的溶解度随温度的降低而增大,将甲、乙两种物质的饱和溶液都从t 2℃将降温至t 1℃时,甲析出晶体,乙的溶解度变大则继续溶解试管内的固体,但溶解固体后是否饱和无法确定,若恰好饱和,则二者的溶质质量分数相等,若溶解后不饱和,则降温后甲的溶质质量分数大于乙的溶质质量分数,故降温后二者的溶质质量分数不一定相等,选项B 错误;C 、氢氧化钠固体溶于水放出大量的热使溶液温度升高,甲物质逐步溶解,溶质的质量分数变大,乙的溶解度减小,析出晶体,溶质质量减小,溶剂不变,所以溶质的质量分数减小,因此只有乙溶液中溶质的质量分数变小,选项C 正确;D 、NH 4NO 3固体溶于水吸收热量使溶液温度降低,甲的溶解度随温度的降低而减小,析出晶体,乙的溶解度随温度的降低而增大,变为不饱和溶液,不会析出晶体,因此只有盛放甲溶液的试管中有晶体析出,选项D 正确。
2022年中考化学真题分类汇编溶解度与坐标曲线图

②张青莲主持测定了铟等元素相对原子质量的新值
③废旧金属的回收利用,不仅可以节约金属资源,而且可以减少对环境的污染
④在低温条件下加压,使空气转变为液态,然后蒸发,氮气先从液态空气中蒸发出来
⑤某固体X可能由KCl、BaCl2、Na2SO4、(NH4)2SO4、NH4Cl、MgCl2中的一种或几种组成,取少量X加入足量NaOH溶液,产生白色沉淀和刺激性气味气体,再加入足量稀盐酸。沉淀部分溶解。则X的组成有8种情况
D. 分别向等质量的镁和锌中滴加溶质质量分数相等的稀盐酸
【答案】BD
8.(2022自贡)下列图像与对应的实验操作相符合的是( )
A. 一定量NaOH固体投入到蒸馏水中
B. 一定量NaOH溶液加水稀释
C. 一定量NaOH溶液中滴加稀盐酸
D. 一定量NaOH溶液中滴加硫酸铜溶液
【答案】A。
9.(2022临沂)下列图像不能正确反映对应变化关系的是
(2)t2℃时,将甲溶液的状态由M点变为N点,可采用的方法是(回答一种即可)。
(3)将t2℃甲、乙、丙的饱和溶液,分别降温到t1℃,所得溶液的溶质质量分数最大的是。
(4)t2℃时,将等质量的甲、乙、丙的饱和溶液,均恒温蒸发等质量的水,析出溶质质量由多到少的顺序为。
C. D.
【答案】C
6.(2022绍兴)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是( )
A. B.
C. D.
【答案】D
7.(2022牡丹江)下列图像能正确表示对应关系的是
A. 向盐酸中加水
B. 镁在密闭容器中燃烧
C. 一定质量的硝酸铵溶于适量的水
(完整版)溶解度曲线练习题

溶解度曲线练习题1。
(2015安徽)甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是()A.甲的溶解度大于乙的溶解度B.两种物质的溶解度都随温度升高而增大C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等D.t2℃时,甲的饱和溶液溶质质量分数为50%2。
(2015南昌)如图是甲、乙两种物质的溶解度曲线.下列说法正确的是()A. 甲的溶解度大于乙的溶解度B。
t1℃时等质量甲、乙两物质的饱和溶液中溶质质量相等C。
t2℃时等质量甲、乙两物质的饱和溶液降温至t1℃时,两溶液中溶质质量分数相等D。
氧气的溶解度随温度变化的规律与图中的甲相似3。
(2017重庆B卷)下图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法不正确的是()A。
10℃时,甲、乙两种物质的饱和溶液浓度相同B. 保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液C. 30℃时,将40 g甲物质加入50 g水中,充分溶解后溶液的质量为80 gD。
10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大4. (2017连云港)如图表示的是KNO3和NaNO3的溶解度曲线,下列说法正确的是()A. t2℃时,KNO3溶液的浓度一定等于NaNO3溶液的浓度B。
t1℃时,在50 g水里加入 15 gKNO3固体,充分溶解,可得到65 g溶液C。
t1℃时,往180 gNaNO3饱和溶液中加入620 g 水可配成质量分数为10%的NaNO3溶液D. 若KNO3中混有少量NaNO3,可用蒸发溶剂的方法提纯5。
(2016孝感)如图是a、b、c三种物质的溶解度曲线,下列说法错误的是( ) A。
t2℃时a、b、c三种物质的溶解度由大到小的顺序是a > b > cB。
P点表示t1℃时,a、c两种物质的溶解度相等C。
将c的饱和溶液变为不饱和溶液,可采用降温的方法D。
t2℃时,将30 g a物质加入到50 g水中充分搅拌,得到80 g a的饱和溶液6. (2015厦门)甲、乙两种物质的溶解度曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶
解度/
g 0
温度/C
O
20 40 60 80
20
40
60 80
甲
乙
全国各地溶解度曲线考题汇编
1.(3分)溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。
请你根据右图的溶解度曲线回答下列问题: (1) 20℃时,甲物质的溶解度_____ (填“大于”、“等于”或“小于”)乙物质
的溶解度。
(2) _______ ℃时,两种物质的溶解度相等。
(3) 60℃时,将80 g 甲物质放入100 g 水中,所得溶液的溶质质量分数为 。
2.(5分)下图甲是A 、B 、C 三种固体物质的溶解度曲线图。
溶
解度g
温度C
镁条
的饱和溶液甲乙
(1)甲图中,t 2℃时,A 、B 、C 三种物质中,溶解度最大的是 。
P 点所表示的含义为_______________; (2)t ℃时,将B 物质的不饱和溶液转变成饱和溶液可采取的方法有______________________________; (3)如乙图所示,20℃时,把试管放入盛有X 的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL 稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X 可能为A
、B 、
C 三种固体物质中的哪一种? 。
3.(3分)根据图1和图2回答问题:
图1
图2
(1)在t 1℃时,等质量的甲、乙两种固体物质在水中的溶解现象如图1所示要使剩余的甲固体继续溶解可采用的方法是____________。
(2)图2中a 、b 分别表示上述两种物质的溶解度曲线,在________℃时,这两种物质的溶解度相等;a 表示的是_____________物质(填“甲”或“乙”)的溶解度曲线。
4.(3分)溶解度曲线能使我们直观的了解物质的溶解度随温度的变化情况,同时,我们还能在曲线图中找到许多“共同点”,4请根据右图回答问题: 1)氯化钠和硫酸锂在0℃的溶解度均为____ g ;
2)它们的溶解度受温度变化的影响都 (选填“很大”或“不大”) 3)分别从它们的溶液中获得大量晶体,都可以采用 的方法结晶。
5.(3分)右图是部分物质的溶解度曲线,根据该曲线图回答问题: (1)下列说法中错误的是 (填A 、B 、C 符号) A .硝酸钾的溶解度大于氯化钠的溶解度 B .0°C 时物质的溶解度都为0g
C . 图中所列物质的溶解度都随温度的升高而增大
(2)10°C 时,100 g 水中溶解 g 硝酸钠才能形成饱和溶液,该饱和溶液中溶质的质量分数是
(
精确到0.1%)。
6.(3分)图2是A 、B 、C 三种固体物质的溶解度曲线。
请回答下列问题:
(1)40℃时,C物质的溶解度是__________g;
(2)60℃时,在100g水中加入90gA物质,充分溶解后,所得溶液的质量是__________g;
(3)将80℃的A、B、C三种物质的饱和溶液分别冷却至室温,溶液中溶质的质量分数
不发生变化的是_______溶液。
7.(4分)右图为A、B两种固体物质的溶解度曲线。
请回答:
(1)曲线上Q点表示 ________ ;
(2)在l0℃时,两种物质的饱和溶液中溶质的质量分数A _____B(选填“>”、
“=”或“<”);
(3)30℃时,将10 gA物质加人到盛有100 g水的烧杯中,充分搅拌,得到不
饱和溶液,若再加入A物质 _____g或降温到℃,则都能恰好
形成饱和溶液。
8.(4分)根据图回答:
(1)S表示物质的溶解度,在_____℃时S
A=S B>S C;
(2)随着温度的升高,A、B、C三种物质的饱和溶液中有溶质从溶液中析出的是
_________________。
(3)要将B物质从它的饱和溶液中析出,应采用的方法是_______________(填冷
却或蒸发)
(4)t3℃时,90 gA物质的饱和溶液中,含有A物质_________________g。
9.(6分)氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:
请分析表格中的数据,回答下列问题:
①若两物质的溶解度相等,此时所对应的温度范围在之间;
②20℃时,氯化钠饱和溶液的质量分数硝酸钾饱和溶液的质量分数(填“>”、“<”或“=”);
③某同学欲从含有少量氯化钠的硝酸钾中分离出硝酸钾,他应采取的方法是
④在40℃时,向100g水中加入80g硝酸钾,形成硝酸钾的______(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为________g,该溶液中溶质与溶剂的质量比为______________。
10.(8分)某固体物质的溶解度曲线如图所示,根据图回答如下问题:
⑴图中B点的意义:表示该物质在t
3℃时,每100g溶剂
和S1 g溶质形成不饱和溶液。
A点的意义:。
此溶液的溶质质量分数的表达式。
⑵若A、B两点的溶液在保持温度不变的情况下各加20克
水,A点的溶解度将 (填“增大”、“减小”、或
“不变”);A、B的溶质质量分数(填“前者大”、
“后者大”或“相等”)。
⑶当温度降低时,A点变动后溶液的质量分数与原来比较(填“增大”、“减小”或“不变”)。
⑷若使M点的(100+S1)g溶液成为饱和溶液的方法:降温至℃;增加溶质 g和。
