培养基有效期的验证
无菌检查用培养基灭菌后的保存有效期的验证方法

无菌检查用培养基灭菌后的保存有效期的验证方法1.检查培养基成分首先,检查培养基成分是否完好。
查看培养基的配方和规格,确保供应商提供的培养基成分和规格与所需一致。
2.制备培养基按照制备培养基的标准操作程序,使用标准工作制备培养基。
在制备过程中,注意无菌技术和操作规范,以避免可能引入外来微生物。
3.贮存培养基将制备好的培养基分装到适合贮存的容器中,如瓶子、培养皿等。
确保容器是无菌的,并在容器上标记相关信息,如配制日期、有效期、负责人等。
4.检测无菌性使用质量合格的培养基进行无菌性验证。
将一部分培养基用于培养对照菌株,以确保培养基的培养性能正常。
另一部分培养基作为对照,进行传统无菌试验或使用快速无菌检测方法,如膜过滤法或微生物培养系统检测培养基。
在进行无菌性验证时,必须严格按照操作规程进行,避免外界污染。
例如,在操作过程中,需要手套、面具、实验台等设备的无菌操作,并进行负压操作或使用专业无菌操作设备,以保证验证结果准确可靠。
5.评估培养基质量根据无菌性验证的结果,评估培养基的质量。
如果培养基通过了无菌性验证,没有发现微生物污染,可以认为培养基在灭菌后的保存有效期是可靠的。
可以依据培养基制备和贮存的相关记录,评估培养基合格的时间范围。
此外,还可以进行培养基质量的其他评估,如pH值的测定、溶解度的测定等。
这些评估数据也可以作为判断培养基质量是否合格的依据。
总结:无菌检查用培养基灭菌后的保存有效期的验证方法主要包括检查培养基成分、制备培养基、贮存培养基、检测无菌性及评估培养基质量。
通过这些步骤,可以确保培养基的保存有效期符合要求,从而保证无菌实验的准确性和可靠性。
无菌检查用培养基灭菌后的保存有效期的验证方法

无菌检查用培养基灭菌后的保存时限验证方法1项目描述质量控制部无菌检查用培养基为硫乙醇酸盐流体培养基及胰酪大豆陈液体培养基,此两种培养基均为商品化的脱水培养基。
根据《中国药典》2023版规定,无菌检查用的硫乙醉酸盐流体培养基和胰酪大豆豚液体培养基等应符合培养基的无菌性检查及灵敏度检查的要求,制备好的培养基若不即时使用,应置于无菌密闭容器中,在2~25℃、避光的环境下保存,并在经验证的保存期内使用。
因此,拟对胰酪大豆月东液体培养基及硫乙醛酸盐流体培养基在灭菌后的保存期进行验证,验证方法为:培养基灭菌后冷处保存(冰柜保存2~10°C),确认在保存期内两种培养基的PH值、无菌性及灵敏度是否符合要求;每种培养基应进行三个配制批次验证;分别确认培养基在灭菌后保存0天、1天、2天、3天、4天、5天的PH值、无菌性检查及灵敏度检查是否符合要求;根据验证结果,确认硫乙醇酸盐流体培养基和胰酪大豆腺液体培养基在灭菌后的保存时限。
2.目的对无菌检查用培养基灭菌后的保存时限进行验证,确认无菌检查用培养基灭菌后在保存有效期内的PH值、无菌性检查及灵敏度检查是否符合要求。
3.范围本验证文件的范围仅适用于质量控制部无菌检查用培养基制备好后的保存时限的验证,验证项目包括:先决条件确认、实验设备及器材确认、培养基确认、灭菌效果确认、包装储藏确认、培养基PH值确认、培养基无菌性检查确认及培养基灵敏度检查确认。
4.职责4.1质量控制部职责:负责验证方案、报告的起草;负责按照批准的方案进行验证操作;负责对验证数据进行收集、整理、分析;负责记录在确认过程中所有发生的偏差及变更;负责针对偏差及变更,并提出解决方案,以采取纠正行动;负责验证过程中的相关检验工作;负责验证结果的总结、分析评价工作;负责人负责审核文件。
4.2质量保证部职责:负责监督整个验证活动,确保验证按计划进度进行;负责过验证项目的验证;负责对验证数据进行收集、整理、分析;负责变差、变更的调查和处理,偏差调查报告及变更情况上报审批;负责人负责审核文件。
培养基贮存有效期验证报告

分发部门:01 品质管理部(1份)共计1份目录一、总论二、参考文件三、验证小组成员与职责四、验证范围和验证时间计划五、风险评估六、验证前准备七、验证内容八、偏差处理九、验证结果评价十、附件验证报告会议与人员签到表会议地点:会议时间:会议记录部门/组别:品质管理部一、总论培养基是微生物试验的基础,直接影响微生物试验结果,我公司使用按处方生产符合规定的脱水培养基,培养基运输过程中采取了有效保护,最大限度的降低了在运输过程中的机械损伤,采用已验证的培养基配制和灭菌程序制备培养基且过程受控,按照中国药典2015版四部所收载的贮藏条件,有效期,适用性检查试验对制备好的培养基进行质量监控试验,定期稳定性检查,在原微生物实验室厂房与设施、检验环境、合格的前提下,对培养基贮存有有效期进行验证,连续进行三个周期的验证,确保提供优质的培养基。
该验证指在我公司现实行的培养基封口方式下,培养基贮存在冰箱2~25℃内一个周期为30天,整个验证周期,包括产品使用的培养时间,无菌培养基为44天,微生物限度与控制菌培养基为35天。
二、参考文件1 验证管理规程2 风险管理规程3 《中国药典》2015年版四部4 《药品GMP指南》三、验证小组成员组长:验证范围:培养基贮存有效期验证的一系列相关活动验证小组于年月日至月日按验证方案进行验证五、风险评估1 风险识别C+A级区检验工器具转移的风险来源:灭菌后二次受到环境污染;培养皿转移污染;传递过程污染;操作人员污染;操作过程污染。
2 风险分析目的:风险分析是对已识别的项目的风险进行分析,以确定风险严重程度。
方法:应用失效模式与影响分析,识别潜在的失效模式,对风险发生的概率、严重性和可检测性评分。
3风险评估3.1风险方法:进行风险评估所用的方法遵循FMEA技术(失效模式与影响分析)包括以下点。
风险确认:可能影响产品质量、产量、工艺操作或数据完整性的风险。
风险判断:包括评估先前确认风险的后果,其基础建立在严重程度、可能性及可检测性上。
培养基有效期验证方案2

培养基有效期验证方案2培养基有效期验证方案2在细菌学和微生物学领域中,培养基是一种含有必需营养物质和生长因子的媒介,用于培养和繁殖微生物。
然而,培养基的有效期是有限的,因为其中的营养物质和生长因子会逐渐降解或变质,从而影响微生物的生长和繁殖。
因此,科学家和实验室技术人员需要定期验证培养基的有效期,以确保其在实验中的可靠性和准确性。
1.选择需要验证有效期的培养基样品:从不同批次的培养基中选择一部分样品进行验证。
确保所选样品的储存条件相同,以排除其它因素对培养基有效期的影响。
2.分析培养基中的营养物质:使用化学分析方法,确定培养基中的营养物质含量。
常见的营养物质包括碳源、氮源和矿物质。
在不同时间点分析多个样品,以观察其营养物质含量的变化趋势。
3.测定微生物的生长曲线:选取一种广泛使用的微生物株,在标准培养条件下分别使用验证样品和新鲜培养基进行培养。
通过测定微生物的生长曲线,确定培养基有效期的变化趋势。
4.观察微生物的生长和形态特征:在培养基有效期内的不同时间点,从验证样品和新鲜培养基中分别取样进行观察。
特别注意微生物的生长速度、生长形态和生理特征的变化。
5.比较验证样品和新鲜培养基的结果:将验证样品和新鲜培养基的分析结果和微生物培养结果进行比较,确定培养基有效期的变化情况。
如果验证样品与新鲜培养基在营养物质含量和微生物生长扩增上无明显差异,那么验证样品的有效期可以延长。
6.数据分析和报告:将所得数据进行统计和分析,并撰写详细的验证报告。
报告应包含验证样品和新鲜培养基的相关数据、观察结果以及培养基的有效期结论。
需要注意的是,培养基的有效期验证可能因不同的培养基配方和储存条件而有所不同。
因此,在验证过程中,需要考虑和控制培养基的储存温度、湿度和光照等因素,以尽可能减少外部因素对培养基有效期的影响。
此外,培养基有效期验证方案还可以结合其他方法,如微生物学检测和保存条件优化等,以提高验证的准确性和可靠性。
通过这些有效期验证方案,科学家和实验室技术人员可以确保培养基的质量和性能,为微生物学研究和实验提供可靠的基础。
培养基有效期的验证方案-2
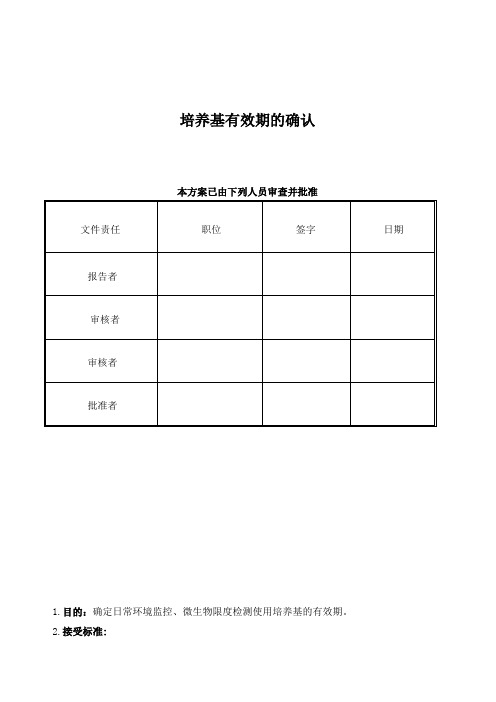
培养基有效期的确认本方案已由下列人员审查并批准1.目的:确定日常环境监控、微生物限度检测使用培养基的有效期。
2.接受标准:2.1试验用菌悬液每1ml含菌数应小于100cfu。
2.2 培养基配制后无菌性检查和营养性检查需符合要求。
2.3 培养基的pH值应符合相应培养基的要求。
3.操作程序:3.1实验仪器及器具:生化培养箱LRH-250A(广东省医疗器械厂,30-35℃, 23-28℃, 20-25℃);XG1.DMX-0.36B 型脉动真空灭菌器(山东医疗器械股份有限公司编号10.0311);FE20型pH计(梅特勒);灭菌生理盐水;移液管;试管;双碟。
3.2验证培养基:硫乙醇酸盐流体培养基TGB(德国merk),大豆酪蛋白消化肉汤培养基TSB(德国merk),营养琼脂培养基NA(德国merk),萨布罗葡萄糖琼脂培养基SDA(德国merk)、平板计数培养基PCA(德国merk)、远腾琼脂培养基ENA(德国merk)、硫酸月桂醇肉汤LST(德国merk)、亮绿乳糖肉汤培养基BGLBB (德国merk)、麦康凯琼脂培养基Mac.A (德国merk)、大豆酪蛋白消化琼脂培养基TSA(德国merk)、假单胞菌分离琼脂培养基PIA (BD)、绿脓荧光素测定用培养基PAF (德国merk)、绿脓菌素测定用培养基PAP (德国merk)、甘露醇胆盐琼脂培养基(MSA) (德国merk)、溴化十六烷基三甲铵琼脂培养基(CET)(德国merk)、沙门氏菌增菌培养基(RVSB) (德国merk)、木糖赖氨酸脱氧胆盐琼脂XLD(德国merk)、麦康凯肉汤培养基Mac.B(德国merk)、曙红亚甲蓝琼脂培养基EMB(德国merk)、三糖铁琼脂TSI(德国merk)、萨布罗葡萄糖肉汤培养基SDB(德国merk)、梭菌增菌培养基RCM(德国merk)、哥伦比亚琼脂培养基CA(德国merk)、肠肝菌增菌培养基EEB-M(德国merk)、紫红胆汁葡萄糖培养基VRBGA(德国merk)3.3试验菌:金黄色葡萄球菌Staphylococcus aureus [ATCC 6538]大肠埃希菌Escherichia coli [ATCC 8739]沙门氏菌Salmonella typhimurium [ATCC 14028]铜绿假单孢菌Pseudomonas aeruginosa [ATCC 9027]枯草芽孢杆菌Bacillus subtilis [ATCC6633]生孢梭菌Clostridium sporogenes [ATCC 19404]白色念珠菌Candida albicans [ATCC 10231]黑曲霉Aspergillus niger [ATCC 16404]3.4菌悬液的制备:3.4.1各取金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌斜面培养物一支,无菌操作接种一白金耳至TSB管中,30-35℃培养24-48小时,其中生孢梭菌需厌氧培养,取出置2-8℃贮存使用7天,每次使用前用灭菌生理盐水或灭菌水稀释至含菌约为10-100cfu/ml。
微生物限度检查用及环境监测用培养基的配制、灭菌和贮存效期验证

目的:本试验通过对微生物限度检查用及环境监测用培养基的配制方法、灭菌程序以及配制后贮存条件和贮存效期进行验证,确保每次配制的培养基质量均满足2010年版《中国药典》要求。
适用范围:适用于微生物限度检查用及环境监测用培养基。
责任人:质监部经理、QC主任、QC人员内容:1.概述:3次独立试验中确定了培养基的配制方法、灭菌参数、贮存条件(2-25℃)及贮存时间(30天),并对贮存0天、7天、15天和30天的培养基进行适用性检查(包括促生长能力、抑制能力、指示能力和无菌性)。
培养基是否合格,对微生物的生长、分离、鉴定及检验结果的正确与否起着至关重要的作用,因此,对培养基的质量控制十分必要。
适宜的培养基制备方法,合理存放,以及质量控制试验,是提供优质培养基的保证。
2005年版《中国药典》还没有规定对培养基进行适用性检查,经过修订,2010年版《中国药典》不但规定了培养基需进行适用性检查,而且在2010年版《中国药典》(一部附录)中规定:“若采用已验证的配制和灭菌程序制备培养基且过程受控,那么同一批脱水培养基的适用性检查实验可只进行一次,如果培养基的制备过程未经验证,那么每一批培养基均要进行适用性检查试验”。
本次验证试验的目的就是通过验证规范培养基的配制和灭菌过程,使培养基的整个配制和灭菌过程受控,同时确定培养基的贮存条件和贮存效期。
2.材料与仪器设备2.1 培养基2.1.1.试验用培养基:营养琼脂培养基(批号121010)、玫瑰红钠琼脂培养基(批号1302172)、胰酪胨大豆琼脂培养基(批号1112092)、胆盐乳糖培养基(批号1209162)、营养肉汤培养基(批号120912)、四硫磺酸钠亮绿培养基 (批号130124)、4-甲基伞形酮葡糖苷酸培养基(批号121023)均由北京三药科技开发公司生产;2.1.2.对照培养基:营养琼脂对照培养基(批号135003-201103)、玫瑰红钠琼脂对照培养基(批号135005-201002)、胰酪胨大豆琼脂对照培养基(批号135025-201101)、胆盐乳糖对照培养基(批号135006-201203)、营养肉汤对照培养基(批号135004-201103)、四硫磺酸钠亮绿对照培养基 (批号135020-201101)、4-甲基伞形酮葡糖苷酸对照培养基(批号135012-201001)均中国药品生物制品检定所提供。
培养基贮存有效期验证方案

培养基贮存有效期验证方案一、背景介绍生物实验室中,培养基的贮存对实验结果有着极大的影响,因此,对培养基的有效期进行验证是必不可少的,有效期过期的培养基可能已经失去了应有的菌落计数和质量特征。
为了保证实验结果的准确性和可靠性,本研究提出一种针对培养基贮存有效期验证的方案。
二、方案内容1.取样从培养基生产厂家或实验室中选取一批标准存储条件下的培养基,根据制备的日期开始计算其有效期,按照有效期截止前后的时间节点分别取样。
2.接种对每一个时间节点的培养基,分别进行菌落计数和菌种检验。
将检验过的菌种分别进行接种,确保接种数量足够多。
3.生长将接种后的菌种进行生长培养,按照标准的培养条件进行培养,周期时间与菌种相关,以确保培养基中的菌落能够充分生长繁殖,并能够区分不同的有效期时间节点。
4.菌落计数在生长周期结束后,对菌落进行计数,确定不同时间节点的培养基中菌落的差异。
并且,在计数过程中,需要注意菌落的数量不仅仅反映出菌落总量,还反映出菌落大小、繁殖速度等因素。
5.质量检验在菌落计数的同时,对菌种质量也进行检验,检验是否出现什么异常情况,如菌落形态异常、菌种污染等。
检验通过后,记录检验结果和菌种数量。
6.数据分析将不同时间节点的培养基中菌落计数和菌种检验的结果进行统计分析,得出培养基有效期与菌落数量、培养基质量的关系。
同时,针对不同菌种,进行细致的分析比较,得出菌种对培养基有效期的敏感度。
最终,将统计结果呈报给相关部门,以确保实验室工作的准确性和可靠性。
三、结论本方案通过对不同时间点的菌落数和质量的观察,可以获得培养基在有效期内菌落数和质量的动态变化规律,这为培养基的贮存和使用提供了有益的依据。
同时,本方案简便易行,时间和成本成本低,适用于各种实验室。
四、注意事项1.在取样、接种和生长过程中,必须按照严格的卫生生产规范进行操作。
2.培养基的贮存温度和时间必须按照标准规范进行控制。
3.在生长周期中,必须严格按照培养条件进行培养。
培养基贮存有效期验证报告

培养基贮存有效期验证报告一、引言本报告旨在验证培养基贮存的有效期,并评估其对微生物生长的影响。
通过对不同批次培养基贮存样品的测试,我们将得出结论,以指导实验室中培养基的使用与管理。
二、材料与方法1. 实验材料:培养基样品(不同批次)、无菌培养基平板、无菌注射器、生物安全柜等。
2. 实验流程:a. 选择不同批次的培养基样品,标注信息包括生产日期、物料批号等基本信息。
b. 根据标准操作规程,采用无菌技术将每批次培养基转移到无菌培养基平板上。
c. 使用无菌的注射器分别对每个培养基平板进行接种,并在一定时间内密封培养。
d. 观察和记录每个培养基上菌落的生长情况,并比较不同批次之间的差异。
e. 根据实验结果进行评估与分析,得出培养基的有效期验证报告。
三、结果与讨论1. 培养基贮存验证结果:根据实验数据显示,不同批次的培养基在存储期间均能支持微生物的生长。
菌落生长情况与存储时间和批次无明显关联。
因此,我们验证了培养基样品的有效期为XXX日期至XXX日期。
2. 培养基对微生物生长的影响:在验证过程中,我们观察到不同批次培养基平板上的菌落生长情况基本一致,符合预期。
这表明培养基样品在贮存期间能够保持其有效性,不会对微生物的生长造成显著的影响。
3. 培养基贮存管理建议:a. 培养基的存储应遵循相关规定,置于干燥、阴凉、避光的环境中,避免暴露在高温或潮湿环境下。
b. 每次开盖时,应尽量迅速并避免因频繁开关而导致的污染风险。
c. 在有效期内使用培养基,尽量避免使用超过有效期的样品,以确保实验结果的准确性。
四、结论经过实验验证,我们确认了培养基样品的有效期为XXX日期至XXX日期。
在这个时间范围内,培养基能够支持微生物的正常生长,贮存管理合理的情况下不会对微生物实验造成显著的影响。
因此,实验室可以根据验证结果合理使用和管理培养基,以确保实验数据和结果的准确性与可靠性。
附:培养基贮存有效期验证报告相关数据表格(如果有的话)[表格内容略]注:该报告旨在提供有关培养基贮存有效期的验证结果,以供实验室参考。
培养基有效期的验证

灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认1.0 Purpose 目的The purpose of this protocol is to validate the shelf life of media in sealed (bottle with silicagel plug and screw cap flask) and unsealed container ( Petri dishes) and USP ReferenceStandard Endotoxin (RSE) working solution. (concentration –10EU/ml)该方案是确认装在密封容器(包括胶塞瓶及旋盖瓶)及非密封容器(培养皿)中的培养基以及美国药典标准参考内毒素工作溶液(浓度为10EU/ml)的有效期。
2.0 Background & Scope背景和范围3.0 Applicable Documents 参考文件4.0 Materials 物料4.1 Test articles测试物品A.Microbiological media after autoclaving 灭菌后的培养基Three separate batches of flasks and petri dishes(screw cap and silica gel plug: per batchwill be filled with 400mls of media; petri dishes: per plate will be filled with 8-10ml of agarmedia.每种培养基准备三个批次瓶装的及倒好平板的(胶塞瓶及旋盖瓶每瓶装400ml 培养基;平板每个装8-10ml 琼脂培养基)B. RSE working solution (concentration –10EU/ml). RSE工作溶液 (浓度为10EU/ml)RSE working solution (concentration –10EU/ml) of 1000ml volumetric flasks for threeseparate batches.准备三个批次碘量瓶装的浓度为10EU/ml的美国药典标准参考内毒素工作溶液,每瓶装1000ml。
酸性罗氏产品稳定性有效期验证方案

1.目的:本报告中的研究为了反映酸性罗氏培养基在不同效期内、不同储存条件下和运输条件下的稳定性及有效性。
2.培养基稳定性研究方法的确定依据:2.1酸性罗氏培养基自然(长期)存放效期后的稳定性试验:在酸性罗氏培养基在实际自然贮存条件下(2-8℃)以及室温存放条件下。
2.2 酸性罗氏培养基开封后稳定性研究资料。
2.3 运输过程中,运输条件下在1℃~29℃和30℃以上(添加冰袋)对酸性罗氏培养基的稳定性影响。
3. 培养基稳定性研究的具体方法和过程:选择三个批次的产品,分别在室温、2-8℃的条件下使用结核分枝杆菌标准株(H37Rv)为阳性质控菌株,对产品从外观、无菌检测、生长试验(敏感性检测)、抑制性试验(特异性检测)、批内重复性和批间重复性几个方面进行测试,并且培养基开封后的稳定性进行测试。
模拟运输过程中的在1℃~29℃和30℃以上(添加冰袋)运输条件下对酸性罗氏培养基的稳定性影响。
3.1室温保存1天、2天、3天、4天、5天、6天、7天、8天、9天、10天,11天,12天;3.2 在2-8℃保存30天、60天、90天、120天;3.3 从培养基开封后,在不同时间分别放置0.5小时,1小时,1.5小时,2小时和3小时,分别对其进行无菌检测。
3.4 模拟运输过程中在1℃~29℃和30℃以上(添加冰袋)运输条件下对其稳定性影响。
4.样品选取和试验时间4.1 酸性罗氏培养基选择批号:批号:P2******* 生产日期:20140324批号:P2******* 生产日期:20140428批号:P2******* 生产日期:201405134.2 试验时间:P2*******从2014年3月24日开始时间,P2*******从2014年4月28日开始时间,P2*******从2014年05月13日开始时间。
试验员:徐雪英,详见下列各记录表。
5.试验方法5.2.1外观:采用目视法,在自然光线明亮处目视。
5.2.2 无菌检测:酸性罗氏培养置36±1℃普通培养箱中,48小时,无细菌生长。
洁净室环境监测用培养基贮存效期的验证及方法学确认

using of tryptose soya agar(TSA)culture plates and TSA (L一80)contact plates which were stored 0,90,1 20 d.The Ion—
gest sam pling time of volum etric sam pling, settling plates and sur face m icroorganism were tested by both types of plates stored 120 d,and then the growth promotion was tested.R esults The applicability examination results of TSA and TSA
普通肉汤等培养基的保质期试验

上 各试 验 结果 , 可将 普 通 肉汤 、 通琼 脂培 养 基保 质 期 暂定 为 1 普 2个 月 , 丁 肉汤 、 丁 琼 脂 、 马 马 麦康
凯琼脂 培养 基 保质 期 暂定 为 6个 月 。 [ 键词 ] 保质 期 ; 关 培养 基 ; 普通 肉汤
Te t o ld t r o f M e i uc s O r i r o h s n Va i iy Pe i d o d a s h a d na y Br t
定期 通过 灵敏 度试 验 和 活菌计 数试 验检 验 其质 量 。通 过试 验 观 察 到 : 普通 肉汤 、 通琼 脂 培 养基 普 于 两种条 件存 放 5 4周 后 , 普通 肉汤 灵敏 度 仍 能达 到 1 娟以上 , 通 琼 脂 培养 基 中活菌 数 没 有 明 0 普
显减 少 ; 马丁 肉汤 、 丁琼 脂 培 养 基 于 两 种 条 件 存 放 至 2 马 6周 , 丁 肉汤 灵 敏 度 仍 能 达 到 1 以 马 0 上 , 丁琼 脂 培养 基 中活 菌数 没有 明显减 少 , 3 马 但 0周 后 C C 4 8在 马 丁 肉汤 和 马 丁琼 脂 中生长 V C2 繁殖 能力 明显下 降 , 4 到 6周 以后 无 生长 ; 麦康 凯琼 脂培 养基 于 两种 条件 存放 5 4周 后 , 质控 菌 活菌 数没 有 明显减 少 , 3 但 0周 后培 养基 中指 示 剂颜 色消 退 明显 , 落特 异 性 显色反 应不 明显。通 过 以 菌
N L n,YAN Tn A i G ig—yn ,S N Ju—y n,L ig U i a UO Yu—fn ,Z i o g e g UO J —rn
( hn ntuef Vt ia " u o t l eig 10 8 ,C ia C iaIstto e r O DrgC nr ,B i 0 0 1 hn ) i en o j n
SOP-QA-1.42 B1 C硫酸粘菌素培养基保存期限验证方案

河北圣雪大成唐山制药有限责任公司1、目的:通过对C 硫酸粘菌素培养基保存期限的验证,从而说明培养基在保存期限内使用能有效地保证质量,满足生产的要求。
(保存条件为,温度:18℃-26℃、湿度:35%-65%。
)2、范围:适用于301车间种子室的C 硫酸粘菌素培养基的保存期限的验证。
3、职责:4、内容:4.1、固体培养基: 4.1.1、概述:固体培养基是由酵母浸出粉、大豆蛋白胨、酵母膏、注射级葡萄糖等物质组成,配制。
经过灭菌的固体培养基长时间保存可能会对菌种的培养有所影响,所以固体培养基的保存期限要严格控制。
4.1.2、方法:固体培养基按种子室SOP-301-2.11配制、灭菌后保存15天,接固体培养基,并同时接当天配的固体培养基作对照,在固体培养基上加等量等浓度的菌悬液,实验组和对照组同时培养4天,统计菌落数量。
连续做3批,实验组菌落数量和对照组相比,不能少于同条件配制的对照组的菌落数量的80%,证明固体培养基保存15天可以保证质量,固体培养基配制、灭菌后在15天内可以使用。
4.1.3、固体培养基的制备、接种及培养:分发号:A、固体培养基的配制、灭菌:固体培养基的配制和灭菌方法:(按配制300ml计)按比率依次称量葡萄糖、大豆蛋白胨、酵母膏、酵母浸出粉、氯化钠倒入配料缸中,再用量筒量取约250ml纯化水加入其中。
搅拌溶解后用量筒定容至300ml。
用20% NaOH溶液调pH至6.0-7.0后,分装入事先准备好装有琼脂的试管(三角瓶)中,加棉塞纱布牛皮纸,绑瓶灭菌。
灭菌温度120-122℃,灭菌压力0.1±0.005Mpa,保压时间为20-30分钟。
灭菌后测pH,总糖、氨氮,溶磷。
然后保存15天。
依照上述方法,连续做3批实验,将实验结果填入下表。
B、固体培养基的接种、培养、结果统计:接种和培养方法:按种子室SOP-301-2.11接种操作接固体培养基,将当天配制的固体培养基作为对照组,同时接实验组和对照组,将接种完毕的固体培养基,在31.5±1℃条件下培养90-100小时。
培养基有效期的验证方案-2

培养基有效期的确认本方案已由下列人员审查并批准1.目的:确定日常环境监控、微生物限度检测使用培养基的有效期。
2.接受标准:2.1试验用菌悬液每1ml含菌数应小于100cfu。
2.2 培养基配制后无菌性检查和营养性检查需符合要求。
2.3 培养基的pH值应符合相应培养基的要求。
3.操作程序:3.1实验仪器及器具:生化培养箱LRH-250A(广东省医疗器械厂,30-35℃, 23-28℃, 20-25℃);XG1.DMX-0.36B 型脉动真空灭菌器(山东医疗器械股份有限公司编号10.0311);FE20型pH计(梅特勒);灭菌生理盐水;移液管;试管;双碟。
3.2验证培养基:硫乙醇酸盐流体培养基TGB(德国merk),大豆酪蛋白消化肉汤培养基TSB(德国merk),营养琼脂培养基NA(德国merk),萨布罗葡萄糖琼脂培养基SDA(德国merk)、平板计数培养基PCA(德国merk)、远腾琼脂培养基ENA(德国merk)、硫酸月桂醇肉汤LST(德国merk)、亮绿乳糖肉汤培养基BGLBB (德国merk)、麦康凯琼脂培养基Mac.A (德国merk)、大豆酪蛋白消化琼脂培养基TSA(德国merk)、假单胞菌分离琼脂培养基PIA (BD)、绿脓荧光素测定用培养基PAF (德国merk)、绿脓菌素测定用培养基PAP (德国merk)、甘露醇胆盐琼脂培养基(MSA) (德国merk)、溴化十六烷基三甲铵琼脂培养基(CET)(德国merk)、沙门氏菌增菌培养基(RVSB) (德国merk)、木糖赖氨酸脱氧胆盐琼脂XLD(德国merk)、麦康凯肉汤培养基Mac.B(德国merk)、曙红亚甲蓝琼脂培养基EMB(德国merk)、三糖铁琼脂TSI(德国merk)、萨布罗葡萄糖肉汤培养基SDB(德国merk)、梭菌增菌培养基RCM(德国merk)、哥伦比亚琼脂培养基CA(德国merk)、肠肝菌增菌培养基EEB-M(德国merk)、紫红胆汁葡萄糖培养基VRBGA(德国merk)3.3试验菌:金黄色葡萄球菌Staphylococcus aureus [ATCC 6538]大肠埃希菌Escherichia coli [ATCC 8739]沙门氏菌Salmonella typhimurium [ATCC 14028]铜绿假单孢菌Pseudomonas aeruginosa [ATCC 9027]枯草芽孢杆菌Bacillus subtilis [ATCC6633]生孢梭菌Clostridium sporogenes [ATCC 19404]白色念珠菌Candida albicans [ATCC 10231]黑曲霉Aspergillus niger [ATCC 16404]3.4菌悬液的制备:3.4.1各取金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌斜面培养物一支,无菌操作接种一白金耳至TSB管中,30-35℃培养24-48小时,其中生孢梭菌需厌氧培养,取出置2-8℃贮存使用7天,每次使用前用灭菌生理盐水或灭菌水稀释至含菌约为10-100cfu/ml。
药品检验用培养基配制及灭菌后贮存有效期的研究

a f t e r s t e r i l i z a t i o n we r e d e t e r mi n e d . Re s u l t s a n d Co n c l u s i o n Al l t h e e x p e i r me n t s we r e s a t i s i f e d C H. P. r e q u i r e me n t s .
Re s e a r c h o n me di u m p r e pa r a t i o n a nd s t e r i l i z a t i o n s t o r a g e pe r i o d i n dr ug t e s t
L I U Q i a n , J I A N G J u n — h u i , Z H A N G H u i — h u i , W A N G Mi n — l a n
微生 物培养 基是 专供微 生 物生长 繁殖使 用 的混 合 营养制 品 , 几 乎是 所有微 生物 实验 室必须 用到 的 , 作 为科学研 究 和应 用 科学 的重 要 支撑 条 件 , 发 挥 着
程 ’ , 使培 养 基 制 备 的整 个 过 程 受 控 。通 过 验 证
试验 , 一方面, 可 以使 培 养基 的整 个 配 制 、 灭 菌 和贮
da t e t he p r e p a r a t i o n me t h o d s, s t o r a g e c o nd i t i o n a n d t h e s t o r a g e pe r i o d a f t e r s t e r i l i z a t i o n. M e t ho ds Ra nd o ml y c h o s e e a c h t wo bo t t l e s o f t h e 7 k i nd s d e h y d r a t e d me di u m, t o c u l t ur e i n a c c o r d a n c e wi t h t h e p r o v i s i o n s o f a p pl i c a b l e CH.P. 2 01 0 e d i — t i o n. I n ad d i t i o n, t hr e e i n de p e n de nt t e s t s we r e c a r r i e d o u t r e s p e c t i v e l y .Th e me di um pr e p a r a t i o n me t h o d a n d s t o r a g e p e r i o d
培养基贮存有效期验证报告

培养基贮存有效期验证报告培养基是用来培养细菌、真菌、酵母等微生物的营养物质,为了保证培养基的质量,在生产过程中需要对其有效期进行验证。
本文将对培养基贮存有效期的验证报告进行详细阐述。
一、实验目的验证培养基贮存有效期,确定其质量在一定时间内能够维持稳定。
二、实验材料和方法1.实验材料(1)培养基:选取常用的LB培养基作为实验材料。
(2)细菌株:以大肠杆菌为研究对象。
(3)测定仪器:培养箱、平板计数器、显微镜等。
2.实验方法(1)制备培养基:按照LB培养基的标准配方,配制培养基,并进行无菌处理。
(2)接种菌株:将已经培养好的大肠杆菌株接种到无菌的LB培养基平板上。
(3)封装培养基:将培养基平板密封包装,以模拟正常存储条件。
(4)存储实验:将密封包装的培养基在指定的温度下存储一定时间,如25℃下存储30天,4℃下存储60天。
(5)定期检测:每隔一段时间,从不同时间点取出培养基平板进行菌落计数和菌液悬浮液的显微镜观察。
(6)数据处理:根据菌落计数和显微镜观察结果,分析培养基质量是否受到时间的影响。
三、实验结果与分析经过存储不同时间的培养基平板进行检测,得到了以下实验结果:1.菌落计数将从不同时间点取出的培养基平板进行菌落计数,结果如下表所示:存储时间(天)菌落计数(CFU/mL)02.3×10^6102.1×10^6202.0×10^6301.8×10^6401.9×10^6501.6×10^6601.4×10^62.显微镜观察将不同时间点取出的培养基平板上的菌液悬浮液进行显微镜观察,结果如下:在存储0-30天的培养基上可观察到菌落和细胞形态正常的大肠杆菌;存储40-60天的培养基上菌落和细胞形态有所变形。
根据以上结果,可以得出以下结论:1.在存储30天内,培养基平板上的菌落计数保持稳定,细菌形态正常。
2.存储40-60天的培养基,菌落计数有所下降,细菌形态变形。
培养基效期报告

培养基效期报告一、简介本报告旨在评估实验室常用培养基的效期,以确保培养基在使用过程中的稳定性和可靠性。
培养基是在细胞培养和微生物培养中广泛使用的一种基础实验工具,其质量和效期对实验结果和数据分析具有重要影响。
通过对培养基的效期进行评估和监控,可以有效控制实验的可重复性和准确性。
二、方法和实验步骤1. 培养基选择本次评估中,我们选择了实验室常用的三种培养基,分别为液体LB培养基、固体Nutrient Agar培养基和YPDA培养基。
2. 样品采集从实验室库存中随机选取三个批次的培养基样品。
每个批次的培养基样品都经过严格标记和记录,以便日后的跟踪和监测。
3. 培养基制备按照培养基的配方,在实验室中制备足够的培养基样品。
确保制备过程符合标准操作规程,并采取一切必要措施以防止污染。
4. 培养基质量评估a. 外观观察观察培养基的外观,包括颜色、透明度、溶解性等,并与标准的培养基样品进行比较。
注意是否存在悬浮物或颗粒。
b. pH值检测使用pH计测量各个批次的培养基的pH值,并记录下来。
检测结果应在预定的范围内。
5. 培养基效能评估a. 菌落计数将各个批次培养基分别用于微生物分离培养,并计算菌落形成单位(CFU)。
理想情况下,不同批次之间的菌落计数应保持一致。
b. 细胞培养效果评估使用各个批次的培养基进行细胞培养,并观察细胞生长和形态。
评估细胞培养效果的关键指标包括细胞密度和细胞形态的一致性。
6. 数据分析和结果呈现根据上述实验步骤所获得的数据,进行数据分析和结果呈现。
统计学方法可以应用于数据的比较和分析,以确定培养基效期是否合格。
三、实验结果1. 培养基外观所有选取的培养基样品都呈现出良好的外观,颜色均一且透明度较高。
各个批次之间无明显差异,没有观察到悬浮物或颗粒。
2. pH值检测结果培养基批次1批次2批次3LB培养基7.07.1 6.9Nutrient Agar培养基 6.8 6.7 6.8YPDA培养基 5.9 6.2 6.13. 菌落计数结果培养基批次1批次2批次3LB培养基 1.2x10^6CFU/mL 1.3x10^6CFU/mL1.1x10^6CFU/mLNutrient Agar 培养基1.5x10^6CFU/mL1.4x10^6CFU/mL1.5x10^6CFU/mLYPDA培养基 1.8x10^6CFU/mL 1.7x10^6CFU/mL1.6x10^6CFU/mL4. 细胞培养效果评估经过细胞培养实验,得到以下结果:•培养基批次1拆分细胞后的细胞密度为1.2x10^7 cells/mL,细胞形态正常。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认1.0 Purpose 目的The purpose of this protocol is to validate the shelf life of media in sealed (bottle with silicagel plug and screw cap flask) and unsealed container ( Petri dishes) and USP ReferenceStandard Endotoxin (RSE) working solution. (concentration –10EU/ml)该方案是确认装在密封容器(包括胶塞瓶及旋盖瓶)及非密封容器(培养皿)中的培养基以及美国药典标准参考内毒素工作溶液(浓度为10EU/ml)的有效期。
2.0 Background & Scope背景和范围3.0 Applicable Documents 参考文件4.0 Materials 物料4.1 Test articles测试物品A.Microbiological media after autoclaving 灭菌后的培养基Three separate batches of flasks and petri dishes(screw cap and silica gel plug: per batchwill be filled with 400mls of media; petri dishes: per plate will be filled with 8-10ml of agarmedia.每种培养基准备三个批次瓶装的及倒好平板的(胶塞瓶及旋盖瓶每瓶装400ml 培养基;平板每个装8-10ml 琼脂培养基)B. RSE working solution (concentration –10EU/ml). RSE工作溶液 (浓度为10EU/ml)RSE working solution (concentration –10EU/ml) of 1000ml volumetric flasks for threeseparate batches.准备三个批次碘量瓶装的浓度为10EU/ml的美国药典标准参考内毒素工作溶液,每瓶装1000ml。
4.2 Test system测试系统A. Microbiological media after autoclaving灭菌后的培养基2-8O C refrigerator 2-8O C 冰箱pH meter instrument pH计Incubator 培养箱Water bath instrument 水浴箱6-Place manifold for filtration 6孔过滤岐管Receiver canister 滤杯灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认B. RSE working solution RSE工作溶液2-8O C refrigerator 2-8O C 冰箱Water bath instrument 水浴箱250o C dry heat oven250o C干热烘箱Vortex Mixer涡旋搅拌器Calibrated 100 microliter pitetter with disposable tips校正过的100微升取液器Test tube racks测试试管架Graduated Narrow- Mouth Erlenmeyer Flasks and stopper碘量瓶Calibrated timer经过校正的计时器4.3 Test Organism 测试菌株A.Microbiological media after autoclaving灭菌后的培养基Pseudomonas Aeruginosa(CMCC10211&10104)铜绿假单胞菌(CMCC10211&10104)Clostridium Sporogenes(CMCC64941)生孢梭菌(CMCC64941)Escherichia coli (CMCC 44113)大肠埃希菌(CMCC44113)Staphylococcus aureus (CMCC26003)金黄色葡萄球菌(CMCC26003)Bacillus subtilis(ATCC5230, CMCC 63501)枯草芽孢杆菌 (ATCC5230, CMCC 63501)Candida albicans(CMCC 98001)白色念珠菌(CMCC 98001)Aspergillus niger(ATCC 16404)黑曲霉(ATCC 1640)B.RSE working solution RSE工作溶液USP Reference Standard Endotoxin (10,000EU/vial)USP参考标准内毒素(10,000EU/vial)5.0 Design Qualification 设计确认NA5.1 Requirements Definition 定义设计要求NA5.2 Design Description / Formal Design Review设计描述和设计复核NA5.3 Qualification Checklist or Testing 设计确认清单或试验NA5.4 Design Qualification Review or Verification 设计最终确认NA灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认6.0 Installation Qualification 安装确认NA6.1 Feasibility Study (Risk Analysis / FMEA) 可行性研究(风险分析/FMEA)NA6.2 Description of Major Systems/Components主要系统/组件描述NA6.3 Installation Verification (Blue Prints/Process Flow or Wiring Diagrams/RequirementDefinition & Design) 安装确认(蓝图/流程或线路图/要求定义和设计)NA6.4 Critical Work Order Request关键工作定单要求NA7.0 Operation Qualification运行确认NA7.1 Operating Procedures / Parameters操作程序/参数NA7.2 General/Preventative Maintenance Recommendation建议的常规/预防维护NA7.3 Calibrations Requirements校正要求NA7.4 Conformance to GMP/Regulatory GMP/法规的符合性NA7.5 Training Requirements/Documentation培训要求/文件Training related person if the verification results does not comply with the currentspecification.如果确认结果与现有SOP不同,需要培训相关人员。
7.6 Programmable Controller/Microcomputer Validation可编程控制器/微型计算机的验证NA7.7 Functional Testing of Product产品功能测试NA7.8 Chemical Evaluation化学评估NA7.9 Microbiological Evaluation微生物评估7.9.1 Verification of microbiological media after autoclaving灭菌后培养基有效期的验证A.After autoclaving per sop-mt-11, initial pH adjustment and growth test(except agar plate) will be performed based on sop-mt-007, the eligible media will be use tovalidate shelf life. Store media until final term at 2-8O C (after 5 day in current storetime), pH adjustment (except agar plate) and growth test will be conducted again andrecorded on the appropriate forms of attachment VI. The test frequency as follow:灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认配制好的培养基按照sop-mt-11要求灭菌后,按sop-mt-007要求测试pH值及进行生长实验测试(琼脂板除外),合格的培养基用于有效期确认。
在储存条件为2-8O C的温度下,保存到最终期限(现有保存期的五天后),再重新测试pH值(琼脂板除外)及做生长实验测试,把数据填在附件VI的表格中。
各种培养基的测试频率参照下表:Remark: B1---Brain –heart Impingement Broth脑心浸液培养基F1---Fluid thioglycollate medium液体巯基醋酸培养基M1---M-Endo agarM-Endo 琼脂T5---Trypticase soy agar with lecithin and polysorbate 80黄豆圩干酪素琼脂中加入卵磷脂和吐温80T1---Soybean casein digest agar大豆胰酶琼脂灭菌后的培养基及美国药典标准参考内毒素工作溶液有效期的确认T2---Soybean casein digest broth大豆胰蛋白肉汤T3---Thermal death time agar致热死时间琼脂T4--- Thermal death time broth致热死时间肉汤Martin--- Martin agar medium改良马丁琼脂培养基B.Media agar in screw cap flask may only be melted once using microwave prior to use .Two flasks with 400mls of media agar may be melted with 80% power for 20minute. Perform growth testing after melting per SOP-MT-007.旋盖瓶的琼脂培养基只能在使用前微波炉溶解一次,每次用80%的火力20分钟溶解两瓶400ml琼脂培养基。
