氧化还原反应PPT
合集下载
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
《氧化还原反应》PPT课件(完美版)

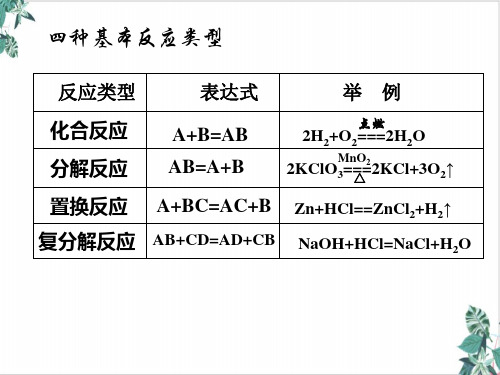
应属于氧化还原反应,但不属于四种基本反应类型中的
任何一种。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(2)有单质参加或生成的反应一定是氧化还原反应吗?
提示:不一定。反应3O2
2O3中有单质参加或生
成,但元素的化合价没有变化,不属于氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不 一定”或“一定不”,下同) (2)复分解反应__一__定__不___是氧化还原反应。 (3)化合反应和分解反应_不__一__定__是氧化还原反应。 ①有单质参加的化合反应_一__定__是氧化还原反应。
(4)Na2O+H2O====2NaOH属于氧化还原反应。( ) 提示:×。此反应中各元素的化合价均没有发生变化,因 此为非氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(3)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) 提示:×。可能是同种元素化合价的升降,如 2H2O2====2H2O+O2↑。
《 氧 化 还 原 反应》 PPT课件
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
氧化还原反应ppt课件

有单质参加或生成的反应不一定是氧化还原反应。
②有单质参加的化合反应一定是氧化还原反应。 √
③有单质生成的分解反应一定是氧化还原反应。
√
知能通练
3.实验室常利用下列反应制取少量N2: NaNO2+NH4Cl === NaCl+N2↑+2H2O。下列关于该反应的说
法不正确的是( B ) A.该反应是氧化还原反应 B.NaNO2发生氧化反应,NH4Cl发生还原反应 C.被还原的物质是NaNO2,被氧化的物质是NH4Cl D.被氧化和被还原的元素是同一种元素
知能通练
4. ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 === 2ClO2↑+K2SO4+2CO2↑+2H2O。下
列关于此反应的说法正确的是( A ) A.KClO3中部分元素的化合价降低,得到电子 B.H2SO4中部分元素的化合价降低 C.H2C2O4发生还原反应 D.H2C2O4既发生氧化反应又发生还原反应
否
Fe+2HCl === FeCl2 + H2↑
置换反应
是
Fe+CuSO4 === FeSO4 + Cu
置换反应
是
知识梳理 4.氧化还原反应与四大反应类型的关系
置换
复分解
知能通练 3.判断下列说法是否正确:
①有单质参加或生成的反应一定是氧化还原反应。 ×
放电
同素形体之间的转化不是氧化还原反应
3O2 === 2O3
知能通练
5. 下列反应既是置换反应又是氧化还原反应的是( A ) A.2F2+2H2O===4HF+O2 B.Cl2+H2O⥫⥬HCl+HClO C.3NO2+H2O===2HNO3+NO D.2Na2O2+2H2O===4NaOH +O2↑
氧化还原反应ppt课件

VS
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
1.3氧化还原反应 课件(共19张PPT)高一上学期化学人教版(2019)必修第一册

2.元素化合价的升降
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
0
+1
-1
- e-
+ e-
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,被氧化
得到2xe- ,化合价降低,被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
0
0
+1
-1
电子对偏离化合价升高,被氧化
电子对偏向化合价降低,被还原
+1
1
+17
2
8
7
你的电子借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2O B.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
0
+1
-1
- e-
+ e-
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,被氧化
得到2xe- ,化合价降低,被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
0
0
+1
-1
电子对偏离化合价升高,被氧化
电子对偏向化合价降低,被还原
+1
1
+17
2
8
7
你的电子借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2O B.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
氧化还原反应ppt

反应前后无 电子转移的反应
非氧化还 原反应
小结
角度 反应
氧化反 应
还原反 应
得失氧 得到氧 失去氧
化合价的变化 电子的转移
化合价升高 化合价降低
失去电子 偏离
得到电子 偏向
▲失—升—氧;得—降—还
▲ 氧化还原反应的特征:元素化合价发生了变化 ▲ 氧化还原反应的本质:电子发生转移
氧化还原反应的发展历程
得到2×e;化合价 降低;被还原
1;
1;
氢偏子在
显向的氯
正氯吸化
;
价
;
偏 离 氢
引 力 较 强
ቤተ መጻሕፍቲ ባይዱ
氢 分 子 里
;
;
故 氯 显 负
共 用 电 子
氯 原 子 对
价对电
从电子的转移得失或偏移认识氧化还原反应
原子失电子
或电子对偏离
反应前后 有电子转
氧化反应
移的反应
氧
化
化学反应
原子得电子
还 原
或电子对偏向
反
还原反应 应
失是 去还 电原 子剂
+11
+17
Cl
得是 到氧 电化 子剂
+17
Cl-
+11
+17
NaCl
氯化钠形成示意图
分析:
在离子化合物里;失去电子的原子带正电; 这种元素的化合价是正价;得到电子的原子带 负电;这种元素的化合价是负价;
在钠与氯气的反应中;钠失去1个电子; 化合价从0价升高到+1价;被氧化;氯得到1个电 子;化合价从0价降低到1价;被还原;
高温
1 2CuO+C △ 2Cu+CO2 2 H2+CuO == H2O + Cu
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化合价降低,得6×e-,被还原
化合价升高,失4×e-,被氧化
氧化剂:Cl2
还
原剂:FeBr2
氧
化产物:FeCl3、Br2还
原产物:FeCl3
2e-
5. 2FeBr2+3 Cl2=2FeCl3+2Br2
4e-
氧化剂:Cl2 铁元素、溴元素被氧化 氧化产物:FeCl3、Br2
还原剂:FeBr2 氯元素被还原 还原产物:FeCl3
不是
-1
-2 0
2H2O2 === 2H2O + O2↑ 是
化合价降低,还原反应
化合价升高,氧化反应
+7 -2
2KMnO4
==
+6
K2MnO4
+4
+ MnO2
+
0
O2↑
是
化合价降低,还原反应
化合价升高,氧化反应
0
0
+1 -1
2Na + Cl2 == 2NaCl 是
化合价降低,还原反应
化合价升高,氧化反应
在氧化还原反应中元 素化合价为什么会有升 降?
点燃
2Na + Cl2 = 2NaCl
氧化反应(化合 价升高)的实质是原 子失去电子的过程。
还原反应(化合 价降低)的实质是原 子得到电子的过程。
H2 + Cl2 =光照 2HCl
H
Cl
H Cl
化学反 应的本质是 原子之间的 重新组合
在生成的氯化氢分子中,一对共用电子对偏 向于Cl原子而偏离于H原子,使H从0→+1价,发 生氧化反应;同时使Cl从0→-1价,发生还原反 应。
一种物质失去氧,同时另一种物质得到氧 的反应,叫做氧化还原反应。
换一个角度观察,对于以下四个 反应,你还能发现其它的共同特征吗?
C+O2=CO2 2Mg+O2=2MgO H2+CuO=Cu+H2O CO+CuO=Cu+CO2
氧化反应,化合价升高
氧化反应,化合价升高
0
H2
+
+2CuO
+1=
H2O
+0
化合价升高,失2e-,被氧化
2.SO2+Cl2+2H2O=2HCl+H2SO4 化合价降低,得2×e-,被还原
氧化剂:Cl2 还原剂:SO2 氧化产物:H2SO4 还原产物:HCl
化合价升高,失2×e-,被氧化
氧化剂:MnO2
3. MnO2+4HCl 〓 MnCl2 +Cl2↑+2H2O 还原剂: HCl
氧化产物: Cl2
化合价降低,得2×e-,被还原
还原产物:MnCl2
化合价升高,失e-,被氧化
氧化剂:Cl2 还
4. Cl2 +2NaOH= NaCl +NaClO+H2O原化剂产: 物C:l2NaClO氧还
化合价降低,得e-,被还原
原产物:NaCl
化合价升高,失2×e-,被氧化 5. 2FeBr2+3 Cl2=2FeCl3+2Br2
应,得到还原产物
总结:“八字真言”
还升失氧、氧降得还
练习
• 指明下列反应中的氧化剂和还原剂;被氧化的元 素和被还原的元素;氧化产物和还原产物,并指 明电子的转移方向和数目。
化合价升高,失3×2e-,被氧化
1.Fe2O3+3CO=2Fe+3CO2 化合价降低,得2×3e-,被还原
氧化剂:Fe2O3 还原剂:CO 氧化产物:CO2 还原产物:Fe
化合价升高,失2e化合价升高,失2e-
+2 +1 +2
0
4.Zn + 2HCl == ZnCl2 + H2↑
化合价降低,得2×e-
化合价升高,失4×3e-
-3 +2 0 5. 4NH3+6NO=5N2+6H2O
化合价降低,得6×2e-
练有所悟
化合价升高对应着失去电子,化合价 升高的总价数等于失电子的总数。
2.箭头总是从失电子的元素指向得 电子的元素;
3.在箭桥上标出转移电子数目,不 写“得”” 失”。
用单线桥表示下列氧化还原反应
2e-
+1 0
0 +2
H2O + C == H2 + CO
2 + 2HCl == ZnCl2 + H2↑
2e-
+1 0 0 +1 CuO + H2 == Cu +H2O
• 2.氧化产物:含有化合价升高的元素的生成物 还原产物:含有化合价降低的元素的生成物
• 3.氧化性:物质得电子的能力(得电子越容易,氧化性就越强) 还原性:物质失电子的能力(失电子越容易,还原性就越强)
. 4.被氧化:元素失去电子的过程(化合价升高的元素被氧化) 被还原:元素得到电子的过程(化合价降低的元素被还原)
氧化还原反应
氧气与磷、硫、铁的反应有一个共同特点:它们都是由两 种物质起反应,生成另一种物质。我们把由两种或两种以 上物质生成另一种物质的反应,叫做化合反应。
这三个反应还有另一个共同特点:它们都是物质与氧发生 的反应。这类反应属于氧化反应。氧气在氧化反应中提供 氧,它具有氧化性。
木碳与氧化铜反应,生成铜和二氧化碳。 2CuO+C===2Cu+CO2↑在这个反应里,氧化铜失去氧 而变成单质铜。这种含氧化合物里的氧被夺去的反应, 叫做还原反应。木碳是使氧化铜还原为铜的物质,它具 有还原性。单质碳的还原性可用于冶金工业。例如,焦 碳可以把铁从它的氧化物矿石里还原出来。 2Fe2O3+3C===4Fe+3CO2↑
0
0
+1 -1
H2 + Cl2 == 2HCl 是
化合价降低,还原反应
练有所得!
• 只要是氧化还原反应,就一定有元素化 合价发生变化,这是氧化还原反应的重要特 征!
• 只要反应前后有元素化合价发生变化, 则该反应就一定是氧化还原反应。这是判断 氧化还原反应的依据。
• 氧化还原反应中,化合价有升必有降。 • 氧化还原反应中不一定有氧原子的得失。
Cu 还原反应,化合价降低
0 0 +4 -2
C+O2=CO2
还原反应,化合价降低
氧化反应,化合价升高
氧化反应,化合价升高
0 0 +2 -2
2Mg+O2=2MgO
还原反应,化合价降低
+2 +2 0 +4
CO+CuO=Cu+CO2
还原反应,化合价降低
氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。
用双线桥法标出以下反应的电 子转移情况情况:
化合价升高,失2e-
0 +2
+2
0
1.Fe + CuSO4 = FeSO4 + Cu
化合价降低,得2e化合价升高,失4×e-
0 0 点燃 +1 -2
2. 2H2 + O2 == 2H2O
化合价降低,得2×2e-
化合价降低,得2×e-
+1 0
0 +2
3.H2O + C == H2 + CO
CaCO3 = CaO+ CO2 ↑ (非氧化还原反应)
③置换反应: Zn+ H2SO4 =ZnSO4 + H2 ↑ (氧化还原反应)
④复分解反应: BaCl2+H2SO4=BaSO4↓+2HCl (非氧化还原反应)
结论:置换反应、部分化合反应、部分分解反应是氧化还原反应,复分解反应都是 非氧化还原反应.
+2
0高温 0 +4
2CuO + C == 2Cu + CO2
化合价降低,得2×2e-
这种表示电子转移情况的方法叫双线桥法!
氧化还原反应电子转移的表示方法———
双线桥法
举例:
失2×e-
CuO+ H2 加热 Cu+ H2O
得2e-
[练习一] 用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl=MnCl2+Cl2↑+2H2O
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
氧化还原反应与四种基本反应类型的关系
交 叉
化合反应
分解反应
分
类
氧化还原反应
图
一
置换反应
复分解反应
置换反应
化合反应 分解反应 复分解反应
交叉分类图二
氧化还原反应 非氧化还原反应
四、 与氧化还原反应相关的五对概念
• 1.氧化剂:得电子(化合价降低)的反应物 还原剂:失电子(化合价升高)的反应物
一 、认识氧化还原反应 请列举两个氧化反应和两个还原反应
C+O2=CO2
2Mg+O2=2MgO (氧化反应)
CuO+H2=Cu+H2O CuO+CO=Cu+CO2 (还原反应)
失去氧,还原反应
CuO + H2 = Cu + H2O
得到氧,氧化反应
(一)从得失氧原子的角度认识氧化还原反应
氧化反应:物质得到氧原子的反应 还原反应:物质失去氧原子的反应 分类的标准:得氧或失氧 从得失氧角度可得出氧化还原反应的定义:
. 5.氧化反应:失去电子的反应或化合价升高的反应 还原反应:得到电子的反应或化合价降低的反应
电子的给予体
电子的接受体
还原剂
氧化剂
失去电子(具有还原性) 得到电子(具有氧化性)
所含元素的化合价升高
化合价升高,失4×e-,被氧化
氧化剂:Cl2
还
原剂:FeBr2
氧
化产物:FeCl3、Br2还
原产物:FeCl3
2e-
5. 2FeBr2+3 Cl2=2FeCl3+2Br2
4e-
氧化剂:Cl2 铁元素、溴元素被氧化 氧化产物:FeCl3、Br2
还原剂:FeBr2 氯元素被还原 还原产物:FeCl3
不是
-1
-2 0
2H2O2 === 2H2O + O2↑ 是
化合价降低,还原反应
化合价升高,氧化反应
+7 -2
2KMnO4
==
+6
K2MnO4
+4
+ MnO2
+
0
O2↑
是
化合价降低,还原反应
化合价升高,氧化反应
0
0
+1 -1
2Na + Cl2 == 2NaCl 是
化合价降低,还原反应
化合价升高,氧化反应
在氧化还原反应中元 素化合价为什么会有升 降?
点燃
2Na + Cl2 = 2NaCl
氧化反应(化合 价升高)的实质是原 子失去电子的过程。
还原反应(化合 价降低)的实质是原 子得到电子的过程。
H2 + Cl2 =光照 2HCl
H
Cl
H Cl
化学反 应的本质是 原子之间的 重新组合
在生成的氯化氢分子中,一对共用电子对偏 向于Cl原子而偏离于H原子,使H从0→+1价,发 生氧化反应;同时使Cl从0→-1价,发生还原反 应。
一种物质失去氧,同时另一种物质得到氧 的反应,叫做氧化还原反应。
换一个角度观察,对于以下四个 反应,你还能发现其它的共同特征吗?
C+O2=CO2 2Mg+O2=2MgO H2+CuO=Cu+H2O CO+CuO=Cu+CO2
氧化反应,化合价升高
氧化反应,化合价升高
0
H2
+
+2CuO
+1=
H2O
+0
化合价升高,失2e-,被氧化
2.SO2+Cl2+2H2O=2HCl+H2SO4 化合价降低,得2×e-,被还原
氧化剂:Cl2 还原剂:SO2 氧化产物:H2SO4 还原产物:HCl
化合价升高,失2×e-,被氧化
氧化剂:MnO2
3. MnO2+4HCl 〓 MnCl2 +Cl2↑+2H2O 还原剂: HCl
氧化产物: Cl2
化合价降低,得2×e-,被还原
还原产物:MnCl2
化合价升高,失e-,被氧化
氧化剂:Cl2 还
4. Cl2 +2NaOH= NaCl +NaClO+H2O原化剂产: 物C:l2NaClO氧还
化合价降低,得e-,被还原
原产物:NaCl
化合价升高,失2×e-,被氧化 5. 2FeBr2+3 Cl2=2FeCl3+2Br2
应,得到还原产物
总结:“八字真言”
还升失氧、氧降得还
练习
• 指明下列反应中的氧化剂和还原剂;被氧化的元 素和被还原的元素;氧化产物和还原产物,并指 明电子的转移方向和数目。
化合价升高,失3×2e-,被氧化
1.Fe2O3+3CO=2Fe+3CO2 化合价降低,得2×3e-,被还原
氧化剂:Fe2O3 还原剂:CO 氧化产物:CO2 还原产物:Fe
化合价升高,失2e化合价升高,失2e-
+2 +1 +2
0
4.Zn + 2HCl == ZnCl2 + H2↑
化合价降低,得2×e-
化合价升高,失4×3e-
-3 +2 0 5. 4NH3+6NO=5N2+6H2O
化合价降低,得6×2e-
练有所悟
化合价升高对应着失去电子,化合价 升高的总价数等于失电子的总数。
2.箭头总是从失电子的元素指向得 电子的元素;
3.在箭桥上标出转移电子数目,不 写“得”” 失”。
用单线桥表示下列氧化还原反应
2e-
+1 0
0 +2
H2O + C == H2 + CO
2 + 2HCl == ZnCl2 + H2↑
2e-
+1 0 0 +1 CuO + H2 == Cu +H2O
• 2.氧化产物:含有化合价升高的元素的生成物 还原产物:含有化合价降低的元素的生成物
• 3.氧化性:物质得电子的能力(得电子越容易,氧化性就越强) 还原性:物质失电子的能力(失电子越容易,还原性就越强)
. 4.被氧化:元素失去电子的过程(化合价升高的元素被氧化) 被还原:元素得到电子的过程(化合价降低的元素被还原)
氧化还原反应
氧气与磷、硫、铁的反应有一个共同特点:它们都是由两 种物质起反应,生成另一种物质。我们把由两种或两种以 上物质生成另一种物质的反应,叫做化合反应。
这三个反应还有另一个共同特点:它们都是物质与氧发生 的反应。这类反应属于氧化反应。氧气在氧化反应中提供 氧,它具有氧化性。
木碳与氧化铜反应,生成铜和二氧化碳。 2CuO+C===2Cu+CO2↑在这个反应里,氧化铜失去氧 而变成单质铜。这种含氧化合物里的氧被夺去的反应, 叫做还原反应。木碳是使氧化铜还原为铜的物质,它具 有还原性。单质碳的还原性可用于冶金工业。例如,焦 碳可以把铁从它的氧化物矿石里还原出来。 2Fe2O3+3C===4Fe+3CO2↑
0
0
+1 -1
H2 + Cl2 == 2HCl 是
化合价降低,还原反应
练有所得!
• 只要是氧化还原反应,就一定有元素化 合价发生变化,这是氧化还原反应的重要特 征!
• 只要反应前后有元素化合价发生变化, 则该反应就一定是氧化还原反应。这是判断 氧化还原反应的依据。
• 氧化还原反应中,化合价有升必有降。 • 氧化还原反应中不一定有氧原子的得失。
Cu 还原反应,化合价降低
0 0 +4 -2
C+O2=CO2
还原反应,化合价降低
氧化反应,化合价升高
氧化反应,化合价升高
0 0 +2 -2
2Mg+O2=2MgO
还原反应,化合价降低
+2 +2 0 +4
CO+CuO=Cu+CO2
还原反应,化合价降低
氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。
用双线桥法标出以下反应的电 子转移情况情况:
化合价升高,失2e-
0 +2
+2
0
1.Fe + CuSO4 = FeSO4 + Cu
化合价降低,得2e化合价升高,失4×e-
0 0 点燃 +1 -2
2. 2H2 + O2 == 2H2O
化合价降低,得2×2e-
化合价降低,得2×e-
+1 0
0 +2
3.H2O + C == H2 + CO
CaCO3 = CaO+ CO2 ↑ (非氧化还原反应)
③置换反应: Zn+ H2SO4 =ZnSO4 + H2 ↑ (氧化还原反应)
④复分解反应: BaCl2+H2SO4=BaSO4↓+2HCl (非氧化还原反应)
结论:置换反应、部分化合反应、部分分解反应是氧化还原反应,复分解反应都是 非氧化还原反应.
+2
0高温 0 +4
2CuO + C == 2Cu + CO2
化合价降低,得2×2e-
这种表示电子转移情况的方法叫双线桥法!
氧化还原反应电子转移的表示方法———
双线桥法
举例:
失2×e-
CuO+ H2 加热 Cu+ H2O
得2e-
[练习一] 用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl=MnCl2+Cl2↑+2H2O
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
氧化还原反应与四种基本反应类型的关系
交 叉
化合反应
分解反应
分
类
氧化还原反应
图
一
置换反应
复分解反应
置换反应
化合反应 分解反应 复分解反应
交叉分类图二
氧化还原反应 非氧化还原反应
四、 与氧化还原反应相关的五对概念
• 1.氧化剂:得电子(化合价降低)的反应物 还原剂:失电子(化合价升高)的反应物
一 、认识氧化还原反应 请列举两个氧化反应和两个还原反应
C+O2=CO2
2Mg+O2=2MgO (氧化反应)
CuO+H2=Cu+H2O CuO+CO=Cu+CO2 (还原反应)
失去氧,还原反应
CuO + H2 = Cu + H2O
得到氧,氧化反应
(一)从得失氧原子的角度认识氧化还原反应
氧化反应:物质得到氧原子的反应 还原反应:物质失去氧原子的反应 分类的标准:得氧或失氧 从得失氧角度可得出氧化还原反应的定义:
. 5.氧化反应:失去电子的反应或化合价升高的反应 还原反应:得到电子的反应或化合价降低的反应
电子的给予体
电子的接受体
还原剂
氧化剂
失去电子(具有还原性) 得到电子(具有氧化性)
所含元素的化合价升高
