12 第十二章 羧酸 C
有机化学下册课后答案李景宁

第十二章羧酸(P32-33) 1.命名下列化合物或写出结构式:(1) 3-甲基丁酸 (2) 3-对氯苯基丁酸(3) 间苯二甲酸 (4) 9,12-十八碳二烯酸(5) 4-甲基己酸 CH3CH2CH(CH3)CH2CH2COOH(6) 2-羟基丁二酸 HOOCCH(OH)CH2COOH(7) 2-氯-4-甲基苯甲酸(8) 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:(第四版保留)(1)C6H5CH2Cl 干醚MgC6H5CH2MgCl(1) CO2(2) H2OC6H5CH2COOH SOCl2C6H5CH2COCl 4.完成下列转变:5、怎样由丁酸制备下列化合物?6、解:7、指出下列反应中的酸和碱。
按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.(1)按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔(2)按碱性降低的次序排列下列离子:①碱性:CH3HC C CH3O>>②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度。
产物DC5H10有一个不饱和度。
从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇。
10.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为CH3CH(CH2COOH)COOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR谱图:3200-2300cm-1为羟基中O-H键的伸缩振动。
1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的 C-H 键的面外弯曲振动。
有机化学第12章 羧酸

四、α-H的卤代反应
羧酸的α-H可在光、碘、红磷、硫等催化剂存在下被溴 或氯取代生成卤代酸。
RCH2COOH
Br2 PΔ
RCHCOOH Br2
Br
PΔ
Br R-C-COOH
Br
控制条件,反应可停留在一取代阶段。
CH3CH2CH2CH2COOH + Br2
P Br2 70 ℃
实质上并非两者的简单组合
醛酮中 C O 键长 0.122nm
醇中
C OH 键长 0.143nm
O HC
OH
(甲酸)
0.1245nm 0.1312nm 电子衍射实验证明
O RC
O-H
P-π 共轭体系
RC sp2 杂化
O OH
O RC
OH O HC OH
O RC
O
O 0.127nm HC
O 0.127nm
O RC
O
O HC
O
羧酸的化学性质
H
脱羧反应
O
RCC
羟基断裂呈酸性
H
OH
α H 的反应
羟基被取代的反应
一、酸性
羧酸具有弱酸性,在水溶液中存在着如下平衡:
RCOOH
RCOO + H+
乙酸的离解常数Ka为1.75×10-5 , pKa =4.76 甲酸的Ka=2.1×10-4 , pKa =3.75 其他一元酸的Ka在1.1~1.8×10-5之间, pKa在4.7~5之间。 可见羧酸的酸性小于无机酸而大于碳酸(H2CO3 pKa1=6.73)。
oocoh形式上看羧基是由一个和一个组成coh实质上并非两者的简单组合醛酮中coo01245nm键长0122nmhc01312nmoh醇中coh甲酸电子衍射实验证明键长0143nmoorcohrc2ohp共轭体系sp杂化ooorcrcrcohoooo0127nmohchchcohoo0127nm羧酸的化学性质h脱羧反应orcc羟基断裂呈酸性ohhh的反应羟基被取代的反应一酸性?羧酸具有弱酸性在水溶液中存在着如下平衡
有机化学

第十二章 羧酸及其衍生物定义:分子中含有羧基的有机化合物称为羧酸(Carboxylic Acid),其通式为RCOOH ,其中R-可以是烷基或芳基。
羧酸的羟基被其它基团取代的化合物称为羧酸衍生物(boxylic acid derivatives)。
第一节 羧酸的结构、分类和命名 一、 结构1. 羰基C 原子以sp2杂化轨道成键:三个sp2杂化轨道形成的三个σ键在同一平面上,键角大约为120度。
2. 键长:C=O 双键键长为123pm ,C —O 单键键长为136pm 。
3. p –π共轭:碳原子的P 轨道和羧基氧的一个P 轨道相互交叠形成π键。
4. —COO-结构:羧基离解为负离子后,负电荷就完全均等地分布在O —C —O 链上,即两个C —O 键键长完全平均化。
0.127nmCHOO0.127n m二、 分类1、根据羧基羧连接烃基不同,将羧酸分为脂肪、脂环和芳香羧酸。
2、根据羧酸分子中所含的羧基数目不同,可分为一元酸、二元酸和多元酸。
三、 命名1、 羧酸常用俗名:通常根据天然来源命名。
如:HCOOH 蚁酸,HOOC —COOH 草酸。
2、 IUPAC 命名法:与醛的命名相同,即选择含有羧基的最长碳链为主链,靠近羧基一端开始编号;对于脂环酸和芳香酸,则把脂环或芳环看作取代基来命名;多元羧酸,选择含两个羧基的碳链为主链,按C 原子数目称为某二酸;如有不饱和键角要标明烯(或炔)键的位次,并使主链包括双键和叁键。
例如:COOHCH 2CH 2CH 2COOH环已基甲酸4—环已基丁酸CH 3(CH 2)7CH=CH (CH 2)7COOH 9—十八碳烯—酸(俗称油酸)第二节 羧酸的物理性质 一、 溶解性羧酸分子可与水形成氢键,所以低级羧酸能与水混溶,随着分子量的增加,非极性的烃基愈来愈大,使羧酸的溶解度逐渐减小,6个碳原子以上的羧酸则难溶于水而易溶于有机溶剂。
二、 熔沸点1、 熔点:随着C 原子的增加呈锯齿状的变化。
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
第12章 羧酸和取代羧酸

b-酮酸
芳香酸的脱羧反应较脂肪酸容易,尤其是邻、对位 上连有吸电子基,如:
NO 2 O 2N CO2H NO 2
H2O
NO 2 O 2N NO 2 + CO2
六)二元酸的热解反应
二元酸受热后,由于两个羧基的位置不同,而发生不同的 化学反应,有的失水,有的失羧,有的同时失水失羧。
1、乙二酸和丙二酸------脱羧
3、烷基苯氧化:制备苯甲酸及其部分衍生物
CH3 KMnO4 Cl COOH Cl
4、格氏试剂与CO2反应后水解
O RMgX + O=C=O RCOMgX H 3 O+
RCOOH
5、羧酸衍生物水解:酰卤、酸酐、酯、酰胺、腈
O RC L H 2O O L=X, OCR, OR, NH2(R) O RC OH + HL
系统命名法原则与醛相同。
1. 选择含羧基在内的最长碳链为主链
2. 从羧基碳原子开始用阿拉伯数字标明取代基等的位置 3. 按所含碳原子数目称为某酸,取代基及位次写在某酸 之前。
对于简单的脂肪酸也常用 α、β、γ 等希腊字 母表示取代基的位次;羧基永远作为C-1。
CH3 CH3-CH2-CH-CH2-CO2H
15.7 16-19
羧酸酸性的强弱决定于电离后所成的羧酸根负离子 (即共轭碱)的相对稳定性。
诱导效应、共轭效应对酸性的影响
1. 诱导效应的影响
G CH2COOG
酸性增强
CH2COO-
酸性减弱
G CH2COO-
各取代基的吸电子诱导效应的强弱次序:
NO2> CN> F> Cl> Br> I> C≡CH> OCH 3> OH > C6H5> CH=CH2> H
高四12章__羧酸

第十二章 12.5 羧酸的波谱性质
IR谱图特征: IR谱图特征 谱图特征: O
羧酸 R-C-OH
羧
酸
-1 νC=O : 1725-1700cm -1 : νOH(缔合) 3000-2500cm (胖峰或漫坡)
δ OH :
O 羧酸盐 R-C O-
-1 约920 cm
O- :1610-1550cm 和 1420-1300cm -1 -1 R-C O
熔点:偶数碳羧酸的m.p高于相邻两奇数碳羧酸的m.p。 熔点:偶数碳羧酸的m.p高于相邻两奇数碳羧酸的m.p。 (P429图12-1) P429图12H3C
原因:
H3C
COOH H3C
COOH H3C
COOH H3C
COOH
H3C COOH
COOH
分子对称性低,排列不够紧密
分子对称性高,排列紧密
同理:二元酸也是偶数碳羧酸之m 高;不饱和酸:E 同理:二元酸也是偶数碳羧酸之m.p高;不饱和酸:E式m.p>Z式m.p;
12.3.1
羧酸的工业合成
(1) 烃氧化
制乙酸: 制乙酸:
CH3CH2CH2CH3
O2,醋酸钴 90~100 C,1.01~5.47MPa
o
CH3COOH + HCOOH + CH3CH2COOH + CO + CO2 + 酯和酮 57% 1~2% 2%~3% 17% 22%
工业制乙酸还可用轻油(C5~C7的烷烃) 工业制乙酸还可用轻油(C5~C7的烷烃)为原料。 制苯甲酸: 制苯甲酸:
RX + NaCN
RCN
RCOOH + NH3
增长碳链的方法之一,RCOOH比RX多一个碳!
第十二章 羧 酸
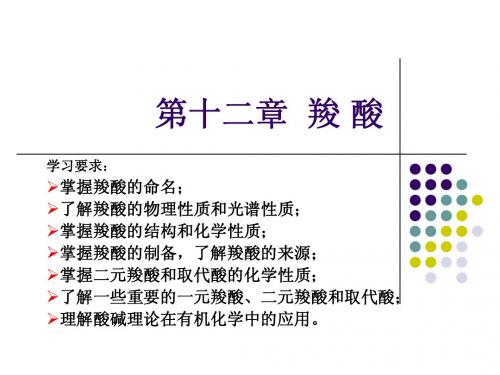
CH COOH 2 CH COOH CH CH COOH β -苯2 基 丙 烯酸 (肉 桂酸 )
丁二酸(琥珀酸)
CH3CH CHCOOH
CH3CHCH2COOH CH3 3-甲 基 丁酸
2-丁烯酸
书 P2 问题12-1
酰基: 羧酸分子中的羧基除去羟基后的基团;
酰氧基:羧酸分子中的羧基除去氢原子后的基团。
O
O18 CH3C-OC(CH3)3 + H2O
三、 脱羧反应
*1.强热脱羧 CH3COONa
*2.催化脱羧
2RCOOH
400—500℃
+
NaOH
CaO
强热
CH4
+
Na2CO3
ThO2
O
+
R
CO2
+
H2O
R
3.α-C原子连有吸电基的一元羧酸易脱羧
HOOCCH2COOH
O2N COOH NO2
H2O
O H3C C H3C O C O
乙 酰基
O PhCH2 C
乙 酰氧 基
O PhCH2 C O
苯 乙 酰基
O O
苯 乙 酰氧 基
O O
CH3CCH3CCH3 乙酰丙酮 CH3CCH3COCH2CH3 乙酰乙酸乙酯
第二节 羧酸的物理性质
1. 沸点:由于羧酸分子间及羧酸 分子与水分子间形成氢键,羧酸的 沸点高于分子量相近的醇。
5.比重:一元羧酸:甲酸、乙酸比重大于1; 其它羧酸的比重小于1。 二元羧酸、芳香羧酸的比重大于1。 6.状态: 十个碳原子以下的饱和一元酸是液体。 高级脂肪酸是蜡状固体。 二元脂肪酸和芳香酸都是结晶固体。
羧 烃 基 基
有机化学第8版第十二章-羧酸衍生物全篇

N-甲基-N-乙基乙酰胺
(N-ethyl -N-methyl acetamide)
O CH3 C-N CH3
N,N-二甲基苯甲酰胺
2、酸酐:按其水解产物命名
OO
OO
CH3C O CCH3
乙酸酐
(acetic anhydride)
O
CH3C O CCH2CH3
乙丙酸酐
(acetic propanoic anhydride)
H2O H+ 或OH
2、氨解反应
O
RC OH + R'OH
COOCH3 + NH3
CONH2 + CH3OH
3、酯缩合反应
酯分子中的α-氢显弱酸性,在碱的作用下与另一分子酯 发生类似于羟醛缩和的反应,生成β-酮酸酯,称为酯缩 和反应或Claisen(克莱森)缩和反应。
O 2CH3C-OC2H5
(1)C2H5ONa (2)H3O+
紫色或紫红色溶液
缩二脲反应
凡分子中含两个或两个以上
O
C NH
肽键
结构的化合物都能进行缩二脲反应
二、胍
NH H2N C NH2
胍
NH H2N C NH
胍基
NH H2N C
脒基
胍的衍生物在临床上是重要的治疗糖尿病的药物。
H2C
COOC2H5
H2N +C
O
COOC2H5 H2N
O
C NH
H2C C O + 2C2H5OH
O-
O
CH3-C=CH-COC2H5
O
O-
CH3-C-CH=COC2H5
乙酸乙酯的性质,具有甲基酮的性质,碘仿反应,2,4-二 硝基苯肼的反应,HCN的反应等;具有烯醇的性质,与金 属钠反应放出氢气,使溴的四氯化碳溶液褪色,与三氯化 铁溶液显色等。
第12章 羧酸

第12章 羧酸§12.1 羧酸的分类、结构与命名12.1.1 结构和分类 1、定义分子中含有C OH O基团(羧基)的有机化合物称为羧酸。
2、羧酸的结构通式:R-COOH (-R=烷基或芳基) 3、羧酸(RCOOH)的分类方法☐ 按照羧基连的烃基构造: ☐ 按照分子中羧基的数目:脂肪族羧酸(饱和及不饱和) 一元羧酸 脂环族羧酸 二元羧酸 芳香族羧酸 多元羧酸其中链状的一元羧酸(包括饱和的及不饱和的)通称为脂肪酸12.1.2 命名 1、系统命名法A 、饱和脂肪酸的命名1)选择含有羧基的最长碳链为主链,并按主链碳数称“某酸”; 2)从羧基碳原子开始编号,用阿拉伯数字标明取代基的位置; 3)并将取代基的位次、数目、名称写于酸名前。
如:C H 3 C H 2 C H 2 CO O H丁酸 C H 3 C H C H 3 C H C H 3C H 2 C O O H 3 , 4 - 二甲基戊酸 β , γ - 二甲基戊酸12 3 4 5 α β γB 、不饱和脂肪酸的命名1)选择包括羧基碳原子和各C=C 键的碳原子都在内的最长碳链为主链,根据主链上碳原子的数目称“某酸”或“某烯(炔)酸”;2)从羧基碳原子开始编号;3)在“某烯(炔)酸”前并注明取代基情况及双键的位置。
如:CH 3CCHCH CH 3CH 3COOHC CCOOHHOOCH H2, 4–二甲基–3–戊烯酸 (E ) –丁烯二酸 3-苯基丙烯酸C 、脂环族羧酸的命名1)羧基直接连在脂环上时,可在脂环烃的名称后加上“羧酸或二羧酸”等词尾; 2)不论羧基直接连在脂环上还是在脂环侧链上,均可把脂环作为取代基来命名。
如:D 、芳香族羧酸的命名1)以芳甲酸为母体;2)若芳环上连有取代基,则从羧基所连的碳原子开始编号,并使取代基的位次最小。
如:E 、二元酸的命名选包括两个羧基碳原子在内的最长碳链作为主链,按主链的碳原子数称为“某二酸”。
有机化学 第十二章 羧酸

王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
二、1H-NMR:
-COOH: δ范围 10~14 邻近羧基的碳上的氢移向低场区, δ约2~2.6 O CH2 C O H
δ: 2~3
10~13
如p282 图13-2异丁酸的核磁图 羧酸核磁的另一特点是活性氢交换后低场区信号 减弱或消失
王鹏
12.4 羧酸的化学性质
酯化反应的亲核取代机理:
O R C OH + H
+
快
+OH
慢
OH R
快
R
快
C
OH
.. R'O H ..
C
+.. O R'
OH H O R C OR'
OH
快
+ OH OR'
H2O 快 慢
R
C
R
C
OR'
H
+
+ OH2
快
叔醇更倾向于酸碱中和机理,即酸失去H+,叔醇 失去OH-,剩余部分结合成酯
溶解性:
低级脂肪酸是极性分子,易溶于水(因为易与水成分子间 氢键)。随着碳原子数增加,水溶性逐渐降低
熔沸点:
羧酸的熔沸点比分子量相近的其他化合物高许多
王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
一、IR:
O-H:3560~3500(单体)3000~2500(二聚) C=O:1720,C-O:1250 羧酸的红外特征是强而宽的羧基峰和羰基峰
王鹏
山东科技大学 化学与环境工程学院
12.2 羧酸的分类和命名
第十二章 羧酸衍生物

C-G的键长一般较那些典型键长有所缩短:
O
O
O
HC NH2 137pm
CH3 NH2 147pm
HC OCH3 133pm
CH3 OH 143pm
HC Cl 178.9pm
CH3 Cl 178.4pm
1、酯(ester)的结构
O R C O-R' 酯键
2、酰卤(acylhalide)的结构
O RC X
相对速率 1 0.47 0.10
0.01
0.102
酸性水解
HCl
CH3COOCH3 + H2O
CH3COOH + CH3OH
一元伯醇、仲醇酯在酸催化下水解,通常也 发生酰氧键断裂。其反应机理为:
O R C OR' + H+
OH
OH
HOH
R C OR'
R C OH2
OR'
OH -R'OH OH
-H+
H3CO
NHCOCH3 KOH H3CO
NO2
回流
NH2 + CH3COOK NO2
CH3O
NH2 + CH3COOK
NO2
HCl CH2CONH2 回流
CH2COOH + NH4Cl
CH2COOH + NH4Cl
• 酸催化机理: • 碱催化机理:
与酯的水解类似
• 羧酸衍生物水解反应的活性顺序是: 酰卤 > 酸酐 > 酯 > 酰胺
O O C CH3 乙酰氧基
O C NH2 氨甲酰基
O C Cl
氯甲酰基
CN
氰基
第二节 羧酸衍生物的性质
第十二章-羧酸

pka 2.98
pka 4.08
OH
pka 4.57
取代基对有机化合物酸性影响一般规律 1 脂肪族一元酸 吸电子基团增加酸性,供电子基团减弱酸性, 吸电子基团增加酸性,供电子基团减弱酸性, 且吸电子基团越多或吸电子基团离羧基越近酸性越强 2 芳香酸 芳香酸连有邻对位定位基时邻 > 间 > 对 芳香酸连有邻对位定位基时邻 芳香酸连有间位定位基时邻 芳香酸连有间位定位基时邻 > 对 > 间 间位定位基及Cl, Br, I 增加酸性 间位定位基及 邻对位致活定位基及F位于羧基对位时减弱酸性, 邻对位致活定位基及 位于羧基对位时减弱酸性, 位于羧基对位时减弱酸性 位于间位及邻位情况较复杂。 位于间位及邻位情况较复杂。
NO2 > CN > F > Cl > Br> I > C C >
OCH3>
C6 H 5 > C C >
H
2. 空间效应: 空间效应: 利于H 离解的空间结构酸性强,不利于H 利于H+离解的空间结构酸性强,不利于H+离解 的空间结构酸性弱. 的空间结构酸性弱. 场效应
COO COOH CH2
场效应的影响: 场效应的影响:
§12.4 羧酸的反应 一、 羧酸的结构和反应 二、 羧基中氢的反应 酰化反应 三 、 酰化反应 四、 脱羧反应 五、 还原反应 羧酸α-H的反应 六 、 羧酸 的反应
(赫尔 乌尔哈 泽林斯基反应) 赫尔-乌尔哈 泽林斯基反应) 赫尔 乌尔哈-泽林斯基反应
一 、 羧酸的结构和反应 酸性
R
C H
O C
硫酸、苯磺酸等 (常用的催化剂有盐酸 、硫酸、苯磺酸等), 常用的催化剂有盐酸 CH3COOH + C2H5OH 投料 1 1 : : 1 10
第12章 羧酸衍生物习题解答
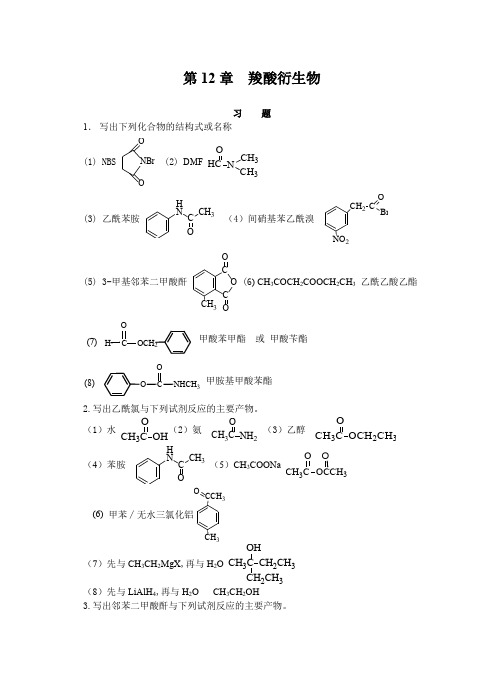
第12章 羧酸衍生物习 题1. 写出下列化合物的结构式或名称(1) NBSOONBr (2) DMF HC N O3CH 3(3) 乙酰苯胺H NC CH 3(4)间硝基苯乙酰溴CH 2NO 2CO Br(5) 3-甲基邻苯二甲酸酐CCH 3C O O (6) CH 3COCH 2COOCH 2CH 3 乙酰乙酸乙酯OCH 2CHO(7) 甲酸苯甲酯 或 甲酸苄酯O CONHCH 3(8)甲胺基甲酸苯酯2.写出乙酰氯与下列试剂反应的主要产物。
(1)水 CH 3C OHO (2)氨 CH 3C NH 2O(3)乙醇 CH 3C OCH 2CH 3O(4)苯胺HN C CH 3(5)CH 3COONa CH 3C 3O O (6) 甲苯∕无水三氯化铝CH 3CCH 3O(7)先与CH 3CH 2MgX ,再与H 2O CH 3C CH 2CH 3CH 2CH 3OH(8)先与LiAlH 4,再与H 2O CH 3CH 2OH3.写出邻苯二甲酸酐与下列试剂反应的主要产物。
(1)水∕△C C O OHOH (2)氨∕△ C C OONH 2ONH 4(3)乙醇∕△ C C O2CH 3OH (6)甲苯∕无水三氯化铝CC O OH CH 3(7)先与CH 3CH 2MgX ,再与H 2OC C OH CH 3OH CH 3 (8)先与LiAlH 4,再与H 2OCH 2OHCH 2OH4.写出乙酸苯酯与下列试剂反应的主要产物。
(1)水∕△CH 3C OCH 2CH 3OOH(2)氨∕△CH 3C NH 2OOH(3)甲酸乙酯∕乙醇钠 HCCH 2CO O(4)钠+乙醇 CH 3CH 2OH + OH(5)先与CH 3CH 2MgX ,再与H 2O CH 3C CH 2CH 3CH 2CH 3OHOH(6)先与LiAlH 4,再与H 2O CH 3CH 2OH +OH5.写出丁酰胺与下列试剂反应的主要产物。
第十二章 羧酸

- H+ O R C OR'
OH slow R C OH
HO R'
..
加成
OH + OH fast + R C OH2 R C OR' 消除 H 2O OR'
..
H2O中无O18,说明反应为酰氧断裂。
(4)酯化反应历程
1°、2°醇为酰氧断裂历程,
O R C OH
OH
O C OH
1700~1725 cm C O 在 -1 OH 二聚体 2500~3000 cm -1 3100~3650 cm 游离
-1
1HNMR:RCOOH
δH
=10.5~13
RCH2COOH
R2CHCOOH
δH = 2~2.6
第三节 羧 酸 的 化 学 性 质
4. 脱羧反应; 氧化与还原
*3.α-H 的反应
CH3COOH
酯键 O C2H5OH H2 O 110~120℃ CH3C-O-C2H5
浓H2SO4
乙酸乙酯
O O H2SO4 C6H5-C—OH + H O-CH3 C6H5-C—O-CH3 +H2O
苯甲酸甲酯 (85-95%) (1) 酯化反应是可逆反应,Kc≈4,一般只有2/3的转化率 提高酯化率的方法: 增加反应物之一,或不断从反应体系中移去一种生成物,可促 使平衡右移,提高酯的收率。
C
δ+
N O O
O-
COOH
COOH CH3 CH3
COOH H3C
COOH
pKa
4.17
3.89
4.28
4.35
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
个强的宽吸收带,羧基中的羰基吸收峰在1700 ~ 1725cm-1处,位置
与醛、酮的羰基相同 丙酸的红外光谱:
C—H
2990
1720
C—O
O—H伸缩振动:中心在3000cm-1附近; C = O伸缩振动:在1720cm-1。
14
核磁共振谱:羧基上H的δ值为10.5~12,大于醇-OH的 δ值。
丙酸的核磁共振谱:
熔 点
\℃
碳原子数
12
原因:偶数个碳的羧酸对称性高,在晶体中容易排列整齐而排列较紧密。
COOH
对称性高
COOH
4.溶解性:羧酸分子中羧基是亲水基团,可以和水分子形成氢键,烃基是憎 水基团。 丁酸以下与水混溶,4-11碳部分溶解;羧酸盐溶解性好(表面活性剂) 。
13
二、光谱性质
红外光谱:羧基中的羟基因有氢键缔合,在2500 ~ 3000cm-1内有一
1871年5月6日,法国,瑟 堡市,造船主。 1892年秋,波多丽女伯爵。 里昂大学,两年补习。 1901年由于格林尼亚发现 了格氏试剂而被授予博士 学位。 1912,格式试剂,诺贝尔 化学奖。 1935年12月13日逝世。 大江歌罢调头东…
维克多· 格林尼亚
1
我们的任务
16周- 1、5 12-21章 12羧酸 13羧酸衍生物 14N类化合物 15S/P/Si化合物 16金属配合物合成应用 17周环反应 18杂环化合物 19糖类 20蛋白质、核酸 21萜类、甾族化合物 考核
OH R C OR' OH2
+
OH
H+
+
OH
R
C
OH
+
R'OH
R
C HOR' +
OH
OH
-H2O
O
R
C
OR'
- H+
R
C
OR'
亲核加成-消除历程
Aac2
29
叔醇的酯化反应是按碳正离子历程进行的,成酯的方式为烷氧断裂。
R3C OH
O R' C
H+
R3C
OH2
+
+
R3C + + H2O
- H+
O
OH
23
邻位效应:邻位取代苯甲酸,不论是给电子基团或吸电子基 团,酸性均较间位与对位强。 芳香羧酸的情况分析: 取代基具有吸电子共轭效应时,酸性强弱顺序为: 邻 > 对 > 间 取代基具有给电子共轭效应时,酸性强弱顺序为: 邻 > 间 > 对 具体分析: 邻 位(诱导、共轭、场、氢键效应、空间效应均要考虑。) 对 位(诱导、共轭共同作用。) 间 位(诱导为主、共轭很小。)
一元羧酸的英文名称用“oic acid”代替相应烃中的词尾“e”
CH3 CH3CH2CH2COOH
丁酸 butanoic acid
CH3CHCHCH2COOH CH3
3,4-二甲基戊酸 3,4-dimethylpentanoic acid
BrCH2CH=CCH2CH2COOH CH2CH3
4-乙基-6-溴-4-己烯酸 6-bromo-4-ethyl-4-hexenoic acid
Y CH2CO2H
Y CH3 + CO2
比较容易脱羧
(Y: COOH, COR,
HOOCCH2COOH
NO2, CN, C=CH2)
CH3COOH + CO2
O O CH3 C C O H
O Cl3C C O H
O -CO2 CH3 C H
CHCl3 + CO2
36
丙二酸的脱羧 :环状过渡态机制
26
1、酯化反应
RCO2H + R'OH
H
RCO2R' + H2O
(1) 酯化反应是可逆反应,Kc≈4,一般只有2/3的转化率。 提高酯化率的方法: a 增加反应物的浓度 b 移走低沸点的酯或水 (2) 酯化反应的活性次序: 酸相同时 : CH3OH > RCH2OH > R2CHOH > R3COH 醇相同时 : HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH 所以:醇或酸空阻大时不利于反应
3.42
pKa:
4.2
2.21
3.49
22
卤素原子具有-I和+C效应,-I > +C。
COOH
COOH Cl
COOH Cl
COOH
Cl
pKa: 4.2 2.92 3.82 3.98
羟基具有-I和+C效应,-I < +C。
COOH
COOH OH
COOH OH
COOH
OH
pKa: 4.2 2.98 4.08 4.57
CH3(CH2)7CH=CH(CH2)7COOH
9-十八碳烯酸(油酸) 9-octadecenoic acid(oleic acid)
7
芳香族羧酸可以作为脂肪酸的芳基取代物命名:
COOH CH2COOH
苯甲酸 benzoic acid
β-萘乙酸 α-naphthaleneacetic acid
COOH
2
第十二章 羧酸 (carboxylic acid)
3
第一节 羧酸的分类和命名 一、分类 二、系统命名法:酸结尾 第二节 饱和一元羧酸的物性 和光谱性质 一、物理性质 二、光谱性质 第三节 羧酸的化学性质 一、酸性 二、羰基的反应 三、脱羧反应 四、α-H卤代 五、还原
第四节 羧酸的来源和制备 一、氧化法 二、水解法 三、羧化法 第五节 重要的羧酸和取代羧酸 一、重要的一元羧酸 二、二元羧酸 三、取代羧酸 第六节 酸碱理论 一、布朗斯特酸碱理论 二、路易斯酸碱理论
取代基的吸电子 (-I效应) 强弱次序 (以饱和C–H键的诱导效应为零):
取代基的供电子 (+I效应) 强弱次序:
21
2.芳香族羧酸:
取代基的诱导效应和共轭效应都有影响,但取代基位于间位 时,共轭效应的影响受到阻碍。 硝基具有-I和-C效应。
COOH
COOH NO 2
COOH NO2
COOH
NO2
O O C O C OH O C O
33
C OH
4、酰胺化反应
在羧酸中通入氨气或加入碳酸铵,可得到羧酸铵盐,铵盐热解 失水而生成酰胺。
O RCOOH + NH3 RCOONH4
-H2O
RCNH2
190 oC PhCOOH + Ph NH2 180— -H2O
PhCONHPh (8 4% ) CH3CON(CH3)2
吸电子基团:负离子稳定增强,增加羧酸酸性; 给电子基团:负离子稳定减弱,减弱羧酸酸性
酸性强弱的比较
(1)诱导效应的影响 看表12-2,总结规律 • 同一母体,取代基-I效应越大,酸性越强; • 同一取代基,位置越远,影响越小; • 同碳上,-I基团越多,酸性越大。
20
P7
取代基的电子效应强弱次序:
c.
a.
b.
c. a. b. CH3CH2COOH
a.1.1 c.11.65
b.2.3
15
第三节
C O OH
羧酸的化学性质
O 形式上看羧基是由一个 C 和一个OH 组成 实质上并非两者的简单组合
·
O R C O H
· ·
sp2杂化
·
O
· ·
R
p-π共轭
C
O
H
由于 p-π共轭,使羧基中的羟基氧原子上的电子云向羰基移动,氧氢键
CH3COOH + (CH3)2NH
DCC/THF 0 oC
34
三、脱羧反应
1、加热脱羧
RCO2H
羧酸盐脱羧较容易:
R
H + C O2
一般难进行
O CH3CONa O
NaOH / 300oC (熔融)
CH4 + Na 2CO3
H3 C C O
CH3 + CO2
H
CH4
35
α-C上连有吸电子基团容易进行脱羧:
Δ9-十八碳烯酸 (Δ—δ)
COOH
二元羧酸选取包括两个羧基在内的主链,称二酸。
HOOCCH2CH2COOH
丁二酸
COOH
(1R, 3R)-1,3-环己烷二羧酸
9
羧酸常用希腊字母来标名位次,即与羧基直接相连的碳原子 为α,其余位次为β、γ…,距羧基最远的为ω位。常用Δ表示烯 键的位次,把双键碳原子的位次写在Δ的右上角。
O R' C OCR3
R3C +
R' C O CR3 H
由于R3C+易与碱性较强的水结合,不易与羧酸结合,故逆向反应比
正向反应容易进行,所以酯的反应产率很低。 Aal1
30
空间位阻大的羧酸:
CH3 CO2H CH3
CH3OH
CH3
浓H2SO4
CH3
C O OH2
H2O
O C
O C
CH3 C O OCH3 H
的电子云更靠近氧原子,增强了氧氢键的极性,有利于氢原子的离解,使
羧基具有酸性。
16
脱羧反应
R
C H
O C
酸性
O
H
-H的反应
还原
羰基的亲核加成,然后再消 除(表现为羟基的取代)
17
一、酸性
羧酸具有弱酸性,在水溶液中存在着如下平衡:
O R C OH
