链格孢菌寄主选择性毒素的研究现状
苹果斑点落叶病

苹果斑点落叶病Apple Alternaria Blotch1956年在日本岩手县南部地区首先发现苹果斑点落叶病,2年后扩大到全县,以后在长野、青森、福岛、秋田等县也先后发生危害。
我国自70年代后期开始有苹果斑点落叶病发生危害的报道,80年代以来在渤海湾、黄河故道、江淮等地的苹果产区普遍发生,成为目前苹果生产上的主要病害。
许多苹果园病叶率高达90%以上,落叶率为20%~80%,造成当年果个小,严重影响树势和次年的产量。
症状主要危害叶片,也可危害嫩枝及果实。
叶片发病后,首先出现极小的褐色小点,后逐渐扩大为直径3~6mm的病斑,病斑红褐色,边缘为紫褐色,病斑的中心往往有1个深色小点或呈同心轮纹状。
天气潮湿时病部正反面均可见墨绿色霉状物。
发病中后期,病斑变成灰色。
有的病斑可扩大为不规则形,有的病斑则破裂成穿孔。
有时,在后期灰白色病斑上产生小黑点(二次寄生菌)。
展叶20d内的嫩叶最易受害,在高温多雨季节病斑扩展迅速,常使叶片焦枯脱落。
内膛的一年生徒长枝容易染病。
染病的枝条皮孔突起,以皮孔为中心产生褐色凹陷病斑,多为椭圆形,边缘常开裂。
果实受害,多以果点为中心,产生近圆形褐色斑点,直径2~5mm,周围有红晕。
病斑下果肉数层细胞变褐,呈木栓化干腐状。
幼果和近成熟的果实均可受害发病,出现的症状不完全相同。
病果往往受二次寄生菌侵染而发生腐烂。
病原学名:病原为链格孢苹果专化型Alternaria alternata f.sp.mali,属半知菌亚门链格孢属。
异名有:A.mali Roberts,Phyllosticta pirina Sacc.,A. tenuis f.sp.mali,Phyllosticta mali。
在苹果斑点落叶病研究的前期国外将其病原菌定为A. mali的强毒株系。
李多川、张天宇等(1993)将其学名修正为A.tenuis f.sp.mali;日本的霜村等(1993)认为病原应为A.alternata的一个致病型;朱虹(1995)通过研究发现,我国的斑点落叶病菌在形态、生物学特性和侵染规律上与日本报道的基本一致,当属同一种,因此将其定为A.alternata f.sp.mali。
植物病原真菌毒素的分类、致病机制及应用前景

植物病原真菌毒素的分类、致病机制及应用前景摘要:研究植物病原真菌毒素及其致病机制,对于了解植物与病原互作具有重要意义。
从植物病原真菌毒素的分类、致病机制、分离纯化、应用前景等方面综述植物病原真菌毒素研究的最新进展,对今后植物病原真菌毒素的研究具有重要的参考价值。
关键词:植物病原菌;真菌毒素;分类;致病机制;分离纯化;应用前景;研究思路中图分类号:S182 文献标志码:A 文章编号:1002-1302(2019)03-0094-04病菌毒素是在植物病原菌代谢过程中产生的对植物有害的非酶类化合物,它能在很低的浓度范围内破坏植物的正常生理功能[1]。
自从菊池链格孢菌毒素被首次报道以来[2],尤其在维多利亚毒素被报道以后,国内外植病学者开始对许多病原菌产生的毒素展开研究。
植物病原真菌毒素的作用机制复杂,它主要是作用于寄主植物的细胞质膜、线粒体和叶绿体等细胞结构,从而破坏和干扰寄主植物的代谢;此外,它还会抑制寄主植物蛋白质和核酸的合成,从而导致寄主植物生理失调、细胞死亡以至整个植株死亡。
研究病原真菌毒素及其致病机制,对于了解寄主与病原互作,以及利用病菌毒素进行植物抗病性鉴定、抗病突变体筛选和病害防治等都具有重要意义。
本文从植物病原真菌毒素的分类、致病机制、分离纯化及应用前景等方面进行综述,以期为今后病原真菌毒素致病机制的研究提供思路。
1 植物病原真菌毒素的分类真菌毒素可根据对寄主植物的特异性作用分为寄主专化性毒素(host-selective toxin,简称HST)和非寄主专化性毒素(non- host-selective toxin,简称NHST)。
1.1 寄主专化性毒素HST是由病原微生物产生的代谢产物,它对寄主植物具有特异性生理活性和高度专化性作用。
HST对寄主选择性强,例如草莓黑斑病病菌所产生的AF-毒素只对Morioka-16草莓和Nijisseiki梨具有致病作用;此外,北美燕麦疫病病菌产生的HV-毒素和玉米小斑病病菌产生的HMT-毒素也都属于寄主专化性毒素,它们不仅对寄主植物的致病性强,而且对寄主有专一性。
核盘菌引起的菌核病生物防治研究进展

引文格式:李恩琛, 郗征, 朱娜, 等. 核盘菌引起的菌核病生物防治研究进展[J]. 云南农业大学学报(自然科学), 2023, 38(4):714−724. DOI: 10.12101/j.issn.1004-390X(n).202211047核盘菌引起的菌核病生物防治研究进展*李恩琛, 郗 征, 朱 娜, 刘 佳, 徐秉良 **, 张树武 **(甘肃农业大学 植物保护学院,甘肃省农作物病虫害生物防治工程实验室 ,甘肃 兰州 730070)摘要: 菌核病是由核盘菌(Sclerotinia sclerotiorum )侵染引起的广谱性植物病害,在世界范围内造成巨大经济损失。
随着生防技术的日益提高,生物防治成为植物病害综合治理的重要措施。
本研究综述了目前菌核病的防治现状,重点围绕菌核病生物防治的研究进展,对不同拮抗真菌、细菌、真菌病毒、植物源杀菌剂和有机土壤改良剂在菌核病防治中的作用机制和防治效果进行系统阐述;讨论了生物防治研究与应用过程存在的问题,对生防微生物和天然植物资源未来的发展方向以及应用前景进行展望,以期为菌核病的安全、高效防治提供参考。
关键词: 核盘菌;菌核病;生物防治;拮抗微生物中图分类号: S476.1 文献标志码: A 文章编号: 1004–390X (2023) 04−0714−11Research Advances on Biocontrol of Sclerotinia Rot caused bySclerotinia sclerotiorumLI Enchen ,XI Zheng ,ZHU Na ,LIU Jia ,XU Bingliang ,ZHANG Shuwu(College of Plant Protection, Gansu Agricultural University, Biocontrol Engineering Laboratory ofCrop Diseases and Pests of Gansu Province, Lanzhou 730070, China)Abstract: Sclerotinia rot, caused by the fungus Sclerotinia sclerotiorum , is a broad spectrum plant disease that causes enormous economic losses worldwide. Biocontrol has become an important strategy for integrated management of plant diseases, as the development of biocontrol technology.This review provides an overview of the current status of sclerotinia rot management, focusing on the research progress of biocontrol of sclerotinia rot, and presents a systematic elucidation of the mechan-isms and effectiveness of different antagonistic fungi, bacteria, mycovirus, botanical fungicides and organic soil amendments in the control of sclerotinia rot. The problems in biocontrol research and ap-plication processes are discussed, and foreground for the future development direction and applica-tion of biocontrol microorganisms and natural plant resources are prospected, in order to provide ref-erences for the safe and effective control measures against sclerotinia rot in the future.Keywords: Sclerotinia sclerotiorum ; sclerotinia rot; biocontrol; antagonistic microorganisms云南农业大学学报(自然科学),2023,38(4):714−724Journal of Yunnan Agricultural University (Natural Science)E-mail: ********************收稿日期:2022-11-22 修回日期:2023-08-25 网络首发日期:2023-09-08*基金项目:甘肃农业大学“伏羲杰出人才培育计划”项目 (Gaufx-03J03);甘肃农业大学人才专项经费(2017RCZX-07)。
紫茎泽兰致病型链格孢菌毒素(TeA)在病原体侵染寄主过程中的作用机制研究

紫茎泽兰致病型链格孢菌毒素(TeA)在病原体侵染寄主过程中的作用机制研究链格孢菌(Alternaria alternata(Fr.)Keissler)是自然界三大致病植物真菌之一。
来自外来恶性杂草紫茎泽兰(Ageratina adenophora)致病型链格孢菌能够产生一种毒素——细交链格孢菌酮酸(TeA),该毒素在较低的浓度下能够迅速杀死紫茎泽兰以及其它多数单双子叶杂草,具有开发成生物除草剂的潜力。
TeA杀草的主要机理是与光系统Ⅱ的D1蛋白结合,抑制光系统Ⅱ受体侧QA 到QB之间光合电子的传递,引起过能量化,导致在叶绿体中活性氧爆发,引起叶绿体结构破坏,大量活性氧扩散到整个细胞中,进一步引起膜脂过氧化、细胞膜破裂、细胞器解体、细胞核浓缩和DNA断裂,导致细胞死亡和组织坏死,最终杀死杂草。
本研究利用通过限制性内切酶介导整合法(REMI)获得的弱毒突变体001和野生型为研究材料来阐明TeA在病原体入侵寄主叶片阶段的作用机理。
利用野生型和缺毒突变体(菌丝体)为材料接种寄主紫茎泽兰叶片,突变体接种时结合加入TeA.研究结果表明TeA是链格孢菌病原体侵染寄主引起病害的主要毒理因子。
来自Imaging-PAM结果显示:野生型菌丝接种寄主紫茎泽兰叶片1 8h后,植物的PSII活性降低,36小时,病害开始出现;而对应时间下,突变体菌丝处理紫茎泽兰叶片并没有引起明显的PSII活性降低和病害出现,但在突变体菌丝中加入一定浓度的TeA后可以得到与野生型相似的结果,突变体的致病能力得到一定程度的恢复。
同时,添加毒素也能恢复部分突变体菌丝扩展的能力。
通过监测孢子萌发和生长、附着胞形成与否、菌丝在细胞和叶片中生长和扩散情况、病斑产生情况,发现毒素在病原体侵入叶片组织和菌丝扩张、病害的发展过程中都发挥作用,是病原体成功入侵和病斑形成的重要因子。
在野生型孢子或者菌丝体引起紫茎泽兰叶片病害过程中我们检测到细胞死亡现象,这意味着活性氧(ROS)也许参入到该过程。
链格孢菌寄主选择性毒素的研究现状

毒素种类
AK- toxin AM - toxin AF - toxin AAL - toxin ACR - toxin ACT - toxin AB - toxin AP - toxin AT - toxin
生物活性
引起膜电位快速去极化 ,使 K+ 渗漏增加. 在 0. 01μg/ ml ,引起敏感叶片叶脉坏死. 作用于质膜蛋白和叶绿体基粒片层 ,引起电解质渗漏 诱导草莓黑斑病 ,在 0. 02μg/ ml 下引起草莓和敏感梨坏死. 在 0. 025μg/ ml 下引起敏感番茄品种叶脉坏死 ,而抗性品种在 100μg/ ml 以上仍无毒性. 诱导糙叶柠檬叶褐斑病 ,引起氧化磷酸化解耦联和线粒体超微结构的变化 ,抑制 malate 的氧化. 在 5μg/ ml 下引起中国柑橘敏感品种叶片的特征伤害. 诱导白菜典型的黑斑病 ,叶片黄化 、坏死或萎蔫. 细胞膜破裂 、电解质渗漏 、叶绿体破坏 、叶绿素分解. 诱导感病型木豆黑斑病 ,对病原菌定植及病害诱导是必需的. 在 0. 2μg/ ml 下可抑制感病烟草品种幼苗根系生长.
第 4 期 万佐玺等 :链格孢菌寄主选择性毒素的研究现状 2 1
品种元帅接种毒素后 SOD 活性降低[2] . 董金皋等 (1999) 研究发现 :无论是接种芸薹链格孢菌 ,还是 AB - 毒 素 ,白菜叶片在 0. 5 - 12 h 内 SOD 和 POD 酶活性都迅速下降 ,说明白菜受芸薹链格孢菌及其毒素影响后 ,可 能活性氧在此期间过量积累 ,导致了最终的感病性[12] . 链格孢菌毒素使紫茎泽兰叶片的 POD 、APX、CAT 活性 下降[16] . 因此可见 ,病原毒素对寄主体内防卫反应重要的酶 SOD 、POD 、CAT、APX 等都有影响 ,导致寄主 的活性氧清除系统中的酶系统受到破坏 ,最终感病.
一种白蜡树真菌病害的分离与鉴定

47--植物保护·园艺园林 引用格式:覃莹菲,张 鑫,陈 岳,等. 一种白蜡树真菌病害的分离与鉴定[J]. 湖南农业科学,2023(12):47-50. DOI:DOI:10.16498/ki.hnnykx.2023.012.010白蜡树(Fraxinus chinensis Roxb )为木犀科梣属大型落叶乔木[1],在我国共有27种。
白蜡树高15~20 m ,树皮呈灰褐色,顶生的小叶与侧生的小叶等大或稍大,羽状复叶长15~25 cm ,叶柄长4~6 cm 。
白蜡树耐旱,萌发能力强,生长迅速,树形优美,材理通直,还有较强的耐盐性,常种植于盐碱地以改良环境,具有较好的绿化及生态价值[2]。
白蜡树在我国种植历史悠久、分布甚广,其植株生长迅速,枝条柔韧可供编制各种用具,树皮还具有较高的药用价值[3],相关产业具有一定规模。
近年来,白蜡树病虫害问题日益严重,在树苗期和成熟期对白蜡树造成严重危害,阻碍白蜡树生长发育及相关产业发展。
研究报道,由立枯丝核菌引起的立枯病是白蜡树苗期的主要病害,主要危害地下根部和茎基部,导致白蜡树出现不规则褐色凹陷的病斑,严重时会导致幼苗死亡[4]。
白蜡褐斑病主要危害叶片,病斑为灰褐色,表面分布深褐色霉点,会造成叶片脱落或变形,严重时会使植株死亡[5]。
流胶病也会影响白蜡树的生长,其发生与气候、栽培管理水平、土壤土质等有相关性,真菌侵染或者病虫侵入都会导致流胶病,具体症状为白蜡枝干流出黄色胶状物质,最终导致树体衰弱、枯竭[6]。
白蜡枯梢病由白蜡鞘孢菌所致,病部出现溃疡或坏死,且木质部褪绿明显,当病斑扩展环绕枝条,就会产生枯梢[7]。
按昆虫类别划分,为害白蜡树的常见害虫有蝉蛾目瘦蛾科害虫,鳞翅目、膜翅目、半翅目、鞘翅目等害虫。
白蜡树从春天长叶到秋冬落叶,均受害虫侵扰[8]。
白蜡窄吉丁初孵幼虫会从白蜡树韧皮部啃食至木质部,导致树皮开裂、脱落[9]。
白蜡梢距甲成虫啃食树苗叶柄,使得叶片萎缩,幼苗不能正常生长[10]。
链格孢菌毒素对紫茎泽兰致病性及生物测定方法的研究

文章编号:1008-8423(2001)01-0020-04链格孢菌毒素对紫茎泽兰致病性及生物测定方法的研究万佐玺(南京农业大学农学院,江苏南京210095)摘要:以紫茎泽兰(Eu p atoriun adenop horum Spreng.)为生物测定材料,对链格孢菌毒素的生物测定方法进行了比较研究,筛选出离体叶片针刺法可作为该毒素的生物测定方法,为进一步研究该毒素提供了可靠的生物检测手段。
关键词:链格孢菌;毒素;紫茎泽兰;生物测定中图分类号:S497 文献标识码:A收稿日期:20000606作者简介:万佐玺(1968-),男,湖北建始人,硕士,讲师,主要从事杂草综合治理研究,现在湖北民族学院园艺系任教.紫茎泽兰(Eupatoriun adenopho rum Spreng )是一种世界性恶性杂草[1],其自然致病菌链格孢菌(Al -ternaria alternata (Fr.)Keissler)的致病机理与其产生的毒素有关[2]。
为了分离、纯化得到链格孢菌产生的对紫茎泽兰有致病作用的毒素,并利用该毒素控制紫茎泽兰,必须首先建立适合该毒素的简便而可靠的生物测定方法。
作者用离体叶片针刺法、叶圆片法、种子萌发抑制法及幼苗浸渍法等,研究毒素对紫茎泽兰的致病性,得出离体叶片针刺法最佳,为毒素纯化和应用提供了指导。
1 材料与方法1.1 材料供试菌株:链格孢菌501菌株。
供试植物:紫茎泽兰(温室培育);培养时间为2个月。
1.2 药品乙酸乙酯:分析纯,上海申鹤化学品有限公司。
无水硫酸钠:分析纯,宜兴市第二化学试剂厂。
1.3 方法1.3.1 产毒培养方法转接菌种501于PDA 培养基上培养7天(25e 、光照L B 黑暗D=12h B 12h),然后取直径为6.5mm 大小的菌丝块,接种到300ml PSK 液体培养基中(500ml 三角瓶),培养5-7天(25e 、L B D=12B 12、110r/min),至菌丝开始变黑。
镰刀菌属真菌毒素在植物和病原菌互作中的研究进展

广东农业科学Guangdong Agricultural Sciences2024,51(3):56-69 DOI:10.16768/j.issn.1004-874X.2024.03.006卓梦霞,刘思文,李春雨,胡位荣. 镰刀菌属真菌毒素在植物和病原菌互作中的研究进展[J]. 广东农业科学,2024,51(3):56-69.ZHUO Mengxia, LIU Siwen, LI Chunyu, HU Weirong. Research progress on Fusarium mycotoxins in plant and pathogen interactions[J]. Guangdong Agricultural Sciences, 2024,51(3):56-69.镰刀菌属真菌毒素在植物和病原菌互作中的研究进展卓梦霞1,刘思文2,李春雨2,胡位荣1(1.广州大学生命科学学院,广东 广州 510006;2.广东省农业科学院果树研究所/农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640)摘 要:镰刀菌是世界上最重要的植物病原菌之一,可影响植物的生长发育,严重威胁全球粮食安全和生物多样性。
几乎所有的镰刀菌都会产生真菌毒素,其毒素种类多、毒性强,一方面可以作为致病因子之一参与镰刀菌的致病过程,另一方面可污染粮食和饲料,进而引起人类和动物的相关病症。
已有研究表明,镰刀菌侵染植物后产生的不同种类真菌毒素不仅毒害植物细胞,引起植物组织的坏死,还会加速病原菌的侵染;同时,针对病原菌产生的毒素,植物会激活防御酶并启动防御相关基因的表达,或将致病毒素转化为无毒或低毒物质并转运到胞外,或通过分泌次生代谢物直接抑制病原菌毒素的生物合成。
为全面解析镰刀菌毒素在病原菌侵染植物中的作用,提高植物对病原菌的抗性,该文综述了镰刀菌属真菌毒素的种类、毒性机理以及毒素在植物和病原菌互作中的作用,并讨论了植物对真菌毒素的防御反应策略,以期为镰刀菌毒素致病机制和病原菌防治策略研究提供参考。
食品中链格孢霉毒素污染现状及检测技术研究进

基金项目:上海市“科技创新行动计划”农业领域项目(编号:21N31900600)作者简介:王霞,女,上海市农产品质量安全中心畜牧师,硕士。
通信作者:张维谊(1979—),女,上海市农产品质量安全中心研究员,硕士。
E mail:zhangharewei@163.com收稿日期:2022 07 13 改回日期:2022 12 09犇犗犐:10.13652/犼.狊狆犼狓.1003.5788.2022.80542[文章编号]1003 5788(2023)05 0224 08食品中链格孢霉毒素污染现状及检测技术研究进展Pollutionstatusandresearchprogressonthedetectiontechnologyof犃犾狋犲狉狀犪狉犻犪mycotoxinsinfoods王 霞犠犃犖犌犡犻犪 丰东升犉犈犖犌犇狅狀犵 狊犺犲狀犵 童金蓉犜犗犖犌犑犻狀 狉狅狀犵 高猛峰犌犃犗犕犲狀犵 犳犲狀犵 张维谊犣犎犃犖犌犠犲犻 狔犻(上海市农产品质量安全中心,上海 201708)(犛犺犪狀犵犺犪犻犆犲狀狋犲狉狅犳犃犵狉犻 狆狉狅犱狌犮狋狊犙狌犪犾犻狋狔犪狀犱犛犪犳犲狋狔,犛犺犪狀犵犺犪犻201708,犆犺犻狀犪)摘要:链格孢霉毒素是由链格孢霉属(犃犾狋犲狉狀犪狉犻犪species)产生的次级代谢产物,具有致突变、致癌、致畸等多种毒性。
文章概述了水果、蔬菜、谷物及其制品中链格孢霉毒素的污染现状,综述了链格孢霉毒素检测方法的研究现状,并展望了链格孢霉毒素检测技术今后的研究方向。
关键词:链格孢霉菌;链格孢霉毒素;污染现状;检测技术;食品犃犫狊狋狉犪犮狋:犃犾狋犲狉狀犪狉犻犪mycotoxinsarethesecondarymetabolitesof犃犾狋犲狉狀犪狉犻犪species,whichhaveobvioustoxicity(mutagenicity,teratogenicityandcarcinogenicity,犲狋犮)tohumansandanimals.Alternariol(AOH),alternariolmonomethylether(AME),alternuene(ALT),tenuazonicacid(TeA)andtenoxin(TEN)arethemoststudiedatpresent.犃犾狋犲狉狀犪狉犻犪mycotoxinswasreportedinapples,orange,tomatoes,cornsandotheragriculturalproducts.Eatingthesefoodscontaminatedby犃犾狋犲狉狀犪狉犻犪mycotoxinswillcauseseriousharmtohumanhealth.Inthispaper,thepollutionstatusandthedetectiontechnologyof犃犾狋犲狉狀犪狉犻犪mycotoxinsweresummarized,andthefutureresearchdirectionof犃犾狋犲狉狀犪狉犻犪mycotoxinswasprospected.Thepurposewastoprovidereferencesfortheriskassessment,detectionandpreventionof犃犾狋犲狉狀犪狉犻犪mycotoxinsinfoods.犓犲狔狑狅狉犱狊:犃犾狋犲狉狀犪狉犻犪;犃犾狋犲狉狀犪狉犻犪mycotoxins;pollutionstatus;detectiontechnology;food链格孢霉毒素(犃犾狋犲狉狀犪狉犻犪mycotoxins)是由链格孢霉菌属(犃犾狋犲狉狀犪狉犻犪species)产生的一类具有致突变、致癌、致畸、致死、细胞毒性、基因毒性、胚胎毒性等多种毒性的次级代谢产物[1]。
紫茎泽兰致病型链格孢菌毒素对莱茵藻作用机理的初步研究

紫茎泽兰致病型链格孢菌毒素对莱茵藻作用机理的初步研究链格孢菌毒素是由紫茎泽兰致病型链格孢菌产生的植物毒素,本实验以野生型莱茵藻和其抗除草剂突变体为材料,对链格孢菌毒素的作用位点和模式进行了初步研究。
实验结果表明该毒素能抑制ATP的生成,而ATP合成的抑制有以下三种原因引起:1)电子传递受到阻断;2)电子传递发生解耦联;3)磷酸化反应被抑制,所以,我们利用氧电极法分析ATP合成受抑制的原因,研究显示毒素能抑制基础的和解耦联的电子传递,浓度越大抑制能力越强,且各浓度之间的差异显著(P<0.01)。
但在其浓度小于40μg/mL时磷酸化的电子传递活性未受到影响(P>0.05),高浓度下才抑制。
并且链格孢菌毒素对解耦联电子传递的抑制程度明显强于基础和耦联磷酸化的电子传递。
因此可以认为,链格孢菌毒素阻断电子传递可能是ATP合成受抑的主要因素。
用氧电极法对电子传递又进一步研究证明,该毒素能抑制光系统Ⅱ的电子传递,但对光系统Ⅰ的电子传递活性几乎没有影响。
因此,可推测链格孢菌毒素的作用位点在光系统Ⅱ。
结合荧光上升和荧光下降的实验结果表明链格孢菌毒素对光系统Ⅱ受体侧有抑制,但对供体侧没有影响。
进而,快速叶绿素荧光诱导动力学方法的结果显示,链格孢菌毒素处理后“J”点和F_o增高,但无K峰出现。
“J”点的增高归因于Q_A和Q_B之间电子传递速率的下降,因此,可推测此毒素影响了受体侧Q_A和Q_B之间的电子传递。
F_o增高可能是由于Q_B被取代后,其所带的电子回传给Q_A所致。
而放氧复合体失活可引起K峰的出现,没有K峰出现说明毒素对光系统Ⅱ供体侧没有抑制作用。
同时,JIP测试详细证实了链格孢菌毒素对光系统Ⅱ有多重影响:(1)阻断受体侧Q_A到Q_B的电子传递;(2)使反应中心失活:(3)降低光能转化效率;(4)破坏反应中心的部分天线色素;(5)降低活性与非活性反应中心的天线色素之间能量传递的协调性。
最后,根据莱茵藻抗除草剂突变体对毒素抗性与敏感性的反应,最终肯定毒素取代了Q_B从而抑制Q_A至Q_B的电子传递,是一种天然的光系统Ⅱ抑制剂。
链格孢属真菌分类研究进展

链格孢属真菌分类研究进展唐岚;江厚利;王义勋;陈京元;郑京津【摘要】本文综述了链格孢属分类地位及特征,链格孢菌种间培养性状,介绍了链格孢菌属真菌在形态学、数值分类学和分子生物学方面的分类研究进展,对链格孢属真菌系统发育的认知和相应的应用开发提供科学的理论基础.【期刊名称】《湖北林业科技》【年(卷),期】2013(042)004【总页数】4页(P47-49,83)【关键词】链格孢菌;形态分类;数值分类;分子生物学分类【作者】唐岚;江厚利;王义勋;陈京元;郑京津【作者单位】湖北省林业科学研究院武汉430075;湖北省林业科学研究院武汉430075;湖北省林业科学研究院武汉430075;湖北省林业科学研究院武汉430075;湖北省林业科学研究院武汉430075【正文语种】中文【中图分类】Q939.5链格孢菌Alternaria是一种常见半只菌类真菌,分布广泛,能够危害农林作物并造成经济损失,有些链格孢菌甚至能够侵染人体和动物。
该属形态特征鲜明,易于辨认,但种间变异性大,种级分类鉴定存在一定困难。
链格孢菌虽然能够危害农林作物甚至威胁人、畜健康,但也可作为被利用的真菌资源,如长柄链格孢A.longies可控制烟草赤星病,防效高达90%以上;百日草链格孢菌A.zinniae毒素可防除加拿大一支黄花[1,2]。
随着分子生物学技术的飞速发展,链格孢菌分类从传统形态特征分类深入到分子生物学系统发育分类。
本文对链格孢菌属真菌在形态学、数值分类学以及分子生物学方面的分类研究进展进行综述。
1 链格孢属分类地位及特征链格孢属是以细链格孢A.tenuissima为模式种建立起来的真菌属。
截止目前,全世界已经发表的链格孢菌种约500个,且仍不断有新种发表[3]。
分生孢子梗颜色深,简单或有分支,直或弯曲,单生或簇生,基部有时膨大,呈褐色;产孢细胞以内壁芽生孔生式产孢,孢痕清晰,边缘色深,中间色浅。
分生孢子卵形、倒棒状、倒梨形、卵圆形或椭圆形,脐部明显,淡褐至深褐色,砖格状,表面光滑或具疣、刺,或具有横隔及纵、斜的真隔膜,分隔处不缢缩或缢缩。
海南飞机草病原真菌鉴定、致病力测定及其寄主范围分析

海南飞机草病原真菌鉴定、致病力测定及其寄主范围分析李雨龙;杨叶;韦诚;符旖晴【摘要】对海南多个市县的飞机草发病情况进行调研发现,飞机草叶斑病受自然环境及病菌种类的影响,从发病样品上分离获得46株病原真菌.经过形态学观察与分子鉴定比对,确定飞机草的重要病原真菌分别为:链格孢Alternaria alternata、新月弯孢Curvularia lunata和尖孢镰刀菌Fusarium oxysporu.通过离体叶片针刺法和活体接种法对病源真菌致病力进行测定,结果显示,强致病力菌株12个(占26.09%),中等致病力菌株13个(占28.26%),弱致病力菌株19个(占41.30%),无致病力菌株2个(占4.3%),其中链格孢菌株LGB100501、LGB100401和弯孢菌株WB110216表现出较高的致病力.利用11个高致病力菌株针对8种海南常见杂草进行寄主范围测试,结果表明,不同菌株致病力存在差异,仅有13.6%的供试杂草对这些菌株表现出高度和中度感病.【期刊名称】《热带作物学报》【年(卷),期】2016(037)001【总页数】6页(P177-182)【关键词】海南;飞机草;病原真菌;致病力;寄主范围【作者】李雨龙;杨叶;韦诚;符旖晴【作者单位】海南大学环境与植物保护学院,海南海口 570228;海南大学环境与植物保护学院,海南海口 570228;海南大学环境与植物保护学院,海南海口 570228;海南大学环境与植物保护学院,海南海口 570228【正文语种】中文【中图分类】S451.1doi 10.3969/j.issn.1000-2561.2016.01.029飞机草(Chromolaena odorata L)是菊科(Compositae)泽兰属(Eupatorium)多年生杂草,学名香泽兰[1],是IUCN确定的全球100种最具破坏力的入侵生物之一,该草遍布海南全岛,对海南农林牧业的生产、物种多样性和生态系统安全造成了严重危害。
天然化合物在农药中的应用研究与进展

16江西化工2010年第4期天然化合物在农药中的应用研究与进展蔡恩钦1黄海金砣赵树钢3(1.广丰环保局环境监测站,江西广丰334600;2.上饶师范学院化学化工学院,江西上饶334001;3.91852部队,江西上饶)摘要:本文综述了不同类型天然化合物在农药(除草剂、杀虫剂、植物防病害及植物生长调节剂等)中应用的研究与进展,简要分析了其存在的问题和解决的策略。
关键词:天然化合物植物源农药除草剂杀虫剂前言我国是一个农业大国,农药在农业生产中发挥着十分重要的作用。
随着人们健康意识的提高,大多数国家都非常重视农产品的安全性,对农药残留的限制十分严格。
化学农药的使用曾为农业的发展起到了重要的作用,但其潜在的危害性也在使用过程中慢慢的暴露出来,其中它对环境的污染、人类自身健康的威胁已成为人们关注的热点问题。
为此努力探索、研制高效、低毒、环环境友好的具有新颖结构的活性农药化合物具有重要的社会意义和经济价值,也是当今农药研究创制的主要趋势。
从上个世纪50—60年代开始,我国就开始了对天然化合物农药进行研究。
三十年后将天然化合物农药的研发列为国家重点项目,而且近20年来,很多新的天然化合物陆续被发掘利用,有的已进入市场生产。
国外在上世纪七十年代后开始重视生物农药的研发而且发展迅猛。
据统计截止2004年11月,美国E PA批准了近220种物质用于天然化合物农药的有效成分‘11。
天然化合物农药来源广泛,作用多样化。
本文按作用将其分为防治杂草、防治病害、防治虫害的天然化合物农药以及生长调节剂分别予以介绍。
1防治杂草的天然化合物农药天然化合物防治杂草有机体筛选,从理论上说主要依据两条标准:有效性(药效)和专一性(安全性)。
而对于生物除草剂的发展,有效性则是最关键的因素。
生物除草剂的药效包括控制杂草的水平、速度以及具体操作的难易程度等。
除草机理涉及到它对防治对象的侵染能力、侵染速度以及对杂草的损害性等。
用于防治杂草的天然化合物农药主要是放线菌产生的抗生素和杂草病原真菌。
一株产毒素葡萄链格孢菌的分离及鉴定

一株产毒素葡萄链格孢菌的分离及鉴定许灵春;杨文蒿;孙和龙;窦诗雯;敬国兴【摘要】Alternaria alternata is a common pathogen causing grapes postharvest decay, the producing mycotoxins will cause safe hazards to human health.In this study, the strain (A-0913) was isolated from the surface of rotten redglobe table grapes fruit and purified in PDA medium.According to the results of morphological characterization and5.8S rDNA-ITS gene sequence analysis, A-0913 was identified asA.alternata.Meanwhile, we have explored the basic biological characteristics of the strain and detection methods of toxin.The experiment results showed that the logarithmic growth phase of A-0913 was reached at 36 h, the optimal growth temperature for the mycelium was 25 ℃, and the neutral or low alkaline cultre conditinos were favorable for the growth of the mycelium.Further expriment showed that two of the most common A.alternata mycotoxins (alternariol and alternariol monomethyl ether) were detected in this strain after extraction.%链格孢菌是导致葡萄采后腐烂的一种重要病原菌,且其产生的真菌毒素会对人体健康造成安全隐患.本研究从自然发病的葡萄果实中分离纯化出一株侵染菌株(A-0913),根据真菌的形态学特征并结合5.8S rDNA-ITS基因序列分析确定该菌株属于链格孢菌(Alternaria alternata).同时,对该菌株基础生物学特性及其毒素检测的研究结果表明:该菌丝体最适生长温度为25 ℃,中性或偏碱性环境均有利于菌丝体的生长, PDA培养基中培养36 h后可达对数生长期.研究发现该菌株具有产毒素的性能,通过进一步优化真菌毒素HPLC检测条件发现该链格孢菌株主要产AOH和AME两种真菌毒素.【期刊名称】《湘潭大学自然科学学报》【年(卷),期】2017(039)002【总页数】6页(P49-54)【关键词】链格孢;形态学特征;5.8SrDNA-ITS;毒素【作者】许灵春;杨文蒿;孙和龙;窦诗雯;敬国兴【作者单位】湘潭大学化工学院,湖南湘潭 411105;湘潭大学化工学院,湖南湘潭411105;湘潭大学化工学院,湖南湘潭 411105;湘潭大学化工学院,湖南湘潭411105;湘潭大学化工学院,湖南湘潭 411105【正文语种】中文【中图分类】O152.1葡萄是中国栽培最普遍的三大水果之一,同时也是经济林中干鲜果品类的主要林木,具有很大的经济价值.产区主要集中在西北、华中、华北、东北南部和黄淮海地区,成熟期主要集中在8、9月份.采后葡萄在常温下极易腐烂,引起腐烂的病原菌主要有:灰霉病、霉腐病、青霉病和黑粉病等采后真菌病害[1].其中霉腐病由链格孢菌(Alternaria spp.)引起,此类真菌属于丝状真菌,是普遍存在于水果、蔬菜等的病原体和腐生菌,其可产生多种次级代谢产物,其产生的真菌毒素对人或牲畜具有诱变性、致癌性和致畸性等慢性或急性毒性作用[2].链格孢酚(Alternariol,AOH)、链格孢酚单甲醚(Alternariol Monomethylether,AME)和细交链孢菌酮酸(Tenuazonic Acid,TeA)为链格孢菌中3种主要的二苯并吡喃酮类非寄主特异性毒素[3-4].目前,关于抑制链格孢病菌生长已有少数相关的报道[5],但相关的抑菌机理及影响真菌毒素合成的报道不多.本研究从本地区采后葡萄果实中分离纯化了一株供试菌株A-0913,通过菌落形态及分子生物学鉴定其属于链格孢属病菌,并研究了此菌株真菌毒素提取及检测的方法,以期为后续葡萄采后链格孢病菌防治及真菌毒素合成抑制相关的基础理论研究奠定基础.1.1 材料、试剂与仪器1.1.1 实验材料供试材料为红提葡萄(Redglobe table grapes)果实,采摘于湘潭大学附近果园.1.1.2 培养基马铃薯葡萄糖琼脂培养基(PDA):100 g马铃薯煮沸后用4层纱布过滤,再加入10 g葡萄糖,10 g琼脂,蒸馏水定容到500 mL,121 ℃高压蒸汽灭菌20 min;马铃薯葡萄糖培养基(PDB):100 g马铃薯煮沸后用4层纱布过滤,再加入10 g葡萄糖,蒸馏水定容到500 mL,121 ℃高压蒸汽灭菌20 min.1.1.3 试剂与仪器 AOH,AME,TeA标准品(纯度 > 99 %,新加坡Pribolab公司);乙腈(色谱纯,天津市科密欧化学试剂有限公司);甲醇(色谱纯,天津市恒兴化学试剂制造有限公司);甲酸(色谱级)和无水MgSO4(分析纯)均订购于上海阿拉丁生化科技股份有限公司;NaCl(分析纯,国药集团化学试剂有限公司).LC-20AT型高效液相色谱仪,SPD-M20A二极管阵列检测器,C18色谱柱(日本岛津公司).1.2 方法1.2.1 致病真菌的分离与纯化采用组织分离法[6]分离菌种,在无菌操作台上将自然发病的葡萄果实用75 %酒精进行表面消毒3 ~ 5 s,再放入0.1 %次氯酸钠溶液中消毒2 min,最后用无菌水冲洗3次,用解剖刀在病健交界处切取0.5 cm× 0.5 cm腐烂组织植入PDA培养基,置于25 ℃恒温箱培养2 ~ 3 d.当培养出的菌落直径为1 cm时,用接种针在菌落边缘挑取少量菌丝植入新PDA培养中,重复上述操作后分离的菌株A-0913即可作为供试菌种后续实验备用.1.2.2 致病真菌形态学鉴定将供试菌株接种到PDA 固体培养基中,25 ℃恒温倒置培养4 ~ 5 d.记录致病真菌的菌落直径大小、颜色变化等特征,并制作菌丝压片,在显微镜下观察其菌落、菌丝和孢子的形态特征,并根据真菌形态学鉴定手册[7]进行初步鉴定.1.2.3 致病真菌的分子学鉴定(1)致病真菌基因组DNA提取将供试菌株接种到PDA 平板上,在培养箱中于25 ℃恒温培养5 d,用6 mm的圆形打孔器在菌落边缘取多个菌丝块,接种到100 mL PDB液体培养基中,25 ℃条件下150 r/min震荡培养3 d,将培养的菌液于4 000 r/min下离心10 min,无菌水洗涤3次后用循环水真空泵抽滤菌丝,致病真菌基因组DNA提取参照刘艳梅等[8]改进的氯化苄法.(2)PCR扩增PCR扩增使用2×Taq PCR MasterMix(北京天根生化科技有限公司)试剂盒.采用25 μL反应体系,1 μL Template,1 μL Primer 1,1 μL Primer 2,1.25 μL2×Taq PCR MasterMix,加ddH2O至25 μL.5.8S rDNA-ITS扩增所需引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[9].PCR扩增反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min.扩增产物用1.2 %的琼脂糖凝胶、1×TAE 电泳缓冲液,上样5 μL 检测,DNA Marker Ⅲ(上海研拓生物科技有限公司)指示分子量,凝胶成像仪观察并照相,将克隆片段送至苏州泓迅生物科技有限公司进行测序分析.1.2.4 致病真菌生物学特性(1)致病真菌生长曲线将供试真菌接种于PDA培养基中培养5 d后,用6 mm圆形打孔器取3个菌苔并将其置于100 mL PDB液体培养基中,25 ℃、150 r/min恒温振荡培养.每12 h 取出菌丝体真空抽滤,称量菌丝体重量,共计录108 h.每组设置3个重复,结果取平均值.(2)温度对致病真菌的影响将供试真菌接种于PDA培养基中培养5 d后,取其中菌苔(直径6 mm)置于新PDA培养基中央,分别放置于10、15、20、25、30、35 ℃恒温培养箱中培养3 d,用十字交叉法测量菌斑直径,每个温度梯度设置3个重复,结果取平均值. (3)pH对治病真菌的影响将供试真菌接种于PDA培养基中培养5 d后,取其中菌苔(直径6 mm)置于pH分别为4、5、6、7、8、9的PDA培养基中央.置于25 ℃恒温培养箱中培养3 d,用十字交叉法测量菌斑直径,每个pH梯度设置3个重复,结果取平均值.1.2.5 致病真菌毒素提取及检测样品毒素提取方法参考蒋黎艳[10],称取已抽滤的供试菌丝体样品1 g(精确至0.01 g)冰浴研磨均匀,置于10 mL具塞离心管中;加入含1 %乙酸的乙腈-水(80∶20,V/V)提取液5 mL,涡旋混匀,150 r/min常温振荡提取60 min,再加入0.5 g无水MgSO4 和0.2 g NaCl,剧烈振荡1 min 后,以4 000 r/min离心10 min,取上清液过0.22 μm有机滤膜,滤液经液相色谱分析.AOH、TeA和AME标准品用甲醇配制.HPLC检测条件:色谱柱C18(250 mm × 4.6 mm,5 μm);柱温40 ℃;流动相体系为1 %甲酸(A)和乙腈(B);梯度洗脱程序为0 ~ 1 min,20 % ~ 55 % B;1 ~ 16 min,55 % ~ 60 % B;16 ~ 18 min,60 % ~ 80 % B;18 ~ 18.5 min,80 % ~ 20 % B;18.5 ~ 22 min,20 % B.进样量20 μL;流速1.0 mL/min.2.1 致病真菌的形态学鉴定供试菌株于25 ℃ PDA 培养基培养3 d后,菌落直径达到3.5 ~ 4.0 cm,菌落平展且呈致密的绒毛状,初期菌丝灰白色,后变为浅绿色或墨绿色,培养基底面为黑色或紫黑色(图1 A).显微镜形态观察其分生孢子呈卵形、倒棒状、梨形或椭圆,形状变化较大;分生孢子褐色或深褐色,表面光滑或有瘤,有横膈膜 1~6 个,纵隔膜0 ~5 个,喙大(图1 B).分生孢子梗直立、分枝或不分枝、淡榄褐色至绿褐色、有屈曲、顶端常扩大而具多个孢子痕;分生孢子形成长达5个左右孢子所组成的孢子链(图1 C).根据菌落特征和参照《真菌形态鉴定手册》初步确认该菌株A-0913为链格孢霉病原菌.2.2 致病真菌的分子学鉴定通过改进氯化苄法提取供试真菌基因组DNA,利用引物ITS1/ITS4扩增出了一条长约570 bp DNA条带(图2 A),该条带经测序后证实其片段大小为579 bp,与PCR结果一致.将测序后的核苷酸序列(图2 B)提交到GenBank中进行BLAST对比,结果表明:该序列与已知的链格孢菌(Alternaria alternata,KU182490.1)5.8S rDNA-ITS区域同源性高达99 %,从基因信息方面进一步证实该供试菌株为链格孢致病菌.2.3 致病真菌生物学特性2.3.1 致病真菌生长曲线图3为链格孢菌生长曲线,0 ~ 36 h菌丝体生长缓慢,为迟缓期;36 ~ 96 h菌丝体生长迅速,为对数生长期;96 ~ 108 h,菌丝体重量变化不显著,说明菌丝生长已达到平稳期.2.3.2 温度对致病真菌生长的影响如图4所示,温度对链格孢菌丝体生长影响较大,随着温度升高菌落直径呈增加后降低的变化趋势,25 ℃时菌落直径达到最大值(39.25 ± 0.87)mm,显著高于其他温度组(P<0.05).而在10 ℃和35 ℃培养条件下链格孢菌丝体的生长明显受到抑制,于PDA培养基培养3 d后菌落直径仅为(15.25 ± 0.65)mm和(16.86 ± 0.48)mm,显著低于25 ℃培养组.因此,链格孢菌丝生长的最适温度为25 ℃.2.3.3 pH对致病真菌生长的影响由图5可知,在pH为6 ~ 9的PDA培养基中链格孢菌落直径差异不大,当pH为6时,供试真菌于PDA培养基上培养3 d后菌落直径最大(37.00±1.50)mm,而pH为4时菌落直径仅为(29.67 ± 0.58)mm,显著低于其他处理组(P<0.05).因此,链格孢病原菌在中性或偏碱性的环境中均能较好地生长.2.4 致病真菌毒素提取与检测方法探究根据3种标准品在200 ~ 400 nm下的紫外吸收光谱,确定AOH和AME最大吸收波长为256 nm,TeA最大吸收波长为276 nm.由图6可知,TeA(图A)、AOH和AME标准品出峰时间分别为8.781 min、9.015 min、12.647 min.供试真菌的毒素提取物经HPLC检测后发现,在与标准品AOH、AME(图B)出峰一致的时间点有特征峰出现.对特征峰的吸收光谱进行进一步分析后确认图6 C中Ⅰ、Ⅱ两个峰分别为AOH和AME毒素,但该A-0913菌株毒素提取液中未检测出TeA毒素.用本研究中分离纯化的拟鉴定菌株(A-0913)侵染葡萄果实,观察发现:初期发病组织表面菌株呈浅绿褐色,边缘为白色菌丝,后期组织部位向内凹陷且呈现深黑色,果实表面生水渍状,后期可致果梗迅速干缩、失绿,导致果实脱落.该菌株在PDA 平板上培养3 d后,菌落青褐色,平展,致密,背面褐色至黑色,显微镜观察发现其可形成 4~7个孢子的链或分生孢子单生,孢身喙柱状,淡黄褐色,与前人报道研究基本一致,因此从外观形态上初步确定该菌株A-0913为链格孢菌.物种中ITS区的进化速率较快,可以提供较丰富的变异位点和信息位点,被广泛用于研究种间的系统进化关系.Pryor和Glbertson[11]对Alternaria及其近源属种间5.8S/ITS在遗传背景上的差异分析发现,通过聚类得出的个别种在属水平的归属上和形态分类结果不一致.将测序后的核苷酸序列提交至NCBI数据库中BLAST比较后发现,菌株A-0913的ITS区段与已知的链格孢菌(Alternaria alternata,KU182490.1)5.8S rDNA-ITS区域同源性高达99 %,根据该区域序列推测本研究中的分离菌株A-0913为链格孢菌.进一步分析该菌的生物学特性发现,该链格孢菌(A-0913)生长速度快,最适生长温度为25 ℃,中性或偏碱性环境均有利于菌丝体的生长.利用HPLC方法来检测本研究中菌株的主要真菌毒素,根据3种标准品的紫外吸收光谱确定TeA、AOH和AME最大吸收波长分别为276 nm、256 nm和256 nm,与Myresiotis[12]和Prendes[13]研究结果一致.实验中比较了不同流动相5 mmol/L乙酸铵-乙腈和0.1 %甲酸-乙腈检测毒素标准品的效果,发现当流动相为0.1%甲酸-乙腈时,毒素分离度较好,保留时间小且峰型对称性好,史文景[14]同样发现当流动相体系为0.1 %甲酸-乙腈时,AOH和AME出峰效果最佳.有报道表明:在一定范围内流动相流速降低,柱效提高,分离度增大;当流速升高会导致保留时间短,但分离效果变差;过高的流速还会损坏泵头和色谱柱[15].本研究中当流速选择为0.5 mL/min时,分离度好但保留时间较长;流速为1.2 mL/min时,出峰过快并集中,分离度较差;当流速选择为1.0 mL/min时,分离度好且保留时间短.基于王蒙[16]和Myresiotis[12]等报道中的链格孢真菌毒素HPLC洗脱程序,结合本实验室中HPLC硬件设施,初步确定了本研究中样品真菌毒素的最优洗脱程序.因此,当流动相体系为0.1 %甲酸-乙腈,流速为1.0 mL/min,本研究中供试菌株A-0913真菌毒素提取液HPLC分离检测效果最好.Schwarz[4]等报道A. alternata DSM 1102菌种中主要毒素为TeA,AOH和AME含量很少;而A. alternata DSM 12633中主要的真菌毒素为AOH,表明链格孢中真菌毒素的种类及含量与其菌种类型有关.本研究中的链格孢菌(A-0913)主要合成AOH和AME两种真菌毒素,但未检测到TeA,与A. alternata DSM 12633检测结果类似.目前,链格孢毒素的研究集中在水果和果汁的检测上[17],菌体毒素合成和抑制方面的研究鲜见报道.本研究从染菌的采后葡萄上成功分离一株链格孢菌(A-0913),然后探索该菌株最佳生长条件,并进一步优化了该菌株中真菌毒素检测的HPLC 方法,为以后探究葡萄采后链格孢菌生长抑制及毒素合成方面的研究提供了技术支撑.【相关文献】[1] 彭新媛. 双组份SO2-ClO2对葡萄采后品质及功能性成分的影响[D].乌鲁木齐:新疆大学,2014.[2] PRELLE A, SPADARO D, GARIBALDI A, et al. A new method for detection of five alternaria toxins in food matrices based on LC-APCI-MS[J]. Food Chemistry, 2013, 140(1): 161-167.[3] SCHWARZ C, TIESSEN C, KREUTZER M, et al. Characterization of a genotoxic impact compound in Alternaria alternata infested rice as Altertoxin II[J]. Archives of Toxicology, 2012, 86(12): 1911-1925.[4] SCHWARZ C, KREUTZER M, MARKO D. Minor contribution of alternariol, alternariol monomethyl ether and tenuazonic acid to the genotoxic properties of extracts from Altenaria alternata infested rice[J]. Toxicology Letters, 2012, 214(1): 46-52.[5] CARVALHO D D C, ALVES E, CAMARGOS R B, et al. Plant extracts to controlAlternaria alternata in Murcott tangor fruits[J]. Revista Iberoamericana de Micología, 2011, 28(4): 173-178.[6] 周海恩,陶能国,贾雷. 一株柑橘采后酸腐病菌的分离与鉴定[J]. 湘潭大学自然科学学报,2013,37(1):92-96.[7] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社, 1979.[8] 刘艳梅,朱建兰,杨宇航.曲霉基因组DNA提取方法研究[J].西北农业学报,2009(2):55-58.[9] 孙霞. 链格孢属真菌现代分类方法研究[D].泰安:山东农业大学,2006.[10] 蒋黎艳,赵其阳,龚蕾,等. 超高效液相色谱串联质谱法快速检测柑橘中的5种链格孢霉毒素[J]. 分析化学,2015,12:1851-1858.[11] PRYOR B M, GILBERTSON R L. Relationships and taxonomic status of Alternaria radicina, A. carotiincultae, and A. petroselini based upon morphological, biochemical, and molecular characteristics[J]. Mycologia, 2002, 94(1): 49-61.[12] MYRESIOTIS C K, TESTEMPASIS S, VRYZAS Z, et al. Determination of mycotoxins in pomegranate fruits and juices using a QuEChERS-based method[J]. Food Chemistry, 2015, 182: 81-88.[13] PRENDES L P, MERíN M G, ANDREONI M A, et al. Mycobiota and toxicogenicAlternaria spp. strains in Malbec wine grapes from DOC San Rafael, Mendoza, Argentina[J]. Food Control, 2015, 57: 122-128.[14] 史文景,赵其阳,焦必宁. UPLC-ESI-MS-MS结合QuEChERS同时测定柑橘中的4种真菌毒素[J]. 食品科学,2014,20:170-174.[15] 包琴,唐洁,马力,等. HPLC法检测柑橘中赤霉酸残留量的色谱条件[J]. 食品研究与开发,2010,11:141-145.[16] WANG M, JIANG N, XIAN H, et al. A single-step solid phase extraction for the simultaneous determination of 8 mycotoxins in fruits by ultra-high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1429: 22-29.[17] 史文景. 柑橘和果汁中链格孢霉毒素检测技术研究[D].重庆:西南大学,2014.。
链格孢引起的病害严重危害农作物生产并危及农产品安全

链格孢引起的病害严重危害农作物生产并危及农产品安全作者:王婧翟伟卜高环来源:《植物保护》2017年第04期摘要链格孢属Alternaria Nees真菌是一类在自然环境中广泛分布的真菌,该属的一些种可引起多种重要农作物病害发生,严重危害农作物生产并造成巨大损失。
另外,这些链格孢产生的毒素还积聚在农产品中,危及农产品食用安全。
为此有必要加强有关链格孢病害的研究和治理。
本文介绍了有关链格孢分类研究进展,近些年来链格孢危害农作物的主要种类及危害情况,以及世界范围内链格孢毒素所引发的农产品食用安全问题。
在此基础上,也综述了链格孢病害的主要防控策略和治理技术。
关键词链格孢病害;毒素;农作物生产;农产品安全中图分类号:S 432.44文献标识码:ADOI:10.3969/j.issn.05291542.2017.04.002AbstractAlternaria Nees is a widely distributed fungal genus in the natural environment. Some Alternaria species are plant pathogens, causing a range of diseases on a large variety of important crops, and often leading to serious damage to the agricultural production. These plant pathogenic Alternaria species often produce Alternaria toxins, which may accumulate in agricultural products, and endanger the safety of edible agricultural products. Therefore, it is necessary to strengthen the studies on the occurrence and management of Alternaria diseases. Here, progresses in Alternaria species classification, the main crops damaged by Alternaria diseases, and the worldwide issues of food and agricultural product safety caused by Alternaria toxins are introduced in this paper. Furthermore, strategies and technologies for management of Alternaria diseases are also reviewed.Key wordsAlternaria disease;toxin;crops production;safety of agricultural products链格孢属于子囊菌Ascomycota座囊菌纲Dothideomycetes格孢腔菌目Pleosporales格孢腔菌科Pleosporaceae链格孢属Alternaria[1]。
链格孢菌毒素对紫茎泽兰的致病机理

植物资源与环境学报 2001,10(3):47-50 Journal o f Plant Resources and Environment 链格孢菌毒素对紫茎泽兰的致病机理万佐玺,朱晶晶,强 胜(南京农业大学杂草研究室,江苏南京210095)摘要:以叶圆片法分析链格孢菌〔Alternaria alternata(Fr.)K eissler〕毒素对紫茎泽兰(Eupatorium adenophorum S preng.)叶组织细胞膜透性、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(C AT)活性以及丙二醛(M DA)含量的影响,结果表明,链格孢菌毒素使紫茎泽兰叶组织细胞膜透性上升,Na+和K+渗漏量增加,膜脂过氧化加强, M DA含量上升;链格孢菌毒素处理的紫茎泽兰叶片中POD、APX和C AT的活性均较对照降低。
关键词:链格孢菌;毒素;紫茎泽兰;致病机理中图分类号:Q949.32;S451.1 文献标识码:A 文章编号:100420978(2001)0320047204The pathogenic mechanism of toxin of Alternaria alternata(Fr.)K eissler to Eupatorium adenophorum Spreng. W AN Zuo2xi,ZH U Jing2jing,QI ANG Sheng(Weed Research Laboratory,Nanjing Agricultural University,Nanjing210095,China),J.Plant Resour.&Environ.2001,10(3):47-50Abstract:E ffects of toxin in Alternaria alternata(Fr.)K eissler on cell membrane permeability,M DA content and activities of POD,APX and C AT enzymes of Eupatorium adenophorum S preng.were conducted by the method of excised leaf test.The results showed that toxin increased permeability of cell membrance,leakage of K+and Na+,over2oxidation of cell membrane and content of M DA in E.adenophorum leaf tissue,but activities of POD,APX and C AT in treated leaves were lower than those in control leaves.K ey w ords:Alternaria alternata(Fr.)K eissler;toxin;Eupatorium adenophorum S preng.;mechanism of pathogenicity 紫茎泽兰(Eupatorium adenophorum S preng.)是一种世界性的恶性杂草,链格孢菌〔Alternaria alternata (Fr.)K eissler〕是紫茎泽兰的自然致病真菌,有潜力开发成防除紫茎泽兰的真菌除草剂[1,2],链格孢菌使紫茎泽兰致病的主要原因是其产生的毒素[3~5]。
链格孢属真菌对农作物的危害_崔迪
.第4期链格孢属真菌对农作物的危害*崔 迪 王继华 陈 捷 王海洋(哈尔滨师范大学)赵阳国(哈尔滨工业大学)【摘要】 链格孢属(A lterna ria )真菌是农作物的主要致病菌之一,它能引起包括玉米、小麦、烟草、马铃薯、番茄、苹果、梨等几十种农作物发病.其发病机理主要是由病菌的代谢产物———毒素导致的.由于毒素的作用使农作物产生各种症状,如黑斑病、褐斑病、茎枯病、赤星病等等,严重影响了农作物的产量,给我国农业生产带来了巨大损失.关键词:链格孢属;植物病害;毒素收稿日期:2005-04-12*哈尔滨师范大学校科研基金项目《作物病害真菌(链格孢属真菌)拮抗菌的分子分类》(2003-06),哈尔滨师范大学大学生科技创新基金重点资助项目,项目编号:(2005-04)1 链格孢属真菌的形态特征1.1 链格孢属真菌的分类 其中链格孢属又分为40多种,如苹果链格孢(A lt e r naria m a lt )、菊池链格孢(A.kikuchiana )、长柄链格孢(A.long ipes )、粗链格孢(A.crassa )、簇生链格孢(A.fascicu lata )、黑链格孢(A.atrans )、苋链格孢(A.a m aranthi )、束梗链格孢(A.boku -r a i )等等[1].1.2 链格孢属真菌的形态特征链格孢属真菌的分生孢子梗为深色,单枝,短或长,顶端单生或串生分生孢子.分生孢子淡褐色至深褐色,形状不一,自倒棍棒形到椭圆形或卵圆形,有纵横分隔,顶端有一喙状细胞,腐生或寄生,腐生为多,引起叶斑和组织腐烂,病菌在病组织上越冬[2].本文摘自哈尔滨师范大学学报2 链格孢属真菌引起农作物发病的症状2.1 马铃薯早疫病2.1.1 症状此病主要为害叶片,也能侵害茎、叶柄及块茎.最初是在叶上呈现褐色小斑点,逐渐扩大成为近圆形上有明显同心轮纹的病斑,以后其上生有绒毛状黑霉.重病时引起叶片萎凋,干枯.一般植株下部的叶片常先发病,渐次向上蔓延.块茎受害后薯皮上出现黑褐色微陷的圆形或不规则形的病斑,边缘清晰,病部的薯肉褐色,干腐.2.1.2 病原该病病原菌为马铃薯早疫病菌A lternaria so-lan.i该病菌的分生孢子梗单生或簇生,圆筒形,有1-7个隔膜,暗褐色,大小为40~90μm×6~8μm.分生孢子长棍棒状,顶端有细长嘴胞,黄褐色,具纵横隔膜,大小为42~113μm×8.4~15μm.嘴胞无色或淡褐色,长24~144μm,宽1.8~3μm,有数个横隔膜.此菌以菌丝体及分生孢子随病残体组织遗落于土壤中越冬,带菌的种薯也是初次侵染的菌源.分生孢子借气流传播,一般自气孔或伤口侵入,也能由表皮侵入.此菌除为害马铃薯外,还可侵害番茄、茄子、龙葵等[3].2.2 梨黑斑病2.2.1 症状主要为害果实、叶片及新梢.幼嫩的叶片最早发病,开始时产生针头大、圆形、黑色的斑点,以后斑点逐渐扩大,近圆形或不规则形,中央褪呈灰白色,边缘黑褐色,有时微现轮纹.潮湿时,病斑表面遍生黑霉,此即病菌的分生孢子梗及分生孢子.叶片上长出多数病斑时,往往相互愈合成不规则形的大病斑,叶片成为畸形,引起早期落叶.幼果受害,初在果面上产生一个至数个黑色圆形针头大的斑点,逐渐扩大,呈近圆形或椭圆形.病斑略凹陷,表面遍生黑霉.由于病健部发育不均,果实长大时,果面发生龟裂,裂隙可深达果心,在裂缝内也会产生很多黑霉,病果往往早落.成长果实感病时,其前期症状与幼果上的相似,但病斑较大,黑褐色,后期果实软化,腐败而落果.重病果常数个病斑合并成为大病斑,甚至使全果遍呈漆黑色,表面密生墨绿色至黑色的霉.,,,扩大为长椭圆形,凹陷更明显,淡褐色,病部与健部分界处常产生裂缝[4].2.2.2 病原该病由菊池链格孢菌A lternaria k i k uchiana引起,病斑上长出的黑霉是病菌的分生孢子梗和分生孢子.分生孢子梗褐色或黄褐色,数根至10余根丛生,单一,少数有分枝;基部较粗,先端略细,有隔膜3-10个,大小40~70μm×4.2~5.6μm;其上端有几个孢痕.分生孢子常2-3个链状长出,形状不一,普通为短棍棒状,基部膨大,顶端细小,往往有较长的嘴胞,有横隔膜4-11个,纵隔膜0-9个,大小10~70μm×6~22μm,隔膜所在处略缢缩.老熟的分生孢子,壁较厚,暗褐色;幼嫩的分生孢子则壁薄而呈黄褐色或暗黄色.2.3 烟草赤星病(褐斑病)早在六十年前赤星病就是非洲烟草的严重病害.五十年代曾在美国爆发流行,造成严重损失.在我国山东、河南、安徽、吉林、云南、贵州、浙江和台湾省均有发生.2.3.1 症状下部叶片先出现病斑,为圆形深褐色小斑点,但在亮而薄的叶片上斑点颜色较淡.病斑最初仅0.1c m大,以后扩大到0.6~0.7c m,并保持圆形,稍后病斑边缘被一条狭窄的鲜黄组织包围,特别被害叶片尚是深绿色时,边缘更明显.以后病斑逐渐扩大到1~2.5c m,斑形不规则或保持圆形,这时在坏死组织内出现同心轮纹环绕病斑的鲜黄晕环.在适宜的条件下,大病斑可合并使全叶成为碎片.此病在烟基、叶中脉、花梗与蒴果产生大量深褐色或黑色斑点.如果环境适宜,病菌就由植株下部向上蔓延,一旦大发生,就能造成严重损失. 2.3.2 病原该病由长柄链格孢菌A lte r naria long ipes引起.主要为害烟草叶片.病斑圆形或不规则形,深褐色,轮纹状,易破裂,分生孢子梗单生或丛生,深褐色.分生孢子深褐色,棍棒形,1-4个纵隔和5 -7个横隔,50~100μm×10~18μm[5].3 链格孢属真菌引起农作物发病的机理———毒素毒素的种类很多,包括引起人、家畜发病的病菌毒素,引起植物发病的病菌毒素;而病菌毒素又包括细菌毒素、真菌毒素等等.在这里,我们只研88哈尔滨师范大学自然科学学报 2005年毒素.3.1 植物病原真菌毒素的定义80年代以来,人们由于不断地发现新的毒素种类和病原物与寄主植物间的作用关系,最终得出植物病原真菌毒素的定义:毒素是病原物的代谢产物,但不属于酶类,是对植物组织有明显损伤作用的物质,是在植物病害发生,发展过程中具有明显致病或致毒作用的物质.到80年代后期,日本西村等学者在研究交链孢菌产生的毒素实验中,又补充了2条针对真菌毒素的含义:即毒素是由真菌孢子萌芽产生的一类致病作用物质,具有对寄主植物诱发病害的敏感性诱导因子.3.2 链格孢属真菌毒素的种类3.2.1 寄主专化性毒素(host -specific toxin ,H ST )寄主专化性毒素是由病原真菌产生的一类对其寄主植物种或栽培品种具有特异性生理活性和高度专化性作用位点的代谢物毒素,亦称寄主选择性毒素.80年代以来,这类寄主专化性毒素一直被人们公认为诱发植物病害的主要致病因子之一.至今已发现有18种,其中有8种是由链格孢属真菌产生的.(见表1)表1 植物病原真菌产生的H ST的产生菌及其致病病害种类3.2.2 非寄主专化性毒素(non -host -specifictox i n ,NH ST )非寄主专化性毒素是由病原真菌产生的一类对其寄主植物种或栽培品种具有一定生理活性和非专化性作用位点的代谢物毒素,亦称为非寄主选择性毒素.由链格孢属产生的NH ST 包括细链格孢毒素(ten t o xin )、细链格孢酮酸(tenuazonic acid ,TA )、链格孢酸(alternaric acid ,AA )、大孢链格孢毒素(m acrospo rin )、布雷菲德菌毒素A (br e feldinA )、百日菊链格孢醇(zi n niol )等等[6].3.3 链格孢属真菌毒素的致病性近年来从许多研究表明毒素不但产生在人工培养液中,更重要的组分是在孢子萌芽液中,从此,量试验证明孢子萌发液决定病害因子的是日本西村为首的植物病理学界,他们用链格孢属的一些病原真菌毒素做了大量的研究,1988年Langsdorf 将浓缩的番茄早疫病菌的孢子萌发液(SGF )与无致病性的A.a lt e r nata 的孢子悬浮液混合喷洒到不同植物叶片上,发现只在番茄早疫病菌寄主植物(番茄、马铃薯)上出现坏死斑,这些诱导的病害症状与人工接种番茄早疫病菌病原后形成的症状相似,他们用分子生物技术和不同色谱技术对SGF 进行分析,得到两种活性组分,即A 和B 组分,而B 组分中的活性因子经分子生物研究为一种链格孢酸(AA )毒素,寄主植物对AA 反应非常敏感,发现在菌丝体和休眠孢子中都含有AA 组分,在孢子萌芽中释放出AA 说明了它在病害发[7].89第4期 链格孢属真菌对农作物的危害1988年Li m eza w a等对AL-toxin进行水解产生两部分,即均丙三羟酸和氨基戊醇,应用分子生物技术分别检测它们对于植物的毒力,发现均丙三羟酸对番茄没有毒力,而氨基戊醇部分保留了寄主选择性毒力,其毒力几乎与AL-toxin相似.尽管如此,不论对哪个基因型,AL-toxin用氨基戊醇在低至0.1×10-6的浓度时,能非选择性地抑制番茄苗根系的生长.同年,Tanaba等用NTC法获得了AK-toxin的缺失型突变体,它完全丧失了对20世纪梨品种叶片的致病性,同时用N-甲基-N'-硝基-N-亚硝基胍诱导的角质酶缺失型突变体,也丧失了致病性,而用类似方法诱变梨黑斑病菌株果胶酶和果胶裂解酶的缺失株的致病性不变,同时又获得3株该菌的黑色素缺失突变体,白化突变体和淡褐突变体,但它们仍是致病的,说明AK-t o xin和角质酶在A.alterna ta日本梨致病型的菌株中,对梨的致病作用中起着很重要的作用[8].3.4 毒素的植物受体3.4.1 毒素与受体的结合过程1990年Kohm otoe等提出感病植物的细胞具有H ST的植物识别子(受体)的假说,他们认为H ST对植物的初期作用直至毒素与受体结合到最后出现症状有一连续过程(见图1).从图1看出,一个毒素与植物受体的结合包括氧控过程、抑制细胞的mRNA和蛋白新合成,抑制细胞Cu或Fe 酶活性及质膜凹陷直至细胞死亡等一系列过程.从毒素与受体结合到出现症状,对于AK-tox in 与梨细胞的这一体系而言,一般需要12~18h.3.4.2 毒素、激发子与植物受体间的分子识别植物病原真菌对寄主植物的识别子,除毒素外,还有真菌激发子(e lic it o r)和真菌抑制子(sup-pr esso r),它们对于植物受体(包括受体蛋白或受体多肽)位点的识别与竞争作用是近几年来研究的热点,也是菌毒学发展的主要方面.植物细胞原生质膜具有对激发子与抑制子的识别位点,也具有对H ST识别受体.因此,毒素,激发子、抑制子在者均与植物相互间发生识别作用,至于谁被植物识别与结合以及引起一系列后效应,其决定因素是植物与病原物间的亲和程度或专化程度.通常,人们将能够使植物产生植物保卫素(phy toa lex i n,P A)或抗菌物质的一类诱导因子称为激发子.真菌细胞壁中富含这种激发子组分.激、质,其分子量在5000D a以上,人们发现在产生P A 或一些抗菌物质以前,能诱发植物产生过敏性反应,O-2活性和植物第二信使物质,最后形成P A 积累,此时病菌既不能成活,也无毒素产生,植物就不发病.病原真菌的细胞壁也含有抑制子,是一类分子量在5000Da以下的葡聚糖物质,抑制子的特异性很强,要在病原菌与寄主植物间属于亲和组合型的情况下才能发挥作用,能阻止激发子的功能,使寄主体不能积累PA,导致植物发病.激发子、抑制子是病原菌胞壁固有的成分,而毒素则是菌的代谢产物,它们都可被植物原生质膜识别,在不亲和组合的情况下,病原菌与寄主细胞进行生物大分子间的识别作用时,由于寄主细胞中存在β-1,3葡聚糖内切酶的诱导,使菌游离出大量的激发子,与寄主细胞膜的受体相结合,迅速产生第二信息到达细胞核,最后导致专化基因的转录,产生PA,故人们称此为激发子———受体相互作用的模式.[9]4 结束语可见,真菌对农作物的危害极大,它们既可以侵染农作物整体,又可以侵染农作物器官,可以说无孔不入的寻找它们的寄生场所.因而我们必须采取积极措施预防这些有害真菌的侵染.首先,要了解与掌握这些有毒真菌的特性,包括遗传特性及生活方式,特别是要研究有毒真菌与寄生作物间的互作关系,在此基础上才能知道和研究它们的代谢物毒素的性质,毒素的毒性机理,检测毒素的方法以及去毒解毒的良好决策.其次,要指出的是真菌产毒都是由产毒基因所支配,同时又受到与农作物之间存在相互识别、相互作用的关系.特别近十年来分子生物学与分子遗传学的发展,使人们从分子生物学水平来理解或研究真菌与农作物之间的识别作用关系,识别包括信息经由两者相互作用的表面分子而传递到农作物的受体位点,真菌分泌的致病毒素物质是一种由菌发出的信息物质,到达农作物细胞表面是否能致病或致毒,这是决定菌与农作物间的亲和关系,亲和型的则农作物被菌寄生,被菌污染,农作物体内包括器官就会污染了毒素.人类、家畜吃了致病(有毒素)的农作物产品就自然会带入体内,所谓“病从口入”.假如菌与农作物间是属非亲和型,则农作物就有抗性,不被真菌侵染90哈尔滨师范大学自然科学学报 2005年品中.所以我们必须采取积极措施,提高农作物的抗病性,预防真菌侵染,消除真菌寄生的场所,防止真菌寻找“良机”污染农作物,培育与栽培抗病良种[10].再次,要创造不利于真菌的生长条件,而有利于农作物的生长发育环境.当农作物被污染之前必须采取一些措施,如喷施一些对人、家畜无残毒的高效杀菌剂或用生物防治法或采取“以毒攻毒”的生物菌及其代谢产物抗菌剂等,预防与杀死有害真菌的繁殖.参 考 文 献1 张天宇.《半知菌分类研究的新进展》.西北农业大学学报,1986,14(2):106~1182 江苏农科院植物保护系.《植物病害诊断》.农业出版社,19783 浙江农业大学.《农业植物病理学》上册.上海科学技术出版社,19784 章元寿.植物病理生理学.南京农业大学出版社,19915 浙江农业大学.《农业植物病理学》下册.上海科学技术出版社,19806 孟昭赫.《真菌毒素图解》.人民卫生出版社,19837 俞大绂.植物病理学和真菌学技术汇编.人民教育出版社,1975,(1):1~38 孟昭赫.《真菌毒素研究进展》.人民卫生出版社,19789 裘维藩.《菌物学大全》.科学出版社,199810 梁平彦.真菌病毒对寄主的影响及利用.科学出版社,198611 彭珍荣主编.现代微生物学.武汉大学出版社,199512 M.W.G ray , D.Sankoff ,R .J .C eclergren .On t he evol u ti onar yd escen t of organ i s m s and organelles :a global phy l ogeny bas ed on a h i gh l y conserved struct u ral core i n s m all subunit riboso m al RNA .N ucl eic Aci d s Research ,1984,12:5837~585213 J .W uyts ,Y .V .d .Peer ,T .w inkdm an s ,R .D.W achter ,The Eu -ropean dat ab ase on s m all s ubun it ri boso m al RNA ,Nucl eic Aci d s Research ,2002,30(1):183~185.14 Ja mes P ,H all aday J ,C rai g EA :G eno m ic li b raries and a hos tstrain des i gned for h i gh l y effi cien t t w o -hy -b rid sel ecti on i n yeas.t G enetics 1996,144:1425~1436.15 A tl as R M.H andbook ofM icrob i ogica lM ed i a .CR C press ,199316 K as t en MM ,Ayer DE ,S till m an D J ;S I N3-dependent tran scri p -tional rep ression by i n t eracti on w it h t he M ad1DNA -b i nd i ng p ro -tei n .M o.l C ell B i o.l 1996,16;4215~4221.17 A ronhei m A ,Zandi E ,H enne m ann H ,E ll edge S J ,Kari n M :I -s o l ation of an AP -1repress or by a novelm ethod for deteci ng p ro -tei n -p rotei n i n t eracti on s .M o.l Ce ll Bio.l 1997,17;3094~3102.18 Dopart m en t ofM icrob iol ogy ,National Un i versit y of S ingapore.M icrob i ology Prati cal s ,199629 PelcarM J et a.l M icrob iol ogy -C oncep t s and App licati on .M e -G ra w -H ill ,Inc ,199320 J ohnss on N ,V ars havsky A :Sp lit ubiquiti n as a sensor of protei ninteractions in vivo .Proc .N at.l Acad .Se.i USA 1994,91;10340~10344THE DANGER OF ALTERNARI A T O THE CR OPSCu iD i W ang Jihua Chen Jie Zhao Yangguo (H arb i n Nor m alUn i versit y ) G ao Chongyang(H arb i n In stit u te of Technology )ABSTRACTA lte r na ira is one o f the m a i n l y ger m swh ich can have ill n ess co m ing on dozens o f kinds o f crops ,such as ,w heat ,tobacco ,po tato ,apple ,pear ,e tc .The supersessi o n r esult toxin of the ger m m ainly causes its patho -genesis .Th is toxin m akes the crops pr oduce various kinds of sy m pto m s ,fo r instance black r o t ,fox iness dis -ease ,w it h ered ill ,red star o f ste m ,etc .A ll o f the influence output of t h e crops seriously ,brings enor m ous loss t o ag ricult u ra l production o f our coun try .K eyw ords :A lt e r naria ;P lant d isease ;Tox i n(责任编辑:柳湘云)91第4期 链格孢属真菌对农作物的危害。
链格孢菌毒素细交链孢菌酮酸在土壤中的降解研究

体重减轻 、 胃病理组织学表现异常等[1 对食品安 脾 13 21 ,,
全带来一定的隐患 。 无论是随着感病植株死亡个体 的降解 , 还是随着 病原真菌 的分泌。 细交链孢菌酮酸均会直接或间接地 进人土壤环境中。一方面, 对土壤生态系统 中的其他 物种产生影响 。 进而影响整个土壤生态系统的系统功 能, 另一方面 , 细交链孢菌酮酸在土壤系统中的存在 , 可能被作物植株通过根系吸收 。 响其生长 、 影 产量 和
Ab t a t T n a o i cd wa n i o t t c t xn f m e n r l r aa tx c t n ma s t sf u d i p i d g an , i a e s r c : e u z n c a i sa mp ra n my o o i r Ah r a i at n t . o i o a i l.I wa _ n s o l r i s d s s d o a e o n e e p a t a d r t n f i a i d n t u l o ae y De r d t n o n a o i cd i o l s v siae n e b rt r n e d l sn t u t s a h d e o be i f d s ft . n o e r , r no g a a o f e u z n c a i s iWa i e t td u d rl o ao a df l i t n n g a y i c n i o s T e r s l h we a , n e b r t r o d t n te s i mi r o g imso vo s c ee ae e d g a ain o n a o i o dt n . h e u t s o dt t u d rl o ao c n i o , h o l co r a s b iu l a c lr t dt e r d t ft u z n c i s h a y i n y h o e a i , u g si gt a c o r a ims l y d a o tn l e a a o f e u z n ca i . u l h s v l e e r d t n o n cd sg et t n h mir o g n s a e n i p mp r t o ei d g d t n o n a o i c d S n i t o i o v d i d g a ai f e — a r n r i t g a l n n o t u z n ca i . u a o si o a ta c o r a imsd . h n t e s i wa o u o lv d t e a o i c d b t s n t w a mp r n mir o g s o W e o l sn t t ca e , t s n h a h r t a a g rt a 0/ n y atr 1 e t n , e u o lv d t e ae w slr e h n 5 0 o l f 0 dt ame t wh n a t ca e , h 0 e r s 5 % 0 Wa s a 0 d t e d ga ain s l st n 1 , e r d t e h h o
链格孢菌毒素对中国月季主要营养物质含量的影响

链格孢菌毒素对中国月季主要营养物质含量的影响李云仙;李永梅;杨发忠;李靖【摘要】Rosa chinensis was treated with tenuazonic acid(TeA) toxin of Alternaria tenuissima. To determine the content of protein,water, soluble sugar and elements in treated and above and below treatment site leavesof R.chinensis after 2,6,10,14,20 days. The methods are:Kjeldahlmethod,drying method,anthrone colorimetric method and inductively coupled plasma emission spectrometer (ICP-OES). The findings indicated that compared with healthy leaves,the contents of protein,water and soluble sugar in leaves treated with TeA decreased signifi-cantly. The change of protein content is complex, after 6 days treatment, the contentof protein increased signifi-cantly,then it decreases with the increase of treated time. Protein content decreased from 208.41 mg/g to 145.09mg/g;Moisture content decreased from 77.36% to 69.56%,dropped by7.79%;Soluble sugar content decreased from 12.58 mg/g to 8.45 mg/g. After treated by the A.tenuissima toxin TeA, the content of mineral elements in rose leaves have changed,Ca,Mg,K,S,P,Zn et al decreased,but Al,Cu,Mn,Na et al increased. The toxin TeA treatment has a spatialeffect,which affects the nutrient above and below the treated leaves.%用链格孢菌毒素细交链孢菌酮酸 (TeA) 处理中国月季叶片后,用凯氏定氮法、烘干法、蒽酮比色法和电感偶合等离子发射光谱仪 (ICP-OES) 分别测定处理2、6、10、14、20 d后,处理部位叶片和位于处理叶片上方和下方的叶片中蛋白质、水分、可溶性糖和矿质元素的含量.结果表明:与健康叶片相比,用TeA处理后的叶片其蛋白质、水分和可溶性糖含量均明显下降,蛋白质含量变化较复杂,在处理6d后,其含量显著增加,之后又随处理时间的增加而降低.蛋白质含量从208.41 mg/g 降低至45.09 mg/g;水分含量从77.36%下降到69.56%,下降了7.79%;可溶性糖含量从12.58 mg/g降低到8.45 mg/g.中国月季用链格孢菌毒素TeA处理后多种矿质元素含量发生变化,Ca、Mg、K、S、P、Zn等元素含量降低,Al、Cu、Mn、Na等元素含量升高.并且TeA处理具有空间效应,对位于处理部位上方和下方的叶片的营养元素都有影响.【期刊名称】《西南林业大学学报》【年(卷),期】2018(038)003【总页数】7页(P101-107)【关键词】中国月季;链格孢菌毒素;水分;蛋白质;矿质元素;可溶性糖【作者】李云仙;李永梅;杨发忠;李靖【作者单位】云南农业大学植物保护学院,云南昆明650201;西南林业大学化学工程学院,云南昆明650224;云南农业大学资源与环境学院,云南昆明650201;西南林业大学化学工程学院,云南昆明650224;西南林业大学生命科学学院,云南昆明650224【正文语种】中文【中图分类】S685.12植物体进化了一系列防御机制来防止昆虫的取食,这些机制主要分为两类:组成型防御反应和诱导型防御反应,组成型防御反应是植物固有的防御反应,具有特异性,以储存化合物、结合化合物或活化化合物前体的形式存在,这些物质都很容易受伤害诱导激发,迄今为止,大多数的防御反应都是组成型的防御反应。
二月兰种子中甘蓝链格孢带菌率检测及6种杀菌剂对病菌的毒力测定
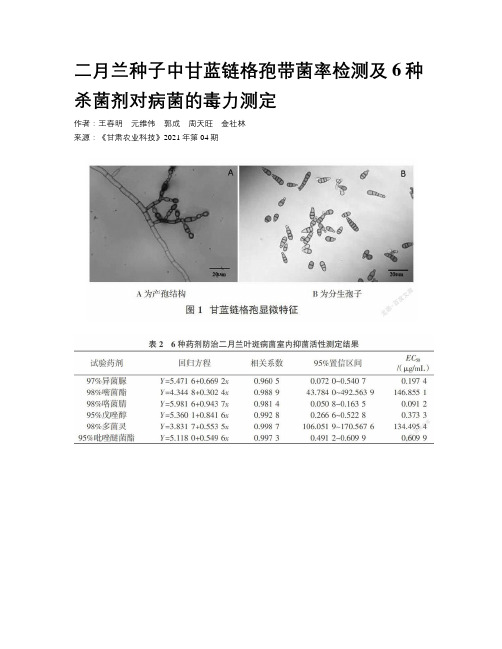
二月兰种子中甘蓝链格孢带菌率检测及6种杀菌剂对病菌的毒力测定作者:王春明元维伟郭成周天旺金社林来源:《甘肃农业科技》2021年第04期摘要:测定了二月兰叶斑病病原菌甘蓝链格孢种子带菌率及6种杀菌剂对其的毒力。
结果显示,二月兰种子上存在叶斑病病原菌甘蓝链格孢,其带菌率为31.3%。
98%咯菌腈对甘蓝链格孢具有良好的杀菌效果,EC50值为0.091 2 μg/mL;97%异菌脲、95%戊唑醇和95%吡唑醚菌酯杀菌效果较好,EC50值分别为0.1974 μg/mL、0.373 3 μg/mL和0.609 9 μg/mL;98%嘧菌酯和98%多菌灵效果较差,EC50值分别为146.855 1 μg/mL和134.495 4 μg/mL。
综上认为,二月兰叶斑病病菌甘蓝链格孢具有种子传播危害的可能,98%咯菌腈对其具有较好毒力,其次为97%异菌脲、95%戊唑醇和95%吡唑醚菌酯。
关键词:二月兰叶斑病;甘蓝链格孢;杀菌剂;病原菌;抑制率;毒力测定中图分类号:S436.8 文献标志码:A 文章编号:1001-1463(2021)04-0018-05doi:10.3969/j.issn.1001-1463.2021.04.006Detection of Carrying Rate of Alternaria brassicicola of Orychophragmus violaceus seed and ToxicityMeasurement of Six Fungicides on BacteriaWANG Chunming 1, YUAN Weiwei 2, GUO Cheng 1, ZHOU Tianwang 1, JIN Shenlin 1(1. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 2. College of Plant Protection, Funjian Agriculture and Forestry University,Fuzhou Fujian 350002, China)Abstract:The carrying rate of Alternaria brassicicola of Orychophragmus violaceus seed and toxicity measurement of 6 fungicides on the bacteria were determined. The results showed that separation ratio of Alternaria brassicicola was 31.3%in Orychophragmus violaceus seeds. Meantime toxicity measurement results showed that 98% Fludioxonil good bactericidal effect on Alternaria brassicicola of Orychophragmus violaceus,and the EC50 values was 0.091 2 μg/mL. The higher toxicity were 97% Iprodione, 95%Tebuconazole and 95% Pyraclostrobin, and the EC50 values were 0.197 4 μg/mL,0.373 3 μg/mL and 0.609 9 μg/mL, respectively. The lowest toxicity were 98% Azoxystrobin and 98% Carbendazim,and the EC50 values were 146.855 1 μg/mL and 134.495 4 μg/mL, respectively. In conclusion, Alternaria brassicicola of Orychophragmus violaceus had the possibility of seed dispersal harm, and 98% Fludioxonil had best virulence to Alternaria brassicicola of Orychophragmus violaceus, then 97% Iprodione, 95% Tebuconazole and 95% Pyraclostrobin.Key words:Leaf spot of Alternaria.brassicicola; Orychophragmus violaceus; Fungicide; Pathogenic bacteria; Inhibition rate; Toxicity measurement二月蘭为诸葛菜属二年生植物,目前多被用作景观绿化植物种植。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 4 期 万佐玺等 :链格孢菌寄主选择性毒素的研究现状 2 1
品种元帅接种毒素后 SOD 活性降低[2] . 董金皋等 (1999) 研究发现 :无论是接种芸薹链格孢菌 ,还是 AB - 毒 素 ,白菜叶片在 0. 5 - 12 h 内 SOD 和 POD 酶活性都迅速下降 ,说明白菜受芸薹链格孢菌及其毒素影响后 ,可 能活性氧在此期间过量积累 ,导致了最终的感病性[12] . 链格孢菌毒素使紫茎泽兰叶片的 POD 、APX、CAT 活性 下降[16] . 因此可见 ,病原毒素对寄主体内防卫反应重要的酶 SOD 、POD 、CAT、APX 等都有影响 ,导致寄主 的活性氧清除系统中的酶系统受到破坏 ,最终感病.
4 链格孢菌寄主选择性毒素的应用研究
4. 1 利用致病毒素的选择压力进行抗病育种 利用致病菌的选择压力进行抗病育种 ,是选育抗病品种的一条重要途径 ,而利用致病毒素进行抗病育种
更具针对性. 番茄早疫病是一种世界性的重要病害 ,在现有的栽培品种中 ,缺乏抗早疫苗的资源 ,且抗早疫苗 的遗传是受不完全显性基因控制 ,难以通过常规育种的方法选出抗病品种. 随着植物组织培养技术的建立 , 利用致病毒素 (AAL - 毒素) 通过体细胞无性系变异及突变体的筛选而获得抗病品种 ,目前已获得了几个对 早疫病有较高抗性的抗病材料[21] .
致病毒素对寄主生理代谢的影响主要表现在影响质膜透性[1 ,2 ,9 ,12 ] 、酶活性[9 ,12 ] 、激素平衡[10 ] 、光合作 用[1 ] 、呼吸作用[11 ] 、及其它代谢过程[8 ] .
人们已经证明 AK - 毒素能引起细胞膜透性改变 ,电解质外渗 ,抑制细胞 mRNA 和蛋白质的新合成 ,使细 胞中 Cu2 + 和 Fe3 + 的含量增加 ,导致质膜凹陷 ,最后促使梨叶脉坏死[2] . AF - 毒素 3 种组分中的 Ⅰ组分可引起 寄主细胞膜去极化 ,离子泵活性被抑制 , K+ 外渗[2] . AM - 毒素主要作用于质膜蛋白和叶绿体基粒片层 ,引起 电解质渗漏. AM - 毒素只对苹果感病品种的 ATP 酶活性有间接的影响 ,AM - 毒素处理苹果 ,感病品种 SOD 活性降低 ,而抗病品种 SOD 活性升高 ,这说明苹果感抗品种抗病性与 SOD 密切相关[12] . AAL - 毒素可引起感 病番茄乙醇胺和磷酸乙醇胺的异常积累 ,从而抑制磷酸酯酰乙醇胺生物合成. AAL - 毒素的作用位点主要是 线粒体的氨甲酰天冬氨酸转移酶[2] . ACR - 毒素和 AT - 毒素作用位点在线粒体上 ,ACT - 毒素作用位点在质 膜和叶绿体上. ACR - 毒素可使线粒体膜电位发生变化 ,氧化磷酸化解偶联 ,同时还抑制苹果酸的氧化过程. AT - 毒素可使叶组织耗氧量增加 ,线粒体嵴断裂和解体. ACT - 毒素的作用主要是引起寄主细胞电解质的渗 漏[2] . AB - 毒素能改变细胞膜的透性 ,造成电解质外渗[2] . AB - 毒素能够抑制光合作用 ,品种感病性越强 ,抑 制作用越强. 生理研究表明 ,AB - 毒素可能降解叶绿体膜 ,减少叶绿素的含量 ,从而降低光合速率 ,使寄主组 织出现黄化或坏死 ,AB - 毒素还能抑制叶片的光呼吸作用[2] . AP - 毒素对于纤细链格孢在寄主组织中的定 殖以及病害的诱导都是必需的[13] , 但作用位点和致病机制有待深入研究. 3. 2. 3 病原毒素对活性氧清除系统的破坏
3 链格孢菌寄主选择性毒素的生理作用机理
3. 1 作用位点类型 病原菌毒素对寄主的作用是一个复杂的程序化过程. 确定毒素的最初作用位点是研究毒素作用机理的
关键 ,寄主细胞与毒素间的相互识别即毒素与最初作用位点的作用是毒素选择性的根源[1] . 链格孢菌寄主选 择性毒素的最初作用位点有原生质膜 、线粒体 、叶绿体等[2] . 3. 2 毒素的作用方式 3. 2. 1 对寄主细胞超微结构的影响
1 链格孢菌寄主选择性毒素的主要种类及其概况
自 Tanaka (1933) 从梨黑斑病菌 菊池链格孢 ( Alternaria kikuchiana) 中分离到第一个链格孢菌产生的寄 主选择性毒素 (AK - toxin) 以来 ,现已报道有 9 种链格孢菌产生的寄主选择性毒素[1 - 3] (见表 1) .
收稿日期 :2001 - 07 - 29. 基金项目 :农业部九五高技术和基础研究项目 (960205) ;国家教委博士点基金资助 (02 - 03 - 031) . 作者简介 :万佐玺 (1968 - ) ,男 ,湖北建始人 ,硕士 ,讲师 ,主要从事杂草生物防治的研究 ,现工作单位 :湖北民族学院园艺系.
在进行活性氧与植物抗病性关系的研究中发现 ,活性氧的产生与植物抵御病原体的侵染有关[14 ,15] . 在 此方面 ,有人对链格孢菌毒素作过一些研究 ,AM - 毒素对苹果叶片超氧化物歧化酶 (SOD) 的影响表明 ,感病
© 1995-2004 Tsinghua Tongfang Optical Disc Co., Ltd. All rights reserved.
链格孢菌寄主选择性毒素的研究现状
万佐玺 , 强 胜 , 李扬汉
(南京农业大学 农学院 植物科学系 , 江苏 南京 , 210095)
摘要 : 就链格孢属 ( Alternaria) 真菌中产生的 9 种寄主选择性植物毒性 、作用机理及应用研究等方面进行 综述和评论. 指出寄主选择性毒素作为致病因子 , 在致病过程中起着十分重要的作用 ; 利用寄主选择性致 病毒素在防病治病 、抗病育种及杂草防治中有广泛的应用前景. 关键词 : 链格孢菌 ; 寄主选择性毒素 ; 作用机理 ; 应用研究 中图分类号 : S792. 95 ;S571. 1 文献标识码 :A
苹果链格孢 长柄链格孢烟草致病型
芸苔链格孢 纤细链格孢
寄主
日本梨 柑桔 番茄 草莓 粗皮柠檬 苹果 烟草 白菜 木豆
病害
黑斑病 褐斑病 茎枯病 黑斑病 褐斑病 轮斑病 褐斑病 黑斑病 黑斑病
结构类型 毒素作用位点
脂类
细胞膜
酮类
叶绿体
脂类
环状四肽 细胞膜 、叶绿体
未知
© 1995-2004 Tsinghua Tongfang Optical Disc Co., Ltd. All rights reserved.
2 0 湖北民族学院学报 (自然科学版) 第 19 卷
表 2 链格孢菌寄主选择性毒素的生物活性
链格孢毒素能破坏质膜 、叶绿体以及线粒体的结构 ,从而影响细胞正常代谢. AM - 毒素处理的苹果感病 品种叶肉细胞中质膜内陷 ,叶绿体片层之间出现电子致密物质沉积 ,基粒片层松散 ,基质片层和基粒片层排 列不规则 ,部分受害严重的叶绿体 ,其外膜破裂 ,基质片层断开 ,出现基粒排列混乱现象[8] . ACR - 毒素处理 敏感柠檬叶组织 ,1h 后即可见线粒体膨胀 、扭曲 、嵴变少 ,基质渗漏[1] . 3. 2. 2 对寄主生理代谢的影响
毒素种类
AK- toxin AM - toxin AF - toxin AAL - toxin ACR - toxin ACT - toxin AB - toxin AP - toxin AT - toxin
生物活性
引起膜电位快速去极化 ,使 K+ 渗漏增加. 在 0. 01μg/ ml ,引起敏感叶片叶脉坏死. 作用于质膜蛋白和叶绿体基粒片层 ,引起电解质渗漏 诱导草莓黑斑病 ,在 0. 02μg/ ml 下引起草莓和敏感梨坏死. 在 0. 025μg/ ml 下引起敏感番茄品种叶脉坏死 ,而抗性品种在 100μg/ ml 以上仍无毒性. 诱导糙叶柠檬叶褐斑病 ,引起氧化磷酸化解耦联和线粒体超微结构的变化 ,抑制 malate 的氧化. 在 5μg/ ml 下引起中国柑橘敏感品种叶片的特征伤害. 诱导白菜典型的黑斑病 ,叶片黄化 、坏死或萎蔫. 细胞膜破裂 、电解质渗漏 、叶绿体破坏 、叶绿素分解. 诱导感病型木豆黑斑病 ,对病原菌定植及病害诱导是必需的. 在 0. 2μg/ ml 下可抑制感病烟草品种幼苗根系生长.
第 19 卷第 4 期
湖北民族学院学报 (自然科学版)
Vol. 19 No. 4
2001 年 11 月 Journal of Hubei Institute for Nationalities(Nat. Sci. ) Nov. 2001
文章编号 :1008 - 8423 (2001) 04 - 0019 - 04
长期以来 ,人们就曾设想通过中和或钝化植物病原菌毒素的方法达到防治植物病害的目的. 张金林 、董 金皋等 (1995) 发现碱性物质 、无机钠盐 (除钼酸钠外) 、有机酸钠盐 、强氧化剂 ( KMnO4) 对 AB - 毒素的钝化作 用很强[2 ,17] . 据报道 ( Takashi ,1995) ,变兰菌素 ,甲硫氨酸等物质可抑制 AK - 毒素的产生. 这两种化学物质也 可抑制 A . Alternata 苹果变种 AM - 毒素及草莓变种 AF - 毒素的产生 ,并使这两菌致病能力降低[12] .
性作用于敏感梨品种[7] . AAL - toxin 的一系列同系物具有相同的毒性和寄主专一性. AB - toxin 是一个混合 物 ,至少由四种组分构成 ,即腐败菌素 B 、高腐败菌素 B 、腐败菌素 B2 和脱甲基腐败菌素 B ,四种组分的致病 力很相似 ,在高温 、碱性或极端酸性条件下分解失去致病性[2] .
线粒体
环状五肽 细胞膜 、叶绿体
未知
线粒体
2 链格孢菌寄主选择性毒素分子结构与生物活性的关系
毒素分子结构与生物活性的关系非常密切 ,往往一个基团的差异 ,甚至一个异构体 ,就会导致活性迥异. 已经研究过的链格孢菌寄主选择性毒素的生物活性[1 ,4]如表 2 所示.
AM - toxin 是环状四肽 ,有 3 种结构类似物 ,其中 AM - Ⅰ为致毒主成分 ,对感病的苹果品种具有专性毒 害作用 ,AM - Ⅰ的活性是 AM - Ⅱ的 10 倍[5] . AK - toxin 有两种主成分 ,AK - Ⅰ的毒性是 AK - Ⅱ的 100 倍[6] . AF - toxin 和 AK - toxin 的主体化学结构很相似 ,均为三烯酸结构 ,仅在 2′位上的功能团不同 ,AF - toxin 是 - OH ,AK - toxin 是 - NH ,因此 ,AF - toxin 和 AK - toxin 虽分别由草莓链格孢和梨链格孢产生 ,但均可专化
