高中化学计算方法:《关系式法》(人教版)
【人教版】高中化学必修一:3.1《金属的化学性质》pdf课件

___________________________。
【解析】 由于钠的密度比水小,比煤油大,所 以钠在煤油与水的界面处漂浮。钠与水反应产生的气 体在逸出过程中把钠带入煤油层,钠在重力作用下再 回到界面。反复多次,直至钠完全消失。产生的气体 聚集在大试管上部,把液体反压到长颈漏斗中。
【答案】 (1)钠在煤油中逐渐下沉,至水面时与 水发生反应,熔化成银白色小球,像热气球一样在煤 油与水的界面处作上下游动,最后完全消失
Zn+2H+===Zn2++H2↑、Fe+2H+ ===Fe2++H2↑。
四、金属与水的反应 1.钠与水的反应
实验操作
实验现象
原因解释
钠 浮 在水面上 钠的密度比水 小
钠熔化成闪亮 钠熔点 低 ,反应放
的小球
热
小球在水面上 四处游动,最 后完全消失
反应产生的 气体 推 动小球运动
与水反应发出 嘶嘶响声
要点二 铝与氢氧化纳、盐酸的反应及有关计算
1.铝的两性 铝与盐酸的反应原理为2Al+6H+===2Al3+ +3H2↑,这是活泼金属的化学通性之一。铝还 能与NaOH溶液反应:2Al+2OH-+ 2H2O===2AlO2-+3H2↑。常利用铝的这一特性 来判断铝的存在。
2.有关计算:
分析依据:2Al+6HCl===2AlCl3+3H2↑
据以上两个方程式知,消耗HCl和 NaOH的物质的量之比为3∶1。
要点三 物质的量在化学方程式计 算中的应用
1.根据化学方程式进行计算的基本步骤 (1)基本步骤
——设所求物质的物质的量或质量、体积等
——写出相关的化学方程式
——在方程式中有关物质的化学式下面标出 已知物质和所求物质的有关物理量关系,并 代入已知量和未知量
化学计算,关系式法

化学计算,关系式法关系式法是一种用于化学计算的方法,它利用量与量之间的正比关系来建立关系式,从而进行计算。
这种方法常用于多个化学式或多步反应的计算中,可以将复杂的计算化繁为简,减少误差。
建立关系式的方法有多种,可以通过化学式、反应方程式、化学基本概念、溶解度、溶质质量分数等多个方面进行。
一、根据等量关系建立关系式可以通过不同物质中所含同种元素质量相等或不同种物质的质量、体积、密度或物质的量相等来建立关系式。
例如,若不同物质中某元素的质量相等,则该元素的原子个数必然相等。
根据这个原理,可以建立关系式。
举例来说,对于问题1,已知264 kg硫铵与316 kg碳铵所含氮元素的质量相当,可以建立关系式:264/(2×14)=316/(2×12)。
其中,2×14和2×12分别是硫铵和碳铵中氮元素的摩尔数。
对于问题2,已知相同条件下,相同质量的二氧化硫气体与三氧化硫气体中氧元素质量比是5/6,氧原子个数比是5/4.可以建立关系式:(32/64)÷(80/192)=5/6,(32/64)÷(80/192)=5/4.其中,32和80分别是二氧化硫和三氧化硫中氧的质量,64和192分别是它们的摩尔数。
二、根据化学反应实质建立关系式可以根据不同活泼金属失电子数相等或并列多步反应找元素对应关系式来建立关系式。
例如,对于问题3,已知铁、镁、铝三种金属分别与足量的稀盐酸反应生成等质量的氢气时,参加反应的铁、镁、铝的质量比为12:28:9.可以建立关系式:1/56×(56/56):1/24×(56/56):1/27×(56/56)=12:28:9.其中,1/56、1/24和1/27分别是铁、镁和铝的摩尔数。
对于问题4,已知铁铝合金溶于足量盐酸中,再用足量KOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧,使之完全变成红色粉末,经称量发现该红色粉末和原合金质量恰好相等。
高中化学《经典计算题》解题方法分类总结

高中化学《经典计算题》解题方法分类总结一、关系式法关系式法是根据化学方程式计算的巧用,其解题的核心思想是化学反应中质量守恒,各反应物与生成物之间存在着最基本的比例(数量)关系。
例题:某种H2和CO的混合气体,其密度为相同条件下再通入过量O2,最后容器中固体质量增加了()A. 3.2gB. 4.4gC. 5.6gD. 6.4g【解析】固体增加的质量即为H2的质量。
固体增加的质量即为CO的质量。
所以,最后容器中固体质量增加了3.2g,应选A。
二、方程或方程组法根据质量守恒和比例关系,依据题设条件设立未知数,列方程或方程组求解,是化学计算中最常用的方法,其解题技能也是最重要的计算技能。
例题:有某碱金属M及其相应氧化物的混合物共10g,跟足量水充分反应后,小心地将溶液蒸干,得到14g无水晶体。
该碱金属M可能是()(锂、钠、钾、铷的原子量分别为:6.94、23、39、85.47)A.锂B.钠C.钾D.铷【解析】设M的原子量为x,解得42.5>x>14.5,分析所给锂、钠、钾、铷的原子量,推断符合题意的正确答案是B、C。
三、守恒法化学方程式既然能够表示出反应物与生成物之间物质的量、质量、气体体积之间的数量关系,那么就必然能反映出化学反应前后原子个数、电荷数、得失电子数、总质量等都是守恒的。
巧用守恒规律,常能简化解题步骤、准确快速将题解出,收到事半功倍的效果。
例题:将5.21g纯铁粉溶于适量稀H2SO4中,加热条件下,用2.53g KNO3氧化Fe2+,充分反应后还需0.009mol Cl2才能完全氧化Fe2+,则KNO3的还原产物氮元素的化合价为___。
【解析】0.093=0.025x+0.018,x=3,5-3=2。
应填:+2。
(得失电子守恒)四、差量法找出化学反应前后某种差量和造成这种差量的实质及其关系,列出比例式求解的方法,即为差量法。
其差量可以是质量差、气体体积差、压强差等。
差量法的实质是根据化学方程式计算的巧用。
化学反应速率的计算方法

化学反应速率的计算方法(1)定义式法:利用公式v==计算化学反应速率,也可以利用公式计算物质的量或物质的量浓度变化或时间等。
(2)关系式法:同一反应中,化学反应速率之比=物质的量浓度变化量之比=物质的量变化量之比=化学计量数之比。
另外,也可以利用该等量关系书写未知的化学方程式或找各物质的速率关系。
2.化学反应速率大小比较的两种方法(1)归一法:换算成同一物质、同一单位表示,再比较数值大小。
(2)比值法:比较化学反应速率与化学计量数的比值。
如反应a A+b Bc C,要比较v(A)与v(B)的相对大小,即比较与的相对大小,若>,则用v(A)表示的反应速率比用v(B)表示的反应速率大。
(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2 (g),CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=mol·L-1·min-1。
(2)对于某反应X(g)+3Y(g)2E(g)+2F(g),在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲,v(X)=0.3 mol·L-1·min-1;乙,v(Y)=1.2 mol·L-1·min-1;丙,v(E)=0.6 mol·L-1·min-1;丁,v(F)=0.9 mol·L-1·min-1。
则反应由快到慢的顺序是。
(1)改变物质状态:若第(2)问中F为固态,则E、F的化学反应速率相同吗?(2)改变速率单位:若E的化学反应速率由0.6 mol·L-1·min-1改为0.6 mol·L-1·s-1,则化学反应速率最快的还是丁吗?1.反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·min-1②v(B)=0.6 mol·L-1·s-1③v(C)=0.4 mol·L-1·s-1④v(D)=0.45 mol·L-1·s-1下列有关反应速率的比较正确的是()A.④<③=②<①B.④>③>②>①C.④>③=②>①D.①>②>③>④2.在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用v(A)、v(B)、v(C)表示。
高中化学常见化学计算方法

常见化学计算方法主要有:差量法、十字交叉法、平均法、守恒法、极值法、关系式法、方程式叠加法、等量代换法、摩尔电子质量法、讨论法、图象法(略)、对称法(略)。
一、差量法在一定量溶剂的饱和溶液中,由于温度改变(升高或降低),使溶质的溶解度发生变化,从而造成溶质(或饱和溶液)质量的差量;每个物质均有固定的化学组成,任意两个物质的物理量之间均存在差量;同样,在一个封闭体系中进行的化学反应,尽管反应前后质量守恒,但物质的量、固液气各态物质质量、气体体积等会发生变化,形成差量。
差量法就是根据这些差量值,列出比例式来求解的一种化学计算方法。
该方法运用的数学知识为等比定律及其衍生式:或。
差量法是简化化学计算的一种主要手段,在中学阶段运用相当普遍。
常见的类型有:溶解度差、组成差、质量差、体积差、物质的量差等。
在运用时要注意物质的状态相相同,差量物质的物理量单位要一致。
1.将碳酸钠和碳酸氢钠的混合物21.0g,加热至质量不再变化时,称得固体质量为12.5g。
求混合物中碳酸钠的质量分数。
2.实验室用冷却结晶法提纯KNO3,先在100℃时将KNO3配成饱和溶液,再冷却到30℃,析出KNO3。
现欲制备500g较纯的KNO3,问在100℃时应将多少克KNO3溶解于多少克水中。
(KNO3的溶解度100℃时为246g,30℃时为46g)3.某金属元素R的氧化物相对分子质量为m,相同价态氯化物的相对分子质量为n,则金属元素R的化合价为多少?4.将镁、铝、铁分别投入质量相等、足量的稀硫酸中,反应结束后所得各溶液的质量相等,则投入的镁、铝、铁三种金属的质量大小关系为( )(A )Al >Mg >Fe (B )Fe >Mg >Al (C )Mg >Al >Fe (D )Mg=Fe=Al5.取Na 2CO 3和NaHCO 3混和物9.5g ,先加水配成稀溶液,然后向该溶液中加9.6g 碱石灰(成分是CaO 和NaOH ),充分反应后,使Ca 2+、HCO 3-、CO 32-都转化为CaCO 3沉淀。
化学计算题解题方法——差量法 平均值法 极限法 估算法 代入法 关系式法

化学计算题解题方法差量法平均值法极限法估算法代入法关系式法化学计算题是中学生在化学学习中比较头痛的一类题目,也是他们在测验和考试中最难得分的一类题目,能选用最合适的方法准确而快速地解决计算题,对于提高学习成绩,增强学习效率,有着重要意义.选用合适的方法解计算题,不但可以缩短解题的时间,还有助于减小计算过程中的运算量,尽可能地降低运算过程中出错的机会.例如下题,有两种不同的解法,相比之下,不难看出选取合适方法的重要性:[例1]30mL一定浓度的硝酸溶液与5.12克铜片反应,当铜片全部反应完毕后,共收集到气体2.24升(S.T.P),则该硝酸溶液的物质的量浓度至少为A.9mol/LB.8mol/LC.5mol/LD.10mol/L解法一:因为题目中无指明硝酸是浓或稀,所以产物不能确定,根据铜与硝酸反应的两个方程式:(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,可以设参与反应(1)的Cu为xmol,则反应生成的NO气体为2/3xmol,反应消耗的硝酸为8/3xmol,再设参与反应(2)的Cu为ymol,则反应生成的NO2气体为2ymol,反应消耗的硝酸为4ymol,从而可以列出方程组:(x+y)*64=5.12,[(2/3)x+2y]*22.4=2.24,求得x=0.045mol,y=0.035mol,则所耗硝酸为8/3x+4y=0.26mol,其浓度为(0.26/0.03)mol/L,在8-9之间,只能选A.解法二:根据质量守恒定律,由于铜片只与硝酸完全反应生成Cu2+,则产物应为硝酸铜,且其物质的量与原来的铜片一样,均为5.12/64=0.08摩,从产物的化学式Cu(NO3)2可以看出,参与复分解反应提供NO3-的HNO3有2*0.08=0.16摩;而反应的气态产物,无论是NO还是NO2,每一个分子都含有一个N原子,则气体分子总数就相当于参与氧化还原反应的HNO3的摩尔数,所以每消耗一摩HNO3都产生22.4L气体(可以是NO或NO2甚至是两者的混合物),现有气体2.24L,即有0.1摩HNO3参与了氧化还原反应,故所耗硝酸为0.16+0.1=0.26摩,其浓度为(0.26/0.03)mol/L,在8-9之间,只能选A.从以上两种方法可以看出,本题是选择题,只要求出结果便可,不论方式及解题规范,而此题的关键之处在于能否熟练应用质量守恒定律,第二种方法运用了守恒法,所以运算量要少得多,也不需要先将化学方程式列出,配平,从而大大缩短了解题时间,更避免了因不知按哪一个方程式来求硝酸所导致的恐慌.再看下题:[例2]在一个6升的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X(气)+3Y(气) 2Q(气)+nR(气) 达到平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是A.3B.4C.5D.6解法一:抓住“X浓度减少1/3”,结合化学方程式的系数比等于体积比,可分别列出各物质的始态,变量和终态:4X 3Y 2Q nR始态3L 2L 0 0变量-1/3*3L=1L -3/4*1L=3/4L +2/4*1L=1/2L +n/4*1L=n/4L终态3-1=2L 2-3/4==5/4L 0+1/2=1/2L 0+n/4=n/4L由以上关系式可知,平衡后(终态)混和气体的体积为(2+5/4+1/2+n/4)L即(15+n)/4L,按题意"混和气体的压强比原来增加5%"即(15+n)/4-5=5*5%,求得n=6.解法二:选用差量法,按题意"混和气体的压强比原来增加5%"按题意"混和气体的压强比原来增加5%",即混和气体的体积增加了(2+3)*5%=0.25L,根据方程式,4X+3Y只能生成2Q+nR,即每4体积X反应,总体积改变量为(2+n)-(4+3)=n-5,现有1/3*3L=1L的X反应,即总体积改变量为1L*[(n-5)/4]=0.25L,从而求出n=6.解法三:抓住"混和气体的压强比原来增加5%",得出反应由X+Y开始时,平衡必定先向右移,生成了Q和R之后,压强增大,说明正反应肯定是体积增大的反应,则反应方程式中X与Y 的系数之和必小于Q与R的系数之和,所以4+3<2+n,得出n>5,在四个选项中只有D中n=6符合要求,为应选答案.本题考查的是关于化学平衡的内容.解法一是遵循化学平衡规律,按步就班的规范做法,虽然肯定能算出正确答案,但没有把握住"选择题,不问过程,只要结果"的特点,当作一道计算题来做,普通学生也起码要用5分钟完成,花的时间较多.解法二运用了差量法,以含n的体积变量(差量)来建立等式,冉峡斓豱算出了的值,但还是未能充分利用选择题的"选择"特点,用时要1分钟左右.解法三对平衡移动与体积变化的关系理解透彻,不用半分钟就可得出唯一正确的答案.由此可见,在计算过程中针对题目特点选用不同的解题方法,往往有助于减少运算过程中所消耗的时间及出错的机会,达到快速,准确解题的效果,而运用较多的解题方法通常有以下几种:1.商余法:这种方法主要是应用于解答有机物(尤其是烃类)知道分子量后求出其分子式的一类题目.对于烃类,由于烷烃通式为C n H2n+2,分子量为14n+2,对应的烷烃基通式为C n H2n+1,分子量为14n+1,烯烃及环烷烃通式为C n H2n,分子量为14n,对应的烃基通式为C n H2n-1,分子量为14n-1,炔烃及二烯烃通式为C n H2n-2,分子量为14n-2,对应的烃基通式为C n H2n-3,分子量为14n-3,所以可以将已知有机物的分子量减去含氧官能团的式量后,差值除以14(烃类直接除14),则最大的商为含碳的原子数(即n值),余数代入上述分子量通式,符合的就是其所属的类别.[例3]某直链一元醇14克能与金属钠完全反应,生成0.2克氢气,则此醇的同分异构体数目为A.6个 B.7个 C.8个 D.9个由于一元醇只含一个-OH,每mol醇只能转换出1/2molH2,由生成0.2克H2推断出14克醇应有0.2mol,所以其摩尔质量为72克/摩,分子量为72,扣除羟基式量17后,剩余55,除以14,最大商为3,余为13,不合理,应取商为4,余为-1,代入分子量通式,应为4个碳的烯烃基或环烷基,结合"直链",从而推断其同分异构体数目为6个.2.平均值法这种方法最适合定性地求解混合物的组成,即只求出混合物的可能成分,不用考虑各组分的含量.根据混合物中各个物理量(例如密度,体积,摩尔质量,物质的量浓度,质量分数等)的定义式或结合题目所给条件,可以求出混合物某个物理量的平均值,而这个平均值必须介于组成混合物的各成分的同一物理量数值之间,换言之,混合物的两个成分中的这个物理量肯定一个比平均值大,一个比平均值小,才能符合要求,从而可判断出混合物的可能组成.[例4]将两种金属单质混合物13g,加到足量稀硫酸中,共放出标准状况下气体11.2L,这两种金属可能是A.Zn和FeB.Al和ZnC.Al和MgD.Mg和Cu将混合物当作一种金属来看,因为是足量稀硫酸,13克金属全部反应生成的11.2L(0.5摩尔)气体全部是氢气,也就是说,这种金属每放出1摩尔氢气需26克,如果全部是+2价的金属,其平均原子量为26,则组成混合物的+2价金属,其原子量一个大于26,一个小于26.代入选项,在置换出氢气的反应中,显+2价的有Zn,原子量为65,Fe原子量为56,Mg原子量为24,但对于Al,由于在反应中显+3价,要置换出1mol氢气,只要18克Al便够,可看作+2价时其原子量为27/(3/2)=18,同样假如有+1价的Na参与反应时,将它看作+2价时其原子量为23*2=46,对于Cu,因为它不能置换出H2,所以可看作原子量为无穷大,从而得到A中两种金属原子量均大于26,C中两种金属原子量均小于26,所以A,C都不符合要求,B中Al的原子量比26小,Zn比26大,D中Mg原子量比26小,Cu原子量比26大,故B,D为应选答案.3.极限法.极限法与平均值法刚好相反,这种方法也适合定性或定量地求解混合物的组成.根据混合物中各个物理量(例如密度,体积,摩尔质量,物质的量浓度,质量分数等)的定义式或结合题目所给条件,将混合物看作是只含其中一种组分A,即其质量分数或气体体积分数为100%(极大)时,另一组分B对应的质量分数或气体体积分数就为0%(极小),可以求出此组分A 的某个物理量的值N1,用相同的方法可求出混合物只含B不含A时的同一物理量的值N2,而混合物的这个物理量N平是平均值,必须介于组成混合物的各成分A,B的同一物理量数值之间,即N1<N平<N2才能符合要求,从而可判断出混合物的可能组成.[例5]4个同学同时分析一个由KCl和KBr组成的混合物,他们各取2.00克样品配成水溶液,加入足够HNO3后再加入适量AgNO3溶液,待沉淀完全后过滤得到干燥的卤化银沉淀的质量如下列四个选项所示,其中数据合理的是A.3.06gB.3.36gC.3.66gD.3.96本题如按通常解法,混合物中含KCl和KBr,可以有无限多种组成方式,则求出的数据也有多种可能性,要验证数据是否合理,必须将四个选项代入,看是否有解,也就相当于要做四题的计算题,所花时间非常多.使用极限法,设2.00克全部为KCl,根据KCl-AgCl,每74.5克KCl可生成143.5克AgCl,则可得沉淀为(2.00/74.5)*143.5=3.852克,为最大值,同样可求得当混合物全部为KBr时,每119克的KBr可得沉淀188克,所以应得沉淀为(2.00/119)*188=3.160克,为最小值,则介于两者之间的数值就符合要求,故只能选B和C.4.估算法.化学题尤其是选择题中所涉及的计算,所要考查的是化学知识,而不是运算技能,所以当中的计算的量应当是较小的,通常都不需计出确切值,可结合题目中的条件对运算结果的数值进行估计,符合要求的便可选取.[例6]已知某盐在不同温度下的溶解度如下表,若把质量分数为22%的该盐溶液由500C逐渐冷却,则开始析出晶体的温度范围是温度(0C) 0 10 20 30 40溶解度(克/100克水) 11.5 15.1 19.4 24.4 37.6A.0-100CB.10-200CC.20-300CD.30-400C本题考查的是溶液结晶与溶质溶解度及溶液饱和度的关系.溶液析出晶体,意味着溶液的浓度超出了当前温度下其饱和溶液的浓度,根据溶解度的定义,[溶解度/(溶解度+100克水)]*100%=饱和溶液的质量分数,如果将各个温度下的溶解度数值代入,比较其饱和溶液质量分数与22%的大小,可得出结果,但运算量太大,不符合选择题的特点.从表上可知,该盐溶解度随温度上升而增大,可以反过来将22%的溶液当成某温度时的饱和溶液,只要温度低于该温度,就会析出晶体.代入[溶解度/(溶解度+100克水)]*100%=22%,可得:溶解度*78=100*22,即溶解度=2200/78,除法运算麻烦,运用估算,应介于25与30之间,此溶解度只能在30-400C中,故选D.5.差量法.对于在反应过程中有涉及物质的量,浓度,微粒个数,体积,质量等差量变化的一个具体的反应,运用差量变化的数值有助于快捷准确地建立定量关系,从而排除干扰,迅速解题,甚至于一些因条件不足而无法解决的题目也迎刃而解.[例7]在1升浓度为C摩/升的弱酸HA溶液中,HA,H+和A-的物质的量之和为nC摩,则HA 的电离度是A.n*100%B.(n/2)*100%C.(n-1)*100%D.n%根据电离度的概念,只需求出已电离的HA的物质的量,然后将这个值与HA的总量(1升*C 摩/升=C摩)相除,其百分数就是HA的电离度.要求已电离的HA的物质的量,可根据HA H++A-,由于原有弱酸为1升*C摩/升=C摩,设电离度为X,则电离出的HA的物质的量为XC摩,即电离出的H+和A-也分别为CXmol,溶液中未电离的HA就为(C-CX)mol,所以HA,H+,A-的物质的量之和为[(C-CX)+CX+CX]摩,即(C+CX)摩=nC摩,从而可得出1+X=n,所以X的值为n-1,取百分数故选C.本题中涉及的微粒数较易混淆,采用差量法有助于迅速解题:根据HA的电离式,每一个HA电离后生成一个H+和一个A-,即微粒数增大一,现在微粒数由原来的C摩变为nC摩,增大了(n-1)*C摩,立即可知有(n-1)*C摩HA发生电离,则电离度为(n-1)C摩/C摩=n-1,更快地选出C项答案.6.代入法.将所有选项可某个特殊物质逐一代入原题来求出正确结果,这原本是解选择题中最无奈时才采用的方法,但只要恰当地结合题目所给条件,缩窄要代入的范围,也可以运用代入的方法迅速解题.[例8]某种烷烃11克完全燃烧,需标准状况下氧气28L,这种烷烃的分子式是A.C5H12B.C4H10C.C3H8D.C2H6因为是烷烃,组成为C n H2n+2,分子量为14n+2,即每14n+2克烃完全燃烧生成n摩CO2和(n+1)摩H2O,便要耗去n+(n+1)/2即3n/2+1/2摩O2,现有烷烃11克,氧气为28/22.4=5/4摩,其比值为44:5,将选项中的四个n值代入(14n+2):[3n/2+1/2],不需解方程便可迅速得知n=3为应选答案.7.关系式法.对于多步反应,可根据各种的关系(主要是化学方程式,守恒等),列出对应的关系式,快速地在要求的物质的数量与题目给出物质的数量之间建立定量关系,从而免除了涉及中间过程的大量运算,不但节约了运算时间,还避免了运算出错对计算结果的影响,是最经常使用的方法之一.[例9]一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,求加入的铁粉质量为A.14gB.42gC.56gD.28g因为题目中无指明铁粉的量,所以铁粉可能是过量,也可能是不足,则与硫粉反应后,加入过量盐酸时生成的气体就有多种可能:或者只有H2S(铁全部转变为FeS2),或者是既有H2S又有H2(铁除了生成FeS2外还有剩余),所以只凭硫粉质量和生成的水的质量,不易建立方程求解.根据各步反应的定量关系,列出关系式:(1)Fe--FeS(铁守恒)--H2S(硫守恒)--H2O(氢守恒),(2)Fe--H2(化学方程式)--H2O(氢定恒),从而得知,无论铁参与了哪一个反应,每1个铁都最终生成了1个H2O,所以迅速得出铁的物质的量就是水的物质的量,根本与硫无关,所以应有铁为9/18=0.5摩,即28克.8.比较法.已知一个有机物的分子式,根据题目的要求去计算相关的量例如同分异构体,反应物或生成物的结构,反应方程式的系数比等,经常要用到结构比较法,其关键是要对有机物的结构特点了解透彻,将相关的官能团的位置,性质熟练掌握,代入对应的条件中进行确定.CH3[例10]分子式为C12H12的烃,结构式为,若萘环上的二溴代物有9种CH3同分异构体,则萘环上四溴代物的同分异构体数目有A.9种B.10种C.11种D.12种本题是求萘环上四溴代物的同分异构体数目,不需考虑官能团异构和碳链异构,只求官能团的位置异构,如按通常做法,将四个溴原子逐个代入萘环上的氢的位置,便可数出同分异构体的数目,但由于数量多,结构比较十分困难,很易错数,漏数.抓住题目所给条件--二溴代物有9种,分析所给有机物峁固氐?不难看出,萘环上只有六个氢原子可以被溴取代,也就是说,每取代四个氢原子,就肯定剩下两个氢原子未取代,根据"二溴代物有9种"这一提示,即萘环上只取两个氢原子的不同组合有9种,即意味着取四个氢原子进行取代的不同组合就有9种,所以根本不需逐个代,迅速推知萘环上四溴代物的同分异构体就有9种.9.残基法.这是求解有机物分子结构简式或结构式中最常用的方法.一个有机物的分子式算出后,可以有很多种不同的结构,要最后确定其结构,可先将已知的官能团包括烃基的式量或所含原子数扣除,剩下的式量或原子数就是属于残余的基团,再讨论其可能构成便快捷得多.[例11]某有机物5.6克完全燃烧后生成6.72L(S.T.P下)二氧化碳和3.6克水,该有机物的蒸气对一氧化碳的相对密度是2,试求该有机物的分子式.如果该有机物能使溴水褪色,并且此有机物和新制的氢氧化铜混合后加热产生红色沉淀,试推断该有机物的结构简式.因为该有机物的蒸气对一氧化碳的相对密度为2,所以其分子量是CO的2倍,即56,而5.6克有机物就是0.1摩,完全燃烧生成6.72L(S.T.P)CO2为0.3摩,3.6克水为0.2摩,故分子式中含3个碳,4个氢,则每摩分子中含氧为56-3*12-4*1=16克,分子式中只有1个氧,从而确定分子式是C3H4O.根据该有机物能发生斐林反应,证明其中有-CHO,从C3H4O中扣除-CHO,残基为-C2H3,能使溴水褪色,则有不饱和键,按其组成,只可能为-CH=CH2,所以该有机物结构就为H2C=CH-CHO.10.守恒法.物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒.所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果.[例12]已知某强氧化剂[RO(OH)2]+能被硫酸钠还原到较低价态,如果还原含2.4*10-3mol[RO(OH)2]+的溶液到低价态,需12mL0.2mol/L的亚硫酸钠溶液,那么R元素的最终价态为A.+3B.+2C.+1D.-1因为在[RO(OH)2]-中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠被氧化只能得硫酸钠,硫的化合价升高了2价,根据2.4*10-3mol[RO(OH)2]-与12ml*0.2mol/L=0.0024mol的亚硫酸钠完全反应,亚硫酸钠共升0.0024*2=0.0048价,则依照升降价守恒,2.4*10-3mol[RO(OH)2]-共降也是0.0048价,所以每mol[RO(OH)2]-降了2价,R原为+3价,必须降为+1价,故不需配平方程式可直接选C.11.规律法.化学反应过程中各物质的物理量往往是符合一定的数量关系的,这些数量关系就是通常所说的反应规律,表现为通式或公式,包括有机物分子通式,燃烧耗氧通式,化学反应通式,化学方程式,各物理量定义式,各物理量相互转化关系式等,甚至于从实践中自己总结的通式也可充分利用.熟练利用各种通式和公式,可大幅度减低运算时间和运算量,达到事半功倍的效果.[例13]1200C时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是A.1B.2C.3D.4本题是有机物燃烧规律应用的典型,由于烃的类别不确定,氧是否过量又未知,如果单纯将含碳由1至4的各种烃的分子式代入燃烧方程,运算量大而且未必将所有可能性都找得出.应用有机物的燃烧通式,设该烃为C X H Y,其完全燃烧方程式为:C X H Y+(X+Y/4)O2==XCO2+Y/2H2O,因为反应前后温度都是1200C,所以H2O为气态,要计体积,在相同状况下气体的体积比就相当于摩尔比,则无论O2是否过量,每1体积C X H Y只与X+Y/4体积O2反应,生成X体积CO2和Y/2体积水蒸气,体积变量肯定为1-Y/4,只与分子式中氢原子数量有关.按题意,由于反应前后体积不变,即1-Y/4=0,立刻得到分子式为C X H4,此时再将四个选项中的碳原子数目代入,CH4为甲烷,C2H4为乙烯,C3H4为丙炔,只有C4H4不可能.12.排除法.选择型计算题最主要的特点是,四个选项中肯定有正确答案,只要将不正确的答案剔除,剩余的便是应选答案.利用这一点,针对数据的特殊性,可运用将不可能的数据排除的方法,不直接求解而得到正确选项,尤其是单选题,这一方法更加有效.[例14]取相同体积的KI,Na2S,FeBr2三种溶液,分别通入氯气,反应都完全时,三种溶液所消耗氯气的体积(在同温同压下)相同,则KI,Na2S,FeBr2三种溶液的摩尔浓度之比是A.1:1:2B.1:2:3C.6:3:2D.2:1:3本题当然可用将氯气与各物质反应的关系式写出,按照氯气用量相等得到各物质摩尔数,从而求出其浓度之比的方法来解,但要进行一定量的运算,没有充分利用选择题的特殊性.根据四个选项中KI和FeBr2的比例或Na2S和FeBr2的比例均不相同这一特点,只要求出其中一个比值,已经可得出正确选项.因KI与Cl2反应产物为I2,即两反应物mol比为2:1,FeBr2与Cl2反应产物为Fe3+和Br2,即两反应物mol比为2:3,可化简为2/3:1,当Cl2用量相同时,则KI与FeBr2之比为2:(2/3)即3:1,A,B,D中比例不符合,予以排除,只有C为应选项.如果取Na2S与FeBr2来算,同理也可得出相同结果.本题还可进一步加快解题速度,抓住KI,Na2S,FeBr2三者结构特点--等量物质与Cl2反应时,FeBr2需耗最多Cl2.换言之,当Cl2的量相等时,参与反应的FeBr2的量最少,所以等体积的溶液中,其浓度最小,在四个选项中,也只有C符合要求,为应选答案.13.十字交叉法.十字交叉法是专门用来计算溶液浓缩及稀释,混合气体的平均组成,混合溶液中某种离子浓度,混合物中某种成分的质量分数等的一种常用方法,其使用方法为:组分A的物理量a 差量c-b平均物理量c(质量,浓度,体积,质量分数等)组分B的物理量b 差量a-c则混合物中所含A和B的比值为(c-b):(a-c),至于浓缩,可看作是原溶液A中减少了质量分数为0%的水B,而稀释则是增加了质量分数为100%的溶质B,得到质量分数为c的溶液.[例15]有A克15%的NaNO3溶液,欲使其质量分数变为30%,可采用的方法是A.蒸发溶剂的1/2B.蒸发掉A/2克的溶剂C.加入3A/14克NaNO3D.加入3A/20克NaNO3根据十字交叉法,溶液由15%变为30%差量为15%,增大溶液质量分数可有两个方法:(1)加入溶质,要使100%的NaNO3变为30%,差量为70%,所以加入的质量与原溶液质量之比为15:70,即要3A/14克.(2)蒸发减少溶剂,要使0%的溶剂变为30%,差量为30%,所以蒸发的溶剂的质量与原溶液质量之比为15%:30%,即要蒸发A/2克.如果设未知数来求解本题,需要做两次计算题,则所花时间要多得多.14.拆分法.将题目所提供的数值或物质的结构,化学式进行适当分拆,成为相互关联的几个部分,可以便于建立等量关系或进行比较,将运算简化.这种方法最适用于有机物的结构比较(与残基法相似),同一物质参与多种反应,以及关于化学平衡或讨论型的计算题.[例16]将各为0.3214摩的下列各物质在相同条件下完全燃烧,消耗氧气的体积最少的是A.甲酸 B.甲醛 C.乙醛 D.甲酸甲酯这是关于有机物的燃烧耗氧量的计算,因为是等摩尔的物质,完全可用燃烧通式求出每一个选项耗氧的摩尔数,但本题只需要定量比较各个物质耗氧量的多少,不用求出确切值,故此可应用拆分法:甲酸结构简式为HCOOH,可拆为H2O+CO,燃烧时办只有CO耗氧,甲醛为HCHO,可拆为H2O+C,比甲酸少了一个O,则等摩尔燃烧过程中生成相同数量的CO2和H2O 时,耗多一个O.同理可将乙醛CH3CHO拆为H2O+C2H2,比甲酸多一个CH2,少一个O,耗氧量必定大于甲酸,甲酸甲酯HCOOCH3拆为2H2O+C2,比乙醛少了H2,耗氧量必定少,所以可知等量物质燃烧时乙醛耗氧最多.当然,解题方法并不仅局限于以上14种,还有各人从实践中总结出来的各种各样的经验方法,各种方法都有其自身的优点.在众多的方法中,无论使用哪一种,都应该注意以下几点:一.要抓住题目中的明确提示,例如差值,守恒关系,反应规律,选项的数字特点,结构特点,以及相互关系,并结合通式,化学方程式,定义式,关系式等,确定应选的方法.二.使用各种解题方法时,一定要将相关的量的关系搞清楚,尤其是差量,守恒,关系式等不要弄错,也不能凭空捏造,以免适得其反,弄巧反拙.三.扎实的基础知识是各种解题方法的后盾,解题时应在基本概念基本理论入手,在分析题目条件上找方法,一时未能找到巧解方法,先从最基本方法求解,按步就班,再从中发掘速算方法.四.在解题过程中,往往需要将多种解题方法结合一齐同时运用,以达到最佳效果.[例17]有一块铁铝合金,溶于足量盐酸中,再用足量KOH溶液处理,将产生的沉淀过滤,洗涤,干燥,灼烧使之完全变成红色粉末,经称量,发现该红色粉末和原合金质量恰好相等,则合金中铝的含量为A.70%B.52.4%C.47.6%D.30%本题是求混合金属的组成,只有一个"红色粉末与原合金质量相等"的条件,用普通方法不能迅速解题.根据化学方程式,因为铝经两步处理后已在过滤时除去,可用铁守恒建立关系式:Fe--FeCl2--Fe(OH)2--Fe(OH)3--(1/2)Fe2O3,再由质量相等的条件,得合金中铝+铁的质量=氧化铁的质量=铁+氧的质量,从而可知,铝的含量相当于氧化铁中氧的含量,根据质量分数的公式,可求出其含量为:[(3*16)/(2*56+3*16)]*100%=30%.解题中同时运用了关系式法,公式法,守恒法等.综上所述,"时间就是分数,效率就是成绩",要想解题过程迅速准确,必须针对题目的特点,选取最有效的解题方法,甚至是多种方法综合运用,以达到减少运算量,增强运算准确率的效果,从而取得更多的主动权,才能在测试中获取更佳的成绩.。
高中新教材人教版化学课件+必修第一册+第三章第二节第2课时 物质的量在化学方程式计算中的应用

均摩尔质量为
=25 g·mol-1。
典型例题
【例题2】 将某份铁铝合金样品均分为两份,一份加入足量
盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体
得到的溶液中加入100 mL盐酸,正好完全反应,并放出气体。
(1)Na2O的物质的量为
;
(2)放出气体的体积在标准状况下为
;
(3)盐酸中c(HCl)=
。
答案:(1)0.05 mol
(2)1.12 L
(3)1.5 mol·L-1
解析:(1)n(Na2O)=
n(NaHCO3)=
.
.
氢离子反应可生成1 mol氢气。( ×)
(6)化学反应前后质量和物质的量均守恒。( × )
2.1.15 g钠与水反应,得到100 mL溶液。
(1)求生成的气体在标准状况下的体积。
(2)求反应后所得溶液中溶质的物质的量浓度。
.
解:参加反应的 Na 的物质的量为 ·-=0.05 mol
第二节
第2课时
金属材料
物质的量在化学方程式计算中的应用
自主预习·新知导学
合作探究·释疑解惑
课 堂 小 结
课标定位
1.会叙述化学计算中的常用方法
2.掌握物质的量在化学方程式计算中的一般步骤和方法
素养阐释
1.能通过分析、推理等方法认识物质的量在化学方程式计
算中的应用
2.建立认知模型,并能运用模型解答化学计算问题
系,同种状况下,气体体积与物质的量成正比关系,因此根据化
学方程式计算时,各物质对应的各物理量的单位上、下都必
须一致,左、右相互对应即可。
归纳提升
1.化学计算的基本
高中化学计算题的常用解题技巧(7)------关系式法

.高中化学计算题的常用解题技巧(7)------关系式法
关系式法:关于多步反响,可依据各样的关系(主假如化学方程式,守恒等 ),列出对应的关系式,快速地在要求的物质的数目与题目给出物
质的数目之间成立定量关系,进而免去了波及中间过程的大批运算,不但节俭了运算时间,还防止了运算犯错对计算结果的影响,是最常常使
用的方法之一。
[ 例 9]必定量的铁粉和9 克硫粉混淆加热,待其反响后再加入过度盐酸,
将生成的气体完整焚烧,共采集得9 克水,求加入的铁粉质量为
A.14g
B.42g
C.56g
D.28g
由于题目中无指明铁粉的量,因此铁粉可能是过度,也可能是不足,则
与硫粉反响后,加入过度盐酸时生成的气体就有多种可能:或许只有
H2S(铁所有转变成 FeS2),或许是既有 H2S 又有 H2(铁除了生成 FeS2外还有节余 ),因此只凭硫粉质量和生成的水的质量,不易成立方程求解 . 依据各步反响的定量关系,列出关系式: (1)Fe--FeS(铁守恒 )--H2S(硫守
恒)--H2O( 氢守恒 ),(2)Fe--H2(化学方程式 )--H2O( 氢定恒 ),进而得悉,不论铁参加了哪一个反响,每 1 个铁都最平生成了 1 个 H2O,因此快速得出铁的物质的量就是水的物质的量,根本与硫没关,因此应有铁为
9/18=0.5 摩,即 28 克。
;..。
化学计算常用的方法与规律
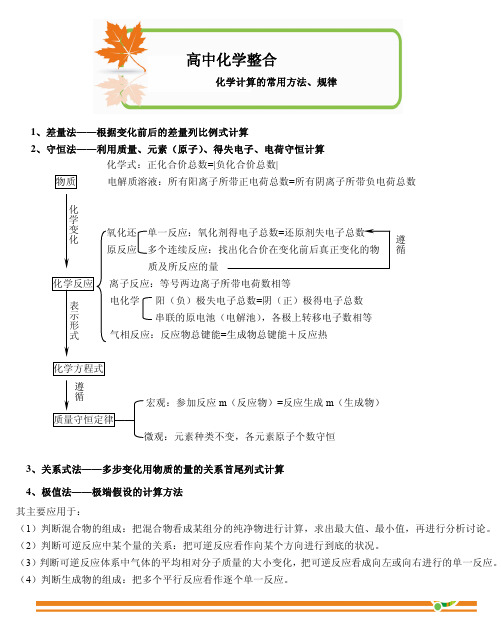
遵 循
原反应 多个连续反应:找出化合价在变化前后真正变化的物
质及所反应的量
化学反应
表 示 形 式
离子反应:等号两边离子所带电荷数相等 电化学 阳(负)极失电子总数=阴(正)极得电子总数
串联的原电池(电解池),各极上转移电子数相等 气相反应:反应物总键能=生成物总键能+反应热
化学方程式 遵 循 宏观:参加反应 m(反应物)=反应生成 m(生成物)
(1)强酸的 pH
(2)稀释强酸溶液
(3)稀释弱酸溶液
(4)混合酸溶液的 pH
【小结】求酸溶液的 pH 须先求
,再求
。求算中注意混合溶液的体积变化。
[H+]= 浓酸中H +的物质的量+稀酸中H +的物质的量 V总
(二)碱性体系
(1)强碱溶液的 pH 计算
(2)稀释碱溶液
【小结】求碱性溶液 pH 的方法:先求
求该酯的分子式
。
8、水的离子积 水是极弱的电解质,存在着电离平衡。水的离子积常数 KW=[H+]·[OH-]。
25℃时,Kw=10-14,Kw 只随温度的升高而增大,无论是中性、酸性、碱性的稀溶液中都有[H+]·[OH-]=KW。
高中化学整合
化学计算的常用方法、规律
9、有关 PH 的计算
(一)酸性体系:
6、十字交叉法
运用“十字交叉法”的要领是:
(1)首先判断哪种计算题可用本法:二元混合物(a>c>b),且有平均值 C 的计算题;
(2)两物质所取的基准量 m、n 可相加;
(3)要有两物质的平均值,且平均值的单位要与两物质所表示的单位相同;
(4)m/n 是所取的基准量之比。
求解元素、同位素、原子、电子等微粒间量的变化的试题。
高一化学化学计算专题复习——关系式法同步练习 人教版

高一化学人教版关系式法同步练习(答题时间:40分钟)一. 选择题:1. 将FeS 和Fe O 23的混和物566.g ,用足量稀H SO 24溶解后可得32.g 硫,原混和物中FeS 质量可能是( )A. 88.gB. 406.gC. 214.g D. 478.g 2. 分析磁铁矿时,将铁沉淀为Fe OH ()3,再灼烧至Fe O 23,若灼烧后Fe O 23的质量在数值上等于试样中Fe O 34的百分含量,则需取试样为( )A. 145.g B. 097.g C. 073.g D. 3.4g 3. 工业上以焦炭、水、空气为原料制NH 3时,根据化学方程式可知,理论上碳与NH 3物质的量之比是( )A. 23:B. 32:C. 43:D. 34:4. 超氧化钾(KO 2)常用于急救器中,它能吸收CO 2生成碳酸盐和氧气。
现用156g 金属钾在一定条件下与O 2充分反应生成KO 2,若此超氧化钾完全吸收CO 2,则生成的氧气在标准状况下的体积是( )A. 112.LB. 224.LC. 448.LD. 672.L二. 填空题:5. 向混有Fe O 23的铁屑中加入足量的稀H SO 24,直到固体完全溶解,若得到的溶液中不含Fe 3+,产生的Fe 2+与H 2的物质的量之比是41:,则原混和物中Fe O 23与Fe 的质量比是_____,有关反应的离子方程式是(1)___________;(2)___________;(3)___________。
6. 某化肥厂用NH 3制备NH NO 43,已知:由NH 3制NO 的产率是98%,NO 制 HNO 3的产率是92%,HNO 3跟NH 3反应生成NH NO 43,则制HNO 3所用去的NH 3的质量占总耗NH 3质量(不考虑生产的其它损耗)的________%。
三. 计算:7. 工业上将氨全部转化变成硝酸。
已知用去空气中的氧气64.kg ,需氨气多少kg ?若硝酸的产率80%,生成多少kg 浓度为60%的硝酸?8. 某试剂厂生产的化学试剂FeCl H O 326⋅,国家规定其二级品含量不低于990%.,三级品不低于980%.。
高中化学计算方法总结

高中化学计算方法总结导读:高中化学教师,在开展计算教学时,应该引导学生掌握常见的解题方法与解题技巧,以促进教学效果的提升。
下面为大家总结了高中化学几种计算方法,希望帮助到大家!一、关系式法所谓关系式法,就是根据化学概念、物质组成、化学反应方程式中有关物质的有关数量之间的关系,建立起已知和未知之间的关系式,然后根据关系式进行计算。
利用关系式的解题,可使运算过程大为简化。
其中包括守恒法。
所谓“守恒”就是以化学反应过程中存在的某些守恒关系如质量守恒、元素守恒、得失电子守恒,电荷守恒等。
运用守恒法解题可避免在纷纭复杂的解题背景中寻找关系式,提高解题的准确度。
例1、有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3% 取1g该样品投入25mL2mol/L的盐酸中后,多余的盐酸用1.0mol/LKOH溶液30.8mL恰好完全中和,蒸发中和后的溶液可得到固体的质量为多少?【解析】本题化学反应复杂,数字处理烦琐,所发生的化学反应:KOH+HCl=KCl+H2O K2CO3+2HCl=2KCl+H2O+CO2↑若根据反应通过所给出的量计算非常繁琐。
但若根据Cl—守恒,便可以看出:蒸发溶液所得KCl固体中的Cl—,全部来自盐酸中的Cl-,即:生成的n(KCl)=n(HCl)=0.025L×2mol/L m(KCl)=0.025L×2mol/L×74.5g/mol=3.725g例2、将纯铁丝5.21g溶于过量稀盐酸中,在加热条件下,用2.53gKNO3去氧化溶液中Fe2+,待反应后剩余的Fe2+离子尚需12mL0.3mol/LKMnO4溶液才能完全氧化,则KNO3被还原后的产物为()A、N2B、NOC、NO2D、NH4NO3【解析】根据氧化还原反应中得失电子的总数相等,Fe2+变为Fe3+失去电子的总数等于NO3-和MnO4-得电子的总数设n为KNO3的还原产物中N的化合价,则(5.21g÷56g/moL)×(3-2)=0.012L×0.3mol/L×(7-2)+(2.53g÷101g/mol)×(5-n) 解得n=3 故KNO3的还原产物为NO。
高考化学解题方法10关系式法

化学解题技巧-关系式法关系式法是一种巧妙利用已知物与未知量之关系进行解题的一种方法,一般适用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系式。
它是化学计算中的基本解题方法之一,利用关系式法可以将多步计算转化为一步计算,免去逐步计算中的麻烦,简化解题步骤,减少运算量,且计算结果不易出错,准确率高。
1、金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn +2HCl=SnCl2+H2再加入过量的FeCl溶液,发生如下反应:SnCl2+2FeCl=SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为:现有金属锡试样0.613g,经上述反应后,共用去0.100 mol/LK2Cr2O7溶液16.0mL。
求试样中锡的百分含量(假定杂质不参加反应)。
解析:该题是应用关系式法解多步反应的综合计算。
根据题目所给出的三个化学反应,得出Sn与K2Cr2O7的物质量的关系。
2、在100mL 36.5%的浓盐酸(密度为1.18g/cm3)中加入多少mL 2mol/L的稀盐酸(密度为1.08g/cm3),才能配成6mol/L的盐酸(密度为1.10g/cm3)。
解析:任何溶液在稀释时,溶液和溶剂的量都要发生变化,但溶质的量不变,据此可以得到稀释下列各种浓度的溶液计算公式。
百分比浓度溶液的稀释公式:浓溶液的质量×浓溶液的浓度 = 稀溶液的质量×稀溶液的浓度mol尔浓度的溶液稀释公式:浓溶液的浓度×浓溶液的体积(L) = 稀溶液的浓度×稀溶液的体积同一溶质的两种不同浓度的溶液混合时,混合溶液的浓度介于溶液之间,混合液跟两原溶液中溶质、溶液量的基本关系是:(1)混合液中所含溶质的总量等于两原溶液的溶质质量之和。
(2)混合溶液的质量等于两原溶液的质量之和,但体积不等于两原溶液的体积之和(当两原溶液很稀时,通常把混合液的体积近似地看做两原溶液的体积之和。
化学计算题巧解十法及混合物中各元素质量分数计算技巧

化学计算题巧解十法一、 关系式法关系式法主要用于多步反应的化学计算,根据化学方程式中有的关系,建立起已知和未知的关系式,然后进行计算,这样能够省去中间过程,快速而准确. 例一、今有13g 锌,把它投入足量的稀硫酸中,放出的氢气可以跟多少克纯度为80℅的氯酸钾完全分解放出的氧气完全反应生成水?此题如果用常规方法需要几步计算:①根据13g 锌求生成氢气的质量,②根据氢气的质量求氧气的质量③根据氧气的质量求KClO 3的质量,这种解法步骤多计算量大,费时费力,但如果用下述方法则极为简便。
解:设需纯度为80℅的KClO 3的质量为X2KClO 32↑ 2H 2+O 2=====2H 2O Zn+H 24=ZnSO 4+H 2↑依上述方程式可得:2KCLO 3~3O 2~6H 2~6Zn 可知:KCLO 3 ~ 3Zn122。
5 3*65 80%x 13g解得:x=10。
2g用关系式发解题,首先要写出各步反应方程式调整化学方程式中的计量数关联的各个化学方程式中的有关物质的计量数相等,进而找出有关物质的关系式再找出关系量进行计算。
二.差量法差量法是利用变化前后物质的质量差建立解题关系式的方法,其基本解题思路是:将过程中某始态量与终态量之差值跟化学方程式中物质的相应量列成比例关系,然后求解。
这种方法不受混合物中其他不参加反应物质的影响。
差量的范围可以是“物质的质量差、相对分子质量差、相对原子质量差”.例2、将H 2缓慢通入盛有20gCuO 的试管中,加热使其反应,过一会停止加热,冷却后称得残余固体质量为19.2g ,求生成铜的质量?解 设生成铜的质量为X CuO+H 2==Cu+H 2O 固体质量减少 80 64 16X 20—19.2=0。
8 64:X=16:0.8 X=3.2(g)差量法的运用范围较广,当遇到反应前后质量发生增减的混合物,可抓住质量变化的原因,运用差量法计算。
3、守恒法守恒法主要包括质量守恒、原子数目守恒、元素种类守恒、电荷守恒等。
2022版步步高《大一轮复习讲义》人教版第1章 第5讲 微专题4 化学计算的常用方法

4 化学计算的常用方法一、应用化学方程式计算方法 1.应用化学方程式列比例最重要的基础方法,关键抓对应项列比例,且“上下单位统一,左右单位相当”。
2.关系式法——一种快速高效的化学方程式计算方法(1)关系式法是一种巧妙利用已知量与未知量之间的关系进行解题的一种方法,一般适用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系式。
(2)列关系式通常有如下几种方法:①有关化学方程式的计量数关系;②原子守恒关系;③得失电子守恒关系。
3.差量法(1)所谓“差量”就是指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差,这种物理量可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。
根据化学方程式求出理论上的差值(理论差量),结合题中的条件求出或表示出实际的差值(实际差量),根据比例关系建立方程式并求出结果。
(2)差量法的解题关键是找准研究对象。
通常有:①固体的质量差,研究对象就是固体。
②气体的质量差,研究对象就是气体。
③液体的质量,研究对象就是液体。
4.列方程组进行的混合物计算计算中的数学思想:在两种物质组成的混合物中。
一般可设两个未知数x 、y ,题目中通常给出两个已知量(设为A 、B ),寻找x 、y 与A 、B 的数学关系,由此建立二元一次方程组进行联解⎩⎪⎨⎪⎧A =f 1(x ,y )B =f 2(x ,y )。
1.取3.38 g K 2CO 3和KHCO 3的混合物溶于水配成25 mL 溶液,往溶液中加入25 mL Ba(OH)2溶液恰好使生成白色沉淀的量最多,反应后溶液中c (OH -)=0.8 mol·L -1(忽略混合后溶液体积变化),则原混合物中K 2CO 3和KHCO 3 物质的量之比为( ) A .1∶2 B .1∶1 C .2∶1 D .2∶3 答案 A解析 设原混合物中n (K 2CO 3)=x mol ,n (KHCO 3)=y mol , 根据总质量可得:138x +100y =3.38①往溶液中加入Ba(OH 2)溶液,恰好使生成白色沉淀的量最多,反应后剩余的氢氧根的物质的量n (OH -)=0.8 mol·L -1×0.05 L =0.04 mol 。
高中化学常见化学计算方法

常见化学计算方法主要有:差量法、十字交叉法、平均法、守恒法、极值法、关系式法、方程式叠加法、等量代换法、摩尔电子质量法、讨论法、图象法(略)、对称法(略)。
一、差量法在一定量溶剂的饱和溶液中,由于温度改变(升高或降低),使溶质的溶解度发生变化,从而造成溶质(或饱和溶液)质量的差量;每个物质均有固定的化学组成,任意两个物质的物理量之间均存在差量;同样,在一个封闭体系中进行的化学反应,尽管反应前后质量守恒,但物质的量、固液气各态物质质量、气体体积等会发生变化,形成差量。
差量法就是根据这些差量值,列出比例式来求解的一种化学计算方法。
该方法运用的数学知识为等比定律及其衍生式:a b c d a c b d ==--或c a d b--。
差量法是简化化学计算的一种主要手段,在中学阶段运用相当普遍。
常见的类型有:溶解度差、组成差、质量差、体积差、物质的量差等。
在运用时要注意物质的状态相相同,差量物质的物理量单位要一致。
1.将碳酸钠和碳酸氢钠的混合物21.0g ,加热至质量不再变化时,称得固体质量为12.5g 。
求混合物中碳酸钠的质量分数。
2.实验室用冷却结晶法提纯KNO 3,先在100℃时将KNO 3配成饱和溶液,再冷却到30℃,析出KNO 3。
现欲制备500g 较纯的KNO 3,问在100℃时应将多少克KNO 3溶解于多少克水中。
(KNO 3的溶解度100℃时为246g ,30℃时为46g )3.某金属元素R 的氧化物相对分子质量为m ,相同价态氯化物的相对分子质量为n ,则金属元素R 的化合价为多少?4.将镁、铝、铁分别投入质量相等、足量的稀硫酸中,反应结束后所得各溶液的质量相等,则投入的镁、铝、铁三种金属的质量大小关系为( )(A )Al >Mg >Fe (B )Fe >Mg >Al (C )Mg >Al >Fe (D )Mg=Fe=Al5.取Na 2CO 3和NaHCO 3混和物9.5g ,先加水配成稀溶液,然后向该溶液中加9.6g 碱石灰(成分是CaO 和NaOH ),充分反应后,使Ca 2+、HCO 3-、CO 32-都转化为CaCO 3沉淀。
2020届高三化学一轮复习 物质的量有关计算(守恒法、差量法、关系式法计算)

2020届高三化学一轮复习物质的量有关计算(守恒法、差量法、关系式法计算)方法一守恒法1.原子(或离子)个数守恒当物质之间发生化学反应时,其实质就是原子之间的化分和化合。
即可推知某种元素的原子无论是在哪种物质中,反应前后其质量及物质的量都不会改变,即质量守恒。
专题训练1.现有铁、氧化亚铁、三氧化二铁的混合物粉末3.44g,向其中加入100mL1mol·L-1盐酸恰好完全溶解,收集到标准状况下的气体22.4mL,向反应后的溶液中加入KSCN溶液不变色,则6.88g该混合物在高温下用足量CO处理后,残留固体质量为________g。
答案 5.62.(2018·浙江4月选考,29)称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。
请计算:(1)加入铁粉充分反应后,溶液中溶质的物质的量为______。
(2)固体混合物中氧化铜的质量为________。
答案(1)0.100mol(2)2.40g3.(2018·舟山质检)向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
(1)样品中物质的量之比n(CaCl2)∶n(HCl)=________。
(2)V2=__________L。
答案(1)1∶2(2)0.10004.(2017·浙江4月选考,29)分别称取2.39g (NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图所示。
混合物中n[(NH4)2SO4]∶n(NH4Cl)为______。
(2)另一份固体混合物中NH+4与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=________(溶液体积变化忽略不计)。
2020高中化学高考解题方法归纳知识点分析:关系式法和虚拟法旧人教版

2020高考化学解题方法归纳(难点7~8)难点7 关系式法关系式法是根据化学方程式计算的诸法中较主要的一种方法,它可以使多步计算化为一步而完成。
●难点磁场请用关系式法解决下列问题,然后自我界定学习本篇是否需要。
将a g 铁和b g 硫粉混合均匀,隔绝空气加强热,充分反应后,再将所得固体混合物放入足量稀 H2SO4中,试求产生的气体在标准状况下的体积(用含a或b的代数式表示)。
●案例探究[例题]用黄铁矿可以制取 H2SO4,再用 H2SO4可以制取化肥(NH4)2SO4。
煅烧含 FeS2 80.2% 的黄铁矿 75.0 t,最终生产出 79.2 t(NH4)2SO4。
已知 NH3的利用率为 92.6%,H2SO4的利用率为 89.8%,试求黄铁矿制取 H2SO4时的损失率。
命题意图:主要考查学生利用关系式法解题的能力,同时考查学生对转化率、损失率的理解和认识。
知识依托:H2SO4的工业制法、NH3与 H2SO4的反应。
错解分析:不能准确理解利用率的含义而错解。
解题思路:首先须搞清 H2SO4的利用率与 FeS2利用率的关系。
H2SO4的利用率为89.8%,与 H2SO4的利用率是 100%、FeS2的利用率为 89.8% 是等价的。
并排除 NH3利用率的干扰作用。
其次,根据 S 原子守恒找出已知量 FeS2与未知量(NH4)2SO4的关系(设黄铁矿的利用率为x):FeS2 ~ 2H2SO4 ~ 2(NH4)2SO4120 26475.0 t×80.2%×89.8%·x 79.2 tx=66.6%黄铁矿的损失率为:1.00-66.6%=33.4%。
答案:33.4%●锦囊妙计凡反应连续进行,上一步反应的产物为下一步反应的反应物的反应,绝大多数可用关系式法解决。
寻找关系式的方法,一般有以下两种:1.写出各步反应的方程式,然后逐一递进找出关系式;2.根据某原子守恒,直接写出关系式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由于2molNH3含6molH,而NH4NO3中只有4molH,损失的2molH应该在生成物的H2O中,即生成1molH2O。又1molNH4NO3和1molH2O中共含4molO即2molO2由此可得下列关系式:
解得:x=42.5ty=80t
由上述关系式可知合成NH4NO3的过程并不消耗水反而生成水。
确定已知与未知之间关系式的一般方法:
1.根据化学方程式确定关系式
先写出化学方程式,然后再根据需要从方程式中提炼出某些关系。如:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
从中可提炼出:①Cu—Cu(NO3)2——2HNO3(未被还原)
2.根据守恒原理确定关系式
如:FeS2—2SO2—2H2SO4(S守恒)
(2)方法一 由于有两步转化不是100%,所以要生成1molNH4NO3消耗NH3应大于2mol:
NH4NO3——?NH3
上述数量之间关系的关键,是制得的HNO3应恰好与留下的NH3完全反应后生成NH4NO3。
解得y=45.3(t)
方法二 留下与HNO3反应的NH3没有损失,由(1)可知为42.5/2=21.25(t),则另21.25tNH3应理解为损失两次之后的剩余量,所以原来为:
【例14】工业上用NH3、空气和水作原料,合成化肥硝酸铵。
(1)若要制100吨硝酸铵,需NH3多少吨?空气中的氧气多少吨?水多少吨?
(2若NH3制NO的转化率为96%,NO转化为HNO3的转化率为92%,生产100吨硝酸铵需NH3多少吨?
解析 (1)用NH3制NH4NO3时,需要先把NH3分成两部分,一部分用于制HNO3,另一部分留作与HNO3反应生成NH4NO3,即NH4NO3中的氮原子均来自于NH3,即:
对于该电解过程还可得到以下重要关系式:
1.nH+——M——ne
2.4H+——O2——4e
【例12】将0.44g含硫的铁矿石在空气中充分煅烧,其中的硫全部转化成SO2,SO2全部氧化成SO3,SO3全部转化成H2SO4,这些硫酸恰好被20mL0.5mol/LNaOH溶液中和,则此铁矿中硫的质量百分比为______。
关系式法
化学计算的依据是物质之间量的比例关系,这种比例关系通常情况下可以从化学反应方程式或分子式中得到。但对复杂问题,如已知物与所求之间是靠很多个反应来联系的,这种情况下就需要直接确定已知与未知之间的比例关系,即“关系式”。其实从广义上说,很多的化学计算都是需要关系式的。只是对于多步反应的计算显得十分的重要。
解析 由于每一步反应硫均完全转化,可得关系式:
2NaOH——H2SO4——SO3——SO2——S
2 1
0.2×0.5 x
x=0.005(mol)
【例13】向VmL硫酸铁溶液中加足量的苛性钠溶液,将产生的沉淀在高温下灼烧后得固体残渣mg, 则原溶液中SO42-的物质的量浓度为______。
解析 最后得到的固体残渣为Fe2O3,
关系式:Fe2O3—2Fe—3O
本题若用Fe2O3—2Fபைடு நூலகம்关系求解M则要麻烦些。
【例11】电解某金属硝酸盐的溶液,当阴极增重ag时,阳极收集到bmL(标准状况)气体,若该金属的化合价为+n价,则该金属的相对原子质量为______。
解析 阴极增重说明该金属阳离子在阴极上得电子被还原成单质。阳极上放出的气体为O2。根据两极通过的电子数相等的原理得:
(NN4)NO3—2NH3(N守恒)
【例10】高温下还原mg氧化铁得ng铁,若已知氧的相对原子质量为16,则铁的相对原子质量可表示为______。
解析 是否一定要写出化学方程式才能解出此题呢?本题的已知为Fe2O3Fe的质量及氧的相对原子质量,求Fe元素的相对原子质量,所以只需找出Fe、O之间的关系即可,而与CO、CO2无关。
共消耗NH3:21.25+24.06=45.3(t)
